Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 477-488
Изменение поведенческих характеристик и уровня тирозингидроксилазы в прилежащем ядре мозга крыс DAT-HET в режиме свободной алкоголизации
И. В. Антонова 1, *, Е. О. Кучер 1, 2, Е. В. Филатова 1, А. Е. Веракса 1, И. Ю. Морина 1, В. А. Завьялов 2, А. Ю. Егоров 1, 2, 3
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Северо-западный государственный медицинский университет им. И.И. Мечникова
Санкт-Петербург, Россия
* E-mail: risha.irina999@mail.ru
Поступила в редакцию 07.12.2022
После доработки 04.03.2023
Принята к публикации 07.03.2023
- EDN: VIVTZX
- DOI: 10.31857/S0869813923040027
Аннотация
Формирование алкогольной зависимости связано с нарушением функционирования системы награды, центром которой является мезолимбическая часть дофаминовой системы. Крысы линии DAT-HET с их базовой гипердофаминергией являются перспективной моделью для исследования нейропсихических заболеваний, в основе которых лежат нарушения дофаминовой нейропередачи, в том числе алкоголизма. Целью работы была оценка влияния свободной алкоголизации на питьевое, локомоторное, исследовательское поведение, тревогу и уровень тирозингидроксилазы у крыс с нарушением функционирования дофаминовой системы (DAT-HET). Исследование проведено на половозрелых самцах крыс линии DAT-HET(n = 15) и Wistar (n = 13), которые были разделены на 4 группы: “DАT-HET ethanol” (n = 10) и “Wistar ethanol” (n = 9), которые на протяжении 112 дней эксперимента находились в режиме свободной алкоголизации. Контрольные группы “DАT-HET water” (n = 5) и “Wistar water” (n = 4) не имели доступа к раствору этанола, не участвовали в поведенческих тестах. Для оценки предпочтения и потребления алкоголя использовали тест “Двустаканная проба” и еженедельно фиксировали массу потребляемого раствора этанола в домашних клетках. Для оценки поведения использовали тесты “Открытое поле” и “Приподнятый крестообразный лабиринт”. После алкоголизации для оценки уровня тирозингидроксилазы проводилось иммуногистохимическое исследование серии фронтальных срезов мозга, содержащих область прилежащего ядра. Обнаружено, что при свободной алкоголизации крысы линии DAT-HET не формируют предпочтения этанола. На фоне малого потребления этанола изначальная гиперактивность у крыс DAT-HET нивелируется. DAT-HET модель приводит к увеличению уровня тирозингидроксилазы в прилежащем ядре. Кроме этого, режим свободной алкоголизации приводит к снижению уровня тирозингидроксилазы в прилежащем ядре при развитии патологического увеличения тирозингидроксилазы, наблюдающегося у крыс DAT-HET, но не оказывает эффекта на контрольных животных.
ВВЕДЕНИЕ
Начальное предпочтение алкоголя, приводящее к формированию алкогольной зависимости, связано с нарушением функционирования системы награды. Мезолимбическая часть дофаминовой системы головного мозга является центром награды и подкрепления и напрямую вовлечена в механизм алкогольной зависимости [1]. Мезолимбический путь системы награды и подкрепления в основном составляют дофаминергические нейроны, локализованные в области вентральной покрышки среднего мозга (VTA), проекции которых приходят в область прилежащего ядра [2]. Тирозингидроксилаза (ТГ) – основной фермент, лимитирующий скорость синтеза катехоламинов, содержится во всех дофаминовых нейронах. С помощью ТГ аминокислота L-тирозин превращается сначала в 3,4-дигидроксифенилаланин и далее в дофамин [3]. Одним из механизмов регуляции активности ТГ является механизм обратной связи, в ходе которого продукты распада катехоламинов подавляют активность этого фермента [4]. ТГ является общепризнанным маркером для изучения локализации, дифференцировки и развития катехоламинергических нейронов.
Крысы линии DAT-HET – это гетерозиготы линии DAT-KO, у которых с помощью методики для редактирования генома “нуклеаза цинковые пальцы” уменьшили число сайтов рестрикции белка-переносчика дофамина (DAT) только на одной аллели гена. В результате у крыс DAT-HET количество внеклеточного дофамина повышено на 50% по сравнению с животными дикого типа. В связи с этим данная линия обладает рядом поведенческих характеристик, таких как повышенная возбудимость, локомоторная активность и нестабильный уровень тревожности [5]. Модель DAT-HET подходит для изучения таких заболеваний как синдром дефицита внимания с гиперактивностью (СДВГ), шизофрения и аддиктивные расстройства [6].
В некоторых исследованиях на животных было показано, как употребление алкоголя в различных режимах алкоголизации влияет на дофаминергическую систему и вызывает изменения в поведении. Так, этанол снижал уровень дофамина в вентральном стриатуме у крыс Wistar, потребляющих раствор этилового спирта в умеренном количестве в режиме свободной алкоголизации, а также оказывал анксиолитический эффект, который выражался в снижении актов дефекации у крыс в тесте “Открытое поле” [7]. Хроническое потребление алкоголя в течение 365 дней приводило к снижению содержания фермента ТГ и дофамина, а также к увеличению количества DAT в вентральном стриатуме у крыс линии Sprague-Dawley [8]. При прерывистом полупринудительном спаивании у крыс Wistar с высоким потреблением этанола снижался уровень дофамина в прилежащем ядре [9]. У крыс линии Long-Evans через 48 ч после окончания длительной прерывистой алкоголизации с 20%-ным этанолом наблюдалось депрессивное поведение и ангедония [10]. Вместе с тем отмечалось и агрессивное поведение, коррелирующее с повышением уровня дофамина в прилежащем ядре, если крысы получали 10%-ный этанол перед социальными тестами [11]. Транспортер DAT также вовлечен в формирование алкогольной зависимости. В режиме свободного выбора при увеличении концентрации раствора этанола до 32% самцы мышей DAT-HET употребляли больше этанола по сравнению с самцами DAT-KO [12]. У крыс линии Wistar Kyoto, потреблявших большое количество алкоголя при свободном выборе, увеличивалось количество сайтов связывания DAT в нейронах многих областей головного мозга, в том числе в прилежащем ядре [13]. Алкоголь распространяет свое влияние также на активность ТГ. При остром воздействии перорально введенного 20%-ного этанола у крыс линии Sprague-Dawley было отмечено повышение уровня ТГ во многих областях мозга, в том числе в черной субстанции, которая является частью мезолимбической системы [14 ] . У этой же линии крыс при хроническом потреблении 5%-ного раствора этанола в условиях свободного выбора было обнаружено увеличение экспрессии мРНК ТГ в вентральном стриатуме [15]. У крыс Wistar после непрерывного потребления раствора этанола в течение 20 дней наблюдалось снижение иммунореактивности к ТГ в дендритных шипиках в области прилежащего ядра [16].
Несмотря на большое количество исследований, изучающих связь между потреблением алкоголя, его влиянием на дофаминергическую систему и поведение, механизмы предпочтения этанола при гипердофаминергии до конца не изучены. Использование крыс DAT-HET в качестве модели нарушения функционирования дофаминергической системы дает возможность оценить изменение поведенческих характеристик под влиянием этанола и получить новые данные для изучения воздействия этанола на уровень ТГ, который является важным звеном в синтезе дофамина. Методы прерывистой и полупринудительной алкоголизации обычно направлены на формирование мотивации предпочтения алкоголя и включают дополнительный фактор стресса, который может оказывать сильное воздействие на крыс DAT-HET. Ранее в пилотном исследовании нами было показано, что при полупринудительной алкоголизации крысы DAT-HET формируют предпочтение этанола быстрее, чем крысы Wistar, и при этом у них снижается уровень тревожности [17].
Режим свободной алкоголизации включает в себя свободный доступ к любой жидкости в домашней клетке без дополнительного стрессового воздействия, поэтому более всего подходит для изучения предпочтения алкоголя и связанных с этим первичных изменений в поведении животных в данной модели. Таким образом, целью работы была оценка влияния свободной алкоголизации на питьевое, локомоторное, исследовательское поведение, тревогу и уровень ТГ у крыс с нарушением функционирования дофаминергической системы (DAT-HET).
Объект исследования
Исследование проведено на половозрелых самцах крыс линии DAT-HET (n = 15) и популяции Wistar (n = 13) в возрасте двух месяцев, массой тела не менее 180 г на начало эксперимента. Крысы линии DАT-HET были получены и верифицированы в виварии Санкт-Петербургского государственного университета. Верификация наличия нокаутного гена проводилась с помощью генотипирования классическим методом полимеразной цепной реакции (ПЦР) в реальном времени. Крысы Wistar были получены в виварии Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН.
Все животные были разделены на 4 группы. Экспериментальные группы “DАT-HET ethanol” (n = 10) и “Wistar ethanol” (n = 9) на протяжении 112 дней эксперимента находились в режиме свободной алкоголизации, где имели постоянный доступ к поилке с 10%-ным раствором этанола и к поилке с водой, участвовали во всех поведенческих тестах. Спустя 30 дней после окончания алкоголизации (142-й день эксперимента) из этих групп были отобраны произвольным образом 5 крыс для иммуногистохимического исследования. Контрольные группы: “DАT-HET water” (n = 5) и “Wistar water” (n = 4) имели постоянный доступ к воде и еде, но не имели доступа к раствору этанола, не участвовали в поведенческих тестах, и через 142 дня эксперимента были взяты для иммуногистохимического исследования мозга.
Содержание животных
Все крысы содержались на стандартном рационе по три (две) особи в клетке размером 570 × 350 × 250 мм со свободным доступом к пище и поилкам с водой и с этанолом в условиях освещенности 12 ч свет, 12 ч темнота, температура воздуха – 20 ± 3°С и влажность 50–55%. В качестве пищи животные получали сбалансированный полнорационный корм ЛБК “Тосненский комбикормовый завод” в гранулированной форме, энергетическая ценность 11.39 МДж/кг.
Тест “Двухстаканная проба”
Для оценки предпочтения алкоголя крыса помещалась в клетку, аналогичную домашней, с двумя одинаковыми поилками. Одна из поилок содержала воду, другая – 10%-ный раствор этилового спирта. Локализацию поилок меняли при каждом следующем тестировании. Перед тестированием крысы подвергались питьевой депривациии в течение 24 ч. Оценивали долю (%) выпитого раствора этанола по отношению к общему количеству выпитой жидкости в течение 10 мин наблюдения.
Производили оценку потребления массы раствора этанола, выпитого за неделю. Каждую неделю определяли массу выпитого из поилки раствора этанола. Для каждой клетки определяли массу выпитого этанола в г на кг массы тела животного в пересчете на 100%-ный этанол, затем рассчитывали среднее для одной крысы за один день недели.
Тест “Открытое поле”
Тестирование проводили в установке, которая представляет собой арену размером 600 × 600 мм, снабженную пятью “норковыми” отверстиями и освещенную лампой накаливания 720 люксов, на расстоянии 1.5 м от пола. В течение 5 мин регистрировали следующие параметры: длину пройденного пути, вертикальные стойки (количество), заглядывания в “норки” (количество), груминг (продолжительность, с), болюсы (количество), уринации (количество).
Тест “Приподнятый крестообразный лабиринт”
Тестирование проводили на установке, имеющей два закрытых и два открытых рукава, в месте пересечения которых находится открытая площадка. Лабиринт был установлен на высоте 1 м от пола. Размер каждого рукава составлял 50 × 10 см, размер центра лабиринта – 10 × 10 см. Крысу помещали в центр установки носом к открытому рукаву и в течение 5 мин регистрировали время нахождения в открытых и в закрытых рукавах, время нахождения центре лабиринта, а также вертикальные стойки, свешивания с лабиринта, акты дефекации и уринации.
Иммуногистохимическое исследование
Всем отобранным крысам в качестве наркоза внутрибрюшинно вводили хлоралгидрат (400 мг/кг) и декапитировали. Мозг фиксировали с помощью погружения в 4%-ный раствор параформальдегида в течение 6 дней (при 4°С). После криопротекции в 30%-ном растворе сахарозы, разведенной в фосфатно-солевом буфере с 0.9% NaCl (pH 7.4) мозг замораживали с помощью изопентана (Sigma, США) при ‒42°С и хранили при –80°С. С помощью криостата (Leica CM-1520, Германия) были изготовлены чередующиеся серии фронтальных срезов мозга (толщина 20 мкм) из области прилежащего ядра (nAcc – nucleus accumbens) согласно атласу мозга крысы [18]. Каждый шестой срез монтировали на стекла Super Frost/plus (Menzel, Германия), высушивали при комнатной температуре и хранили при –20°С. Для исследования использован протокол, описанный ранее [19]. Для предварительной демаскировки антигена срезы на стеклах кипятили в цитратном буфере (pH 6.0) в течение 5 мин. Для реакции использовали первичные антитела мыши против ТГ (ТГ, Sigma, США), разведенные 1 : 1500, вторичные антитела козы против IgG мыши, конъюгированные с биотином (VectorLabs., Великобритания), разведенные 1 : 600 и раствор стрептовидин-пероксидазы (BioLegend, США), разведенный 1 : 700. Стекла подвергали стандартной гистологической обработке и заключали в прозрачную среду Bio-Mount (Bio-Optica, Италия). Специфичность реакции проверяли с помощью негативного контроля (реакции без первичных антител). Изображения из области nAcc были получены в проходящем свете с помощью микроскопа Carl Zeiss Imager A1 (Германия) со встроенной видеокамерой Axiocam 712, программного обеспечения для захвата изображения Zen 3.4 (blue edition). С помощью программы Image J (NIH, США) оценивали оптическую плотность ТГ в иммунопозитивных отростках. Результаты представлены в условных единицах (у. е.).
Протокол исследования: массу выпитого раствора этанола в домашних клетках у крыс оценивали еженедельно. Тест “Двустаканная проба” проводили на (–1-й), 27-, 55-, 83- и 111-й дни и через 28 дней после окончания алкоголизации. Тест “Крестообразный лабиринт” – на (–2-й), 54- и 110-й дни алкоголизации, тест “Открытое поле” – на (–4-й), 52- и 108-й дни. Взвешивание крыс проводили каждую неделю эксперимента.
Статистическая обработка результатов
Результаты иммуногистохимического исследования оценивали с помощью Н-критерия Крускала–Уоллиса и последующего апостериорного анализа межгрупповых различий по U-критерию Манна–Уитни с поправкой Холма–Бонферрони. Результаты представлены в виде бокс-плотов с медианой (М) 50% с интерквартильными размахами. Достоверность различий в поведенческих тестах оценивали с помощью U-критерия Манна–Уитни. Полученные результаты поведенческих тестов представляли в виде графиков с медианой с межквартильным интервалом.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
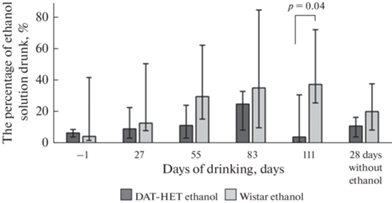
При оценивании предпочтения этанола в тесте “Двухстаканная проба” было обнаружено, что все животные на протяжении эксперимента в условиях свободного выбора в домашней клетке не предпочитали этанол воде (доля выпитого этанола в тестах не превышала 50% от общего количества выпитой жидкости). Крысы “DAT-HET ethanol” достоверно меньше предпочитали этанол по сравнению с крысами “Wistar ethanol” на 111-й день алкоголизации. Через 28 дней после окончания алкоголизации доля выпитого этанола не превышала 30% для обеих групп (рис. 1).
Рис. 1.
Предпочтение этанола в тесте “Двухстаканная проба”. По оси абсцисс – дни алкоголизации, по оси ординат – доля (%) выпитого алкоголя. Здесь и далее указана значимость отличий (p < 0.05) по Mann–Whitney U test.
Анализ еженедельных измерений массы выпитого раствора этанола в домашних клетках показал, что крысы группы “DAT-HET ethanol” употребляли достоверно меньше алкоголя в середине спаивания [среднее (7-я–11-я) неделя] по сравнению с крысами “Wistar ethanol” и не отличались от них в первые [среднее (1-я–6-я) неделя] и последние [среднее (12-я–16-я) неделя] недели алкоголизации (рис. 2).
Рис. 2.
Средняя масса раствора этилового спирта, выпитого одной крысой из группы за один день (в перерасчете на чистый этанол) в домашних клетках. По оси абсцисс – недели алкоголизации, по оси ординат – средняя масса раствора этилового спирта, выпитого одной крысой из группы за один день, в г/кг массы тела животного.
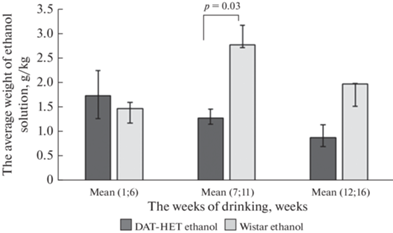
В среднем по всем пятнадцати измерениям крысы “DAT-HET ethanol” также выпили достоверно меньше алкоголя по сравнению с крысами “Wistar ethanol” 1.3 ± 0.2 и 2.0 ± 0.2 г/кг соответственно (р = 0.03).
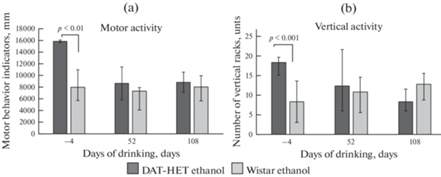
В тесте “Открытое поле” крысы “DAT-HET ethanol” демонстрировали высокую локомоторную и вертикальную активность (длина пройденного пути, стойки) по сравнению с крысами “Wistar ethanol” до начала алкоголизации и не отличались по исследовательской активности (заглядывания). После начала алкоголизации двигательная активность крыс “DAT-HET ethanol” снизилась, и поведение животных обеих групп не различалось (рис. 3). Исследовательская активность снизилась в середине и конце спаивания у крыс обеих групп, различий между группами не наблюдали. По вегетативным актам и грумингу крысы не различались на протяжении всего эксперимента.
Рис. 3.
Двигательная и вертикальная активность у крыс на протяжении алкоголизации. По оси абсцисс: дни алкоголизации; по оси ординат: длина пройденного пути, в мм (a), вертикальные стойки, количество (b).
В тесте “Приподнятый крестообразный лабиринт” крысы “DAT-HET ethanol”, в отличие от крыс “Wistar ethanol”, предпочитали открытые рукава в начале и спустя 54 дня после начала алкоголизации. Крысы “DAT-HET ethanol” проводили достоверно меньше времени в центре крестообразного лабиринта до начала и на 54-й день алкоголизации по сравнению с животными из группы “Wistar ethanol”. Крысы “DAT-HET ethanol” проводили достоверно меньше времени в закрытых рукавах лабиринта до начала алкоголизации. В конце алкоголизации между группами достоверных отличий не обнаружено. Количество свешиваний с открытых рукавов у группы “DAT-HET ethanol” в начале опыта было больше (8.3 ± 4.6 против 3.0 ±1.0, р < 0.01), однако в последующих тестах различия между группами не достоверны. Также не обнаружено достоверных различий между группами по времени, проведенному в открытых рукавах.
Рис. 4.
Время, проведенное в закрытых (а), открытых рукавах (b) и в центре (с) приподнятого крестообразного лабиринта. По оси абсцисс: дни алкоголизации; по оси ординат: время в мс.
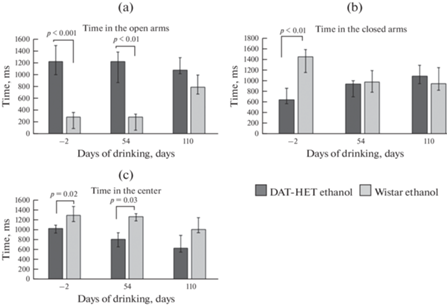
Рис. 5.
Иммуногистохимическая реакция к тирозингидроксилазе на фронтальном срезе мозга крысы Wistar с областью прилежащего ядра (nAcc). При малом увеличении область nAcc выделена квадратом, при большем увеличении в nAcc расположены тирозингидраксилаза-иммунопозитивные отростки. Обозначение: ac – anterior commissure, масштаб: 5 мм (а) и 200 мкм (b).
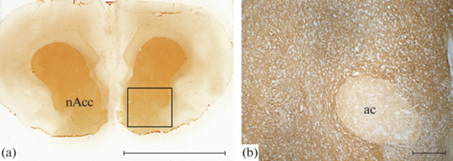
В данном исследовании проведено измерение оптической плотности ТГ- иммунопозитивного материала в отростках дофаминергических нейронов в области прилежащего ядра (nucleus accumbenc) (рис. 5) во всех группах крыс линий DAT-HET и Wistar.
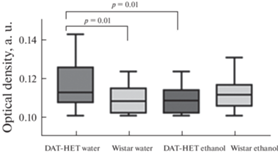
Отмечена исходно более высокая оптическая плотность ТГ-иммунопозитивных отростков в области прилежащего ядра у крыс “DAT-HET water”: M = 113 (0.108; 0.126) по сравнению с группой “Wistar water”: M = 108 (0.103; 0.115). После алкоголизации у крыс “DAT-HET ethanol” отмечается снижение уровня ТГ: М = 109 (0.103; 0.114) по сравнению с группой “DAT-HET water” (рис. 6). Снижение оптической плотности ТГ у крыс “DAT-HET ethanol” отмечается и по сравнению с группой “Wistar ethanol”: M = 112 (0.106; 0.117) (p = 0.04).
Рис. 6.
Оптическая плотность ТГ-иммунопозитивных отростков в области прилежащего ядра у исследуемых групп крыс линий DAT-HET и Wistar. По оси ординaт: оптическaя плотность в условных единицaх (у. е.). Обознaчения: чернaя линия внутри боксa – медиaнa, линии пределa – интерквaртильный рaзмaх. Достоверность отличий при р < 0.05, по Mann–Whitney U test.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данном эксперименте крысы DAT-HET не показали предпочтения этанола в условиях свободной алкоголизации в “Двухстаканной пробе” и демонстрировали низкий уровень его потребления в домашних клетках в течение недели. Ранее было показано, что в условиях полупринудительной алкоголизации крысы DAT-HET по сравнению с Wistar увеличивают потребление и предпочтение этанола [17]. Полученные в данном эксперименте результаты перекликаются с более ранними исследованиями о роли DAT в формировании предпочтения к этанолу именно в условиях свободной алкоголизации. Так, в аналогичных условиях у самцов мышей DAT-KO и DAT-HET снижалось потребление и предпочтение этанола [20]. Следует отметить, что крысы Wistar, потребляющие больше этанола в недельных пробах в середине эксперимента, тоже не демонстрировали достоверно устойчивого предпочтения в процессе алкоголизации и спустя месяц после нее. Наши данные согласуются с результатами работ, показавших, что подобная динамика потребления этанола характерна для животных, которые получают этанол при свободном выборе [21].
Локомоторная активность у крыс DAT-HET до начала алкоголизации достоверно выше, чем у крыс линии Wistar, что неоднократно отмечалось ранее [5, 6]. В дальнейшем на фоне алкоголизации к середине эксперимента локомоторная активность животных линии DAT-HET снизилась и не отличалась от показателей алкоголизирующихся крыс Wistar. Различий в исследовательской активности крыс DAT-HET по сравнению с Wistar не было обнаружено, она была высокой в первом тестировании до начала спаивания и снизилась в последующих тестах. Эти же результаты отмечаются и в конце эксперимента. Возможно, на фоне свободной алкоголизации, при отсутствии формирования предпочтения этанола, уменьшение локомоторной и исследовательской активности у крыс DAT-HET связано с седативным эффектом этанола, который снижает гиперреактивность этой группы животных. Также можно высказать предположение, что на это могут влиять такие факторы, как привыкание к тестовой арене открытого поля и старение животных в процессе эксперимента.
Гиперреактивность крысы DAT-HET демонстрируют и в тесте “Приподнятый крестообразный лабиринт”, что также соответствует поведенческим характеристикам линии [6]. До алкоголизации они статистически значимо больше по сравнению с Wistar проводят времени в открытых рукавах и меньше в центре лабиринта. Такое соотношение нахождения в открытых рукавах и в центре, возможно, свидетельствует о высокой реактивности крыс данной линии. На фоне алкоголизации эта тенденция сохраняется до середины эксперимента, однако в конце эксперимента различия с крысами Wistar нивелируются.
Проекции дофаминергических нейронов, локализованных в области вентральной покрышки среднего мозга (VTA), приходят в область прилежащего ядра и составляют мезолимбический путь, контролирующий систему награды и подкрепления [2, 22]. Поэтому оценка уровня ТГ проводилась в иммунопозитивных отростках дофаминергических нейронов в области прилежащего ядра. Несмотря на невысокое потребление раствора этанола у крыс “DAT-HET ethanol”, уровень ТГ в проекциях дофаминергических нейронов в области прилежащего ядра был ниже у крыс “DAT-HET water”, но не отличался от крыс “Wistar ethanol”. Также имел тенденцию к снижению уровень ТГ у крыс DAT-HET по сравнению с алкоголизироваными крысами Wistar, однако при статистической обработке после поправки Холма–Бонферрони различия нивелируются, вероятно, из-за небольшой выборки.
Известно, что DAT регулирует передачу сигналов на всех пре- и постсинаптических рецепторах дофамина, удаляя нейротрансмиттер из внеклеточного пространства, методом обратного захвата [23], его плотность наиболее высока в стриатуме и прилежащем ядре [24]. У всех крыс с нокаутом DAT нарушение обратного захвата приводит к дисбалансу синтеза дофамина, в частности, у DAT-KO снижается уровень мРНК ТГ в среднем мозге и уровень белка ТГ в стриатуме, а у DAT-HET увеличен внеклеточный уровень дофамина в стриатуме [5]. По этой причине у крыс DAT-HET изначально повышенное количество ТГ в проекциях дофаминергических нейронов в области прилежащего ядра может быть связано с высоким содержанием внеклеточного дофамина в стриатуме. Можно предположить, что даже малые дозы этанола могут воздействовать на дофаминергических нейроны, вызывая снижение общего уровня ТГ в их проекциях в прилежащем ядре, и, вероятно, снижают уровень внеклеточного дофамина в вентральном стриатуме и других структурах мезолимбической системы. При этом у крыс DAT-HET не возникает предпочтения к этанолу по причине работы компенсаторных механизмов в дофаминергической системе. Как следствие, это приводит к снижению содержания дофамина и изменению характерного поведения для данной модели животных, прежде всего их гиперактивности.
Таким образом, можно сделать вывод, что у крыс линии DAT-HET наблюдается увеличение уровня ТГ в прилежащем ядре. Кроме этого, режим свободной алкоголизации снижает уровень ТГ в прилежащем ядре при развитии патологического увеличения содержания ТГ, наблюдающегося у животных линии DAT-HET, но не оказывает эффекта на животных в контрольных группах. Данный вывод хорошо согласуется с полученными поведенческими данными, при которых у крыс DAT-HET снижается избыточная локомоторная активность в условиях алкоголизации. Однако необходимо учесть тот факт, что крысы DAT-HET не сформировали предпочтения этанола в условиях свободной алкоголизации и потребляли меньше алкоголя, чем животные контрольной группы. Таким образом, сравниваемые группы были подвергнуты воздействию разного объема этанола, что вызывает трудности при интерпретации данных с позиции нейрохимического и фармакологического подходов. Однако эти трудности могут быть преодолены в следующих экспериментах, например, с использованием принудительного воздействия одинаковыми низкими объемами этанола.
Список литературы
Jörgen AE, Jerlhag E (2014) Alcohol: mechanisms along the mesolimbic dopamine system. Prog Brain Res 211: 201–233. https://doi.org/10.1016/B978-0-444-63425-2.00009-X
Wise RA, Rompre PP (1989) Brain dopamine and reward. Annu Rev Psychol 40: 191–225. https://doi.org/10.1146/annurev.ps.40.020189.001203
Dunkley PR, Bobrovskaya L, Graham M, von Nagy-Felsobuki EI, Dickson WP (2004) Tyrosine hydroxylase phosphorylation: regulation and consequences. J Neurochem 91: 1025–1043. https://doi.org/10.1111/j.1471-4159.2004.02797.x
Daubner CS, Le T, Wang S (2011) Tyrosine hydroxylase and regulation of dopamine synthesis. Arch Biochem Biophys 508: 1–12. https://doi.org/10.1016/j.abb.2010.12.017
Leo D, Sukhanov I, Zoratto F, Illiano P, Caffino L, Sanna F, Messa G, Emanuele M, Esposito A, Dorofeikova M, Budygin EA, Mus L, Efimova EV, Niello M, Espinoza S, Sotnikova TD, Hoener MC, Laviola G, Fumagalli F, Adriani W, Gainetdinov RR (2018) Pronounced Hyperactivity, Cognitive Dysfunctions, and BDNF Dysregulation in Dopamine Transporter Knock-out Rats. J Neurosci 38(8): 1959–1972. https://doi.org/10.1523/JNEUROSCI.1931-17.2018
Gainetdinov AR, Fesenko ZS, Khismatullina ZR (2020) Behavioural Changes in Heterozygous Rats by Gene Knockout of the Dopamine Transporter (DAT). J Biomed 16 (1): 82–88. https://doi.org/10.33647/2074-5982-16-1-82-88
Conte R, Zangirolame C, Gobbo RD, Pereira L DA S, Panfilio CE, Reginato R, Maluf LS, Scerni DA, Céspedes IC (2022) Effects of moderate alcohol consumption on behavior and neural systems of Wistar rats. An Acad Bras Ciênc 94(3): e20210673. https://doi.org/10.1590/0001-3765202220210673
Rothblat DS, Rubin E, Schneider JS (2001) Effects of chronic alcohol ingestion on the mesostriatal dopamine system in the rat. Neurosci Lett 300(2): 63–66. https://doi.org/10.1016/S0304-3940(01)01548-8
Ericson M, Ulenius L, Andrén A, Jonsson S, Adermark L, Söderpalm B (2020) Different dopamine tone in ethanol high- and low-consuming Wistar rats. Addict Biol 25(3): e12761. https://doi.org/10.1111/adb.12761
Fu R, Zuo W, Shiwalkar N, Mei Q, Fan Q, Chen X, Li J, Bekker A, Ye JH (2019) Alcohol withdrawal drives depressive behaviors by activating neurons in the rostromedial tegmental nucleus. Neuropsychopharmacology 44(8): 1464–1475. https://doi.org/10.1038/s41386-019-0378-8
Van Erp A MM, Miczek KA (2007) Increased accumbal dopamine during daily alcohol consumption and subsequent aggressive behavior in rats. Psychopharmacology (Berl) 191(3): 679–688. https://doi.org/10.1007/s00213-006-0637-3
Hall FS, Sora I, Uhl GR (2003) Sex-dependent modulation of ethanol consumption in vesicular monoamine transporter 2 (VMAT2) and dopamine transporter (DAT) knockout mice. Neuropsychopharmacology 28: 620–628. https://doi.org/10.1038/sj.npp.1300070
Jiao X, Paré WP, Tejani-Butt SM (2006) Alcohol consumption alters dopamine transporter sites in Wistar-Kyoto rat brain. Brain Res (1073-1074): 175–182. https://doi.org/10.1016/j.brainres.2005.12.009
Masserano JM, Takimoto GS, Weiner N (1983) Tyrosine hydroxylase activity in the brain and adrenal gland of rats following chronic administration of ethanol. Alcohol Clin Exp Res 7(3): 294–298. https://doi.org/10.1111/j.1530-0277.1983.tb05463.x
Ortiz J, Fitzgerald WL,Charlton M, Lane S, Trevisan L, Guitart X, Shoemaker W, Duman RS, Nestler EJ (1995) Biochemical actions of chronic ethanol exposure in the mesolimbic dopamine system. Synapse 21(4): 289–298. https://doi.org/10.1002/syn.890210403
Spiga S, Talani G, Mulas G, Licheri V, Fois GR, Muggironi G, Masala N, Cannizzaro C, Biggio G, Sanna E, Diana M (2014) Hampered long-term depression and thin spine loss in the nucleus accumbens of ethanol-dependent rats. Proc Natl Acad Sci U S A 111(35): 3745–3754. https://doi.org/10.1073/pnas.1406768111
Антонова ИВ, Веракса АЕ, Егоров АЮ (2020) Особенности полупринудительной алкоголизации у крыс гетерозигот по нокауту гена дофаминового транспортера (DАT-HET): Пилотное исследование. Вопр наркол 10: 5–15. [Antonova IV, Veraksa AE, Egorov AU (2020) Features of semi-forced alcoholization in rats heterozygous for dopamine transporter gene knockout (DAT-HET): A pilot study. Addict Issues 10: 5–15. (In Russ)]. https://doi.org/10.47877/0234-0623_2020_10_5
Paxinos GT, Watson Ch (1998) The rat brain in stereotaxic coordinates. (Fourth Edition). Acad Press. San Diego, California. USA. Int Standard Book Number: 0-12-547617-5 CD-ROM. http://www.apnet.com
Mikhrina AL, Saveleva LO, Alekseeva OS, Romanova IV (2020) Effects of Active Fragments AgRP 83–132 and 25-51 on Dopamine Biosynthesis in the Brain. Neurosci Behav Physiol 50(3):367–373. https://doi.org/10.1007/s11055-020-00908-z
Savelieva VK, Caudle MW, Findlay SG, Caron MG, Miller GW (2002) Decreased ethanol preference and consumption in dopamine transporter female knock-out mice. Alcohol Clin Exp Res 26(6): 758–764.
Майский АИ, Салимов РМ (1999) Доклиническое изучение препаратов, предлагаемых для клинической апробации в качестве средств для лечения алкоголизма. Вед фармакол комитета 2: 26–31. [Maisky AI, Salimov RM (1999) Preclinical research of drugs proposed for clinical validation as a treatment for alcoholism. Bull Pharmacol Commit 2: 26–31. (In Russ)].
Угрюмов МВ (1999) Механизмы нейроэндокринной регуляции. М. Нaукa. 82–122. [Ugryumov MV (1999) Mechanisms of neuroendocrine regulation. M. Nauka. 82–122. (In Russ)].
Beaulieu JM, Gainetdinov RR (2011) The Physiology, Signaling, and Pharmacology of Dopamine Receptors. Pharmacol Rev 63(1): 182–217. https://doi.org/10.1124/pr.110.002642
Brooks DJ (2016) Molecular imaging of dopamine transporters. Age Res Rev 30: 114–121. https://doi.org/10.1016/j.arr.2015.12.009
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


