Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 466-476
Иммуногистохимическое исследование макрофагов седалищного нерва крысы после повреждения и субпериневрального введения мезенхимных стволовых клеток
Е. С. Петрова 1, *, Е. А. Колос 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: iempes@yandex.ru
Поступила в редакцию 03.02.2023
После доработки 03.03.2023
Принята к публикации 07.03.2023
- EDN: VJJIZZ
- DOI: 10.31857/S0869813923040076
Аннотация
Изучена динамика изменений процессов валлеровской дегенерации в седалищном нерве крыс Вистар-Киото после травмы (наложения лигатуры, 40 с): исследованы плотность Iba-1+ макрофагов и состояние миелиновых волокон, окрашенных люксолевым прочным синим, в дистальном сегменте нерва в разные сроки после повреждения. Части крыс субпериневрально трансплантировали мезенхимные стволовые клетки костного мозга крыс той же линии. Показано, что наибольшая плотность распределения макрофагов в дистальном сегменте нерва наблюдается через 7 сут после операции. Применение клеточной терапии приводит к снижению числа макрофагов в этот срок и к задержке демиелинизации поврежденных нервных волокон. Через 60 сут после операции плотность популяции макрофагов и количество ремиелинизированных регенерирующих нервных волокон дистального сегмента нерва не отличается у контрольных (лигатура) и подопытных (лигатура и введение мезенхимных стволовых клеток) животных. Молекулярные механизмы отмеченных изменений в ранние сроки после повреждения требуют дальнейших исследований.
ВВЕДЕНИЕ
В течение последних двух десятилетий в экспериментальных нейробиологических исследованиях активно ведется разработка способов стимуляции регенерации нервных проводников с применением мезенхимных стволовых клеток (МСК), полученных из разных тканей [1, 2]. МСК рассматривают как источник ростовых факторов и цитокинов, которые влияют на репаративные процессы в поврежденных нервах. Известно, что МСК вырабатывают такие биологически активные вещества, как ростовые (эпидермальный фактор роста, трансформирующий фактор роста β, тромбоцитарный фактор роста, фактор роста гепатоцитов и др.), ангиогенные (bFGF, VEGF), антиоксидантные, иммуносупрессивные и другие факторы, способные оказывать репаративное, антиапоптотическое, противовоспалительное и антифибротическое влияние на ткани, а также комплекс цитокинов и хемокинов [3]. В исследованиях, выполненных на различных экспериментальных моделях поврежденного нерва с использованием генной терапии, доказано, что некоторые из них оказывают воздействие на рост нервных волокон: например, нейротрофический фактор головного мозга [4], фактор роста гепатоцитов [5], фактор роста фибробластов (FGF2), фактор роста эндотелия сосудов (VEGF) [6]. Кроме того, МСК могут оказывать влияние на шванновские клетки (нейролеммоциты) и фибробласты эндоневрия, на ангиогенез микрососудов эндоневрия [7], на клетки соединительнотканных оболочек нерва. Влияние экзогенных МСК на изменение клеточных взаимодействий, происходящих в нерве в ответ на травму, остается малоизученным. Удобной моделью для изучения межклеточных коммуникаций, происходящих в нерве после повреждения, является субпериневральная трансплантация МСК.
Известно, что после травмы нерва в его дистальном сегменте начинается валлеровская дегенерация (WD), включающая в себя распад нервных волокон, их демиелинизацию, миграцию гематогенных макрофагов, дедифференцировку шванновских клеток и ряд других клеточных и молекулярных изменений [8–10]. Практически одновременно из проксимального отдела нерва начинают расти на периферию регенерирующие аксоны. Большое значение для осуществления их регенерации имеют макрофаги [11]. Резидентные и гематогенные макрофаги принимают участие в уборке продуктов распада миелина, а также модулируют шванновские клетки и, вырабатывая факторы роста, цитокины, белки экстрацеллюлярного матрикса, создают необходимое для регенерации нервных волокон микроокружение [12]. Каскад событий, развивающихся в дистальном сегменте поврежденного нерва, достаточно сложен, многие вопросы, касающиеся взаимодействия клеток эндоневрия и их регуляции, до сих пор неясны [3, 10]. Целью настоящей работы явилось исследование Iba-1+ макрофагов в седалищном нерве крысы после травмы и однократной трансплантации МСК.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании использовали крыс инбредной линии Вистар-Киото массой 200–250 г (n = 50). Повреждение седалищных нервов крыс и трансплантацию МСК осуществляли по методу, описанному в предыдущих исследованиях [13, 14]. У крыс-реципиентов под эфирным наркозом после эпиляции делали разрез кожи размером 1–1.5 см на уровне верхней трети бедра, раздвигали подлежащие мышцы и повреждали седалищный нерв путем наложения лигатуры в течение 40 с. Части животных субпериневрально в крупный нервный ствол седалищного нерва вводили взвесь МСК (5 × 104 в 5 мкл культуральной среды). Животным контрольной группы повреждали седалищный нерв аналогичным образом и вводили субпериневрально культуральную среду в объеме 5 мкл. МСК костного мозга крыс Вистар-Киото получали в ООО Транс-Технологии (ген. директор к. б. н. Д.Г. Полынцев). Выделение МСК и их характеристика представлены в работе Зиньковой и соавт. [15]. МСК выделяли из костного мозга бедренной кости крыс Вистар-Киото и культивировали в стандартных условиях. Проведенное фенотипирование показало, что 97% клеток полученной взвеси экспрессирует на поверхности CD90+. Ранее показано, что используемые для трансплантации клетки в условиях in vitro обладают свойствами, характерными для МСК: адгезивностью, морфологическим сходством с фибробластами и экспрессией виментина [13].
После операции крыс содержали в стандартных условиях вивария без ограничения доступа к корму и воде. Через 1, 7, 21 и 60 сут после операции животных умерщвляли передозировкой паров этилового эфира, выделяли фрагменты седалищного нерва и фиксировали в течение 1 суток в растворе цинк-этанол-формальдегида [16]. Для дальнейших гистологических исследований материал обезвоживали в этиловом спирте и ксилоле и заливали в парафин. Cрезы седалищных нервов изготавливали на ротационном микротоме фирмы Pfm Rotary 3003 (PFM, Германия). Толщина срезов составляла 5 мкм.
Для идентификации макрофагов проводили иммуногистохимическую реакцию на белок Iba-1. Первичные антитела наносили на депарафинированные срезы. В качестве первичных антител использовали поликлональные козьи антитела к антигену Ibа-1 (разведение 1 : 800, AbCam, Великобритания). При выявлении комплекса антиген–антитело применяли вторичные антикозьи биотинилированные антитела и стрептавидин, конъюгированный с пероксидазой, из набора Anti-Goat HRP-DAB Cell & Tissue Staining Kit (R&D Systems, США). Визуализацию продукта иммуногистохимической реакции проводили при помощи диаминобензидинового хромогена (DAB+) (Agilent, США; ранее Dako, Дания). После проведения реакций часть срезов подкрашивали толуидиновым синим для обзорного гистологического анализа препаратов.
Для изучения изменений миелиновых оболочек применяли гистохимическое окрашивание люксолевым прочным синим (Luxol fast blue) (LFB). При отработке протокола окрашивания основывались на рекомендациях Niemi и соавт. [17] и Коржевского и соавт. [18].
Области с Iba-1+ или LFB-реакцией измеряли с помощью программного обеспечения ImageJ. Площадь, занятую структурами с положительной реакцией, выражали в процентах от общей исследованной площади. Измерения проводили на 4–5 изображениях при увеличении микроскопа ×400 (для миелина) и при увеличении ×100 (для макрофагов). При проведении статистического анализа применяли непараметрический критерий Краскела–Уоллиса. Попарное сравнение показателей производилось по U-критерию. Данные гистограмм приведены как среднее значение в группе со стандартным отклонением. Различия считали значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Гистологический анализ продольных срезов седалищного нерва показал, что в интактном нерве крысы структуры, содержащие белок Iba-1, в бóльшем количестве встречаются в эпиневральной соединительнотканной оболочке, в эндоневрии они представлены в незначительном числе. Выявленные в интактном нерве крысы отдельные Iba-1+ клетки являются резидентными макрофагами. Они присутствуют в эндоневрии среди нервных волокон, нейролеммоцитов, фибробластов и других клеточных элементов. Это небольшие отростчатые клетки неправильной формы, большинство из них вытянуты вдоль нервных волокон. Нередко они встречаются вблизи кровеносных микрососудов. Через 1 сут после операции в дистальном сегменте нерва крысы плотность популяции макрофагов достоверно не меняется по сравнению с нервом интактных животных ни в контрольной, ни в опытной группе. Однако некоторые Iba-1+ клетки становятся более заметными, увеличиваясь в размерах.
Через 7 сут после повреждения на срезах дистального сегмента нервного ствола определяли площадь, занимаемую Iba-1+ клетками. Оказалось, что в этот период в его эндоневрии резко увеличивается количество макрофагов по сравнению с интактным нервом. Об этом свидетельствует достоверное увеличение площади среза, занятой структурами с положительной реакцией на Iba-1 (рис. 1). В настоящем исследовании показано, что через 7 сут Iba-1+ макрофаги выстраиваются цепочками вдоль погибших нервных волокон и фагоцитируют продукты распада нейритов и их миелиновых оболочек (рис. 2а). В более поздние сроки наблюдений их число снижается и через 60 сут не отличается от контроля (рис. 1).
Рис. 1.
Изменение плотности распределения Iba-1+ макрофагов в седалищном нерве крысы в разные сроки после повреждения. По оси ординат – доля площади, занимаемой Iba-1+ структурами, %. * p < 0.05 по сравнению с интактным нервом; ** p < 0.05 по сравнению с контрольной группой (лигатура).
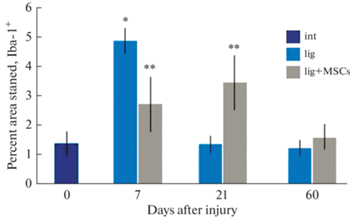
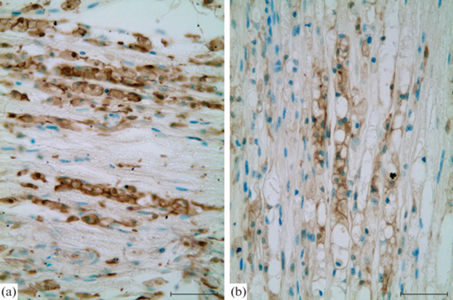
Рис. 2.
Iba-1+ макрофаги в нервном стволе крысы через 7 суток после наложения лигатуры (а) и после наложения лигатуры и введения МСК (b). Иммуногистохимическая реакция на белок Iba-1 (макрофаги коричневого цвета), подкраска толуидиновым синим. Масштабный отрезок равен 50 мкм.
Сравнительное исследование площади, занимаемой иммунореактивными клетками в группе крыс с лигатурой и в группе крыс, которым после наложения лигатуры трансплантировали МСК, показало, что однократное введение суспензии МСК приводило к заметному снижению количества Iba-1+ макрофагов (рис. 1, 2b). Через 21 сут число макрофагов в дистальном сегменте после введения МСК превышало их количество в контрольной группе (лигатура без введения клеток) (рис. 1). Через 60 сут в эндоневрии дистального сегмента поврежденного нерва число макрофагов на единицу площади снижалось до уровня интактного нерва.
Для того, чтобы сопоставить полученные данные об изменении плотности популяции макрофагов в дистальном сегменте поврежденного нерва с процессами WD, мы исследовали состояние миелиновых волокон в изученные сроки после травмы и применения клеточной терапии. Для этого был использован метод визуализации миелина с помощью гистохимического окрашивания люксолевым прочным синим (рис. 3).
Рис. 3.
Изменение плотности миелиновых нервных волокон в седалищном нерве крысы после наложения лигатуры и введения МСК. (a) – интактный нерв, (b) – проксимальный отдел нерва после травмы через 7 суток, (c) – дистальный сегмент нерва через 7 суток после травмы, (d) – дистальный сегмент нерва через 21 сутки после травмы, (e) – дистальный сегмент через 7 суток после лигатуры и введения МСК, (f) – дистальный сегмент через 21 сутки после лигатуры и введения МСК. Окраска Luxol fast blue. Масштабный отрезок равен 50 мкм.
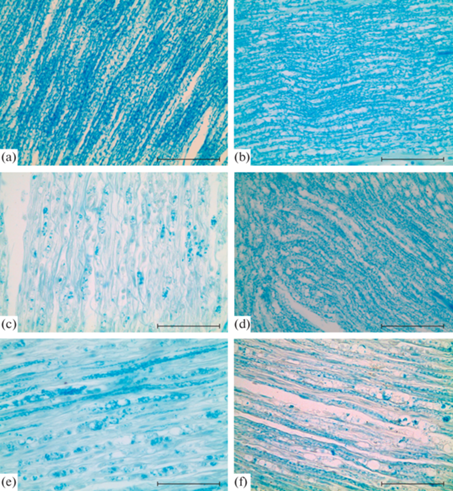
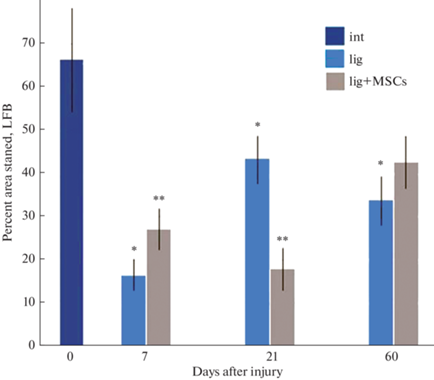
Подсчет окрашенной LFB площади нерва показал, что количество миелиновых волокон после травмы резко снижается к 7 сут и постепенно возрастает через 21 сут (рис. 3, 4). Что касается эксперимента с введением МСК, установлено, что через 7 сут после травмы в дистальном сегменте нерва сохраняется больше миелиновых волокон, чем в контроле. Однако через 21 сут после операции плотность миелиновых волокон ниже, чем в контрольных нервах. Через 60 сут в нервах животных контрольной и опытной группы процент миелинизации достоверно не отличается и возрастает по сравнению с предыдущим сроком (рис. 4). При этом процент миелинизации не достигает уровня интактного нерва.
Рис. 4.
Изменение плотности распределения LFB+ миелина в дистальном сегменте седалищного нерва крысы в разные сроки после повреждения. По оси ординат – доля площади, занимаемой LFB+ структурами, %. * p < 0.05 по сравнению с интактным нервом; ** p < 0.05 по сравнению с контрольной группой (лигатура).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящее время установлено, что экспериментальная клеточная терапия с применением МСК может способствовать регенеративным процессам, протекающим в поврежденных тканях, однако ее роль в регуляции локального воспаления, возникающего в нервных проводниках в ответ на механическое повреждение, изучена недостаточно. В настоящей работе исследованы изменения, происходящие в седалищном нерве крысы после травмы и трансплантации МСК в период развития WD. Проведено сопоставление двух процессов: реакции макрофагов и реорганизации миелиновых оболочек нервных волокон дистального сегмента нерва.
Следует отметить, что макрофаги периферических нервных проводников являются малоизученной гетерогенной популяцией. Макрофаги, выявленные нами в интактном нерве и в нерве через 1 сутки после травмы, представляют собой резидентные клетки, которые по данным литературы составляют 2–9% всех клеток нерва [19] и выполняют ряд важных функций. Во-первых, они участвуют в процессе фагоцитоза продуктов распада миелина в первые сутки после повреждения нерва, в период, предшествующий миграции в нерв гематогенных моноцитов/макрофагов [11]. Во-вторых, предположительно именно эти клетки ответственны за асептический статус воспалительной реакции, которая развивается в нерве после травмы в период, соответствующий WD. В-третьих, наряду с нейролеммоцитами они способствуют рекрутированию гематогенных макрофагов, миграции в дистальный сегмент нерва моноцитов из кровеносного русла. В нашем исследовании показано, что число резидентных макрофагов в интактном нерве крысы невелико и через 1 сут после повреждения их количество достоверно не меняется.
В последующие сроки после операции (7–60 сут) мы исследовали плотность распределения всех макрофагов, как резидентных, так и гематогенных, поскольку используемый в настоящей работе ИГХ-маркер – кальций-связывающий белок Iba-1 – не позволяет разделить различные субпопуляции мононуклеарных фагоцитов. Он применяется для идентификации макрофагов различных органов и тканей, в том числе микроглиоцитов ЦНС [20, 21] и макрофагов периферических нервных проводников [22–24].
Показано, что через 7 сут после операции в дистальном сегменте поврежденного нерва наблюдается наиболее высокая плотность распределения Iba-1+ клеток по сравнению с другими изученными сроками. Это наблюдение согласуется с ранее полученными данными гистологических и электронномикроскопических исследований [8]. Считается, что пик миграции моноцитов/макрофагов приходится на 7–14-е сутки после передавливания и зависит от степени поврежденности нерва и степени нарушения гемато-неврального барьера.
В настоящей работе плотность распределения макрофагов сопоставляли с изменением миелиновых нервных волокон в дистальном сегменте нерва. Для изучения состояния миелиновых волокон применяли метод визуализации миелина с помощью гистохимического окрашивания красителем LFB. LFB имеет свойство связываться с липопротеинами миелиновой оболочки и считается простым и надежным методом измерения клиренса миелина [17, 25].
Сопоставление данных, полученных при оценке популяции макрофагов и миелиновых нервных волокон в поврежденном нерве, показало, что в его дистальном сегменте наблюдается процесс WD, гибель части аксонов и разрушение их миелиновых оболочек. Через 7 сут выявлено увеличение числа макрофагов и снижение количества миелина. В дальнейшем наблюдается ремиелинизация регенерирующих нервных волокон, число макрофагов уменьшается.
Установлено, что под влиянием клеточной терапии последовательность событий меняется. Оказалось, что через 7 сут наблюдается замедление демиелинизации в дистальном сегменте нерва, часть тонких миелиновых волокон сохраняется, не подвергаясь WD. Плотность распределения миелина в этот срок у подопытных животных выше, чем у контрольных (повреждение нерва без введения МСК) в полтора раза. При этом плотность популяции макрофагов в группе животных с трансплантацией МСК ниже, чем в контроле. Через 21 сут у животных контрольной группы отмечена ремиелинизация большинства регенерирующих нервных волокон, в то время как у подопытных животных в этот срок доля площади, занятой миелином, оказывается значительно ниже, чем в контроле. Выравнивание процента миелинизации у контрольных и подопытных животных наблюдается через два месяца после операции и свидетельствует о том, что отмеченное воздействие МСК (в использованной концентрации) носит непродолжительный характер.
Полученный результат согласуется с данными японских исследователей Miyano и соавт. [27], которые изучали влияние однократного введения полученных из пуповины МСК на поврежденный седалищный нерв и соответствующие спинномозговые ганглии крысы. Было показано, что после применения МСК количество поврежденных вследствие травмы нерва нейронов спинномозговых ганглиев, а также Iba-1+ макрофагов в них значительно снижается. Работа Miyano и соавт. явилась первым исследованием, в котором изучено влияние клеточной терапии на процесс демиелинизации аксонов нерва. Впервые было установлено, что клеточная терапия может способствовать сохранности миелиновых волокон в дистальном сегменте нерва после повреждения [27].
Как отмечалось ранее, МСК оказывают влияние на репаративные процессы, происходящие в поврежденных нервных проводниках, благодаря секреции комплекса нейротрофических и ростовых факторов, цито- и хемокинов [3, 28]. Показано, что применение МСК (а также экзосом МСК или кондиционированной среды культуры МСК) может приводить к уменьшению нейропатической боли [29], способствовать сохранности нейронов реципиента [30, 31], влиять на демиелинизацию аксонов за счет уменьшения уровня провоспалительных цитокинов [27].
Экзогенные МСК, вырабатывая биологически активные вещества, а также непосредственно контактируя с эндогенными клетками реципиента, способны изменять микроокружение регенерирующих нервных волокон и влиять на популяции макрофагов и нейролеммоцитов [29]. Дальнейшее изучение воздействия экзогенных МСК на функциональную активность макрофагов поврежденного нерва и на их поляризацию (трансформацию провоспалительных макрофагов М1 в иммуносупрессорные противовоспалительные клетки М2) могут прояснить механизм их влияния на процессы де- и ремиелинизации нервных волокон дистального конца поврежденного нерва.
Таким образом, в настоящей работе впервые изучена динамика Iba-1+ макрофагов в поврежденном седалищном нерве крысы в разные сроки после наложения лигатуры и однократной субпериневральной трансплантации МСК костного мозга. Установлено, что при применении экспериментальной клеточной терапии наблюдается задержка миграции гематогенных макрофагов, что коррелирует с задержкой процесса демиелинизации поврежденных нервных волокон. Показано, что через 60 сут после операции плотность популяции макрофагов и количество ремиелинизированных регенерирующих нервных волокон дистального сегмента нерва не отличается у контрольных (лигатура) и подопытных (лигатура и введение МСК) животных. Молекулярные механизмы отмеченных на ранних сроках после повреждения нерва изменений требуют дальнейших исследований.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
При работе с животными руководствовались международными правилами Европейского сообщества по гуманному обращению с экспериментальными животными. Исследование было одобрено этическим комитетом Федерального государственного бюджетного научного учреждения “Институт экспериментальной медицины” (протокол № 2/22 от 06.04.2022).
Список литературы
Lavorato A, Raimondo S, Boido M, Muratori L, Durante G, Cofano F, Vincitorio F, Petrone S, Titolo P, Tartara F, Vercelli A, Garbossa D (2021) Mesenchymal stem cell treatment perspectives in peripheral nerve regeneration: systematic review. Int J Mol Sci 22 (2): 572. https://doi.org/10.3390/ijms22020572
Siemionow M, Strojny MM, Kozlowska K, Brodowska S, Grau-Kazmierczak W, Cwykiel J (2022) Application of human epineural conduit supported with human mesenchymal stem cells as a novel therapy for enhancement of nerve gap regeneration. Stem Cell Rev Rep 18(2): 642–659. https://doi.org/10.1007/s12015-021-10301-z
Петрова ЕС (2022) Клеточные технологии в экспериментальной терапии повреждений нерва (проблемно-аналитический обзор). Успехи совр биол 142(6): 638–649. [Petrova ES (2022) Cell technologies in experimental damage therapy nerve (problem-analytical review). Succes Modern Biol 142(6): 638–649. (In Russ)].https://doi.org/10.31857/S0042132422060060
Karagyaur M, Makarevich P, Semina E, Stambolsky D, Plekhanova O, Tkachuk V, Dyikanov D, Kalinina N (2015) Non-viral transfer of BDNF and UPA stimulates peripheral nerve regeneration. Biomed & Pharmacother 74: 63–70. https://doi.org/10.1016/j.biopha.2015.07.002
Boldyreva MA, Bondar IV, Stafeev IS, Makarevich PI, Beloglazova IB, Zubkova ES, Shevchenko EK, Molokotina YD, Karagyaur MN, Ratner EI, Parfyonova YV (2018) Plasmid-based gene therapy with hepatocyte growth factor stimulates peripheral nerve regeneration after traumatic injury. Biomed Pharmacother 101: 682–690. https://doi.org/10.1016/j.biopha.2018.02.138
Masgutov R, Zeinalova A, Masgutova G, Salafutdinov I, Garanina E, Syromiatnikova V, Idrisova K, Mullakhmetova A, Andreeva D, Mukhametova L, Rizvanov A, Bogov A, Kadyrov A, Pankov I (2021) Angiogenesis and nerve regeneration induced by local administration of PLASMID PBUD-COVEGF165-COFGF2 into the intact rat sciatic nerve. Neural Regenerat Res 16(9): 1882–1889. https://doi.org/10.4103/1673-5374.306090
Petrova ES, Isaeva EN, Kolos EA, Korzhevskii DE (2018a) Vascularization of the damaged nerve under the effect of experimental cell therapy. Bull Exp Biol Med 165(1): 161–165. https://doi.org/10.1007/s10517-018-4120-z
Ноздрачев АД, Чумасов ЕИ (1999) Периферическая нервная система. СПб. Наука. [Nozdrachev AD, Chumasov EI (1999) Peripheral nervous system. St. Petersburg. Nauka. (In Russ)].
Koeppen AH (2004) Wallerian degeneration: history and clinical significance. J Neurol Sci 220: 115–117. https://doi.org/10.1016/j.jns.2004.03.008
Kerns JM, Walter JS, Patetta MJ, Sood A, Hussain AK, Chung JJ, Deshpande A, DesLaurier JT, Dieter RA, Siemionow M, Seiler FA, Amirouche FML, Gonzalez MH (2021) Histological assessment of Wallerian degeneration of the rat tibial nerve following crush and transection injuries. J Reconstr Microsurg 37(5): 391–404. https://doi.org/10.1055/s-0040-1716870
Kolter J, Kierdorf K, Henneke P (2020) Origin and differentiation of nerve-associated macrophages. J Immunol 204 (2): 271–279. https://doi.org/10.4049/jimmunol.1901077
Chen P, Piao X, Bonaldo P (2015) Role of macrophages in Wallerian degeneration and axonal regeneration after peripheral nerve injury. Acta Neuropathol 130(5): 605–618. https://doi.org/10.1007/s00401-015-1482-4
Petrova E, Isaeva E, Kolos E, Korzhevskii D (2018) Allogeneic bone marrow mesenchymal stem cells in the epineurium and perineurium of the recipient rat. Biol Communicat 63(2): 123–132. https://doi.org/10.21638/spbu03.2018.205
Petrova ES, Kolos EA (2021) Nerve fiber regeneration in the rat sciatic nerve after injury and administration of mesenchymal stem cells. Neurosci Behav Physiol 51(4): 513–518. https://doi.org/10.1007/s11055-021-01098-y
Zinkova NN, Sokolova IB, Shvedova EV, Bilibina AA, Kruglyakov PV, Polyntsev DG, Gilerovitch EG (2007) Dynamics of morphological changes after transplantation of mesenchymal stem cells in rat brain provoked by stroke. Cell Tissue Biol 1(6): 482–490.
Grigorev IP, Korzhevskii DE (2018) Current technologies for fixation of biological material for immunohistochemical analysis (Review). Modern Technol Med 10(2): 156–165. https://doi.org/10.17691/stm2018.10.2.19
Niemi JP, DeFrancesco-Lisowitz A, Roldán-Hernández L, Lindborg JA, Mandell D, Zigmond RE (2013) A critical role for macrophages near axotomized neuronal cell bodies in stimulating nerve regeneration. J Neurosci 33(41): 16236–16248. https://doi.org/10.1523/JNEUROSCI.3319-12.2013
Коржевский ДЭ, Григорьев ИП, Колос ЕА, Сухорукова ЕГ, Кирик ОВ, Алексеева ОС, Гусельникова ВВ (2015) Молекулярная нейроморфология. Нейродегенерация и оценка реакции нервных клеток на повреждение. Санкт-Петербург. СпецЛит. [Korzhevskii DE, Grigoriev IP, Kolos EA, Sukhorukova EG, Kirik OV, Alekseeva OS, Guselnikova VV (2015) Molecular neuromorphology. Neurodegeneration and evaluation of the response of nerve cells to damage. St. Petersburg. SpecLit. (In Russ)].
DeFrancesco-Lisowitz A, Lindborg JA, Niemi JP, Zigmond RE (2015) The neuroimmunology of degeneration and regeneration in the peripheral nervous system. Neuroscience 302: 174–203. https://doi.org/10.1016/j.neuroscience.2014.09.027
Kolos EA, Korzhevskii DE (2020) Spinal cord microglia in health and disease. Acta Naturae 12(1(44)): 4–17. https://doi.org/10.32607/actanaturae.10934
Ohsawa K, Imai Y, Kanazawa H, Sasaki Y, Kohsaka S (2000) Involvement of Iba1 in membrane ruffling and phagocytosis of macrophages/microglia. J Cell Sci 113 (17): 3073–3084. https://doi.org/10.1242/jcs.113.17.3073
Komori T, Morikawa Y, Inada T, Hisaoka T, Senba E (2011) Site-specific subtypes of macrophages recruited after peripheral nerve injury. Neuroreport 22: 911–917. https://doi.org/10.1097/WNR.0b013e32834cd76a
Старинец АА, Пономаренко АИ, Манжуло ИВ, Манжуло OC (2019) Активность М1/М2-макрофагов при повреждении седалищного нерва у крыс. Нац научн центр морск биол им АВ Жирмунского ДВО РАН. Владивосток. 90–95. [Starinets AA, Ponomarenko AI, Manzhulo IV, Manzhulo OC (2019) M1/M2 macrophage activity in rats with sciatic nerve injury. Nat Res Center for Marine Biol AV Zhirmunsky FEB RAS. Vladivostok. 90–95. (In Russ)].
Петрова ЕС, Колос ЕА (2022) Iba-1-иммунопозитивные клетки в седалищном нерве крысы в норме и при патологии. Современная нейробиология: фундаментальные исследования и практические аспекты. Уфа. Изд-во Башкирск гос универ. 226–230. [Petrova ES, Kolos EA (2022) Iba-1-immunopositive cells in the sciatic nerve of rats in normal and pathological conditions. Modern neurobiology: fundamental research and practical aspects. Ufa. Publisher: Bashkir State Univer. 226–230. (In Russ)]. https://doi.org/10.33184/snfipa-2022-10-19.24
Lindborg JA, Mack M, Zigmond RE (2017) Neutrophils are critical for myelin removal in a peripheral nerve injury model of Wallerian degeneration. J Neurosci 37(43): 10258–10277. https://doi.org/10.1523/JNEUROSCI.2085-17.2017
Otake K, Toriumi T, Ito T, Okuwa Y, Moriguchi K, Tanaka S, Isobe Y, Saku T, Kurita K, Honda M. (2020) Recovery of sensory function after the implantation of oriented-collagen tube into the resected rat sciatic nerve. Regen Ther 14: 48–58. https://doi.org/10.1016/j.reth.2019.12.004
Miyano K, Ikehata M, Ohshima K, Yoshida Y, Nose Y, Yoshihara S-I, Oki K, Shiraishi S, Uzu M, Nonaka M, Higam Y, Uezono Y (2022) Intravenous administration of human mesenchymal stem cells derived from adipose tissue and umbilical cord improves neuropathic pain via suppression of neuronal damage and anti-inflammatory actions in rats. PLoS One 17(2): e0262892. https://doi.org/10.1371/journal.pone.0262892
Li X, Guan Y, Li C, Zhang T, Meng F, Zhang J, Li J, Chen S, Wang Q, Wang Y, Peng J, Tang J (2022) Immunomodulatory effects of mesenchymal stem cells in peripheral nerve injury. Stem Cell Res Ther 13(1): 18. https://doi.org/10.1186/s13287-021-02690-2
Shiue SJ, Rau RH, Shiue HS, Hung YW, Li ZX, Yang KD, Cheng JK (2019) Mesenchymal stem cell exosomes as a cell-free therapy for nerve injury-induced pain in rats. Pain 160(1): 210–223. https://doi.org/10.1097/j.pain.0000000000001395
Masgutov R, Masgutova G, Mullakhmetova A, Zhuravleva M, Shulman A, Rogozhin A, Syromiatnikova V, Andreeva D, Zeinalova A, Idrisova K, Allegrucci C, Kiyasov A, Rizvanov A (2019) Adipose-Derived Mesenchymal Stem Cells Applied in Fibrin Glue Stimulate Peripheral Nerve Regeneration. Front Med 6: 68. https://doi.org/10.3389/fmed.2019.00068
Demyanenko SV, Pitinova MA, Kalyuzhnaya YN, Khaitin AM, Batalshchikova SA, Dobaeva NM, Shevtsova YA, Goryunov KV, Plotnikov EY, Pashkevich SG, Sukhikh GT, Silachev DN (2022) Human Multipotent Mesenchymal Stromal Cell–Derived Extracellular Vesicles Enhance Neuroregeneration in a Rat Model of Sciatic Nerve Crush Injury. Int J Mol Sci 23: 8583. https://doi.org/10.3390/ ijms23158583
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


