Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 517-529
Роль кальциевых каналов L-типа в повышенной утомляемости камбаловидных мышц крыс на фоне функциональной разгрузки
К. А. Шарло 1, *, И. Д. Львова 1, С. А. Тыганов 1, Д. А. Сидоренко 1, Б. С. Шенкман 1
1 Институт медико-биологических проблем Российской академии наук
Москва, Россия
* E-mail: sharlokris@gmail.com
Поступила в редакцию 20.02.2023
После доработки 10.03.2023
Принята к публикации 10.03.2023
- EDN: VJOVIZ
- DOI: 10.31857/S086981392304009X
Аннотация
Избыточное долговременное накопление ионов кальция в миоплазме скелетных мышц может негативно влиять на митохондрии и приводить к нарушению функционирования мышцы. Целью настоящего исследования стало выявление роли кальциевых каналов L-типа в развитии повышенной утомляемости камбаловидной мышцы крыс в условиях функциональной разгрузки. Cамцы крыс Вистар были разделены на три группы по 8 животных в каждой: группа виварного контроля (С), группа, подвергнутая разгрузке задних конечностей на протяжении 7 сут (7HS), и группа, подвергнутая 7-суточной разгрузке задних конечностей с ежедневным внутрибрюшинным введением нифедипина (7 мг/кг массы тела). Введение нифедипина на фоне вывешивания предотвратило рост кальций-зависимого фосфорилирования кальций-кальмодулин киназы II и повышение утомляемости и способствовало сохранению митохондриальных белков, ДНК и экспрессии мРНК ряда генов-регуляторов биогенеза митохондрий в камбаловидных мышцах животных.
ВВЕДЕНИЕ
Состояние функциональной (механической) разгрузки скелетных мышц наблюдается при иммобилизации в травматологии, длительном постельном режиме или ограничении двигательной активности человека или животного, а также в условиях космического полета [1]. Это состояние приводит к изменениям молекулярных регуляторных путей в скелетной мышце, что в свою очередь уже после 3–7 сут механической разгрузки мышц ведет к снижению экспрессии мРНК “медленной” изоформы тяжелых цепей миозина, снижению окислительных способностей мышц и повышению утомляемости, что негативно отражается на качестве жизни и работоспособности людей и осложняет реабилитацию [1]. В наибольшей степени негативным изменениям, вызванным механической разгрузкой, подвержены позно-тонические мышцы, в частности, камбаловидная мышца, у человека принимающая участие в поддержании вертикального положения тела, ходьбе и беге [2]. Параллельно с описанными изменениями в миоплазме камбаловидной мышцы уже после вторых суток функциональной разгрузки наблюдается накопление ионов кальция, которое сохраняется как минимум до 14 сут воздействия [3, 4]. По данным ряда работ, ключевым событием, приводящим к избытку кальция в миоплазме в условиях функциональной разгрузки мышц, является деполяризация сарколеммы и последующее открытие кальциевых каналов L-типа (дигидропиридиновых каналов) [5, 6].
Известно, что избыточное долговременное накопление ионов кальция в миоплазме скелетных мышц может приводить к истощению депо саркоплазматического ретикулума и повышению утомляемости мышцы [7], а также за счет увеличения содержания внутримитохондриального кальция может происходить нарушение митохондриальных функций и активация митофагии [8]. В связи с этим, целью настоящего исследования стало выявление роли активации кальциевых каналов L-типа в развитии повышенной утомляемости камбаловидной мышцы крыс в условиях функциональной разгрузки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Самцы крыс Вистар в возрасте 1.5–2 мес. и массой тела 180–200 г были разделены на три группы по 8 животных в каждой: группа виварного контроля (С), группа, подвергнутая разгрузке задних конечностей на протяжении 7 сут с ежедневным внутрибрюшинным введением плацебо (2%-ный диметилсульфоксид в физрастворе) (7HS), и группа, подвергнутая 7-суточной разгрузке задних конечностей с ежедневным внутрибрюшинным введением нифедипина (7 мг/кг массы тела, в 2%-ном диметилсульфоксиде в физрастворе). В исследовании использовалась общепринятая модель антиортостатического вывешивания, позволяющая имитировать эффекты гипогравитации [9]. После проведения эксперимента у каждого животного под бромэтанольным наркозом из обеих ног были выделены камбаловидные мышцы, после чего одна из мышц подвергалась анализу утомляемости ex vivo, а вторая замораживалась в жидком азоте. Животные содержались в виварных условиях, получая стандартный корм и воду ad libitum.
Анализ утомляемости
Камбаловидные мышцы экспериментальных животных были помещены в охлажденный раствор Рингера–Кребса с постоянным продуванием 95%-ным карбогеном и инкубированы в течение 15 мин. В это время на сухожилиях были завязаны узлы, необходимые для крепления мышцы. После 15 мин мышца была помещена в ванночку для теста с фиксированной температурой 37°С, прикреплена за сухожилия к датчику силы с одного конца и к фиксированному крючку с другого, после чего была определена оптимальная длина мышцы с помощью подачи короткого электрического импульса (супра-максимальные квадратные импульсы 0.5 мс, 20 В) и замера силы сокращения мышцы (наибольшая сила одиночного сокращения соответствует оптимальной длине мышцы (L0) [10]. L0 была измерена с помощью цифрового штангенциркуля. После одиночных сокращений был проведен тест на тетаническое изометрическое сокращение. Мышца была установлена на длину L0, после чего начиналась стимуляция (1-миллисекундные квадратные импульсы, 40 Гц, продолжительность стимуляции 2 с), в процессе чего фиксировалась максимальная сила тетанического сокращения. Для тестирования индекса утомления камбаловидной мышцы проводилась серия из 20 тетанических сокращений за одну минуту, с перерывом в 1 с между сокращениями. За индекс утомления брали силу сокращения после 20 повторений, деленную на максимальную силу сокращения, измеренную в течение всего теста [11, 12]. Показатели нормировали на физиологическое поперечное сечение мышцы (pCSA). Измерение силовых показателей проводили с помощью Aurora Scientific Dual Mode Lever System 305C-LR (Aurora Scientific, США) с частотой сбора данных 10 кГц. Обработку данных проводили с помощью программного обеспечения Aurora Scientific 615A Analysis Software Suite. Репрезентативные графики сокращений представлены на рис. 2a, 2b, данные с характеристиками одиночных и тетанических сокращений представлены в табл. 1.
Анализ экспрессии генов
Таблица 1.
Механические свойства камбаловидной мышцы
| C | 7HS | 7HS + N | |
|---|---|---|---|
| Длина мышцы, мм | 18.4 ± 0.4 | 19.2 ± 0.3 | 17.3 ± 0.4 |
| pCSA, мм2 | 5.2 ± 0.2 | 3.5 ± 0.2* | 3.9 ± 0.1* |
| Сила одиночного сокращения, мН | 69.6 ± 4.8 | 52.5 ± 6.0* | 45.7 ± 4.1* |
| Удельная сила одиночного сокращения, мН/мм2 | 13.8 ± 1.5 | 15.3 ± 1.4 | 11.8 ± 1.1 |
| TTP одиночного сокращения, мс | 78.9 ± 7.3 | 62.6 ± 6.5 | 63.6 ± 8.5 |
| HRT одиночного сокращения, мс | 105.9 ± 12.9 | 91.7 ± 9.0 | 95.4 ± 14.0 |
| Сила тетанического сокращения, мН | 618.6 ± 63.7 | 291.8 ± 57.0* | 304.4 ± 57.3* |
| Удельная сила тетанического сокращения, мН/мм2 | 120.3 ± 12.0 | 81.7 ± 14.1 | 77.3 ± 14.3 |
| HRT тетанического сокращения в начале теста, мс | 210.8 ± 10.7 | 172.0 ± 18.2 | 223.9 ± 32.1 |
| HRT тетанического сокращения в конце теста, мс | 288.0 ± 136.6 (+37%) | 236.0 ± 18.7 (+37%) | 291.5 ± 29.5 (+30%) |
| F/T интеграл, мН*с | 1217.1 ± 135.2 | 554.7 ± 107.6* | 566.7 ± 103.8* |
pCSA – физиологическая (расчетная) площадь поперечного сечения, TTP – время сокращения, HRT – время полурасслабления. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С. Данные представлены в виде средних ± стандартная ошибка среднего.
Для выделения нуклеиновых кислот из камбаловидных мышц экспериментальных животных был использован набор AllPrep DNA/RNA/miRNA extraction (Qiagen, Германия). Выделение проводили согласно рекомендациям производителя. Содержание тотальной РНК и ДНК в образцах определяли путем измерения оптической плотности образца на 260 и 280 нм. Чистоту образцов определяли по соотношению длин волн на 260 и 280 нм. Для проведения обратной транскрипции тотальной РНК и синтеза кДНК использовали набор для обратной транскрипции ОТ-1 (Синтол, Россия) согласно рекомендациям производителя.
Для определения содержания митохондриальной ДНК в образцах 120 нг фракции ДНК брали в качестве матрицы для ПЦР-анализа в реальном времени.
Для определения уровня экспрессии генов кДНК, полученную из фракции тотальной РНК, также брали в качестве матрицы для ПЦР-анализа в реальном времени. Для проведения ПЦР в реальном времени использовали праймеры с концентрацией 10 мкМ мастер-микс (0.3 мМ дНТФ, 3 мМ MgCl2, 2.5 мкл 10-кратного ПЦР-буфера Б (pH 8.8), 0.06 ед/мкл Taq ДНК-полимеразы, Синтол, Россия). Для анализа содержания нуклеиновых кислот в пробах использовали метод анализа данных ПЦР по Pffafl [13]. Нормирование уровня экспрессии проводили по экспрессии гена “домашнего хозяйства” RPL13. В работе использовались следующие праймеры: PGC1α F: 5'-GTGCAGCCAAGACTCTGTATGG-3', R: 5'-GTCCAGGTCATTCACATCAAGTTC-3'; Myh7 (MyHC I(β)) R: 5'-ACAGAGGAAGACAGGAAGAACCTAC-3', F: 5'-GGGCTTCACAGGCATCCTTAG-3'; Myh2 (MyHC IIa) F: 5'-TATCCTCAGGCTTCAAGATTTG-3', R: 5'-TAAATAGAATCACATGGGGACA-3'; Myh4 (MyHC IIb) F: 5'-CTGAGGAACAATCCAACGTC-3', R: 5'-TTGTGTGATTTCTTCTGTCACCT-3'; Myh1 (MyHC IId/x) R: 5'-CGCGAGGTTCACACCAAA-3', F: 5'-TCCCAAAGTCGTAAGTACAAAATGG-3'; COXI F: 5'-ATTGGAGGCTTCGGGAACTG-3', R: 5'-AGATAGAAGACACCCCGGCT-3'; COXII F: 5'-ATTGGAGGCTTCGGGAACTG-3', R: 5'-AGATAGAAGACACCCCGGCT-3'; COXIV F: 5'-TGGGAGTGTTGTGAAGAGTGA-3', R: 5'-GCAGTGAAGCCGATGAAGAAC-3'; TFAM1 F: 5'-CGCCTGTCAGCCTTATCTGTA-3', R: 5'-TGCATCTGGGTGTTTAGCTTA-3'; NRF2α F: 5'-AAGTGACGAGATGGGCCGC-3', R: 5'-CGTTGTCCCCATTTTTGTG-3'; NRF1 F: 5'-TTACTCTGCTGTGGCTGATGG-3', R: 5'-CCTCTGATGCTTGCGTCGTCT-3'; RPL19 F: 5'-GTACCCTTCCTCTTCCCTATGC-3', R: 5'-CAATGCCAACTCTCGTCAACAG-3'.
Анализ содержания белков в тотальной фракции камбаловидной мышцы
Для выделения тотальной белковой фракции и последующей оценки содержания в ней PGC1α был использован набор реагентов RIPA Lysis Buffer System (Santa Cruz, США). При этом дополнительно использовались ингибиторы протеаз Complete Protease Inhibitor Coctail (Santa Cruz, США), 10 мкг/мл апротинина (SIGMA, США), 10 мкг/мл леупептина (SIGMA, США), 10 мкг/мл пепстатина (SIGMA, США), complete Mini Protease Inhibitor Cocktail (Roche, Швейцария) 20 мкл, фосфоингибиторный коктейль (Santa Cruz, США), 40 мкл.
Для проведения электрофореза в полиакриламидном геле (ПААГ) образцы разводились в двукратном буфере для образцов (5.4 мМ Tris-HCl (pH 6.8), 4%-ный Ds-Na, 20%-ный глицерин, 10%-ный β-меркаптоэтанол, 0.02%-ный бромфеноловый синий). Электрофорез был проведен в 10%-ном разделяющем ПААГ. Образцы каждой группы загружались на один гель с контрольными образцами. Электрофорез проводили при силе тока 17 мА на гель в мини-системе (Bio-Rad Laboratories) при комнатной температуре. Электроперенос белков проводили на нитроцеллюлозную мембрану при 100 V при температуре 4°C в течение 120 мин в системе mini Trans-Blot (Bio-Rad Laboratories). После электропереноса НЦ-мембраны инкубировали в растворе 5%-ного сухого молока (Bio-Rad Laboratories) в PBST (PBS + 0.1% Tween 20) в течение 1 ч при комнатной температуре. Для выявления белковых полос использовали первичные поликлональные антитела против PGC1α (Abcam, США, 1 : 2000), тотальной CaMK IIB (CSB-PA061493, Kusabio, Китай 1 : 1000), фосфо-CaMK IIB (CSB-PA283993, Kusabio, Китай, 1 : 1000), MOTS-C (MBS542112, Mybiosource, США, 1 : 1000), GAPDH (Cell Signaling Technology, США, 1 : 10 000), COX1/MT-CO1 (1 : 1000, Cell Signaling Technology, США), TOM20 (4F3, BioRad, Германия, 1 : 500). В качестве вторичных антител использовали антитела goat anti-rabbit или goat-anti-mouse, конъюгированные с пероксидазой хрена (Santa Cruz, США) в разведении 1 : 30 000. Определение тотальной формы белка проводилось на той же мембране, что и определение фосфорилированной формы: комплекс антител к фосфорилированной форме белка снимали с помощью инкубации в Restore buffer (Thermo Fisher, США), после чего проводили инкубацию с антителами против тотальной формы белка.
Инкубация блотов с первичными антителами проводилась в течение ночи при 4°С, со вторичными антителами 1 ч при комнатной температуре. Выявление белковых полос осуществляли с помощью набора ImmunStar Substrate Kit (BioRad Laboratories, США). Анализ белковых полос проводили с использованием C-DiGit Blot Scanner (LI-COR Biotechnology, США). Все измерения плотности изображений проводились в линейном диапазоне проявляющего реагента и сканера. Нормирование содержания белков проводили по содержанию GAPDH, уровень фосфорилирования определяли по соотношению содержания фосфорилированной и тотальной форм белка.
Статистическая обработка данных
Данные представлены в виде диаграмм размаха (на графике присутствуют медиана, первая и третья квартили, а также максимум и минимум, все значения представлены в процентах от медианы контрольной группы. Достоверность отличий между группами определяли с помощью непараметрического критерия Краскелла–Уоллиса c последующим апостериорным тестом Данна. Достоверными считали различия между группами, если значение p < 0.05. Количество животных составляло 8 для каждой группы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
После 7 сут вывешивания задних конечностей индекс утомления камбаловидных мышц животных в группе 7HS был достоверно снижен на 22% в сравнении с группой С, при этом в группе с введением нифедипина индекс утомления мышц был достоверно выше, чем в группе 7HS и составлял 101% от значений группы С (рис. 1).
Рис. 1.
Функциональные параметры камбаловидной мышцы экспериментальных животных. Индекс утомления – данные представлены в виде диаграмм размаха. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С, & – достоверные отличия от группы 7HS.
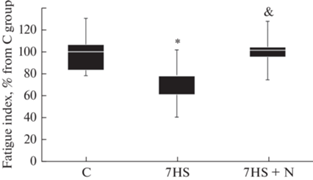
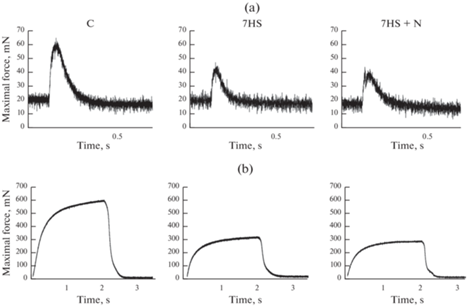
Рис. 2.
Графики одиночных (a) и тетанических (b) сокращений для каждой группы. Выбраны сокращения, наиболее близко соответствующие средним в группах. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина.
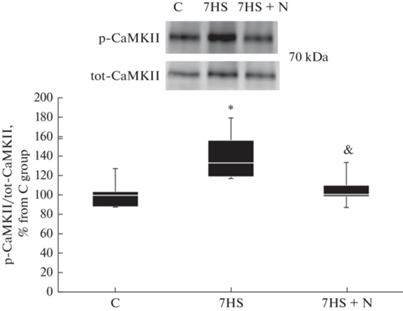
Уровень фосфорилирования кальций-кальмодулин киназы II по Thr287 был достоверно повышен на 33% в группе 7HS в сравнении с группой С, при этом в группе 7HS + N составлял 101% от группы С и был достоверно ниже значений группы 7HS (рис. 3).
Рис. 3.
Уровень фосфорилирования кальций-кальмодулин киназы II в тотальной белковой фракции камбаловидных мышц экспериментальных животных. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С, & – достоверные отличия от группы 7HS.
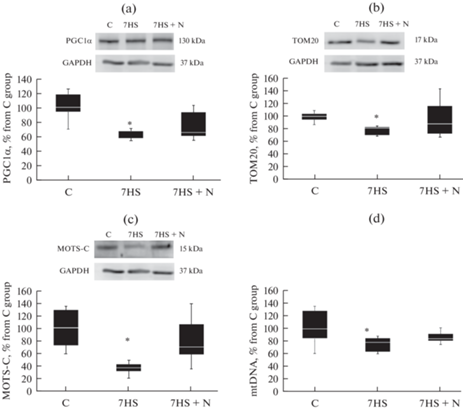
Содержание регулятора биогенеза митохондрий PGC1α, TOM20, митокина MOTS-C и митохондриальной ДНК было достоверно снижено в группе 7HS в сравнении с группой С, при этом достоверных отличий между группами С и 7HS + N для перечисленных параметров обнаружено не было (рис. 4).
Рис. 4.
Содержание PGC1α (a), TOM20 (b), MOTS-C (c) в тотальной белковой фракции, а также митохондриальной ДНК (d) в камбаловидных мышцах экспериментальных животных. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С, & – достоверные отличия от группы 7HS.
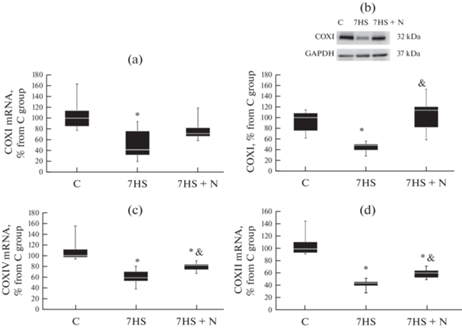
Экспрессия мРНК субъединицы I IV комплекса дыхательной цепи (COXI) в группе 7HS была достоверно снижена на 60% в сравнении с группой С, такое же снижение наблюдалось и для содержания COXI в тотальной белковой фракции (рис. 5a, 5b). В группе 7HS + N экспрессия мРНК COXI и ее содержание в тотальной белковой фракции не имели достоверных отличий от группы С, и содержание COXI в этой группе было достоверно выше, чем в группе 7HS. Экспрессия мРНК субъединиц IV комплекса дыхательной цепи COXII и COXIV также была достоверно снижена в группе 7HS, тогда как в группе 7HS + N их содержание было достоверно выше значений группы 7HS, хотя и достоверно ниже чем в группе С (рис. 5с, 5d).
Рис. 5.
Экспрессия мРНК COXI (a), содержание COXI (b), экспрессия мРНК COXIV (c) и экспрессия мРНК COXII (d) в камбаловидных мышцах экспериментальных животных. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С, & – достоверные отличия от группы 7HS.
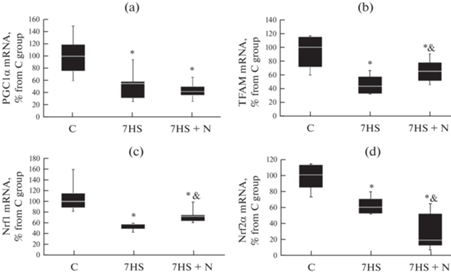
Экспрессия мРНК PGC1α была достоверно снижена в группах 7HS и 7HS + N в сравнении с группой С, а группы 7HS и 7HS + N не различались между собой (рис. 6a). Экспрессия мРНК Tfam была достоверно снижена на 60% в группе 7HS сравнении с группой С и на 35% в группе 7HS + N, при этом значения группы 7HS + N были достоверно выше чем в группе 7HS (рис. 6b). Экспрессия Nrf1 и Nrf2α была достоверно снижена в обеих вывешенных группах в сравнении с группой С, однако экспрессия мРНК Nrf1в группе 7HS + N было достоверно выше, чем в группе7HS, а содержание Nrf2α – достоверно ниже, чем в группе 7HS (рис. 6с, d).
Рис. 6.
Экспрессия мРНК PGC1α (a), TFAM (b), Nrf1 (c) и Nrf2α (d) в камбаловидных мышцах экспериментальных животных. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С, & – достоверные отличия от группы 7HS.
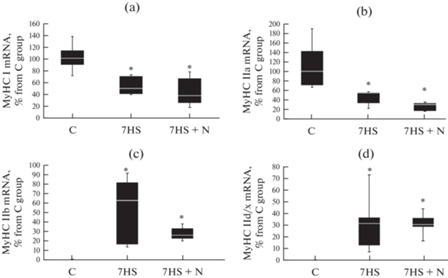
Экспрессия мРНК изоформы тяжелых цепей миозина “медленного” типа M-yHC I и “быстрого окислительного” типа MyHC IIa была достоверно снижена в обеих вывешенных группах в сравнении с контролем, и между этими двумя группами различий не было. Экспрессия “быстрых” миозиновых изоформ MyHC IIb и MyHC IId/x была достоверно повышена в обеих вывешенных группах в сравнении с группой С, при этом между группами 7HS и 7HS + N различий не было (рис. 7).
Рис. 7.
Экспрессия мРНК MyHC I (a), MyHC IIa (b), MyHC IIb (c) и MyHC IId/x (d) в камбаловидных мышцах экспериментальных животных. С – контрольная группа, 7HS – группа 7-суточного вывешивания, 7HS + N – группа 7-суточного вывешивания с введением нифедипина. * – достоверные отличия от группы С, & – достоверные отличия от группы 7HS.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наблюдаемое в данной работе увеличение утомляемости камбаловидной мышцы в условиях функциональной разгрузки хорошо согласуется с предыдущими данными, полученными как на животных, так и на человеке [14, 15]. В литературе также было описано предотвращение повышения утомляемости камбаловидных мышц на фоне вывешивания путем введения непрямого активатора АМПК бета-гуанидинпропионовой кислоты и путем механической стимуляции опорных зон стопы вывешенных животных [14, 16]. Предотвращение утомляемости камбаловидных мышц на фоне функциональной разгрузки при блокировании кальциевых каналов L-типа наблюдается впервые; такой эффект может быть связан с вызванным нифедипином снижением содержания миоплазматического кальция. Известно, что в условиях функциональной разгрузки в миоплазме мышечных волокон происходит избыточное накопление кальция [4, 17]. Ранее было показано, что введение нифедипина приводит к снижению содержания кальция в миоплазме мышечных волокон камбаловидных мышц [18]. Это хорошо согласуется с повышением уровня кальций-зависимого фосфорилирования CaMK II при вывешивании и его предотвращении в группе с введением нифедипина (рис. 2).
Известно, что избыточное накопление кальция в миоплазме может приводить к увеличению утомляемости скелетных мышц при старении, а также при ряде патологических состояний [7, 19]. Ряд авторов связывает такой эффект избыточного миоплазматического кальция с повышением генерации активных форм кислорода митохондриями, которое приводит к окислению рианодиновых рецепторов, утечке (leakage) кальция из саркоплазматического ретикулума и истощению кальциевого депо саркоплазматического ретикулума [7, 20]. Нельзя исключать, что аналогичный механизм может действовать и в условиях функциональной разгрузки.
Отдельно следует отметить, что в данном исследовании было обнаружено, что введение нифедипина на фоне вывешивания предотвращает снижение содержания митохондриальных белков и ДНК, а также экспрессии мРНК ряда генов-регуляторов биогенеза митохондрий. В частности, введение нифедипина предотвращает снижение содержания TOM20, компонента транслоказного комплекса внешней мембраны митохондрий. Изменения содержания данного белка, как и изменение содержания митохондриальной ДНК, коррелируют с изменением массы митохондрий [21], таким образом можно предположить, что введение нифедипина предотвращает снижение митохондриальной массы в камбаловидных мышцах на фоне функциональной разгрузки. Этот эффект, вероятно, также вносит свой вклад в предотвращение повышенной утомляемости в группе с введением нифедипина. Введение нифедипина привело к предотвращению снижения содержания регулятора биогенеза PGC1α в тотальной белковой фракции, однако не предотвратило снижение экспрессии мРНК данного гена. Известно, что PGC1α является мишенью ряда убиквитинлигаз и количество PGC1α в мышечном волокне может регулироваться в том числе за счет протеолиза [22]. Предотвращение избыточного накопления кальция, по-видимому, приводит к снижению уровня протеолитической деградации PGC1α, что ведет к усилению его транскрипционной активности и активации экспрессии мРНК его генов-мишеней, таких как COXI и COXIV. Наряду с этим, предотвращение снижения содержания митохондриальных белков и ДНК может объясняться снижением уровня митофагии, которая также может активироваться накоплением избыточного кальция в миоплазме [23].
Также следует обратить внимание на тот факт, что введение нифедипина привело к разнонаправленным изменениям ядерных эритроид-связанных факторов (Nrf) 1 и 2. Известно, что Nrf2 регулирует метаболизм активных форм кислорода, в то время как Nrf1 является регулятором генов, связанных с митохондриальными функциями [24]. Экспрессия Nrfα может, в частности, активироваться накоплением активных форм кислорода [25]. Таким образом, подавление экспрессии Nrf2α в группе с введением нифедипина может косвенно свидетельствовать о меньшем количестве активных форм кислорода в данной группе.
Введение нифедипина также привело к предотвращению снижения содержания митокина MOTS-C – этот пептид вырабатывается в митохондриях при упражнениях на выносливость и способствует повышенной устойчивости к утомлению, активируя ряд регуляторов биогенеза митохондрий и экспрессию медленной изоформы тяжелых цепей миозина [26]. Тем не менее, введение нифедипина на фоне 7 суток вывешивания не привело к предотвращению трансформации паттерна экспрессии миозиновых генов, характерного для функциональной разгрузки, что противоречит данным о предотвращении трансформации миозинового фенотипа камбаловидной мышцы при введении нифедипина на фоне 14-суточной функциональной разгрузки [27]. Это противоречие может быть вызвано недостаточной продолжительностью введения препарата в данном эксперименте.
Таким образом, введение нифедипина на фоне 7 сут функциональной разгрузки камбаловидных мышц крыс предотвращает избыточное накопление миоплазматического кальция, предотвращает повышение утомляемости и способствует сохранению митохондриальных белков, ДНК и экспрессии мРНК ряда генов-регуляторов биогенеза митохондрий.
Список литературы
Sharlo K, Tyganov SA, Tomilovskaya E, Popov DV, Saveko AA, Shenkman BS (2021) Effects of Various Muscle Disuse States and Countermeasures on Muscle Molecular Signaling. Int J Mol Sci 23(1): 468. https://doi.org/10.3390/ijms23010468
Shenkman BS, Kozlovskaya IB (2019) Cellular Responses of Human Postural Muscle to Dry Immersion. Front Physiol 10: 187.https://doi.org/10.3389/fphys.2019.00187
Ingalls CP, Warren GL, Armstrong RB (1999) Intracellular Ca2+ transients in mouse soleus muscle after hindlimb unloading and reloading. J Appl Physiol 87(1): 386–390. https://doi.org/10.1152/jappl.1999.87.1.386
Ingalls CP, Wenke JC, Armstrong RB (2001) Time course changes in [Ca2+]i, force, and protein content in hindlimb-suspended mouse soleus muscles. Aviat Space Envir Med 72 (5): 471-476.
Krivoi II, Kravtsova VV, Altaeva EG, Kubasov IV, Prokof’ev AV, Drabkina TM, Nikol’skii EE, Shenkman BS (2008) Decrease in the electrogenic contribution of Na,K-ATPase and resting membrane potential as a possible mechanism of calcium ion accumulation in filaments of the rat musculus soleus subjected to the short-term gravity unloading. Biofizika 53 (6): 1051-1057.
Kravtsova VV, Matchkov VV, Bouzinova EV, Vasiliev AN, Razgovorova IA, Heiny JA, Krivoi II (2015) Isoform-specific Na,K-ATPase alterations precede disuse-induced atrophy of rat soleus muscle. Biomed Res Int 2015: 720172. https://doi.org/10.1155/2015/720172
Andersson DC, Betzenhauser MJ, Reiken S, Meli AC, Umanskaya A, Xie W, Shiomi T, Zalk R, Lacampagne A, Marks AR (2011) Ryanodine receptor oxidation causes intracellular calcium leak and muscle weakness in aging. Cell Metab 14 (2): 196–207. https://doi.org/10.1016/j.cmet.2011.05.014
Yu Z, Wang H, Tang W, Wang S, Tian X, Zhu Y, He H (2021) Mitochondrial Ca(2+) oscillation induces mitophagy initiation through the PINK1-Parkin pathway. Cell Death & Disease 12 (7): 632. https://doi.org/10.1038/s41419-021-03913-3
Morey-Holton ER, Globus RK (2002) Hindlimb unloading rodent model: technical aspects. J Appl Physiol 92(4): 1367–1377. https://doi.org/10.1152/japplphysiol.00969.2001
Gordon AM, Huxley AF, Julian FJ (1966) The variation in isometric tension with sarcomere length in vertebrate muscle fibres. J Physiol 184(1): 170–192.
Burke RE, Levine DN, Salcman M, Tsairis P (1974) Motor units in cat soleus muscle: physiological, histochemical and morphological characteristics. J Physiol 238(3): 503–514. https://doi.org/10.1113/jphysiol.1974.sp010540
Roy RR, Zhong H, Monti RJ, Vallance KA, Edgerton VR (2002) Mechanical properties of the electrically silent adult rat soleus muscle. Muscle & Nerve 26(3): 404–412. https://doi.org/10.1002/mus.10219
Pfaffl MW (2001) A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res 29(9): e45. https://doi.org/10.1093/nar/29.9.e45
Matoba TWY, Ohira Y (1993) β-Guanidinopropionic acid suppresses suspension-induced changes in myosin expression in rat skeletal muscle. Med Sci Sports Exer 25: 157.
Mulder ER, Kuebler WM, Gerrits KH, Rittweger J, Felsenberg D, Stegeman DF, de Haan A (2007) Knee extensor fatigability after bedrest for 8 weeks with and without countermeasure. Muscle Nerve 36(6): 798-806. https://doi.org/10.1002/mus.20870
Sharlo K, Lvova I, Turtikova O, Tyganov S, Kalashnikov V, Shenkman B (2022) Plantar stimulation prevents the decrease in fatigue resistance in rat soleus muscle under one week of hindlimb suspension. Arch Biochem Biophys 718: 109150. https://doi.org/10.1016/j.abb.2022.109150
Aлтаева ЕГ, Огнева ИВ, Шенкман БС (2010) Динамика уровня кальция и изменения содержания SERCA в мышечных волокнах крыс и монгольских песчанок при разгрузке задних конечностей различной продолжительности. Цитология 52(9): 770–775. [Altaeva EG, Ogneva IV, Shenkman BS (2010) Dynamics of calcium levels and changes SERCA content in muscle fibers of rats and Mongolian gerbils during hind limb unloadings of various duration. Tsitologiia 52 (9): 770–775. (In Russ)].
Altamirano F, Valladares D, Henriquez-Olguin C, Casas M, Lopez JR, Allen PD, Jaimovich E (2013) Nifedipine treatment reduces resting calcium concentration, oxidative and apoptotic gene expression, and improves muscle function in dystrophic mdx mice. PloS One 8(12): e81222. https://doi.org/10.1371/journal.pone.0081222
Andersson DC, Meli AC, Reiken S, Betzenhauser MJ, Umanskaya A, Shiomi T, D’Armiento J, Marks AR (2012) Leaky ryanodine receptors in beta-sarcoglycan deficient mice: a potential common defect in muscular dystrophy. Skelet Muscle 2(1): 9. https://doi.org/10.1186/2044-5040-2-9
Yutaka Kano TS, Inagaki T, Sudo M, Poole DC (2012) Mechanisms of exercise-induced muscle damage and fatigue: Intracellular calcium accumulation. J Phys Fitness Sports Med 1 (3): 505–512. https://doi.org/10.7600/jpfsm.1.505
Zhang Y, Marsboom G, Toth PT, Rehman J (2013) Mitochondrial respiration regulates adipogenic differentiation of human mesenchymal stem cells. PloS One 8(10): e77077. https://doi.org/10.1371/journal.pone.0077077
Fernandez-Marcos PJ, Auwerx J (2011) Regulation of PGC-1alpha, a nodal regulator of mitochondrial biogenesis. Am J Clin Nutrit 93(4): 884S–890S. https://doi.org/10.3945/ajcn.110.001917
Perrone M, Patergnani S, Di Mambro T, Palumbo L, Wieckowski M, Giorgi C, Pinton P (2022) Calcium homeostasis in the control of mitophagy. Antioxid Redox Signal 38(7-9): 581–598. https://doi.org/10.1089/ars.2022.0122
Walsh M. ZQ, Musci RV, Hamilton KL (2022) The combination of NRF1 and Nrf2 activators in myoblasts stimulate mechanisms of proteostasis without changes in mitochondrial respiration. Redox Muscle Physiol Exerc Sport 1. https://doi.org/10.1016/j.rimpes.2022.100001
Kasai S, Shimizu S, Tatara Y, Mimura J, Itoh K (2020) Regulation of Nrf2 by Mitochondrial Reactive Oxygen Species in Physiology and Pathology. Biomolecules 10 (2): 320. https://doi.org/10.3390/biom10020320
Reynolds JC, Lai RW, Woodhead JST, Joly JH, Mitchell CJ, Cameron-Smith D, Lu R, Cohen P, Graham NA, Benayoun BA, Merry TL, Lee C (2021) MOTS-c is an exercise-induced mitochondrial-encoded regulator of age-dependent physical decline and muscle homeostasis. Nat Commun 12(1): 470. https://doi.org/10.1038/s41467-020-20790-0
Мухина АМ, Алтаева ЕГ, Немировская ТЛ, Шенкман БС (2006) Роль Ca-каналов L-типа в накоплении Ca2+ и изменениях в распределении тяжелой цепи миозина и изоформ SERCA у M. soleus крысы при гравитационной разгрузке. Рос физиол журн им ИМ Сеченова 92(11): 1285–1295. [Mukhina AM, Altaeva EG, Nemirovskaia TL, Shenkman BS (2006) Role of L-type Ca-channels in Ca2+ accumulation and changes in distribution of myosin heavy chain and SERCA isoforms in rat M. soleus under gravitational unloading. Russ J Physiol 92 (11): 1285–1295. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


