Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 4, стр. 502-516
Поддержание нормальной активности AMPK устраняет аномально ускоренную дифференцировку первичных миобластов, выделенных из атрофированной m. soleus крысы
Н. А. Вильчинская 1, *, Т. М. Мирзоев 1, Б. С. Шенкман 1
1 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: vilchinskayanatalia@gmail.com
Поступила в редакцию 14.02.2023
После доработки 09.03.2023
Принята к публикации 10.03.2023
- EDN: VJZPXH
- DOI: 10.31857/S086981392304012X
Аннотация
Функциональная разгрузка скелетных мышц приводит к развитию атрофических процессов и снижению общего числа сателлитных клеток, осуществляющих регенерацию этих мышц. В исследованиях in vitro было выявлено усиление дифференцировки миобластов камбаловидной мышцы на фоне снижения активности АМФ-активируемой протеинкиназы (АМРК) после действия функциональной разгрузки. АМРК необходима для активации сателлитных клеток, участвует в регуляции процессов пролиферации и дифференцировки. Можно предположить, что снижение активности АМРК после действия механической разгрузки способствует усилению/ускорению дифференцировки миобластов и усиленному формированию миотуб. Основная цель данного исследования состояла в изучении участия АМРК в регуляции процессов дифференцировки миобластов камбаловидной мышцы у крыс, подвергшихся действию гравитационной разгрузки. Для проверки этой гипотезы применили специфический активатор АМРК – AICAR для предотвращения снижения фосфорилирования АМРК при дифференцировке миобластов in vitro, выделенных из камбаловидных мышц крыс, подвергшихся 7-суточному воздействию функциональной разгрузки. Для оценки процессов дифференцировки миобластов применили методы иммуноцитохимии, ПЦР-РТ и Вестерн-блоттинга. В дифференцирующихся миобластах камбаловидной мышцы после действия функциональной разгрузки наблюдалось значительное снижение уровня фосфорилирования АМРК и ацетил-КоА-карбоксилазы (АСС), повышенный индекс дифференцировки миотуб, повышение экспрессии миогенных регуляторных факторов (МРФ) и факторов слияния миобластов, снижение экспрессии “медленной” изоформы тяжелых цепей миозина и усиление экспрессии “быстрых” изоформ тяжелых цепей миозина. Применение AICAR при дифференцировке миобластов, полученных из атрофированной мышцы, предотвращало снижение фосфорилирования АМРК и АСС, возвращало уровень экспрессии МРФ и “быстрых” изоформ тяжелых цепей миозина к уровню контрольных значений, поддерживало экспрессию “медленной” изоформы тяжелых цепей миозина. Таким, образом аномально ускоренная дифференцировка миобластов, выделенных из атрофированной камбаловидной мышцы крыс, компенсируется поддержанием контрольного уровня активности AMPK с помощью AICAR.
ВВЕДЕНИЕ
Деструктивное влияние гравитационной/функциональной разгрузки на структуру и функцию скелетных мышц (преимущественно постуральных) многократно показано в литературных источниках и достаточно обширно изучено [1–4]. Как известно, регенерация скелетных мышц осуществляется при помощи особого типа одноядерных клеток, расположенных рядом с сарколеммой мышечного волокна, но под его базальной мембраной – сателлитных клеток мышц [5, 6]. При повреждении мышц происходит активация сателлитных клеток, они выходят из фазы клеточного цикла G0, начинают пролиферировать, а затем вступают в стадию дифференцировки. При регенерации мышечной ткани дифференцированные миобласты могут сливаться с поврежденными мышечными волокнами или друг с другом, формируя новые мышечные волокна [7, 8]. Процессы регенерации скелетных мышц при действии гравитационной разгрузки до сих пор мало изучены. Отмечено снижение общего числа сателлитных клеток мышц при механической разгрузке и при бездействии мышц [9–11]. Литературные данные об изменении регенеративного потенциала сателлитных клеток мышц в этих условиях противоречивы. Одни авторы утверждают о снижении пролиферации и дифференцировки сателлитных клеток в условиях механической разгрузки и при бездействии мышц, атрофиях, дистрофиях [10–12], другие, наоборот, отмечают увеличение активности этих клеток [13, 14].
Ранее было показано, что гравитационная разгрузка влияет на активность АМФ-активируемой протеинкиназы (АМРК) в волокнах камбаловидной мышцы: при кратковременном воздействии механической разгрузки наблюдалось снижение активности этой киназы, при более длительном действии, наоборот, активность АМРК была повышена [15].
АМРК – это ключевой регулятор энергетического метаболизма клетки, активация данной киназы происходит при изменении соотношения АМФ/АТФ в сторону накопления АМФ [16, 17]. АМРК участвует в регуляции процессов клеточного роста, белкового синтеза, катаболизма, метаболизма, аутофагии, апоптоза [18]. При повреждении мышц АМРК необходима для активации сателлитных клеток, участвует в регуляции процессов их пролиферации и дифференцировки [19].
В поврежденной мышце при активации сателлитных клеток АМРКα1 обеспечивает переход клетки на анаэробный гликолиз (“эффект Варбурга”), который необходим для активации сателлитных клеток и дальнейшего развития регенеративных процессов [20]. В данных процессах задействована преимущественно АМРКα1. При нокауте гена белка АМРКα1 развития регенеративных процессов при повреждении мышцы не происходило [20, 21]. В миобластах с2с12 после нокдауна гена АМРКа1 происходило снижение экспрессии миозинов, ряда миогенных регуляторных факторов (МРФ), было затруднено формирование миотуб. Определенный уровень активности АМРК требуется для нормального миогенеза при регенерации мышц [21]. Сниженная регенерации мышц вследствие пониженной активности АМРК была выявлена при таких метаболических нарушениях, как ожирение, сахарный диабет, старение [22, 23]. Однако чрезмерная активация АМРК приводит к ослаблению процессов пролиферации и дифференцировки сателлитных клеток [24, 25].
При исследовании регенеративного потенциала сателлитных клеток камбаловидной мышцы in vitro обнаружено значительное снижение уровня пролиферации этих клеток после действия функциональной разгрузки [26]. Помимо этого была выявлена ускоренная дифференцировка миобластов, выделенных из камбаловидной мышцы, подвергшейся действию гравитационной разгрузки [26]. На более поздних этапах дифференцировки таких миобластов наблюдалось снижение активности основного субстрата AMPK – ацетил-КоА-карбоксилазы (АСС) [27].
Можно предположить, что снижение активности АМРК после действия механической разгрузки способствует усилению/ускорению дифференцировки таких миобластов и усиленному формированию миотуб. Для проверки этой гипотезы мы применили специфический активатор АМРК (аналог АМФ – 5-аминоимидазол-4-карбоксамид рибонуклеотид, AICAR) для предотвращения снижения фосфорилирования АМРК при дифференцировке миобластов in vitro, выделенных из камбаловидных мышц крыс, подвергшихся 7-суточному воздействию моделируемой гравитационной разгрузки.
Основная цель данного исследования состояла в изучении участия АМРК в регуляции процессов дифференцировки миобластов камбаловидной мышцы, подвергшихся действию функциональной разгрузки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для моделирования гравитационной разгрузки применяли модель антиортостатического вывешивания задних конечностей крыс по методу Новикова–Ильина в модификации Morey-Holton и соавт. [28, 29]. Подробный дизайн эксперимента представлен на рис. 1. Для эксперимента было отобрано 30 самцов крыс линии Wistar массой 180–200 г: интактный контроль (С), 7-суточное вывешивание (HS), 7-суточное вывешивание + AICAR (HSA). Животные содержались при температуре 20–22°C, вода и корм грызунам давались без ограничения (ad libitum) в соответствии с рационом для лабораторных животных. После завершения эксперимента у каждого животного под наркозом из обеих ног была выделена камбаловидная мышца. Далее камбаловидные мышцы использовались для выделения сателлитных клеток. Выделение сателлитных клеток из m. soleus проводилось по методике, описанной в наших в предыдущих работах [26]. В полученной культуре первичных миобластов более 90% клеток экспрессировали Pax7. После получения “чистой” культуры миобласты культивировались в ростовой среде (DМЕМ с добавлением 1% L-glutamine (Invitrogen, США), 1% антибиотика penicillin-streptomycin (Invitrogen, США) и 20% Fetal Bovine Serum (Gibco, США)) до достижения субконфлюентого состояния (в культуре появляются признаки спонтанной дифференцировки). После этого проводилась их миогенная дифференцировка путем замены ростовой среды на дифференцировочную, состоящую из DМЕМ с добавлением 1% L-glutamine (Invitrogen, США), 1% антибиотика penicillin-streptomycin (Invitrogen, США) и 2% Horse Serum (Gibco, США). C 3-го по 5-й день дифференцировки миобласты группы HSA инкубировались в дифференцировочной среде, содержащей 1мM AICAR (ab120358, Abcam, Великобритания) (рис. 1). Все измерения проводились на 5-й день дифференцировки миобластов (рис. 1).
Гель-электрофорез и иммуноблоттинг
Для получения тотальной фракции белков миобласты камбаловидной мышцы лизировались с помощью RIPA буфера согласно рекомендациям производителя (sc-24948, Santa Cruz Biotechnology, Dallas, TX, США). Содержание белка в полученных пробах определяли при помощи набора Quick Start Bradford Protein Assay (Bio-Rad Laboratories, США). Электрофорез проводился в 10%-ном ПААГ при 17 мА на гель в мини-системе (Bio-Rad Laboratories) при комнатной температуре. Электроперенос белков проводился на нитроцеллюлозную мембрану при 100 В при температуре 4°C в течение 120 мин в системе mini Trans-Blot (Bio-Rad Laboratories). По окончании электропереноса мембраны блокировались в EveryBlot Blocking Buffer (#12010020, Bio-Rad Laboratories, США), а затем инкубировались с первичными антителами на протяжении ночи. Инкубация со вторичными антителами проводилась в течение 1 ч при комнатной температуре. В данной работе были использованы первичные антитела к p-AMPK (Thr172) (1 : 500, Cell Signaling Technology, США, #2531), t-AMPK (1 : 1000, Cell Signaling Technology, США, #2523), p-ACC (S79) (1 : 1000, Cell Signaling Technology, США, #3661), t-ACC (1 : 1000, Cell Signaling Technology, США, #3662), p-rpS6 (S240/244) (1 : 2000, Cell Signaling Technology, США, #5364), rpS6 (1 : 2000, Cell Signaling Technology, США, #2217), вторичные антитела goat-anti-rabbit, конъюгированные с пероксидазой хрена (1 : 60 000, # 111-035-003, Jackson Immuno Research, Великобритания). Выявление белковых полос осуществлялось с помощью набора ImmunStar Substrate Kit (BioRad Laboratories) и сканера C-DiGit Blot Scanner (LI-COR Biotechnology, США). Белковые полосы анализировали с использованием программного обеспечения Studio Digits Ver. 4.0. Статистический анализ полученных экспериментальных данных был проведен с помощью двухфакторного дисперсионного анализа. Результаты приведены в виде минимума, максимума, медианы и интерквартильных разбросов. Достоверными считали различия при p < 0.05.
Иммуноцитохимия
Недифференцированные миобласты камбаловидной мышцы высеивали на покровные стекла. Часть препаратов фиксировали на следующий день, другую часть миобластов после достижения 80%-ной конфлюентности запускали в миогенную дифференцировку и фиксировали на 5-й день. Клетки фиксировали в 4%-ном растворе параформальдегида в течение 10 мин, а затем пермеабилизировали 0.02%-ным тритоном Х-100 в течение 5 мин. Затем клетки блокировали 5%-ным бычьим сывороточным альбумином (# A9647, Sigma-Aldrich, США) в течение 30 мин, далее инкубировали с первичными антителами против PAX7 (Developmental Studies Hybridoma Bank, США), MHC fast (# M8421, Sigma; Sigma-Aldrich, США), реагентом Phalloidin-iFluor 488 (# ab176753, Abcam, Великобритания) и вторичными антителами, коньюгированными с Alexa Fluor 546 (# A28175, ThermoFisher Scientific, США). Ядра контрастировали 4',6-диамидино-2-фенилиндолом (DAPI) (кат. D1306, Molecular Probes, США). Микроскопические изображения были получены с использованием инвертированного микроскопа Olympus IX83P2ZF3 с камерой DP74 (Olympus, Tokyo, Япония) и объективом 20X. Анализ изображений проводился с помощью программы Cell Sens Imaging (Olympus, Tokyo, Япония).
ПЦР в реальном времени
Выделение тотальной РНК из миобластов m. soleus проводили с помощью реагента ExtractRNA (Евроген, Россия) согласно рекомендациям производителя. Обратную транскрипцию проводили с использованием 0.5 мкг РНК и набора для проведения обратной транскрипции RevertAid RT Kit (# K1691, Thermo Fisher Scientific, США) согласно стандартному протоколу. Полученные образцы кДНК использовались для проведения ПЦР в реальном времени с использованием интеркалирующего красителя SYBR Green I в амплификаторе CFX96 Touch Real-Time PCR Detection System (Bio-Rad Laboratories, США). Для проведения ПЦР в реальном времени использовали праймеры, последовательности которых представлены в табл. 1. В качестве референсного гена использовали ген GAPDH и Ywhaz. Анализ полученных данных осуществлялся по методу Ливака (2-ΔΔСt). Статистический анализ полученных экспериментальных данных был проведен с помощью двухфакторного дисперсионного анализа. Результаты приведены в виде минимума, максимума, медианы и интерквартильных разбросов. Достоверными считали различия при p < 0.05.
Таблица 1.
Последовательности использованных в работе праймеров
| Ген | Последовательность (5'–3') | Ссылка на GenBank |
|---|---|---|
| Myog | 5'-ggtcccaacccaggagatca-3' 5'-acatatcctccaccgtgatgc-3' |
NM_017115.3 |
| Myod1 | 5'-tgctctgatggcatgatgga-3' 5'-ctggacgcctcactgtagta-3' |
NM_176079.2 |
| Mymx | 5′-gatcgctgctatcacgcct-3′ 5′-ctcacgtcttgggagctcag-3′ |
NM_001399466.1 |
| Mymk | 5′-tctttgtggcgttctcccat-3′ 5′-cagggctgtcccatagatgc-3′ |
NM_001399315.1 |
| Myh7 | 5'- agaggagagggcggacatt-3' 5'- actcttcattcaggcccttgg-3' |
NM_017240.2 |
| Myh4 | 5'- agagaacaagaatctacagcagga-3' 5'-ccagagacgcctgtaattcact-3' |
NM_019325.1 |
| Myh2 | 5'-tcatttgccaataagggtctgt-3' 5'-cctcgattcgctccttttca-3' |
NM_001135157.1 |
| Myh1 | 5'-tgcatccctaaaggcagactc-3' 5'-gacttccggaggtaaggagc-3' |
NM_001135158.1 |
| Ywhaz | 5'-cccactccggacacagaata-3' 5'-tgtcatcgtatcgctctgcc-3' |
NM_013011.4 |
| Gapdh | 5'-cggtgtgaacggatttggc-3' 5'- ttgaggtcaatgaaggggtcg-3' |
NM_017008.4 |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела крыс и масса камбаловидных мышц
В результате 7-суточного вывешивания наблюдалось незначительное снижение массы тела крыс по сравнению с контролем (табл. 2). Сырая и нормированная масса камбаловидной мышцы в группе вывешивания была значительно снижена по сравнению с контрольной группой (табл. 2).
Уровень фосфорилирования AMPK (Thr172), ACC (Ser79) и rpS6 (Ser 240/244) в дифференцирующихся миобластах камбаловидной мышцы после действия гравитационной разгрузки
Выявлено снижение уровня фосфорилирования АМРК у миобластов группы HS на 57% по сравнению с контрольными миобластами (рис. 2а). Применение AICAR в миобластах камбаловидной мышцы после вывешивания предотвращает снижение активности АМРК (рис. 2а). Фосфорилирование АСС по сайту (S79) было снижено в культурах миобластов после вывешивания, применение AICAR предотвращало это снижение (рис. 2b).
Рис. 2.
Уровень фосфорилирования АМРК, АСС и рибосомального белка S6 в дифференцирующихся миобластах камбаловидной мышцы после функциональной разгрузки и применения AICAR (стимулятора активности АМФ-активируемой протеинкиназы). (a) – фосфо-АМРК (Thr 172)/AMPK, (b) – фосфо-АСС (Ser79)/ACC и (c) – фосфо-rpS6 (S240/244)/rpS6. C – контроль; HS – антиортостатическое вывешивание, HS + A – антиортостатическое вывешивание + AICAR. * – достоверное отличие от контроля (p < 0.05); # – достоверное отличие от HS (p < 0.05).
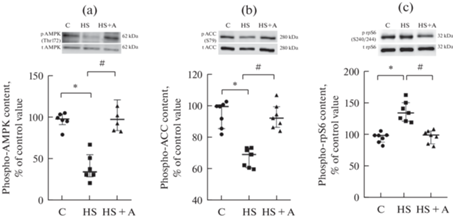
Помимо этого было исследовано фосфорилирование рибосомального белка S6 по сайту (S240/244). Обнаружено увеличение фосфорилирования рибосомального белка S6 на 28% по сравнению с контрольными значениями в культурах дифференцирующихся миобластов после вывешивания. Применение AICAR в культурах дифференцирующихся миобластов после вывешивания предотвращает повышение фосфорилирования рибосомального белка S6 (рис. 2с).
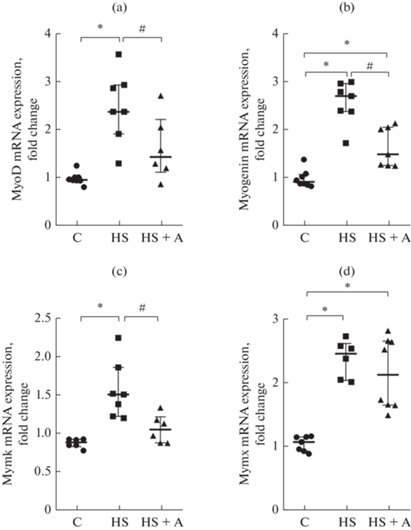
Экспрессия миогенных регуляторных факторов в миобластах камбаловидной мышцы после действия гравитационной разгрузки
Выявлено увеличение экспрессии мРНК MyoD в 1.5 раза в миобластах группы HS по сравнению с группой контроля (рис. 3а), при применении AICAR уровень экспрессии мРНК MyoD не отличался от контрольных значений (рис. 3а). Экспрессия мРНК миогенина достоверно увеличена в 2.9 раз в группе миобластов HS по сравнению с контрольной группой миобластов (рис. 3b). В группе миобластов HS + A уровень экспрессии мРНК миогенина значительно снижался (рис. 3b). В миобластах, выделенных из камбаловидной мышцы после действия гравитационной разгрузки, наблюдалось увеличение экспрессии мРНК Myomaker (фактор, регулирующий слияние миобластов) по сравнению с контрольной группой (рис. 3с), при инкубации таких миобластов с AICAR экспрессия мРНК Myomaker возвращалась к уроню контрольных значений (рис. 3с). Уровень экспрессии мРНК Myomixer, фактора, регулирующего слияние миобластов, был также повышен у миобластов группы HS (рис. 3d), применение AICAR не предотвращало увеличение экспрессии этого фактора (рис. 3d).
Рис. 3.
Экспрессия МРФ и факторов слияния миотуб в дифференцирующихся миобластах камбаловидной мышцы после действия функциональной разгрузки и применения AICAR. (a) – MyoD, (b) – Myogenin, (c) – Mymk, (d) – Mymx. C – контроль; HS – антиортостатическое вывешивание, HS + A – антиортостатическое вывешивание + AICAR. * – достоверное отличие от контроля (p < 0.05); # – достоверное отличие от HS (p < 0.05).
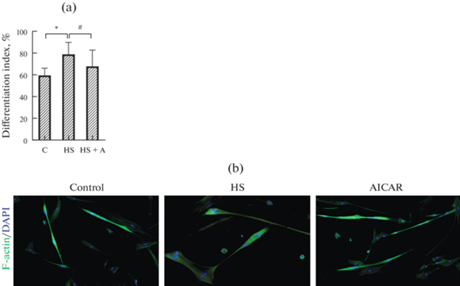
Помимо этого, в данной работе был оценен индекс дифференцировки миотуб. Выявлено достоверное увеличение значений индекса дифференцировки в миобластах группы HS (рис. 4a). Применение AICAR возвращает уровень дифференцировки миотуб к контрольным значениям (рис. 4b).
Рис. 4.
Индекс дифференцировки миотуб камбаловидной мышцы крысы после действия функциональной разгрузки и применения AICAR. (а) – диаграмма; (b) – репрезентативные микрофотографии миотуб. C – контроль; HS – антиортостатическое вывешивание, HS + A – антиортостатическое вывешивание + AICAR. * – достоверное отличие от контроля (p < 0.05); # – достоверное отличие от HS (p < 0.05).
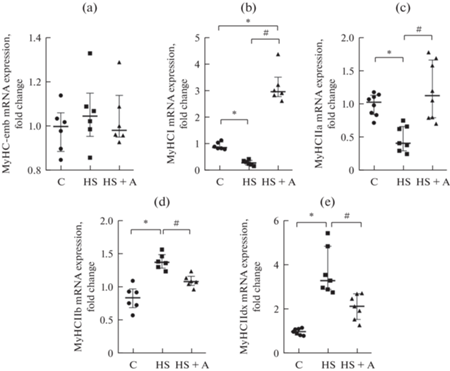
Экспрессия различных изоформ тяжелых цепей миозина в дифференцирующихся in vitro миобластах камбаловидной мышцы после действия гравитационной разгрузки
Изменений экспрессии мРНК эмбриональной изоформы тяжелых цепей миозина не обнаружено (рис. 5a). Уровень экспрессии мРНК медленной (I) изоформы тяжелых цепей миозина в миобластах группы HS достоверно снижен по сравнению с контрольной группой (рис. 5b), при инкубации миобластов с AICAR уровень экспрессии мРНК медленной (I) изоформы тяжелых цепей миозина значительно увеличивался (рис. 5b). Экспрессия мРНК тяжелых цепей миозина IIа была снижена в группе миобластов HS (рис. 5c), при применении AICAR экспрессия мРНК миозина IIа не отличалось от группы контроля (рис. 5c). Выявлено увеличение экспрессии мРНК быстрых изоформ тяжелых цепей миозина IIb и IIdx в группе дифференцирующихся миобластов HS (рис. 5d–5e), при инкубации таких миобластов с AICAR экспрессия мРНК быстрых изоформ тяжелых цепей миозина возвращается к контрольным значениям (рис. 5d–5e).
Рис. 5.
Экспрессия различных изоформ тяжелых цепей миозина в дифференцирующихся миобластах камбаловидной мышцы после действия гравитационной разгрузки и после применения AICAR. (a) – MyHC-emb, (b) – MyHC I, (c) – MyHC IIa, (d) – MyHC IIb, (e) – MyHC IIdx. C – контроль; HS – антиортостатическое вывешивание, HS + A – антиортостатическое вывешивание + AICAR. * – достоверное отличие от контроля (p < 0.05); # – достоверное отличие от HS (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В недавних исследованиях нашей лаборатории был обнаружен феномен аномально ускоренного (“преждевременного”) процесса слияния и дифференцировки миобластов, полученных из m. soleus крысы после периода функциональной разгрузки задних конечностей продолжительностью 7 и 14 сут [26, 27]. Так, миобласты, выделенные из m. soleus крысы после 7-суточной функциональной разгрузки, начинали образовывать миотубы раньше, чем контрольные миобласты [27]. При этом аномально ускоренный процесс миогенной дифференцировки сопровождался повышенной экспрессией мРНК MyoD и миогенина (транскрипционных факторов, определяющих дифференцировку), а также цитоскелетного белка десмина [27]. Не исключено, что наблюдавшийся аномально ускоренный процесс дифференцировки миобластов ведет к образованию мышечных волокон с функциональными нарушениями [27], что может негативно влиять на регенерацию мышечной ткани после повреждений. Однако внутриклеточные сигнальные пути, ответственные за ускоренную миогенную дифференцировку и слияние миобластов, выделенных из атрофированной скелетной мышцы, оставались неисследованными. Исходя из литературных данных, фермент AMPK, являющийся ключевым регулятором ряда метаболических сигнальных путей в клетке, является одним из потенциальных претендентов на роль регулятора самообновления сателлитных клеток [30], а также процесса миогенеза посредством влияния на экспрессию миогенина [22, 31]. Кроме того, была показана важная роль AMPK в активации сателлитных клеток и регуляции процессов пролиферации и дифференцировки при регенерации скелетной мышцы после повреждения [22]. При этом следует отметить, что стимулирование активности AMPK с помощью аналога АМФ AICAR может значительно подавлять миогенную дифференцировку миобластов и образование миотуб, а также вызывать снижение содержания MyoD и миозина, приводя к атрофии миотуб [24]. В связи с этим настоящее исследование было посвящено проверке гипотезы о роли поддержания активности AMPK в нормализации процесса дифференцировки первичных миобластов, выделенных из атрофированной в результате функциональной разгрузки камбаловидной мышцы крысы. В культуре исследованных миобластов нами было обнаружено достоверное снижение фосфорилирования AMPK (Thr 172) и ACC (Ser 79), что свидетельствовало о пониженной киназной активности AMPK. Эти данные вполне согласуются с ранее опубликованными результатами исследований, в которых было показано достоверное снижение экспрессии мРНК AMPK и фосфорилирования ACC (Ser 79) в культуре дифференцирующихся миобластов, полученных из атрофированной m. soleus крысы [27]. Интересно также отметить, что пониженная активность AMPK ранее наблюдалась непосредственно в камбаловидной мышце крыс на ранних стадиях функциональной разгрузки (6 ч, 12 ч, 1 сут, 3 сут антиортостатического вывешивания) [15, 32–34]. Однако на более поздних этапах функциональной разгрузки (14 суток и более) регистрировалось повышенное фосфорилирование AMPK (Thr 172) в m. soleus крыс [35]. При этом хорошо известна роль данной киназы в подавлении анаболических сигнальных путей и синтеза белка в клетке. AMPK может ингибировать ключевой mTORC1 (mammalian target of rapamycin, complex 1)-зависимый анаболический сигнальный путь посредством фосфорилирования TSC2 (негативный регулятор mTORC1) [36] или белка raptor (ключевой компонент mTORС1) [37]. Роль AMPK в качестве негативного регулятора mTORC1-зависимого сигнального пути и синтеза белка была подтверждена в экспериментах на скелетной мышце [38] и культивируемых мышечных клетках [39, 40]. Одним из маркеров активности протеинкиназного комплекса mTORC1 является рибосомальный белок S6 (rpS6). Фосфорилирование rpS6 по Ser240/244 свидетельствует об активации mTORC1-зависимого сигнального пути [41]. В нашем исследовании пониженное фосфорилирование AMPK (Thr 172) и ACC (Ser 79) сопровождалось повышенным фосфорилированием rpS6 (Ser240/244), что могло свидетельствовать об активации mTORC1-зависимого сигнального пути в дифференцирующихся миобластах, полученных из атрофированной камбаловидной мышцы. При этом восстановление контрольного уровня фосфорилирования AMPK и ACC в культуре мышечных клеток с помощью AICAR привело к возвращению фосфорилирования rpS6 (Ser240/244) к контрольным значениям. Эти данные подтверждают имеющиеся в литературе данные о способности AMPK подавлять mTORC1-зависимый путь в мышечных клетках [39, 40]. Аналогичная взаимосвязь между пониженной активностью AMPK и одновременно повышенной активностью сигнального пути mTORC1/p70S6K ранее была описана в m. soleus крыс на ранних стадиях вывешивания задних конечностей [15, 33, 34]. Возникает закономерный вопрос о возможности сигнального пути mTORC1/p70S6K влиять на процесс миогенной дифференцировки. Ряд литературных данных говорит в пользу того, что определенный уровень активности mTORC1-зависимого пути необходим для поддержания пролиферации и дифференцировки миобластов. Так, было показано, что ингибирование mTORC1 с помощью рапамицина приводит к значительному снижению экспрессии креатинкиназы, миогенина и тяжелых цепей миозина в клетках C2C12 на 3-й день дифференцировки [42]. Добавление в среду дифференцирующихся мышечных клеток C2C12 рапамицина также приводит к подавлению процесса формирования миотуб [42]. Pollard и соавт. показали, что ингибирование mTORC1 эверолимусом (RAD001) (производное рапамицина) значительно снижало фосфорилирование rpS6 и приводило к задержке дифференциации миобластов [43]. Rion и соавт. обнаружили, что селективная инактивация mTORC1 (путем удаления из данного комплекса белка Raptor) в сателлитных клетках приводит не только к ухудшению способности скелетных мышц регенерировать после повреждения, но также к частичному подавлению процессов пролиферации и дифференцировки миобластов в культуре [44]. Важно также отметить, что фармакологическое ингибирование mTORC1 в культивируемых миобластах способно значительно снижать содержание транскрипционного фактора MyoD [45]. Исходя из данных литературы, данный транскрипционный фактор играет важную роль в положительной регуляции экспрессии тяжелых цепей миозина “быстрого” типа (MyHC IId/x, MyHC IIB) в скелетных мышцах грызунов [46–49]. В частности, Seward и соавт. продемонстрировали, что у мышей, нокаутных по гену MyoD, содержание “быстрой” изоформы миозина (MyHC IIB) в m. soleus после функциональной разгрузки значительно меньше, чем у мышей дикого типа [48]. В нашем исследовании наблюдались схожие изменения экспрессии мРНК MyoD и тяжелых цепей миозина “быстрого” типа (MyHC IId/x, MyHC IIB) в дифференцирующихся миобластах как в группе “HS”, так и в группе “HS + A”. Таким образом, можно предположить, что регуляция экспрессии тяжелых цепей миозина “быстрого” типа в ответ на действие AICAR в нашем эксперименте осуществлялась посредством сигнального пути AMPK/mTORC1/MyoD. Что касается изменения экспрессии “медленной” изоформы ТЦМ (MyHC Iβ) в настоящем исследовании, то один из возможных механизмов мог быть связан с сигнальным путем AMPK/HDAC4/MEF-2D [32, 50], так как на ранних сроках функциональной разгрузки (24 ч) снижение экспрессии пре-РНК MyHC I(β) в m. soleus крыс было связано со снижением фосфорилирования AMPK (Thr 172) и последующим накоплением диацетил-гистонов 4 (HDAC4) в миоядрах (где HDAC4 формирует комплекс с транскрипционным фактором MEF-2D) [32, 50]. При этом поддержание фосфорилирования AMPK (Thr 172) в камбаловидной мышце крыс на контрольном уровне с помощью AICAR предотвращает снижение экспрессии MyHC I(β)и MyHC IIa [32]. Таким образом, полученные в настоящем исследовании изменения активности AMPK и экспрессии мРНК различных изоформ тяжелых цепей миозина в дифференцирующихся миобластах, выделенных из атрофированной мышцы, схожи с изменениями, ранее наблюдавшимися в камбаловидной мышце взрослых крыс после функциональной разгрузки. Конкретные механизмы, которые могли бы объяснить данный феномен неясны, однако можно предположить, что мышечные волокна камбаловидной мышцы могли оказывать непосредственное влияние на окружающие их сателлитные клетки посредством паракринного воздействия. Такого рода воздействие могло бы “корректировать” миогенную “программу” сателлитных клеток в ответ на изменившиеся внешние условия (в нашем случае – это функциональная разгрузка камбаловидной мышцы). Возможность существования такого механизма подтверждается недавним исследованием японских авторов, которые впервые показали, что миокин R-spondin 3 (Rspo3), селективно экспрессирующийся в “медленных” мышечных волокнах, воздействует на сателлитные клетки, способствуя их дифференцировке исключительно в волокна “медленного” типа посредством сигнального пути Wnt/β-catenin [51].
Таким образом, полученные в настоящем исследовании результаты впервые обнаружили, что аномально ускоренная дифференцировка миобластов, выделенных из атрофированной камбаловидной мышцы крысы, компенсируется поддержанием контрольного уровня активности AMPK с помощью AICAR. При этом нормализуется повышенная экспрессия МРФ, факторов слияния миобластов, а также ряда изоформ тяжелых цепей миозина.
Список литературы
Oganov VS, Skuratova SA, Murashko LM, Guba F, Takach O (1988) Effect of short-term space flights on physiological properties and composition of myofibrillar proteins of the skeletal muscles of rats. Kosm Biol Aviakosm Med 22 (4): 50–54.
Shenkman BS (2016) From Slow to Fast: Hypogravity-Induced Remodeling of Muscle Fiber Myosin Phenotype. Acta Naturae 8 4(31): 47–59.https://doi.org/10.32607/20758251-2016-8-4-47-59
Ohira Y, Yoshinaga T, Nomura T, Kawano F, Ishihara A, Nonaka I, Roy RR, Edgerton VR (2002) Gravitational unloading effects on muscle fiber size, phenotype and myonuclear number. Adv Space Res 30(4): 777–781. https://doi.org/10.1016/s0273-1177(02)00395-2
Thomason DB, Biggs RB, Booth FW (1989) Protein metabolism and beta-myosin heavy-chain mRNA in unweighted soleus muscle. Am J Physiol 257(Pt 2): R300–R305. https://doi.org/10.1152/ajpregu.1989.257.2.R300
Yin H, Price F, Rudnicki MA (2013) Satellite cells and the muscle stem cell niche. Physiol Rev 93(1): 23–67. https://doi.org/10.1152/physrev.00043.2011
Dumont NA, Bentzinger CF, Sincennes MC, Rudnicki MA (2015) Satellite Cells and Skeletal Muscle Regeneration. Compr Physiol 5(3): 1027–1059. https://doi.org/10.1002/cphy.c140068
Wang YX, Dumont NA, Rudnicki MA (2014) Muscle stem cells at a glance. J Cell Sci 127(Pt 21): 4543–4548. https://doi.org/10.1242/jcs.151209
Wagers AJ, Conboy IM (2005) Cellular and molecular signatures of muscle regeneration: current concepts and controversies in adult myogenesis. Cell 122(5): 659–667. https://doi.org/10.1016/j.cell.2005.08.021
Shenkman BS, Turtikova OV, Nemirovskaya TL, Grigoriev AI (2010) Skeletal muscle activity and the fate of myonuclei. Acta Naturae 2(2): 59–66.
Nakanishi R, Hirayama Y, Tanaka M, Maeshige N, Kondo H, Ishihara A, Roy RR, Fujino H (2016) Nucleoprotein supplementation enhances the recovery of rat soleus mass with reloading after hindlimb unloading-induced atrophy via myonuclei accretion and increased protein synthesis. Nutr Res 36(12): 1335–1344. https://doi.org/10.1016/j.nutres.2016.10.007
Mitchell PO, Pavlath GK (2004) Skeletal muscle atrophy leads to loss and dysfunction of muscle precursor cells. Am J Physiol Cell Physiol 287(6): C1753–C1762. https://doi.org/10.1152/ajpcell.00292.2004
Matsuba Y, Goto K, Morioka S, Naito T, Akema T, Hashimoto N, Sugiura T, Ohira Y, Beppu M, Yoshioka T (2009) Gravitational unloading inhibits the regenerative potential of atrophied soleus muscle in mice. Acta Physiol (Oxf) 196(3): 329–339. https://doi.org/10.1111/j.1748-1716.2008.01943.x
Ferreira R, Neuparth MJ, Ascensao A, Magalhaes J, Vitorino R, Duarte JA, Amado F (2006) Skeletal muscle atrophy increases cell proliferation in mice gastrocnemius during the first week of hindlimb suspension. Eur J Appl Physiol 97(3): 340–346. https://doi.org/10.1007/s00421-006-0197-6
Guitart M, Lloreta J, Manas-Garcia L, Barreiro E (2018) Muscle regeneration potential and satellite cell activation profile during recovery following hindlimb immobilization in mice. J Cell Physiol 233(5): 4360–4372. https://doi.org/10.1002/jcp.26282
Mirzoev T, Tyganov S, Vilchinskaya N, Lomonosova Y, Shenkman B (2016) Key Markers of mTORC1-Dependent and mTORC1-Independent Signaling Pathways Regulating Protein Synthesis in Rat Soleus Muscle During Early Stages of Hindlimb Unloading. Cell Physiol Biochem 39(3): 1011–1020. https://doi.org/10.1159/000447808
Hardie DG (2005) New roles for the LKB1–>AMPK pathway. Curr Opin Cell Biol 17 (2): 167–173. https://doi.org/10.1016/j.ceb.2005.01.006
Mounier R, Lantier L, Leclerc J, Sotiropoulos A, Pende M, Daegelen D, Sakamoto K, Foretz M, Viollet B (2009) Important role for AMPKalpha1 in limiting skeletal muscle cell hypertrophy. FASEB J 23(7): 2264–2273. https://doi.org/10.1096/fj.08-119057
Villanueva-Paz M, Cotan D, Garrido-Maraver J, Oropesa-Avila M, de la Mata M, Delgado-Pavon A, de Lavera I, Alcocer-Gomez E, Alvarez-Cordoba M, Sanchez-Alcazar JA (2016) AMPK Regulation of Cell Growth, Apoptosis, Autophagy, and Bioenergetics. Exp Suppl 107: 45–71. https://doi.org/10.1007/978-3-319-43589-3_3
Thomson DM (2018) The Role of AMPK in the Regulation of Skeletal Muscle Size, Hypertrophy, and Regeneration. Int J Mol Sci 19(10): 3125. https://doi.org/10.3390/ijms19103125
Fu X, Zhu MJ, Dodson MV, Du M (2015) AMP-activated protein kinase stimulates Warburg-like glycolysis and activation of satellite cells during muscle regeneration. J Biol Chem 290 (44): 26445–26456. https://doi.org/10.1074/jbc.M115.665232
Fu X, Zhao JX, Zhu MJ, Foretz M, Viollet B, Dodson MV, Du M (2013) AMP-activated protein kinase alpha1 but not alpha2 catalytic subunit potentiates myogenin expression and myogenesis. Mol Cell Biol 33 (22): 4517–4525. https://doi.org/10.1128/MCB.01078-13
Fu X, Zhu M, Zhang S, Foretz M, Viollet B, Du M (2016) Obesity Impairs Skeletal Muscle Regeneration Through Inhibition of AMPK. Diabetes 65 (1): 188–200. https://doi.org/10.2337/db15-0647
Steinberg GR, Michell BJ, van Denderen BJ, Watt MJ, Carey AL, Fam BC, Andrikopoulos S, Proietto J, Gorgun CZ, Carling D, Hotamisligil GS, Febbraio MA, Kay TW, Kemp BE (2006) Tumor necrosis factor alpha-induced skeletal muscle insulin resistance involves suppression of AMP-kinase signaling. Cell Metab 4(6): 465–474. https://doi.org/10.1016/j.cmet.2006.11.005
Williamson DL, Butler DC, Alway SE (2009) AMPK inhibits myoblast differentiation through a PGC-1alpha-dependent mechanism. Am J Physiol Endocrinol Metab 297 (2): E304–E314. https://doi.org/10.1152/ajpendo.91007.2008
Fulco M, Cen Y, Zhao P, Hoffman EP, McBurney MW, Sauve AA, Sartorelli V (2008) Glucose restriction inhibits skeletal myoblast differentiation by activating SIRT1 through AMPK-mediated regulation of Nampt. Dev Cell 14(5): 661–673. https://doi.org/10.1016/j.devcel.2008.02.004
Komarova MY, Rozhkov SV, Ivanova OA, Turtikova OV, Mirzoev TM, Dmitrieva RI, Shenkman BS, Vilchinskaya NA (2022) Cultured Myoblasts Derived from Rat Soleus Muscle Show Altered Regulation of Proliferation and Myogenesis during the Course of Mechanical Unloading. Int J Mol Sci 23(16): 9150. https://doi.org/10.3390/ijms23169150
Vilchinskaya NA, Rozhkov SV, Komarova MY, Dmitrieva RI, Shenkman BS (2022) Effect of simulated gravitational unloading on m. Soleus satellite cells. Aviakosm Ekol Med (Russia) 56(1): 20–29. https://doi.org/10.21687/0233-528X-2022-56-2-20-29
Novikov VE, Ilyin EA (1981) Age-related reactions of rat bones to their unloading. Avia Space Environ Med 52(9): 551–553.
Morey-Holton ER, Globus RK (2002) Hindlimb unloading rodent model: technical aspects. J Appl Physiol (1985) 92(4): 1367–1377. https://doi.org/10.1152/japplphysiol.00969.2001
Theret M, Gsaier L, Schaffer B, Juban G, Ben Larbi S, Weiss-Gayet M, Bultot L, Collodet C, Foretz M, Desplanches D, Sanz P, Zang Z, Yang L, Vial G, Viollet B, Sakamoto K, Brunet A, Chazaud B, Mounier R (2017) AMPKalpha1-LDH pathway regulates muscle stem cell self-renewal by controlling metabolic homeostasis. EMBO J 36(13): 1946–1962. https://doi.org/10.15252/embj.201695273
Fu X, Zhao JX, Liang J, Zhu MJ, Foretz M, Viollet B, Du M (2013) AMP-activated protein kinase mediates myogenin expression and myogenesis via histone deacetylase 5. Am J Physiol Cell Physiol 305 (8): C887–C895. https://doi.org/10.1152/ajpcell.00124.2013
Vilchinskaya NA, Mochalova EP, Nemirovskaya TL, Mirzoev TM, Turtikova OV, Shenkman BS (2017) Rapid decline in MyHC I(beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J Physiol 595 (23): 7123–7134. https://doi.org/10.1113/JP275184
Belova SP, Vilchinskaya NA, Mochalova EP, Mirzoev TM, Nemirovskaya TL, Shenkman BS (2019) Elevated p70S6K phosphorylation in rat soleus muscle during the early stage of unloading: Causes and consequences. Arch Biochem Biophys 674: 108105. https://doi.org/10.1016/j.abb.2019.108105
Chibalin AV, Benziane B, Zakyrjanova GF, Kravtsova VV, Krivoi II (2018) Early endplate remodeling and skeletal muscle signaling events following rat hindlimb suspension. J Cell Physiol 233(10): 6329–6336. https://doi.org/10.1002/jcp.26594
Hilder TL, Baer LA, Fuller PM, Fuller CA, Grindeland RE, Wade CE, Graves LM (2005) Insulin-independent pathways mediating glucose uptake in hindlimb-suspended skeletal muscle. J Appl Physiol (1985) 99(6): 2181–2188. https://doi.org/10.1152/japplphysiol.00743.2005
Inoki K, Zhu T, Guan KL (2003) TSC2 mediates cellular energy response to control cell growth and survival. Cell 115(5): 577–590. https://doi.org/10.1016/s0092-8674(03)00929-2
Gwinn DM, Shackelford DB, Egan DF, Mihaylova MM, Mery A, Vasquez DS, Turk BE, Shaw RJ (2008) AMPK phosphorylation of raptor mediates a metabolic checkpoint. Mol Cell 30(2): 214–226. https://doi.org/10.1016/j.molcel.2008.03.003
Bolster DR, Crozier SJ, Kimball SR, Jefferson LS (2002) AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling. J Biol Chem 277(27): 23977–23980. https://doi.org/10.1074/jbc.C200171200
Williamson DL, Bolster DR, Kimball SR, Jefferson LS (2006) Time course changes in signaling pathways and protein synthesis in C2C12 myotubes following AMPK activation by AICAR. Am J Physiol Endocrinol Metab 291(1): E80–E89. https://doi.org/10.1152/ajpendo.00566.2005
Nakashima K, Ishida A (2022) AMP-activated Protein Kinase Activation Suppresses Protein Synthesis and mTORC1 Signaling in Chick Myotube Cultures. J Poult Sci 59 (1): 81–85. https://doi.org/10.2141/jpsa.0210021
Ruvinsky I, Sharon N, Lerer T, Cohen H, Stolovich-Rain M, Nir T, Dor Y, Zisman P, Meyuhas O (2005) Ribosomal protein S6 phosphorylation is a determinant of cell size and glucose homeostasis. Genes Dev 19(18): 2199–2211. https://doi.org/10.1101/gad.351605
Cuenda A, Cohen P (1999) Stress-activated protein kinase-2/p38 and a rapamycin-sensitive pathway are required for C2C12 myogenesis. J Biol Chem 274(7): 4341–4346. https://doi.org/10.1074/jbc.274.7.4341
Pollard HJ, Willett M, Morley SJ (2014) mTOR kinase-dependent, but raptor-independent regulation of downstream signaling is important for cell cycle exit and myogenic differentiation. Cell Cycle 13(16): 2517–2525. https://doi.org/10.4161/15384101.2014.941747
Rion N, Castets P, Lin S, Enderle L, Reinhard JR, Eickhorst C, Ruegg MA (2019) mTOR controls embryonic and adult myogenesis via mTORC1. Development 146(7): 172460. https://doi.org/10.1242/dev.172460
Zhang P, Liang X, Shan T, Jiang Q, Deng C, Zheng R, Kuang S (2015) mTOR is necessary for proper satellite cell activity and skeletal muscle regeneration. Biochem Biophys Res Commun 463(1-2): 102–108. https://doi.org/10.1016/j.bbrc.2015.05.032
Wheeler MT, Snyder EC, Patterson MN, Swoap SJ (1999) An E-box within the MHC IIB gene is bound by MyoD and is required for gene expression in fast muscle. Am J Physiol 276(5): C1069–C1078. https://doi.org/10.1152/ajpcell.1999.276.5.C1069
Hughes SM, Koishi K, Rudnicki M, Maggs AM (1997) MyoD protein is differentially accumulated in fast and slow skeletal muscle fibres and required for normal fibre type balance in rodents. Mech Dev 61(1-2): 151–163. https://doi.org/10.1016/s0925-4773(96)00631-4
Seward DJ, Haney JC, Rudnicki MA, Swoap SJ (2001) bHLH transcription factor MyoD affects myosin heavy chain expression pattern in a muscle-specific fashion. Am J Physiol Cell Physiol 280(2): C408–C413. https://doi.org/10.1152/ajpcell.2001.280.2.C408
Ekmark M, Rana ZA, Stewart G, Hardie DG, Gundersen K (2007) De-phosphorylation of MyoD is linking nerve-evoked activity to fast myosin heavy chain expression in rodent adult skeletal muscle. J Physiol 584 (Pt 2): 637–650. https://doi.org/10.1113/jphysiol.2007.141457
Paramonova II, Vilchinskaya NA, Shenkman BS (2021) HDAC4 Is Indispensable for Reduced Slow Myosin Expression at the Early Stage of Hindlimb Unloading in Rat Soleus Muscle. Pharmaceuticals (Basel) 14(11): 1167. https://doi.org/10.3390/ph14111167
Mita Y, Zhu H, Furuichi Y, Hamaguchi H, Manabe Y, Fujii NL (2022) R-spondin3 is a myokine that differentiates myoblasts to type I fibres. Sci Rep 12(1): 13020. https://doi.org/10.1038/s41598-022-16640-2
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова