Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 6, стр. 737-748
Сравнительный анализ экспрессии факторов фиброза в сердечной ткани крыс Sprague-Dawley и Wistar при развитии хронической почечной недостаточности
Н. И. Агалакова 1, Е. В. Михайлова 1, А. А. Пьянков 2, О. В. Надей 1, И. А. Ершов 1, М. М. Галагудза 3, А. Я. Багров 4, И. В. Романова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
3 Институт экспериментальной медицины НМИЦ им. В.А. Алмазова Минздрава России
Санкт-Петербург, Россия
4 Padakonn Pharma
Narva, Estonia
* E-mail: irinaromanova@mail.ru
Поступила в редакцию 05.04.2023
После доработки 03.05.2023
Принята к публикации 04.05.2023
- EDN: WGYLZJ
- DOI: 10.31857/S086981392306002X
Аннотация
Проведено сравнение степени развития уремической кардиомиопатии и фиброза сердечной ткани при хронической почечной недостаточности в модельных экспериментах на самцах крыс Sprague-Dawley и Wistar категории SPF. Для индукции ХПН у крыс проводили субтотальную нефрэктомию слева, а через 2 нед. – тотальную нефрэктомию справа. Контролем служили ложнооперированные животные. Через 4 нед. после второй операции у животных измеряли артериальное давление, а в тканях левого желудочка сердца методами ПЦР в реальном времени и иммуноблоттинга оценивали экспрессию факторов фиброза (транскрипционного фактора Fli1, проколлагена-I, коллагена-I и коллагена-IV). После нефрэктомии у крыс Sprague-Dawley выявлено значительное повышение систолического артериального давления и гипертрофия левого желудочка сердца. У крыс Wistar разница артериального давления между нефрэктомированными и ложнооперированными животными была меньше, а отношение массы левого желудочка к массе тела не изменилось. Экспериментальная хроническая почечная недостаточность у крыс Sprague-Dawley сопровождалась 1.5–2.5-кратным подавлением экспрессии гена Fli1 и снижением содержания белка Fli1 в ткани сердца, в то время как у крыс Wistar достоверных различий не наблюдалось. Уровни проколлагена-I и коллагена-I в сердце крыс обеих линий не изменялись ни на уровне транскрипции, ни на уровне трансляции. Такая разница в развитии патологических процессов в ткани сердца животных двух линий свидетельствует о неэффективности примененной схемы нефрэктомии для индукции уремической кардиомиопатии и изучения про-фибротических механизмов у крыс Wistar.
ВВЕДЕНИЕ
Хроническая почечная недостаточность (ХПН) представляет собой многофакторное прогрессирующее патологическое состояние, неизбежно приводящее к необратимому снижению функции почек [1]. Этот синдром ежегодно диагностируется у миллионов людей по всему миру, достигая 10–15% от мировой популяции, и в большинстве случаев сопровождается развитием сердечно-сосудистых осложнений – уремической кардиомиопатии (УКП). Более того, у большинства пациентов уремическая кардиомиопатия развивается даже раньше ХПН, а риск инвалидности и неожиданной смерти из-за сердечно-сосудистых патологий выше, чем из-за терминальной почечной недостаточности, в целом в 15–30 раз чаще, чем от других заболеваний. Уремическая кардиомиопатия характеризуется гипертензией, множеством метаболических нарушений в клетках сердца и ремоделированием ткани сердца (гипертрофией левого желудочка сердца и фиброзом миокарда), приводящим к аритмии (систолической и диастолической дисфункции) [2, 3].
Экспериментальное моделирование ХПН является важнейшим подходом для изучения патофизиологических механизмов развития уремической кардиомиопатии и поиска новых терапевтических стратегий, направленных на снижение тяжести его течения. Одной из наиболее эффективных моделей ХПН у экспериментальных животных, быстро приводящих к УКП, является нефрэктомия (НЭ) разных типов, например, 5/6 и 2K1C (2-kidney-1-clip) [4]. В предыдущих работах было показано, что частичная НЭ (5/6 почек) у крыс и мышей приводит к появлению симптомов, характерных для уремической кардиомиопатии, в частности фиброзному поражению сердца [5–8]. Однако грызуны разных видов и линий вследствие генетических различий по-разному реагируют на НЭ, в результате чего степень и эффективность развития ХПН может различаться, и для появления выраженных симптомов требуется разное время или различные схемы НЭ [4, 9]. В предыдущих исследованиях механизмов развития сосудистого фиброза при уремической кардиомиопатии в качестве модельного объекта использовались крысы Sprague-Dawley [5–7]. Целью данной работы было оценить универсальность и эффективность модели 5/6 НЭ для индукции уремической кардиомиопатии и фиброза сердечной ткани у двух родственных линий крыс (Sprague-Dawley и Wistar).
Известно, что одним из универсальных сигнальных путей фиброза тканей сердечно-сосудистой системы при гипертензивных заболеваниях является активация внутриклеточного каскада, включающего подавление экспрессии транскрипционного фактора Fli1, что приводит к стимуляции экспрессии генов проколлагена и избыточному синтезу коллагенов различных типов [10]. Для того чтобы выяснить, какая из линий крыс является более подходящей экспериментальной моделью для изучения процессов развития фиброза сердечной ткани при ХПН, на уровне транскрипции и трансляции был проведен сравнительный анализ уровней экспрессии фактора Fli1, коллагенов I и IV.
МЕТОДЫ ИССЛЕДОВАНИЯ
Самцы крыс линий Sprague-Dawley (n = 13) и Wistar (n = 12) статуса SPF были получены из НПП “Питомник лабораторных животных” филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (г. Пущино, Московская обл.) в возрасте 3 мес. Масса тела животных составляла 280–330 г. Крысы содержались на базе вивария Института экспериментальной медицины НМИЦ им. В.А. Алмазова при температуре 23–25°C, цикле освещении 12 ч день/ночь и с доступом к еде и воде ad libitum.
После 1-недельной адаптации крысы каждой линии были случайным образом разделены на 2 группы. Для индукции ХПН животным проводили субтотальную НЭ слева (удаление коркового и части мозгового слоев), а еще через 2 нед. – тотальную НЭ справа. Контролем служили ложнооперированные животные. Для анестезии использовали изофлуран. Через 4 нед. после второй операции у животных измеряли артериальное давление (АД) с помощью установки для неинвазивного измерения фирмы ADInstruments (Австралия), состоящей из NIBP Controller (запись пульсограммы, измерение АД) и Power Lab 4/35 (преобразование и вывод сигнала на ПК в программу для анализа Lab Chart 8 ). В конце эксперимента под анестезией изофлураном крысам рассекали брюшную аорту, выделяли левые желудочки сердца и замораживали их на сухом льду. Экспрессию факторов фиброза (транскрипционного фактора Fli1, проколлагена-I, коллагена-I и коллагена-IV) в сердечной ткани оценивали методами ПЦР в реальном времени и иммуноблоттинга.
Анализ уровня экспрессии генов был проведен с помощью количественной ПЦР в реальном времени. Для выделения тотальной РНК использовали RNA-extract (Евроген, Россия) согласно инструкции производителя. Концентрацию РНК и ее чистоту (A260/A280 ≥ 1.6) определяли с помощью “Nanophotometer C40” (Implen, Германия). Синтез обратной транскрипции (ОТ) был проведен с 1 мкг тотальной РНК и набором ОТ MMLV RT kit (Евроген, Россия) по инструкции производителя. Амплификацию проводили в смеси (25 мкл), содержащей ОТ-продукт (по 10 нг для генов, кодирующих коллагены, 20 нг для гена, кодирующего Fli1), по 0.4 мкМ прямого (F – forvard) и обратного (R – reverse) праймеров (табл. 1), qPCRmix-HS SYBR + LowROX (Евроген, Россия) в 96-луночных ПЦР-планшетах (в триплетах) на приборе “Real-Time System CFX96 C1000 Touch Thermal Cycler” (BioRad Laboratories, Inc., Singapoure). Протокол циклов амплификации ранее был подробно описан ранее [11]. Чистоту ПЦР-продукта проверяли с помощью электрофореза в 30%-ном агарозном геле с бромистым этидием и оценивали с помощью гель-документирующей системы (Chemidoc, BioRad, Великобритания). Для количественной оценки уровня мРНК целевых генов относительно контрольного гена 18S использовали метод delta-delta Ct.
Таблица 1.
Характеристики праймеров, использованных для ПЦР в “реальном времени”
| Ген | Положение | Последовательность (5'–3') | NCBI номер |
|---|---|---|---|
| Collagen-I | F | TGG CAA CCT CAA GAA GTC CC | NM_053304.1 |
| R | ACA AGC GTG CTG TAG GTG AA | ||
| Collagen-IV | F | AAA TGG CGC TCC TGA TCC AA | NM_001135009.1 |
| R | TTC TTG TGG AGT TCT CGC CC | ||
| Fli1 | F | CCAACGAGAGGAGAGTCATCG | NM_002017.5 |
| R | TTCCGTGTTGTAGAGGGTGGT | ||
| 18S* | F | GGACACGGACAGGATTGACA | NR_046237.1 |
| R | ACCCACGGAATCGAGAAAGA |
Для иммуноблоттинга кусочки левого желудочка сердца гомогенизировали при 4°C в буфере RIPA (Santa Cruz Biotechnology, Inc., Santa Cruz, CA, США). Белки в солюбилизированных пробах разделяли по молекулярной массе с помощью SDS-PAGE в 10%-ном геле и переносили на нитроцеллюлозную мембрану (GE Health Care/Life Sciences, Pittsburgh, PA, США). Мембраны последовательно инкубировали с первичными антителами к Fli1 (rabbit ab124791, Abcam; 1 : 500), проколлагену-I (mouse sc-166572, Santa Cruz Biotechnology, Santa Cruz, CA, США; 1 : 200), коллагену-I (mouse sc-393573, Santa Cruz Biotechnology, Santa Cruz, CA, США; 1 : 200) и коллагену-IV (rabbit ab6586, Abcam; 1 : 500), а затем со вторичными HRP-конъюгированными антителами к кролику (Amersham RPN934, GE Health Care/Life Sciences, Великобритания; 1 : 1000) или к мыши (Amersham RPN931; 1 : 2000). Для оценки уровня экспрессии контрольного белка GAPDH (глицеральдегид-3-фосфатдегидрогеназы) использовали первичные антитела мыши (Santa Cruz Biotechnology, США; 1 : 1000), а затем вторичные антитела козы против мыши (1 : 2000). Иммунопозитивный сигнал визуализировали с помощью реагентов Amersham ECL detection system (RPN2236) на пленку X-ray film (CEA, Göteborg, Швеция). Оптическую плотность полос определяли с помощью денситометрического анализа, используя программу Image Lab (BioRad, Hercules, CA, США).
Статистическую обработку данных проводили в программе GraphPad Prism 6 software (San Diego, CA, США), используя однофакторный дисперсионный анализ ANOVA и апостериорный тесты Тьюки или Даннета. Различия между пробами считали статистически достоверными при p < 0.05. Результаты представлены как среднее ± стандартная ошибка.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
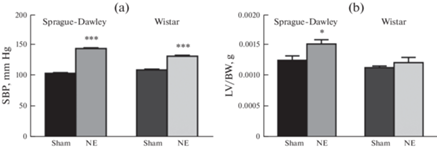
У животных обеих линий НЭ привела к значительному повышению систолического АД по сравнению с контрольными группами (рис. 1a). У крыс Sprague-Dawley АД повышалось от 105.3 ± 1.0 у ложнооперированных животных до 145.8 ± 1.2 мм рт. ст. у крыс после НЭ, в то время как у крыс Wistar – от 110.7 ± 1.4 мм рт. ст. до 133.4 ± 1.4 мм рт. ст. соответственно. Кроме того, развитие ХПН у крыс Sprague-Dawley сопровождалось увеличением массы левого желудочка сердца по отношению к массе тела, в то время как у животных линии Wistar это отношение статистически достоверно не изменилось (рис. 1b).
Рис. 1.
Артериальное давление (a) и отношение массы левого желудочка к массе тела (b) у крыс Sprague-Dawley и Wistar после ложной операции (Sham) и нефрэктомии (NE). Обозначения: LV – левый желудочек, BW – масса тела. Достоверность отличий от Sham: * – p < 0.05, *** – p < 0.001, n = 6–7 в каждой группе.
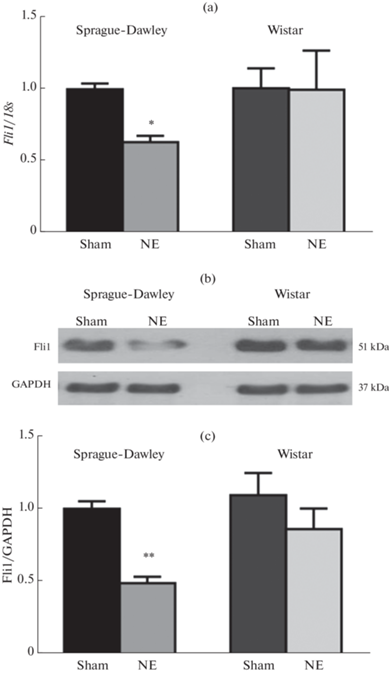
Сравнительный анализ экспрессии транскрипционного фактора Fli1, одного из ключевых факторов фиброза, показал, что экспериментальная ХПН у крыс Sprague-Dawley сопровождалась значительным подавлением экспрессии гена Fli1 (рис. 2a). Содержание белка Fli1 в клетках сердца также снижалось в 2–2.5 раза (рис. 2b). У крыс Wistar после НЭ в нашем эксперименте уровень Fli1 достоверно не изменился ни на уровне транскрипции, ни на уровне трансляции (рис. 2a–c).
Рис. 2.
Относительный уровень мРНК транскрипционного фактора Fli1 (a) и белка Fli1 (b, c) в тканях сердца крыс Sprague-Dawley и Wistar после ложной операции (Sham) и нефрэктомии (NE). * – p < 0.05, ** – p < 0.001 по сравнению с Sham, n = 6–7 в каждой группе.
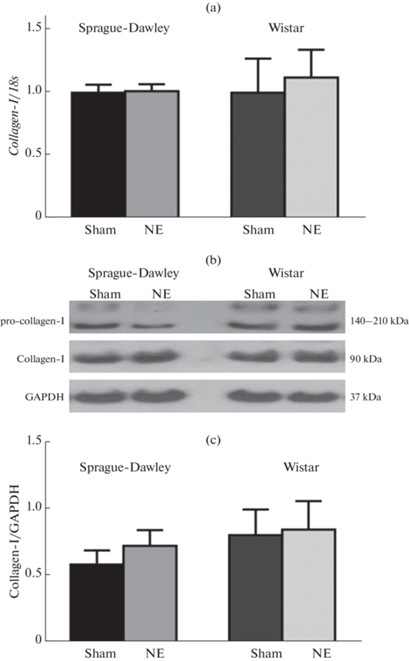
Экспрессия гена другого маркера фиброза – коллагена-I в тканях левого желудочка после НЭ не изменилась ни у крыс Sprague-Dawley, ни у животных Wistar. Уровни белка про-коллагена-I и коллагена-I также не различалась в ткани cердца контрольных и НЭ-крыс обеих линий (рис. 3).
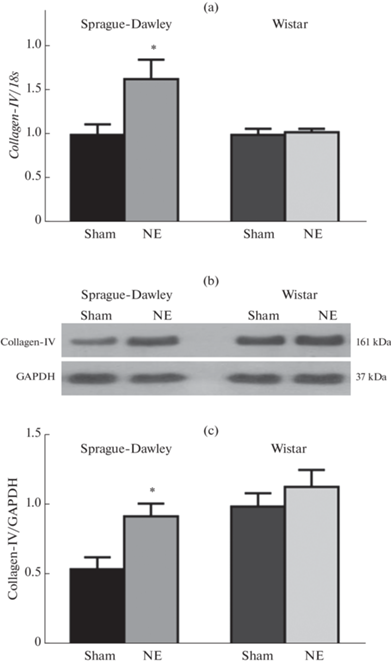
Рис. 3.
Относительный уровень мРНК коллагена-I (a) и уровень белков проколлагена-I (b) и коллагена-I (b, c) в ткани сердца крыс Sprague-Dawley и Wistar после ложной операции (Sham) и нефрэктомии (NE). В каждой группе n = 6.
В ткани сердца крыс Sprague-Dawley после НЭ было выявлено значительное повышение уровня мРНК коллагена-IV и накопление белка коллагена-IV, в то время как у крыс Wistar ни уровень мРНК коллагена-IV, ни содержание белка коллагена-IV не изменялись (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хотя точные генетические отличия между животными линий Sprague-Dawley и Wistar не определены, в ряде исследований выявлены различные метаболические особенности, а также отличия реакций сердечно-сосудистой и респираторной систем в ответ на действие различных стимулов. Например, крысы Sprague-Dawley представляют собой менее активных и более быстро растущих животных, однако метаболические эффекты высокожировой диеты (набор массы тела и жировой ткани, размер адипоцитов, уровни адипонектина и лептина в плазме, снижение толерантности к глюкозе) более очевидны у крыс Wistar [12]. Кроме того, животные этих линий различаются по эндокринному профилю [13] и метаболизму глюкозы и аминокислот в клетках печени [14]. Эмбрионы Wistar более подвержены тератогенному воздействию, например, бис-диамин индуцирует более выраженные сердечно-сосудистые аномалии [15]. Повышение артериального давления в ответ на кратковременную гипоксию было более выражено у Sprague-Dawley [16], в то время как у Wistar гипоксия индуцировала более сильную полицитемию и гипертрофию правого желудочка, которые являются важнейшими признаками легочной гипертензии [17]. У крыс Sprague-Dawley наблюдались более стабильные ишемические повреждения и максимальное снижение мозгового кровоснабжения по сравнению с крысами Wistar после окклюзии средней мозговой артерии, хотя уровень смертности был выше у последних [18]. Наоборот, в исследовании Kunze и соавт. [19] уровень смертности после подобной процедуры была выше у Sprague-Dawley.
Результаты нашей работы продемонстрировали значительные отличия в восприимчивости крыс Sprague-Dawley и Wistar к НЭ и, как следствие, разную эффективность развития уремической кардиомиопатии и фиброза сердечной ткани при ХПН. Хотя АД повышалось у животных обеих линий, степень гипертензии у крыс Sprague-Dawley была значительно выше, чем у Wistar (рис. 1). Разница АД между ложнооперированными и нефрэктомированными животными линии Sprague-Dawley составила ~40 мм рт. ст., в то время как у крыс Wistar АД повысилось только на ~23 мм рт. ст. Увеличение массы левого желудочка сердца по отношению к массе тела у Sprague-Dawley может косвенно указывать на развитие гипертрофии сердца, в отличие от крыс линии Wistar, у которых этот параметр не отличался от такового у ложнооперированных животных. Уровни экспрессии изучаемых маркеров фиброза в тканях левого желудочка сердца крыс двух линий также различались. Если в сердце крыс Sprague-Dawley экспрессия гена Fli1 и белка Fli1 подавлялась в 1.5–2.5 раза, в сердце Wistar содержание этого фактора оставалась относительно стабильным как на уровне транскрипции, так и на уровне трансляции (рис. 2). Содержание коллагена-IV также увеличивалось только в ткани сердца крыс Sprague-Dawley (рис. 4).
Данные, полученные для крыс Sprague-Dawley, согласуются с результатами предыдущих исследований, полученных на НЭ-животных этой линии [5–7] и мышах линии В6 [8]. Экспериментальная уремическая кардиомиопатия и фиброз тканей сердечно-сосудистой системы, индуцированные 5/6 НЭ, сопровождались увеличением в плазме крови содержания одного из кардиотонических стероидов – маринобуфагенина. Более того, было показано, что сигнальный путь фиброза, включающий подавление экспрессии Fli1 и избыточный синтез коллагена, зависел от прямого ингибирования активности Na/K-ATФазы маринобуфагенином.
Проявления уремической кардиомиопатии и возможное развитие фиброза сердечной ткани у крыс Wistar в предыдущих исследованиях не оценивались. Однако в ряде работ была выявлена меньшая восприимчивость крыс Wistar к НЭ, хотя полученные данные противоречивы, возможно, вследствие использования разных сублиний животных и схем НЭ. Так, 30-дневная выживаемость крыс Sprague-Dawley после 150-минутной односторонней тепловой ишемии почки, реперфузии и двухсторонней НЭ составила 55% по сравнению с 67% таковой Wistar-Furth [20]. После 5/6 НЭ 75% крыс линии Wistar-Kyoto остались нормотензивными, а в оставшейся почке не наблюдалось гломерулярных повреждений [21]. В работе Fleck и соавтор. [9] долговременные последствия и умеренный фиброз почки после 5/6 НЭ наблюдался только у самок Wistar. В противоположность этому, в исследовании Appenroth и соавт. [22] 5/6 НЭ и временная тепловая ишемия не приводили к каким-либо фиброзным изменениям в почках самок Wistar даже после 20 нед. после операции. Резистентность Wistar к развитию ХПН по сравнению со Sprague-Dawley была выявлена и в работах, в которых использовали как 5/6 НЭ [23], так и одностороннюю НЭ + DOCA + NaCl [24], хотя у животных обеих линий наблюдалось снижение экспрессии нескольких типов эндотелиальной синтазы оксида азота. Однако стеноз почечной артерии по методу 2K1C (2-kidney-1-clip) у крыс Wistar индуцировал значительное увеличение массы сердца и повышение АД, а также увеличение содержания мочевины в плазме крови через 4 нед. после процедуры [25].
Хотя известно, что уремическая кардиомиопатия развивается раньше, чем выраженные симптомы ХПН [2, 3], меньшая степень патологических процессов в ткани сердца крыс Wistar, наблюдаемая в нашей работе, свидетельствует о неэффективности примененной схемы НЭ для изучения про-фибротических процессов. По-видимому, 4 нед. после НЭ недостаточно для развития уремической кардиомиопатии и полноценного фиброза, а для получения сравнимых со Sprague-Dawley показателей этим животным необходимо более длительное время или другая схема НЭ. Повышение АД у крыс Wistar может быть связано с активацией других механизмов. Развитие гипертензии и сосудистых осложнений, в том числе при заболеваниях почек, также может быть следствием активации вазоконстрикции, один из механизмов которой включает избыточную продукцию эндотелием вазоконстрикторных факторов, в частности эндотелина-1 [26, 27]. Например, в недавнем исследовании отсроченной кардиотоксичности доксорубицина развитие фиброза сердца у крыс Wistar через 2 мес. после достижения максимальной кумулятивной дозы (15 мг/кг) сопровождалось достоверным увеличением экспрессии гена эндотелина [28], хотя минимальная доза препарата (5 мг/кг) приводила к значимому снижению уровня этого фактора. Кроме того, формирование фиброзной ткани зависело от дозы доксорубицина. Например, у крыс, получавших минимальную дозу (5 мг/кг) доксорубицина, экспрессия генов, кодирующих коллаген-I и коллагена-II, снижалось по сравнению с контрольной группой, в то время как введение 10 и 15 мг/кг доксорубицина не влияло или увеличивало экспрессию этих генов соответственно. Кроме того, у всех животных, получавших доксорубицин, снижался уровень мРНК коллагена-III [28]. Мы не исключаем, что и в сердце крыс Wistar после схемы НЭ, примененной в нашей работе, может изменяться экспрессия коллагенов других типов.
Список литературы
Garikapati K, Goh D, Khanna S, Echampati K (2021) Uraemic Cardiomyopathy: A Review of Current Literature. Clin Med Insights Cardiol 15: 1179546821998347. https://doi.org/10.1177/1179546821998347
Patel N, Yaqoob MM, Aksentijevic D (2022) Cardiac metabolic remodelling in chronic kidney disease. Nat Rev Nephrol 18(8): 524–537. https://doi.org/10.1038/s41581-022-00576-x
Law JP, Pickup L, Pavlovic D, Townend JN, Ferro CJ (2023) Hypertension and cardiomyopathy associated with chronic kidney disease: epidemiology, pathogenesis and treatment considerations. J Hum Hypertens 37(1): 1–19. https://doi.org/10.1038/s41371-022-00751-4
Adam RJ, Williams AC, Kriegel AJ (2022) Comparison of the surgical resection and infarct 5/6 nephrectomy rat models of chronic kidney disease. Am J Physiol Renal Physiol 322(6): F639–F654. https://doi.org/10.1152/ajprenal.00398.2021
Kennedy DJ, Vetteth S, Periyasamy SM, Kanj M, Fedorova L, Khouri S, Kahaleh MB, Xie Z, Malhotra D, Kolodkin NI, Lakatta EG, Fedorova OV, Bagrov AY Shapiro JI (2006) Central role for the cardiotonic steroid marinobufagenin in the pathogenesis of experimental uremic cardiomyopathy. Hypertension 47: 488–495. https://doi.org/10.1161/01.HYP.0000202594.82271.92
Elkareh, J, Kennedy DJ, Yashaswi B, Vetteth S, Shidyak A, Kim EG, Smaili S, Periyasamy SM, Hariri IM, Fedorova L, Liu J, Wu L, Kahaleh MB, Xie Z, Malhotra D, Fedorova OV, Kashkin VA, Bagrov AY, Shapiro JI (2007) Marinobufagenin stimulates fibroblast collagen production and causes fibrosis in experimental uremic cardiomyopathy. Hypertension 49(1): 215–224. https://doi.org/10.1161/01.HYP.0000252409.36927.05
Haller ST, Kennedy DJ, Shidyak A, Budny GV, Malhotra D, Fedorova OV, Shapiro JI, Bagrov AY (2012) Monoclonal antibody against marinobufagenin reverses cardiac fibrosis in rats with chronic renal failure. Am J Hypertens 25(6): 690–696. https://doi.org/10.1038/ajh.2012.17
Elkareh J, Periyasamy SM, Shidyak A, Vetteth S, Schroeder J, Raju V, Hariri IM, El-Okdi N, Gupta S, Fedorova L, Liu J, Fedorova OV, Kahaleh MB, Xie Z, Malhotra D, Watson DK, Bagrov AY, Shapiro JI (2009) Marinobufagenin induces increases in procollagen expression in a process involving protein kinase C and Fli-1: implications for uremic cardiomyopathy. Am J Physiol Renal Physiol 296(5): F1219–F1226. https://doi.org/10.1152/ajprenal.90710.2008
Fleck C, Appenroth D, Jonas P, Koch M, Kundt G, Nizze H, Stein G (2006) Suitability of 5/6 nephrectomy (5/6NX) for the induction of interstitial renal fibrosis in rats – pinfluence of sex, strain, and surgical procedure. Exp Toxicol Pathol 57(3): 195–205. https://doi.org/10.1016/j.etp.2005.09.005
Mikhailova EV, Romanova IV, Bagrov AY, Agalakova NI (2023) Fli1 and Tissue Fibrosis in Various Diseases. Int J Mol Sci 24(3): 1881. https://doi.org/10.3390/ijms24031881
Agalakova NI, Grigorova Y, Ershov I, Reznik VA, Mikhailova EV, Nadei OV, Samuilovskaya L, Romanova LA, Adair CD, Romanova IV, Bagrov A (2022) Canrenone restores vasorelaxation impaired by marinobufagenin in human preeclampsia. Int J Mol Sci 23: 3336. https://doi.org/10.3390/ijms23063336
Marques C, Meireles M, Norberto S, Leite J, Freitas J, Pestana D, Faria A, Conceição Calhau C (2016) High-fat diet-induced obesity Rat model: a comparison between Wistar and Sprague-Dawley Rat. Adipocyte 5(1): 11–21. https://doi.org/10.1080/21623945.2015.1061723
Kühn ER, Bellon K, Huybrechts L, Heyns W (1983) Endocrine differences between the Wistar and Sprague-Dawley laboratory rat: influence of cold adaptation. Horm Metab Res 15(10): 491–498. https://doi.org/10.1055/s-2007-1018767
Garg R, Heinzle E, Noor F (2018) Hepatocytes of Wistar and Sprague Dawley rats differ significantly in their central metabolism. J Cell Biochem 119(1): 909–917. https://doi.org/10.1002/jcb.26255
Fujino H, Nakagawa M, Nishijima S, Okamoto N, Hanato T, Watanabe N, Shirai T, Kamiya H, Takeuchi Y (2005) Morphological differences in cardiovascular anomalies induced by bis-diamine between Sprague–Dawley and Wistar rats. Congenit Anom (Kyoto) 45: 52–58. https://doi.org/10.1111/j.1741-4520.2005.00063.x
Bazilio DS, Rodrigues KL, Moraes DJA, Machado BH (2021) Distinct cardiovascular and respiratory responses to short-term sustained hypoxia in juvenile Sprague Dawley and Wistar Hannover rats. Auton Neurosci 230: 102746. https://doi.org/10.1016/j.autneu.2020.102746
Snow JB, Kanagy NL, Walker BR, Resta TC (2009) Rat Strain Differences in Pulmonary Artery Smooth Muscle Ca2+ Entry Following Chronic Hypoxia. Microcirculation 16(7): 603–614. https://doi.org/10.1080/10739680903114268
Svoboda J, Litvinec A, Kala D, Pošusta A, Vávrová L, Jiruška P, Otáhal J (2019) Strain differences in intraluminal thread model of middle cerebral artery occlusion in rats. Physiol Res 68(1): 37–48. https://doi.org/10.33549/physiolres.933958
Kunze A, Zierath D, Drogomiretskiy O, Becker K (2014) Variation in behavioral deficits and patterns of recovery after stroke among different rat strains. Transl Stroke Res 5(5): 569–576. https://doi.org/10.1007/s12975-014-0337-y
Raman RN, Pivetti CD, Ramsamooj R, Matthews DL, Demos SG, Troppmann C (2011) Factors influencing rat survival in a warm renal ischemia model: time to adapt the protocols. Transplant Proc 43(5): 1511–1514. https://doi.org/10.1016/j.transproceed.2011.01.177
Bidani AK, Mitchell KD, Schwartz MM, Navar LG, Lewis EJ (1990) Absence of glomerular injury or nephron loss in a normotensive rat remnant kidney model. Kidney Int 38: 28–38. https://doi.org/10.1038/ki.1990.163
Appenroth D, Lupp A, Kriegsmann J, Sawall S, Splinther J, Sommer M, Stein G, Fleck C (2001) Temporary warm ischaemia, 5/6 nephrectomy and single uranyl nitrate administration–comparison of three models intended to cause renal fibrosis in rats. Exp Toxicol Pathol 53(4): 316–324. https://doi.org/10.1078/0940-2993-00197
Saracyn M, Czarzasta K, Brytan M, Murawski P, Lewicki S, Ząbkowski T, Zdanowski R, Cudnoch-Jędrzejewska A, Kamiński GW, Wańkowicz Z (2017) Role of Nitric Oxide Pathway in Development and Progression of Chronic Kidney Disease in Rats Sensitive and Resistant to its Occurrence in an Experimental Model of 5/6 Nephrectomy. Med Sci Monit 23: 4865–4873. https://doi.org/10.12659/msm.903820
Erdely A, Freshour G, Tain YL, Engels K, Baylis C (2007) DOCA/NaCl-induced chronic kidney disease: a comparison of renal nitric oxide production in resistant and susceptible rat strains. Am J Physiol Renal Physiol 292(1): F192–F196. https://doi.org/10.1152/ajprenal.00146.2006
Drábková N, Hojná S, Zicha J, Vaněčková I (2020) Contribution of selected vasoactive systems to blood pressure regulation in two models of chronic kidney disease. Physiol Res 69(3): 405–414. https://doi.org/10.33549/physiolres.934392
de Oliveira MG, Nadruz W Jr, Mónica FZ (2022) Endothelial and vascular smooth muscle dysfunction in hypertension. Biochem Pharmacol 205: 115263. https://doi.org/10.1016/j.bcp.2022.115263
Martínez-Díaz I, Martos N, Llorens-Cebrià C, Álvarez FJ, Bedard PW, Vergara A, Jacobs-Cachá C, Soler MJ (2023) Endothelin receptor antagonists in kidney disease. Int J Mol Sci 24(4): 3427. https://doi.org/10.3390/ijms24043427
Podyacheva EY, Shmakova TV, Andreeva DD, Toropov RI, Cheburkin YV, Danilchuk MS, Martynov MO, Toropova YG (2023) Molecular markers profile of fibrosis in rats exposed to different doses of doxorubicin. J Evol Biochem Physiol 59(2): 359–368. https://doi.org/10.1134/S0022093023020059
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова