Сенсорные системы, 2019, T. 33, № 3, стр. 204-211
Участие протеинкиназы С в рецептор-опосредованных сигнальных процессах
В. А. Пеннияйнен 1, *, В. Б. Плахова 1, И. В. Рогачевский 1, С. Г. Терехин 1, С. А. Подзорова 1, Б. В. Крылов 1
1 Федеральное Государственное бюджетное учреждение науки
Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, наб. Макарова, д. 6, Россия
* E-mail: pvalentina2@yandex.ru
Поступила в редакцию 19.02.2019
После доработки 22.03.2019
Принята к публикации 16.04.2019
Аннотация
Коменовая кислота является специфическим агонистом опиоидоподобных рецепторов, обнаруженных в мембране сенсорного нейрона. Эти рецепторы связаны с каналами NaV1.8, участвующими в кодировании ноцицептивной информации. Данные, полученные методом локальной фиксации потенциала, свидетельствуют о том, что на мембранном уровне процесс лиганд-рецепторного связывания коменовой кислоты проявляется в снижении эффективного заряда активационного воротного устройства каналов NaV1.8. Применение специфического ингибитора протеинкиназы С не влияло на этот рецептор-опосредованный механизм модуляции указанных каналов. На тканевом уровне получен противоположный результат: указанный ингибитор (Tamoxifen) полностью блокировал сигнал, вызванный приложением коменовой кислоты и направленный радиально на геном нервной клетки. Тот факт, что Tamoxifen устранял нейрит-стимулирующий эффект коменовой кислоты, доказывает участие протеинкиназы С в исследуемом каскадном процессе в качестве последовательного звена.
ВВЕДЕНИЕ
Коменовая кислота является специфическим агонистом обнаруженных нами в мембране сенсорного нейрона опиоидоподобных рецепторов, которые передают сигнал к каналам NaV1.8, кодирующим ответы ноцицепторов (Крылов и др., 1999; Krylov et al., 2017). В роли трансдуктора сигнала здесь выступает Na,K-АТФаза в комплексе с Src-киназой (Пеннияйнен и др., 2014; Шелых и др., 2017; Penniyaynen et al., 2018). Этот рецептор-опосредованный сигнал направлен также и на геном сенсорного нейрона, что приводит к регуляции роста нейритов (Penniyaynen et al., 2018). Другие участники данного внутриклеточного каскадного процесса, активируемого коменовой кислотой и связанного с сигнальным комплексом Na,K-АТФаза/Src, остаются малоизученными.
Исследования последних двадцати лет показали, что Na,K-АТФаза, помимо своей хорошо известной насосной функции, выполняет также и функцию трансдуктора сигнала в мембранах клеток различных тканей (Kometiani et al., 1998; Xie, Askari, 2002; Khalaf et al., 2018; Pratt et al., 2018). Данная функция запускается очень низкими (наномолярными) концентрациями уабаина, которые были обнаружены в крови человека (Hamlyn et al., 1991). Видимо, эндогенные концентрации уабаина достаточны для запуска внутриклеточных каскадных процессов, причем функцию трансдуктора сигнала в этих случаях выполняют не G-белки, а Na,K-АТФаза/Src-киназный комплекс. Указанный комплекс осуществляет клеточно-специфическую трансдукцию сигнала, активируя пути Raf/MEK/ERK, PLC/PKC, PI3K/Akt, а также Ca2+ сигнализацию и генерацию ROS (Tian et al., 2006; Aperia et al., 2016; Cui, Xie, 2017). Отметим, что в клетках, которые способны на пролиферативный рост, запускаемая уабаином передача сигналов может активировать как Src-зависимый, так и Src-независимый пути (Xie, Askari, 2002; Liu et al., 2007; Wu et al., 2013; Madan et al., 2017). На клетках линии LM-α3-1 был продемонстрирован Src-независимый способ активации путей ERK и Akt с участием PI3K и PKC, индуцируемый уабаином (Madan et al., 2017). В сенсорном нейроне нами было обнаружено, что очень низкие эндогенные концентрации уабаина трансдуктор-опосредованно активируют Src-зависимый р38-МАР-киназный сигнальный путь (Пеннияйнен и др., 2016). Однако рецептор-опосредованный Src-зависимый механизм внутриклеточной сигнализации, запускаемый коменовой кислотой при взаимодействии с опиоидоподобным рецептором, остается неизученным.
Цель настоящей работы – выяснение роли протеинкиназы С в указанном рецептор-опосредованном сигнальном процессе в первичном сенсорном нейроне.
МЕТОДИКИ ИССЛЕДОВАНИЯ
Метод органотипической культуры эмбриональной нервной ткани. Исследования проведены на эксплантатах дорзальных ганглиев 10-12-дневных куриных эмбрионов, культивируемых в чашках Петри на подложках из коллагена в СО2-инкубаторе (Sanyo, Япония) в течение трех суток при 36.5°С и 5% -ном СО2. В работе использовали питательную среду следующего состава: 45% раствора Хенкса, 40% среды Игла, 10% фетальной сыворотки коровы с добавлением глюкозы (0.6%), глютамина (2 ммоль/л) и гентамицина (100 ед/мл) (Penniyaynen et al., 2018). В ряде экспериментов в культуральную среду добавляли специфический ингибитор протеинкиназы С Tamoxifen (Tmf) (Tsubaki et al., 2018; Valvassori et al., 2017) и коменовую кислоту. Контрольными служили эксплантаты, культивированные только в условиях питательной среды. Для визуализации объектов использовался микроскоп Axio Observer Z1 (Carl Zeiss, Германия). Полученные изображения анализировались с использованием программ ImageJ и ZEN_2012. Для количественной оценки роста эксплантатов применялся морфометрический метод. Индекс площади (ИП) рассчитывался как отношение площади зоны роста эксплантата к исходной центральной площади, где находились немигрирующие клетки. Значение ИП контрольных эксплантатов принимали за 100%. Работа выполнена на оборудовании ЦКП “Конфокальная микроскопия” Института физиологии им. И.П. Павлова РАН.
Метод локальной фиксации потенциала. В электрофизиологических экспериментах нами был использован метод локальной фиксации потенциала (patch-clamp method) в конфигурации “регистрация активности целой клетки” (“whole-cell”) (Hamill et al., 1981). Объектом исследования являлись полученные методом краткосрочного культивирования изолированные сенсорные нейроны, выделенные из областей L5–S1 ганглиев спинного мозга новорожденных крысят линии Wistar. Интактные нервные клетки были получены путем культивирования изолированных нейронов в течение двух часов в стандартных питательных средах с использованием СО2-инкубатора. Более подробно модифицированный метод краткосрочного культивирования диссоциированных сенсорных нейронов описан ранее (Плахова и др., 2003; Penniyaynen et al., 2018).
Работу проводили на животных из ЦКП “Биоколлекция ИФ РАН”.
Для регистрации характеристик каналов NaV1.8. применялись стандартные растворы (концентрации представлены в ммоль/л). Внеклеточный: NaCl – 65, CaCl2 – 2, MgCl2 – 2, Choline Cl – 70, HEPES Na – 10, TTX – 0.0003, pH 7.4. Внутриклеточный: CsF – 100, NaCl – 10, CsCl – 40, MgCl2 – 2, HEPES Na – 10, Tmf – 0.01, pH 7.2. Наличие ионов фтора во внутриклеточном растворе и полное отсутствие ионов калия позволили избавиться от всех компонентов калиевых и кальциевых токов (Kostyuk et al., 1975; Elliott, Elliott, 1993). Благодаря присутствию во внеклеточном растворе тетродотоксина блокировалось функционирование быстрых тетродотоксинчувствительных каналов, что делало возможным регистрировать ответы только одной популяции натриевых каналов, NaV1.8. В работе использованы реактивы фирмы Sigma (США).
Токи натриевых каналов NaV1.8 фиксировались до и после приложения коменовой кислоты в присутствии Tmf во внутриклеточном растворе. Оценку изменения потенциалочувствительности каналов NaV1.8 осуществляли на основании регистрации величины эффективного заряда (Zeff) активационного воротного устройства указанных каналов с применением метода Алмерса (Almers, 1978). Подробно этот подход описан в наших предыдущих работах (Крылов и др., 1999; Krylov et al., 2017).
Статистическую обработку полученных результатов выполняли в программе STATISTICA 8.0 (StatSoft, США) с использованием t-критерия Стьюдента. Данные представлены в виде среднего значения ± стандартная ошибка среднего. Различия принимались статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
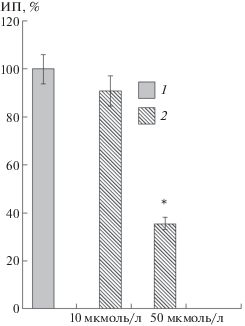
Метод органотипической культуры ткани был использован для выяснения участия протеинкиназы C во внутриклеточных каскадных процессах, рецептор-опосредованно запускаемых коменовой кислотой. Нами было исследовано влияние Tmf, специфического ингибитора протеинкиназы C, на рост нейритов сенсорных нейронов. При добавлении Tmf в питательную среду в концентрации 50 мкмоль/л наблюдали достоверное ингибирование роста нейритов дорзальных ганглиев на 65 ± 7% (n = 28, р < 0.05) по отношению к контрольным значениям (n = 30). В концентрации 10 мкмоль/л Tmf практически не влиял на рост нейритов: ИП экспериментальных эксплантатов не отличался от своего контрольного значения (рис. 1).
Рис. 1.
Влияние ингибитора протеинкиназы С Tmf на рост нейритов дорзальных ганглиев 10-12-дневных куриных эмбрионов.
1 – контроль; 2 – Tmf.
По оси ординат – индекс площади эксплантатов (ИП, %).
* – различия достоверны относительно контрольных эксплантатов, p < 0.05.
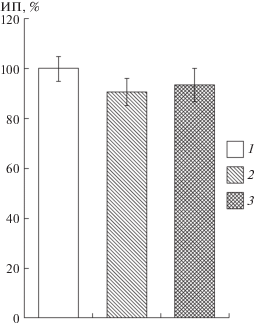
Как было отмечено выше, выраженная нейрит-стимулирующая активность коменовой кислоты реализуется благодаря ее воздействию на опиоидоподобный рецептор, связанный с Nа,К-АТФазой, которая выполняет в данном случае функцию трансдуктора сигнала и передает его далее на геном. Ранее нами в аналогичных экспериментальных условиях было показано, что коменовая кислота в концентрации 10 нмоль/л значительно стимулирует рост нейритов сенсорных нейронов (Penniyaynen et al., 2018). Результаты, полученные в настоящей работе, показывают, что нейрит-стимулирующий эффект коменовой кислоты устранялся при культивировании дорзальных ганглиев в среде, содержащей указанную субстанцию (10 нмоль/л) и ингибитор протеинкиназы C Tmf (10 мкмоль/л) (рис. 2). Так как в данной концентрации сам по себе Tmf не влияет на рост нейритов, можно заключить, что протеинкиназа С участвует во внутриклеточном каскаде, который рецептор-опосредованно запускается коменовой кислотой.
Рис. 2.
Изменение индекса площади эксплантатов дорзальных ганглиев 10–12-дневных куриных эмбрионов при воздействии коменовой кислоты (10 нмоль/л) в присутствии ингибитора протеинкиназы С Tmf (10 мкмоль/л).
1 – контроль; 2 – Tmf; 3 – коменовая кислота + Tmf.
По оси ординат – индекс площади эксплантатов (ИП, %).
* – различия достоверны относительно контрольных эксплантатов, p < 0.05.
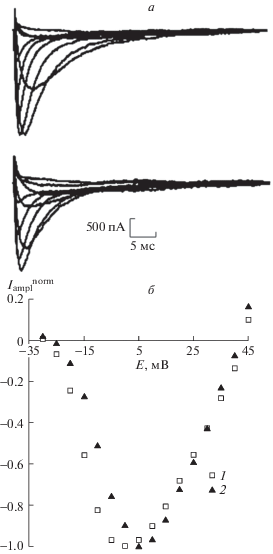
Метод локальной фиксации потенциала позволил исследовать участие протеинкиназы C в процессе передачи сигнала в тангенциальном направлении (вдоль мембраны нейрона) от опиоидоподобного рецептора к каналам NaV1.8. Во всех экспериментах, включая контрольные, внутриклеточный раствор содержал специфический ингибитор протеинкиназы С Tmf в концентрации 10 мкмоль/л. Эта концентрация была выбрана на основании представленных выше результатов, поскольку применение метода органотипической культуры ткани показало, что именно такая концентрация Tmf приводила к блокированию рецептор-опосредованного влияния коменовой кислоты на рост нейритов. На рис. 3,а представлены записи семейств натриевых токов NaV1.8, полученные до и после приложения коменовой кислоты (100 нмоль/л) с наружной стороны мембраны. На рис. 3,б приведены нормированные пиковые вольт-амперные характеристики натриевых токов, построенные обычным способом (Hodgkin, Huxley, 1952) в контрольном эксперименте и после воздействия коменовой кислоты. Как видно, приложение коменовой кислоты вызывает сдвиг вольт-амперной характеристики вправо в область положительных потенциалов, что свидетельствует о взаимодействии этого агента с обнаруженным нами опиоидоподобным рецептором и, следовательно, об активации рецептор-опосредованного механизма сигнализации (Крылов и др., 1999; Krylov et al., 2017; Penniyaynen et al., 2018). Важным количественным параметром, который определяет электровозбудимость мембраны ноцицептивного нейрона, является эффективный заряд активационной воротной системы медленных натриевых каналов NaV1.8. Для его измерения были построены зависимости хордовой проводимости от величины трансмембранной разности потенциалов GNa(E). Эта функция имеет вид
Рис. 3.
Влияние коменовой кислоты на потенциалочувствительность медленных натриевых каналов NaV1.8 в экспериментах с использованием внутриклеточного раствора, содержащего ингибитор протеинкиназы С Tmf в концентрации 10 мкмоль/л.
а – записи семейств медленных натриевых токов, зарегистрированных до (вверху) и после (внизу) приложения коменовой кислоты (100 нмоль/л) с внешней стороны мембраны нейрона.
Тестирующий потенциал изменялся от –35 до 45 мВ с шагом 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен –110 мВ. Токи утечки и емкостные токи вычтены программным способом.
б – нормированные значения пиковых вольт-амперных характеристик медленных натриевых каналов.
Зависимости построены по данным контрольного эксперимента (1) и после приложения 100 нмоль/л коменовой кислоты (2).
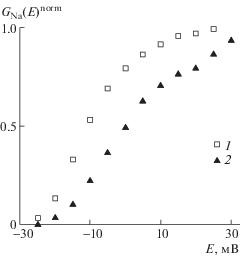
Функция GNa(E) имеет начальный S-образный участок, крутизна которого отражает особенности потенциалочувствительности активационного процесса. После построения нормированной функции $G_{{{\text{Na}}}}^{{{\text{norm}}}}(E)$ (рис. 4) легко видеть, что крутизна этого участка изменяется после действия коменовой кислоты.
Рис. 4.
Потенциалозависимость хордовой проводимости медленных натриевых каналов, полученная в экспериментах с использованием внутриклеточного раствора, содержащего ингибитор протеинкиназы С Tmf в концентрации 10 мкмоль/л.
Функция GNa(E) была нормирована, т.е. строилась ${{G}_{{{\text{Na}}}}}{{(E)}^{{{\text{norm}}}}}$ = ${{G}_{{{\text{Na}}}}}(E){\text{/}}G_{{{\text{Na}}}}^{{\max }}(E)$, где $G_{{{\text{Na}}}}^{{\max }}(E)$ – ее максимальное значение. Показаны данные контрольного эксперимента (1) и результаты, полученные после приложения 100 нмоль/л коменовой кислоты (2).
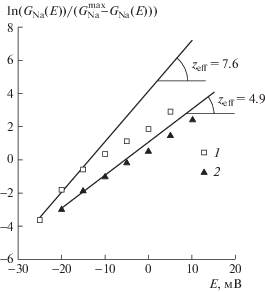
Для количественной оценки функции GNa(E) обычно применяется распределение Больцмана. При этом предполагается, что стационарные характеристики переходов между состояниями активационной воротной системы натриевых каналов определяются потенциалозависимостью хордовой проводимости. Для оценки величины Zeff активационной системы нами применяется другой подход, впервые предложенный создателями мембранной ионной теории (Hodgkin, Huxley, 1952) и модифицированный позднее (Almers, 1978). Рисунок 5 иллюстрирует этот способ построения Zeff. Тангенсы углов наклона регрессионных прямых построены по первым трем точкам и определяют предельную логарифмическую чувствительность (Almers, 1978) каналов NaV1.8 к изменениям трансмембранного потенциала. В представленном эксперименте величина Zeff, измеренная в единицах заряда электрона, изменяется от 7.6 (в контрольном эксперименте) до 4.9.
Рис. 5.
Присутствие во внутриклеточном растворе ингибитора протеинкиназы С Tmf в концентрации 10 мкмоль/л не блокирует эффект снижения потенциалочувствительности активационной воротной системы медленных натриевых каналов.
Экспоненциальные функции, представленные в логарифмическом масштабе (ось ординат), позволяют определить величины Zeff по тангенсам углов наклона асимптот, проведенных к начальным участкам этих функций в контрольном опыте (1) и после приложения 100 нмоль/л коменовой кислоты с внешней стороны мембраны клетки (2).
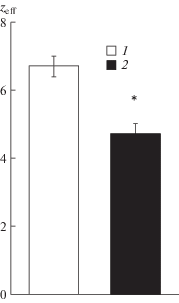
На рис. 6 представлены средние значения эффективного заряда в контрольных экспериментах и при действии коменовой кислоты в концентрации 100 нмоль/л. Во всех опытах происходит снижение величины Zeff в присутствии Tmf во внутриклеточном растворе, что полностью совпадает с данными, полученными в предыдущей работе. Как было установлено, коменовая кислота в концентрации 100 нмоль/л также снижает величину эффективного заряда в экспериментах с обычными растворами, не содержащими Tmf (Plakhova et al., 2014).
Рис. 6.
Снижение эффективного заряда активационной воротной системы медленных натриевых каналов после приложения коменовой кислоты в экспериментах с использованием внутриклеточного раствора, содержащего ингибитор протеинкиназы С Tmf в концентрации 10 мкмоль/л.
1 – контрольные значения; 2 – после приложения коменовой кислоты (100 нмоль/л) .
* – различия достоверны относительно контрольных значений, p < 0.05.
ОБСУЖДЕНИЕ
Проведенное нами исследование роли протеинкиназы C в механизмах передачи сигнала, запускаемого при активации коменовой кислотой опиоидоподобного рецептора, позволило выявить следующие особенности этих процессов. На мембранном уровне лиганд-рецепторное связывание исследуемого агента проявляется в сдвиге пиковой вольт-амперной характеристики каналов NaV1.8 и снижении эффективного заряда их активационного воротного устройства. Применение специфического ингибитора протеинкиназы C не влияло на этот рецептор-опосредованный процесс: сигнал, запускаемый коменовой кислотой, без искажений доходил до своего эффекторного звена, которым служили медленные натриевые каналы.
Совершенно иначе происходит распространение этого сигнала в радиальном направлении. Данные, полученные на тканевом уровне, свидетельствуют об участии протеинкиназы C в процессе внутриклеточной сигнализации, направленном на геном нервной клетки. Tmf устранял нейрит-стимулирующий эффект коменовой кислоты, что доказывает участие этого белка в исследуемых каскадных процессах в качестве последовательного звена.
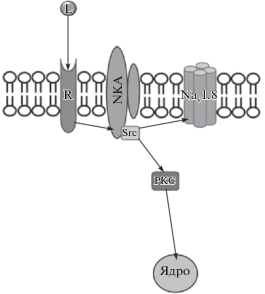
Рисунок 7 обобщает полученные данные. Они свидетельствуют о том, что расхождение сигналов, запускаемых коменовой кислотой при ее специфическом связывании с опиоидоподобным рецептором, происходит на уровне протеинкиназы C: этот белок участвует во внутриклеточных каскадных процессах, направленных на геном клетки. Однако он не принимает участия в тангенциальном распространении сигнала к каналам NaV1.8, кодирующим ноцицептивную информацию. Коменовая кислота, являющаяся лекарственной субстанцией разрабатываемого нами неопиоидного анальгетика, снижает возбудимость ноцицепторов благодаря рецептор-опосредованной модуляции каналов NaV1.8 (Plakhova et al., 2014), что является механизмом купирования нейропатической боли. Другим важнейшим проявлением положительного действия коменовой кислоты является ее нейрит-стимулирующий эффект. Данные, полученные в настоящей работе, указывают на важную роль, которую играет протеинкиназа C в рассматриваемом механизме. Детализация этого внутриклеточного каскадного процесса является задачей дальнейших исследований.
Рис. 7.
Схема рецептор-опосредованной модуляции процессов внутриклеточной сигнализации в сенсорном нейроне, запускаемых коменовой кислотой в тангенциальном и радиальном направлениях.
L – коменовая кислота; R – опиоидоподобный рецептор; NKA – Nа,К-АТФаза; NaV1.8 – медленный натриевый канал NaV1.8; PКС – протеинкиназа С.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 64), гранта РФФИ N 18-015-00079.
Список литературы
Крылов Б.В., Дербенев А.В., Подзорова С.А., Людыно М.И., Кузьмин А.В., Изварина Н.Л. Морфин уменьшает чувствительность к потенциалу медленных натриевых каналов. Российский физиологический журнал им. И.М. Сеченова. 1999. Т. 85. № 2. С. 225–236.
Пеннияйнен В.А., Кипенко А.В., Лопатина Е.В., Крылов Б.В. Участие р38 МАРК сенсорных нейронов в сигнальном каскаде, запускаемом уабаином. Российский физиологический журнал им. И.М. Сеченова. 2016. Т. 102. № 12. С. 80–86.
Пеннияйнен В.А., Ячнев И.Л., Кипенко А.В., Лопатина Е.В., Крылов Б.В. Роль Src-киназы в рецепции инфракрасного излучения. Сенсорные системы. 2014. Т. 28. № 4. С. 90–94.
Плахова В.Б., Подзорова С.А., Мищенко И.В., Баграев Н.Т., Клячкин Л.Е., Маляренко А.М., Романов В.В., Крылов Б.В. Возможные механизмы действия инфракрасного излучения на мембрану сенсорного нейрона. Сенсорные системы. 2003. Т. 17. № 1. С. 24–31.
Шелых Т.Н., Рогачевский И.В., Мошкина В.Н., Подзорова С.А., Крылов Б.В., Плахова В.Б. Исследование влияния ингибитора Src-киназы PP2 на способность уабаина модулировать медленные натриевые каналы. Сенсорные системы. 2017. Т. 31. № 1. С. 16–21.
Almers W. Gating currents and charge movements in excitable membranes. Rev. Physiol. Biochem. Pharmacol. 1978. V. 82. № 7. P. 97–190.
Aperia A., Akkuratov E.E., Fontana X.J., Brismar H. Na+-K+-ATPase, a new class of plasma membrane receptors. Am. J. Physiol. Cell Physiol. 2016. V. 310. P. C491–C495. https://doi.org/10.1152/ajpcell.00359.2015
Cui X., Xie Z. Protein interaction and Na/K-ATPase-mediated signal transduction. Molecules. 2017. V. 22. № 6. E990. https://doi.org/10.3390/molecules22060990
Elliott A.A., Elliott J.R. Characterization of TTX-sensitive and TTX-resistant sodium currents in small cells from adult rat dorsal root ganglia. J. Physiol. (Lond.). 1993. V. 463. № 4. P. 39–56.
Hamill O.P., Marty A., Neher E., Sakmann B., Sigworth F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers. Arch. 1981. V. 391. № 1. P. 85–100.
Hamlyn J.M., Blaustein M.P., Bova S., DuCharme D.W., Harris D.W., Mandel F., Mathews W.R., Ludens J.H. Identification and characterization of a ouabain-like compound from human plasma. Proc. Natl. Acad. Sci. USA. 1991. V. 88. № 21. P. 6259–6263.
Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol. 1952. V. 116. № 4. P. 449–472.
Khalaf F.K., Dube P., Mohamed A., Tian J., Malhotra D., Haller S.T., Kennedy D.J. Cardiotonic steroids and the sodium trade balance: new insights into trade-off mechanisms mediated by the Na+/K+-ATPase. Int. J. Mol. Sci. 2018. V. 19 № 92576. https://doi.org/10.3390/ijms19092576
Kometiani P., Li J., Gnudi L., Kahn B.B., Askari A., Xie Z. Multiple signal transduction pathways link Na+/K+-ATPase to growth-related genes in cardiac myocytes. The roles of Ras and mitogen-activated protein kinases. J. Biol. Chem. 1998. V. 273. № 24. P. 15249–15256.
Kostyuk P.G., Krishtal O.A., Pidoplichko V.I. Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells. Nature. 1975. V. 257. № 5528. P. 691–693.
Krylov B.V., Rogachevskii I.V., Shelykh T.N., Plakhova V.B. Frontiers in pain science. Volume 1. New nonopioid analgesics: understanding molecular mechanisms on the basis of patch-clamp and quantumchemical studies. Sharjah, U.A.E., Bentham Science Publishers Ltd., 2017. 203 p. https://doi.org/10.2174/97816080593001170101
Liu L., Zhao X., Pierre S.V., Askari A. Association of PI3K-Akt signaling pathway with digitalis-induced hypertrophy of cardiac myocytes. Am. J. Physiol. 2007. V. 293. № 5. P. C1489–C1497. https://doi.org/10.1152/ajpcell.00158.2007
Madan N., Xu Y., Duan Q., Banerjee M., Larre I., Pierre S.V., Xie Z. Src-independent ERK signaling through the rat α3 isoform of Na/K-ATPase. Am. J. Physiol. Cell Physiol. 2017. V. 312. № 3. C222–C232. https://doi.org/10.1152/ajpcell.00199.2016
Penniyaynen V., Plakhova V., Rogachevskii I., Krylov B. Src kinase is involved in comenic acid-triggered signaling pathways in sensory neurons. Activitas nervosa superior rediviva. 2018. V. 60. № 1. P. 19–27.
Plakhova V., Rogachevsky I., Lopatina E., Shelykh T., Butkevich I., Mikhailenko V., Otellin V., Podzorova S., Krylov B. A novel mechanism of modulation of slow sodium channels: from ligand-receptor interaction to design of an analgesic medicine. Activitas nervosa superior rediviva. 2014. V. 56. № 3–4. P. 55–64.
Pratt R.D., Brickman C.R., Cottrill C.L., Shapiro J.I., Liu J. The Na/K-ATPase signaling: from specific ligands to general reactive oxygen species. Int. J. Mol. Sci. 2018. 19. № 9. 2600. https://doi.org/10.3390/ijms19092600
Tian J., Cai T., Yuan Z., Wang H., Liu L., Haas M., Maksimova E., Huang X.Y., Xie Z.J. Binding of Src to Na+/K+-ATPase forms a functional signaling complex. Mol. Biol. Cell. 2006. V. 17. № 1. P. 317–326. https://doi.org/10.1091/mbc.e05-08-0735
Tsubaki M., Takeda T., Matsumoto M., Kato N., Yasuhara S., Koumoto Y.I., Imano M., Satou T., Nishida S. Tamoxifen suppresses paclitaxel-, vincristine-, and bortezomib-induced neuropathy via inhibition of the protein kinase C/extracellular signal-regulated kinase pathway. Tumour Biol. 2018. V. 40. № 10. P. 1–13. https://doi.org/10.1177/1010428318808670
Valvassori S.S., Dal-Pont G.C., Resende W.R., Varela R.B., Peterle B.R., Gava F.F., Mina F.G., Cararo J.H., Carvalho A.F., Quevedo J. Lithium and tamoxifen modulate behavior and protein kinase c activity in the animal model of mania induced by ouabain. Int. J. Neuropsychopharmacol. 2017. V. 20. № 11. P. 877–885. https://doi.org/10.1093/ijnp/pyx049
Wu J., Akkuratov E.E, Bai Y., Gaskill C.M., Askari A., Liu L. Cell signaling associated with Na(+)/K(+)-ATPase: activation of phosphatidylinositide 3-kinase IA/Akt by ouabain is independent of Src. Biochemistry. 2013. V. 52. № 50. P. 9059–9067. https://doi.org/10.1021/bi4011804
Xie Z., Askari A. Na(+)/K(+)-ATPase as a signal transducer. Eur. J. Biochem. 2002. V. 269. № 10. P. 2434–2439. https://doi.org/10.1046/j.1432-1033.2002.02910.x
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


