Сенсорные системы, 2023, T. 37, № 1, стр. 65-77
Изменение спектральных характеристик и уровня когерентности фокальной активности обонятельной луковицы крысы в динамике ксилазин-тилетамин-золазепамового наркоза
В. Н. Кирой 1, П. О. Косенко 1, *, П. Д. Шапошников 1, Е. В. Асланян 1, А. И. Саевский 1
1 Южный федеральный университет
344058 Ростов-на-Дону, пр. Стачки, 194, Россия
* E-mail: peza-i@mail.ru
Поступила в редакцию 03.06.2022
После доработки 21.10.2022
Принята к публикации 03.11.2022
- EDN: ATSRWQ
- DOI: 10.31857/S0235009223010043
Аннотация
Известно, что фокальная активность (ФА), регистрируемая в обонятельной луковице (ОЛ), в значительной степени генерируется в ее локальных нейронных сетях, имеет непосредственное отношение к обработке ольфакторной информации и подвержена влиянию различных факторов, в том числе анестетиков. С использованием 8-электродных матриц на шести взрослых самцах серых доминитицированных крыс в хронических экспериментах исследовали эффекты ксилазин-тилетамин-золазепамовой (КТЗ) анестезии на спектральные характеристики и когерентность ФА, регистрируемой с дорзальной поверхности ОЛ в частотном диапазоне 1–150 Гц в течение двух часов. Показано, что наиболее существенные изменения в ФА ОЛ крыс в КТЗ-наркозе наблюдаются в области высоких гамма-частот. Статистически значимое увеличение мощности (в 2–4 раза) и когерентности (до 50%) этих частот наблюдалось в ФА всех животных уже в течение 10–15 мин от начала наркотизации. При этом, если в бодрствовании модальные значения этих частот приходились на область 70–80 Гц, то по прошествии указанного времени – 110–130 Гц. В динамике наркоза наблюдалось постепенное смещение модального значения в распределении их мощности влево, в область более низких частот (90–110 Гц), при этом их суммарная мощность (но не когерентность) статистически значимо снижалась лишь на фоне выхода животного из наркоза.
ВВЕДЕНИЕ
Известно, что характеристики фокальной активности (ФА) структур обонятельного анализатора, например обонятельной луковицы, существенно зависят от ряда факторов, в том числе уровня бодрствования (Jessberger et al., 2016), наличия/отсутствия и вида наркоза (Li et al., 2012), поведенческой парадигмы (Frederick et al., 2016; Martin, Gervais et al., 2004). Выяснен ряд аспектов, связанных с нейронными механизмами ее формирования в отдельных частотных диапазонах на отдельных структурных уровнях обонятельной системы: тета (Nusser et al., 2001), бета (Fourcaud-Trocme et al., 2014) и гамма (Rojas-Libano, Kay, 2012). Для обонятельной луковицы предложены модели ее нейронной организации (Li, Cleland, 2017; Polese et al., 2014), которые все чаще становятся самостоятельным и достаточно эффективным исследовательским инструментом. Однако не до конца понятны механизмы формирования всего спектра регистрируемых в ФА ОЛ частот, их взаимосвязь с переработкой информации, поступающей по специфическим афферентам и нисходящим входам от вышерасположенных структур как обонятельной системы, так и других неспецифических структур мозга. Все это серьезно осложняет интерпретацию регистрируемых в ФА феноменов, которые характеризуются значительной изменчивостью даже при предъявлении аналогичных по своим характеристикам адекватных запаховых раздражителей. В значительной степени именно это препятствует разработке универсальных, высокочувствительных и мобильных биоэлектронных (биогибридных) детекторов запахов, потребность в которых достаточно высока как при решении диагностических задач, так и поиске вредных и опасных веществ.
Анестезия является одним из факторов, позволяющих, с одной стороны, стабилизировать состояние нервных структур, а с другой – существенно влиять на это состояние. В течение последних нескольких лет активно изучается влияние на ФА структур обонятельной систем наиболее часто используемых неингаляционных анестетиков, включая хлоралгидрат, пентобарбитал, уретан и кетамин (Li et al., 2012; Schoppa, 2006). Недавние исследования, выполненные нами, свидетельствуют о влиянии ксилазин-тилетамин-золазепамовой (КТЗ) анестезии на характеристики ФА, прежде всего, в области гамма-частот (30–120 Гц) (Kosenko et al., 2020), которые, как известно, с одной стороны, генерируются локальными сетями М/Т и гранулярных клеток ОЛ, а с другой – связаны с обработкой ольфакторной информации (Gschwend et al., 2012; Kay, 2015). Показано, в частности, что при искусственном увеличении выраженности этих колебаний тонкая дискриминация одорантов улучшается, равно как и в случае, когда крысы обучаются распознавать близкие запахи (Kay, 2014).
Использование КТЗ анестезии не влияет на вегетативную активность мозга, что позволяет обездвиживать животное, не прибегая к искусственной вентиляции легких. Кроме того, у животного сохраняется возможность распознавать запахи. Однако применение данной комбинации анестетиков приводит к изменениям биоэлектрической активности обонятельной луковицы мозга, что влечет за собой изменение информативных параметров в вызванной биоэлектрической активности ОЛ, использующихся при разработке биогибридной технологии распознавания веществ в воздухе (Shepelev et al., 2022).
Цель настоящей работы – исследование спектральных и когерентных характеристик ФА ОЛ в динамике КТЗ-анестезии.
ОПИСАНИЕ МЕТОДИКИ
Эксперименты проводились на шести взрослых самцах серых доминитицированных крыс (от 350 до 450 г), которые содержались в отдельных клетках с постоянной температурой (23 ± 1°C), влажностью и 12/12-часовым циклом свет/темнота. Крысы имели свободный доступ к еде и воде.
Операция. Крыс анестезировали КТЗ смесью (30 мг золетила и 0.6 мг ксилазина на кг массы тела) и помещали в стереотаксический станок (Narishige, SR-6M-HT). После снятия кожного лоскута над лобными костями череп зачищали от надкостницы, вкручивали пять крепежных винтов по краям скальпированного участка. Над левым полушарием обонятельной луковицы делали трепанационное отверстие в границах 0–1.5 мм от сагиттального шва/ 7.0–10.0 мм кпереди от Bregma для имплантации микроэлектродной матрицы, которая содержала восемь остро заточенных вольфрамовых микроэлектродов диаметром 50 мкм в их толстой части в стеклянной оболочке (два ряда по четыре микроэлектрода с расстоянием между ними 700 мкм). Матрица погружалась в луковицу на глубину порядка 400 мкм ниже поверхности. Для верификации точек регистрации ФА после завершения экспериментов использовали методы гистологического контроля. Провод, имплантированный в пространство между кожей и костью носа, использовался в качестве заземления. Матрица и разъем укреплялись на черепе светоотверждаемой пластмассой. Послеоперационный период восстановления животных составлял не меньше одной недели.
Регистрация фокальной активности обонятельной луковицы. Фокальная активность регистрировалась у крыс непрерывно как в состоянии бодрствования, так и после инъекции КТЗ-наркоза. Наркоз вводился после 40-минутного периода регистрации ФА в бодрствовании, регистрация активности в наркозе осуществлялась в течение 120 мин сразу после инъекции. Для контроля функционального состояния животного дополнительно регистрировали пневмограмму и кардиограмму.
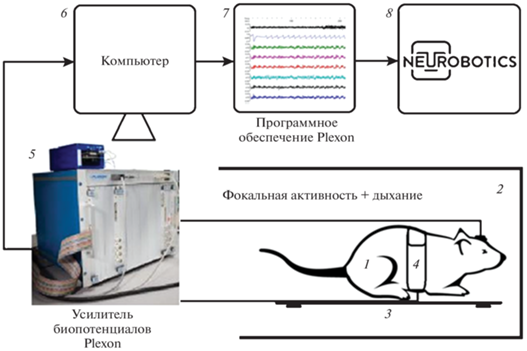
Регистрация ФА осуществлялась монополярно (референтный электрод – неизолированная вольфрамовая проволока, вкалываемая под кожу в области затылочной кости) с использованием программно-аппаратного комплекса Plexon MAP 32 (Multichannel Acquisition Processor, Plexon, Dallas, TX) в диапазоне частот 1–200 Гц, частота дискретизации сигнала составляла 10 кГц по каждому из каналов. Полученные записи прореживали до 1 кГц и конвертировали в формат edf для последующей обработки средствами программной части комплекса биоусилителей фирмы Neurobotics (Россия) (рис. 1).
Рис. 1.
Блок-схема проведения экспериментов.
1 – наркотизированная крыса с вживленной в ОЛ микроэлектродной матрицей; 2 – экспериментальная камера (бокс); 3 – система для автоматического поддержания температуры тела животного; 4 – система контроля дыхания; 5 – 32-канальная система Plexon Multichannel Acquisition Processor (MAP) (Plexon Corp., Dallas, Texas, USA); 6 – компьютер; 7 – программное обеспечение Plexon, 8 – программное обеспечение Neurobotics.
Анализ фокальной активности. Зарегистрированные электрограммы фрагментировались на 10-минутные блоки, соответствующие этапам бодрствования (Б) и наркоза (Н). Блоки маркировались в порядке следования непрерывной записи от ее начала. Внутри каждого блока автоматически выделяли эпохи длительностью 8196 отсчетов (что соответствует ≈ 8 с записи). Эпохи, содержавшие технические или физиологические (двигательные, дыхательные) артефакты, удалялись. Как правило, их общее количество не превышало 5% от длины всей записи. Таким образом, анализировались до 4 Б-блоков, соответствующих бодрствованию, и 12 Н-блоков, соответствующих состоянию наркоза.
Для каждой 8-секундной эпохи рассчитывали спектры мощности (СпМ) и частотную когерентность (КоГ) – нормированную взаимную спектральную мощность – с шагом по частоте 0.8 Гц, которые затем усреднялись в следующих частотных диапазонах: 0.98–9.80; 10.78–20.58; 21.56–30.38; 31.36–40.18; 41.16–49; 50.96–59.78; 60.76–69.58; 70.56–79.38; 80.36–90.16; 91.14–99.96; 100.94–109.76; 110.74–120.54; 121.52–130.34; 131.32–140.14; 141.12–1349.94 Гц. Выбор указанных диапазонов определялся следующими обстоятельствами. Во-первых, согласно существующим сведениям (Kay et al., 2009), частоты до 12 Гц, регистрируемые в ФА ОЛ грызунов (в частности, крыс), относятся к дыхательному или тета-ритму. Бета-частоты представлены в диапазоне 15–30, а гамма – 40–100 Гц. Во-вторых, в ФА ОЛ крыс регистрируются и более высокие частоты, вплоть до 120 (Beshel et al., 2007) и даже 170 Гц (Kosenko et al., 2020). Наконец, в динамике КТЗ-наркоза наблюдается перераспределение мощности в пределах гамма-частот. Из анализа были также исключены частоты в районе 50, 100 и 150 Гц, соответствующие сетевой наводке и ее гармоникам. Учитывая мерность микроэлектродной матрицы, СпМ рассчитывалась для восьми точек регистрации, а КоГ – 28 пар отведений (по числу сочетаний из 8 по 2).
Статистический анализ. Наличие и достоверность различий значений СпМ и КоГ ФА ОЛ крыс оценивали при помощи многомерного дисперсионного анализа ANOVA/MANOVA. Использовали метод повторных измерений (repeated measurer) с последующим выделением контрастов (planned comps) и однофакторным анализом (break down & one-way ANOVA), реализованными в пакете прикладных программ Statistica-10. Группирующим фактором выступали БЛОКИ (уровни: Б, Н1-12 Н), в качестве зависимых переменных (R1) рассматривались значения СпМ (восемь отведений ×16 диапазонов) или КоГ (28 пар отведений), которые предварительно с целью приближения к нормальному распределению подвергались, соответственно, log-трансформации и Z-преобразованию. При анализе значений КоГ частотные диапазоны также рассматривались как группирующий фактор.
При интерпретации полученных результатов использовали два уровня значимости: при р < 0.05 различия считались статистически достоверными, при 0.05 ≤ p < 0.08 – существенными (констатировали наличие тренда). Различия (в %) рассчитывали по формуле: Б – Н (%) = (Н – Б) / Б × 100%.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Спектральные характеристики ФА ОЛ крыс в бодрствовании. В бодрствовании ФА ОЛ крыс характеризовалась наличием преимущественно тета-ритма (дыхательного) и бета-частот (рис. 2, а), мощность которых была в 1.5–2 раза выше, по сравнению с гамма-частотами.
Рис. 2.
Образец записи ФА ОЛ крысы НС75, зарегистрированной в бодрствовании (а) и КТЗ-наркозе (б), и распределение мощности (СпМ) и когерентности (КоГ) в частотном диапазоне 1–150 Гц (приведены четыре отведения).
Нижняя часть рисунка – результаты корреляционного анализа спектральной мощности гамма-диапазона 90–140 Гц в динамике наркоза.
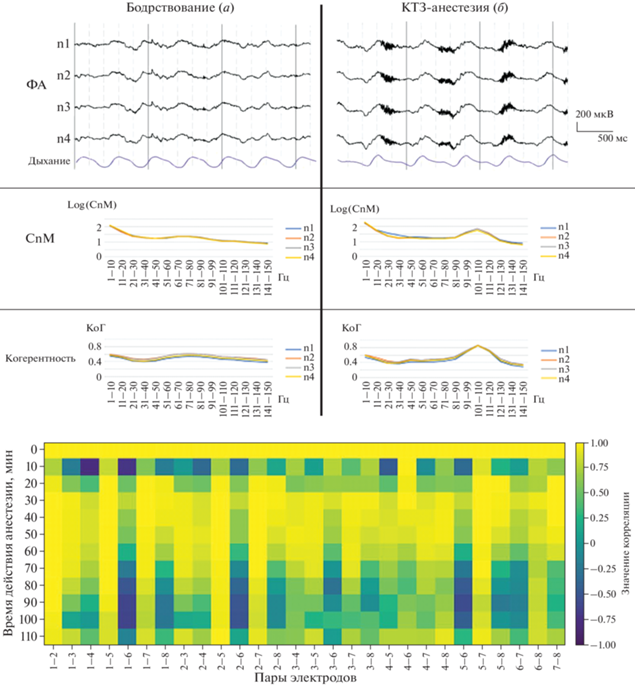
Статистически значимых различий в показателях СпМ между отведениями и 10-минутными блоками не обнаруживалось. Это позволило объединить их для каждого животного при проведении сравнительного анализа с электрограммами, зарегистрированными в КТЗ-наркозе.
Динамика спектральной мощности ФА ОЛ крыс в КТЗ-наркозе. Уже визуальный анализ свидетельствовал о том, что в наркозе наблюдаются существенные изменения характера ФА ОЛ крыс, в которой формируются отчетливые гамма-осцилляции (рис. 2, б). МАNOVA-анализ показал, что, по сравнению с бодрствованием, в наркозе в ФА ОЛ крыс наблюдаются статистически значимые перестройки спектральных характеристик (табл. 1).
Таблица 1.
Результаты МANOVA-анализа значений СпМ ФА ОЛ крыс, зарегистрированной в бодрствовании и КТЗ-наркозе
| Факторы и их взаимодействия | SS | df | MS | F | p |
|---|---|---|---|---|---|
| Свободный член | 1621187.38 | 1 | 1621187.38 | 1264172.24 | 0.00 |
| Блок | 235.56 | 12 | 19.63 | 15.31 | 0.00 |
| Ошибка факторов | 7563.66 | 5898 | 1.28 | – | – |
| R1 | 58642.66 | 119 | 492.80 | 17931.77 | 0.00 |
| R1×Блок | 3488.79 | 1428 | 2.44 | 88.90 | 0.00 |
| Ошибка взаимодействий | 19288.36 | 701862 | 0.03 | – | – |
Сравнительный анализ значений СпМ электрограмм, зарегистрированных в покое и в динамике наркоза, выполненный с использованием метода контрастов (planned comps), показал (табл. 2), что статистически значимые различия имеют место уже в течение первых 10 мин наркотизации, затем они прогрессивно снижаются вплоть до 80-й минуты от начала наркотизации, после чего статистически значимо не отличаются от бодрствования.
Таблица 2.
Результаты сравнительного анализа значений СпМ ФА ОЛ крыс, зарегистрированной в бодрствовании и в динамике КТЗ-наркоза (приведены только Main effects (M.e.))
| Сравнения | df (effect, error) | F | p | % |
|---|---|---|---|---|
| Б – Н1 (10 мин) | 1.132 | 62.93 | 0.00 | 3.49 |
| Б – Н2 (20 мин) | 1.145 | 72.63 | 0.00 | 3.29 |
| Б – Н3 (30 мин) | 1.145 | 68.55 | 0.00 | 3.20 |
| Б – Н4 (40 мин) | 1.146 | 18.08 | 0.00 | 1.63 |
| Б – Н5 (50 мин) | 1.146 | 7.66 | 0.01 | 1.06 |
| Б – Н6 (60 мин) | 1.146 | 8.14 | 0.00 | 1.09 |
| Б – Н7 (70 мин) | 1.144 | 14.37 | 0.00 | 1.47 |
| Б – Н8 (80 мин) | 1.144 | 13.67 | 0.00 | 1.44 |
| Б – Н9 (90 мин) | 1.142 | 1.39 | 0.24 | 0.47 |
| Б – Н10 (100 мин) | 1.143 | 2.99 | 0.08 | 0.68 |
| Б – Н11 (110 мин) | 1.144 | 0.49 | 0.48 | −0.27 |
| Б – Н12 (120 мин) | 1.143 | 1.05 | 0.31 | 0.40 |
Примечание: % – разница между СпМ, в %. Остальные обозначения, как в табл. 1.
В целом СпМ частот, представленных в ФА ОЛ крыс, на начальных этапах наркоза была несколько выше, чем в бодрствовании, что было обусловлено повышением мощности тета- и высоких (90–140 Гц) гамма-частот (рис. 2, СпМ). Мощность бета- и низких гамма-частот (30–90 Гц) в ФА ОЛ крыс в наркозе была существенно ниже, чем в бодрствовании. Результаты расчета корреляционных матриц для спектральной мощности в диапазоне частот 90–140 Гц показали, что после введения наркоза спектр гамма-колебаний изменяется индивидуально для каждой пары электродов. На некоторых парах отведений наблюдалась схожая динамика коэффициентов корреляции.
Дальнейшая детализация полученных результатов, проведенная с использованием однофакторного анализа (break down & one-way ANOVA), показала (рис. 3), что указанные различия наблюдались в ФА всех отведений и полностью формировались в течение 20 мин от начала наркотизации.
Рис. 3.
Графическое изображение результатов сравнительного анализа значений СпМ ФА ОЛ крыс, зарегистрированной в бодрствовании и в динамике КТЗ-наркоза.
Обозначения: ⚫ – рост СпМ,  – снижение, большие – различия достоверны (p < 0.05), малые – тренд (0.05 ≤ p < 0.08).
– снижение, большие – различия достоверны (p < 0.05), малые – тренд (0.05 ≤ p < 0.08).
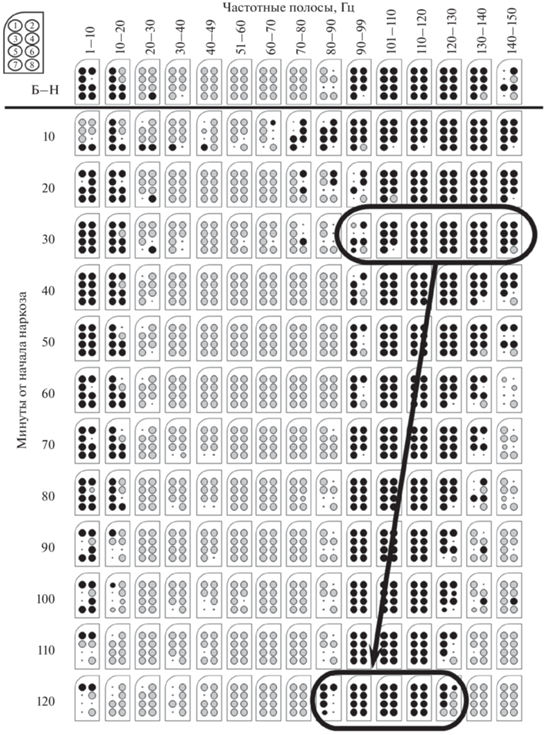
В последующем наблюдалось постепенное снижение мощности тета-частот, которая после 110-й минуты наркотизации практически не отличалась от бодрствования, при сохранении мощности высоких гамма-частот.
Наиболее существенные изменения в КТЗ-наркозе наблюдались в области высоких гамма-частот (90–140 Гц). Анализ показал, что статистически значимый (p < 0.05) рост мощности этих частот (в 2–4 раза) в ФА ОЛ наблюдался уже спустя 10 мин от начала наркотизации. При этом, если в бодрствовании модальные значения этих частот приходились на область 70–80 Гц, то в наркозе – 90–130 Гц, причем в динамике наркоза наблюдалось постепенное смещение модального значения в распределении их мощности влево, в область более низких частот, а мощность этих частот статистически значимо снижалась относительно бодрствования после 110 мин, что связано с выходом животного из наркоза (рис. 3).
В целом, если в начале наркотизации модальные значения в спектре гамма-частот приходились на область 110–130 Гц, то в конце (по прошествии 120 мин) – 90–110 Гц. Индивидуальные различия между животными были незначительными и не превышали 5–8 Гц. Тренд на снижение для всех точек регистрации не ниже R2 = 0.88. Повышение мощности тета-частот на начальных этапах КТЗ-наркоза, характерное для многих анестетиков (Li et al., 2012), коррелировало с частотой и глубиной дыхания. Снижение мощности этих частот до уровня, характерного для бодрствования, начиналось спустя 70 мин от начала наркотизации и завершалось на 110-й минуте (рис. 3).
Когерентность ФА ОЛ бодрствующих крыс. Несмотря на то что регистрация ФА ОЛ крыс осуществлялась с использованием усилителей с большим входным сопротивлением и микроэлектродными матрицами со значительным расстоянием между электродами, существенно превышающим диаметр гломерул, а значит, с уровня расположения М/Т нейронов, иннервирующих различные гломерулы, когерентность регистрируемых у бодрствующих крыс электрограмм значимо отличалась от нулевых значений практически во всем частотном диапазоне (рис. 2 КоГ). Максимальной была когерентность тета- и гамма-частот (51–70 Гц), которые синхронно развивались в различных отведениях на протяжении 25–35% времени регистрации.
Динамика когерентности ФА ОЛ крыс в КТЗ-наркозе. MANOVA-анализ показал, что когерентность частот, представленных в ФА ОЛ крыс в КТЗ-наркозе, в целом статистически значимо отличалась от представленных в бодрствовании (табл. 3).
Таблица 3.
Результаты МANOVA-анализа значений КоГ ФА ОЛ крыс, зарегистрированной в бодрствовании и КТЗ-наркозе
| Факторы и их взаимодействия | SS | df | MS | F | p |
|---|---|---|---|---|---|
| Свободный член | 595998.33 | 1 | 595998.33 | 841729.87 | 0.00 |
| Блок | 3117.57 | 12 | 259.80 | 366.91 | 0.00 |
| Частотная полоса (ЧП) | 27815.30 | 14 | 1986.81 | 2805.97 | 0.00 |
| Блок × ЧП | 14448.85 | 168 | 86.01 | 121.47 | 0.00 |
| Ошибка факторов | 63417.72 | 89565 | 0.71 | – | – |
| R1 | 70072.50 | 27 | 2595.28 | 64709.83 | 0.00 |
| R1 × Блок | 1624.30 | 324 | 5.01 | 125.00 | 0.00 |
| R1 × ЧП | 9093.42 | 378 | 24.06 | 599.82 | 0.00 |
| R1 × Блок × ЧП | 3579.48 | 4536 | 0.79 | 19.68 | 0.00 |
| Ошибка взаимодействий | 96987.48 | 2418255 | 0.04 | – | – |
Примечание: Обозначения, как в табл. 1.
Статистически значимыми были также различия между анализируемыми частотными полосами и временными блоками.
Сравнительный анализ значений КоГ, рассчитанной для электрограмм, зарегистрированных в бодрствовании и в динамике КТЗ-наркоза, выполненный с использованием метода контрастов (planned comps), также показал наличие статистически значимых различий (табл. 4).
Таблица 4.
Результаты МANOVA-анализа значений КоГ ФА ОЛ крыс, зарегистрированной в динамике наркоза, по сравнению с бодрствованием (приведены только Main effects (M.e.))
| Блок | df | F | p | % |
|---|---|---|---|---|
| Б – Н1 (10 мин) | 1.201 | 398.13 | 0.00 | 15.91 |
| Б – Н2 (20 мин) | 1.220 | 1413.44 | 0.00 | 26.33 |
| Б – Н3 (30 мин) | 1.219 | 1039.13 | 0.00 | 22.61 |
| Б – Н4 (40 мин) | 1.221 | 1332.24 | 0.00 | 25.35 |
| Б – Н5 (50 мин) | 1.221 | 994.78 | 0.00 | 21.91 |
| Б – Н6 (60 мин) | 1.221 | 905.44 | 0.00 | 20.90 |
| Б – Н7 (70 мин) | 1.220 | 685.06 | 0.00 | 18.35 |
| Б – Н8 (80 мин) | 1.218 | 385.66 | 0.00 | 13.88 |
| Б – Н9 (90 мин) | 1.215 | 542.90 | 0.00 | 16.73 |
| Б – Н10 (100 мин) | 1.217 | 364.90 | 0.00 | 13.61 |
| Б – Н11 (110 мин) | 1.219 | 484.17 | 0.00 | 15.46 |
| Б – Н12 (120 мин) | 1.217 | 460.21 | 0.00 | 15.26 |
Примечание: Обозначения, как в табл. 1.
В целом в состоянии КТЗ-наркоза уровень КоГ был почти на 19% выше, чем в наркозе. Наиболее значительный прирост (25% и более) наблюдался на 20−40-й минуте наркотизации.
Детализация полученных результатов также проводилась с использованием однофакторного анализа (break down & one-way ANOVA, рис. 4).
Рис. 4.
Графическое изображение результатов сравнительного анализа значений КоГ ФА ОЛ крыс, зарегистрированной в бодрствовании и в динамике КТЗ-наркоза.
Обозначения: красные линии – рост КоГ, синие – снижение. (для удобства восприятия схема расположения электродов немного изменена, по сравнению со СпМ).
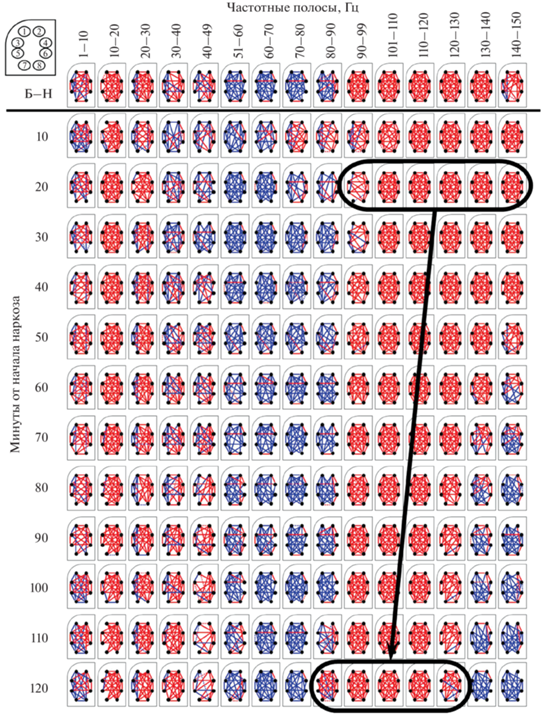
Она показала, что в КТЗ-наркозе (по сравнению с бодрствованием) когерентность ФА выше на частотах 10–20 и 90–150 Гц, тогда как на частотах 51−90 Гц она ниже, а на частотах 1–10 и 20–49 Гц изменяется разнонаправленно в различных парах отведений. При этом в динамике наркоза вначале наблюдался рост когерентности всего спектра высоких гамма-частот (90–150 Гц), который затем сужалась и к 20-й минуте формировалась достаточно устойчивая структура связей на частотах 100–150 Гц. На указанном временном интервале параллельно наблюдался преимущественно рост когерентности низких (до 30 Гц) частот, разнонаправленные изменения в диапазоне 30–49 Гц и снижение – 51–70 Гц. По мере развития наркоза полоса когерентных гамма-частот постепенно сужалась преимущественно за счет частот 130–150 Гц. Это приводило к смещению фокуса когерентности в более низкочастотную область (90–120 Гц). В полосе частот 1–10 Гц в динамике наркоза сначала наблюдался рост когерентности, а на ее завершающем этапе – снижение. Такая динамика когерентности тета-частот коррелировала с характеристиками дыхательного ритма, который был наиболее устойчив в середине наркотизации.
Также было установлено, что для пар электродов, которые оказались высоко коррелированными в наркозе, частотная когерентность ведет себя одинаково. В начале наркоза в диапазоне 90–99 Гц для большинства пар идет статистически значимое увеличение, в то время как между такими электродами (1, 2, 5, 7) происходит уменьшение уровня когерентности. По прошествии 40 мин, когда доминирующая частота гамма-осцилляций уменьшается, между этими же отведениями начинается уменьшение когерентности в диапазоне от 140 до 150 Гц.
ОБСУЖДЕНИЕ
Фокальная активность, которую рассматривают как отражение когерентной ритмической активности групп нейронов, расположенных вблизи регистрирующего электрода (Laurent et al., 1996), является одним из ключевых показателей функционирования нейронных ансамблей мозга. В динамике ксилазин-золетоловой анестезии уровни частотной когерентности между электродами ведут себя по-разному в частотных диапазонах, связанных с обработкой ольфакторной информации (Rojas-Libano, Kay, 2012; Li, Cleland, 2017; Polese et al., 2014), что позволяет разделять источники, связанные с разными запахами (Shcherban et al., 2020; Shepelev et al., 2022). Характеристики регистрирующих электродов и их конфигурация позволяют минимизировать влияние дальних генераторов потенциалов на ФА ОЛ (Lindén et al., 2011; Nelson, Pouget, 2010; Yaeli, 2009).
Ритмическая активность нейронных ансамблей и механизмы ее синхронизации связаны как собственно со свойствами самих нейронов (Fuentes et al., 2008) и их сетей (Lagier et al., 2004), так и такими синхронизирующими факторами, как химические вещества, присутствующие в межнейронном пространстве, сенсорные (афферентные) входы и нисходящие влияния из структур мозга (Gschwend et al., 2012; Hayar et al., 2004).
Различные аспекты, связанные с природой ритмической активности обонятельного анализатора, наиболее детально изучены на мелких лабораторных животных, в частности, мышах и крысах. Эти исследования показали, что в обонятельной системе (в том числе обонятельной луковице) млекопитающих, в частности крыс, представлена ритмическая активность в трех основных частотных диапазонах, а именно, тета (~1–12 Hz), бета (~15–30 Hz) и гамма (~40–100 Hz) (Kay et al., 2009). В ФА бодрствующих ненаркотизированных крыс наиболее выражен тета-ритм. Поскольку он отчетливо связан с дыханием и обонятельным поведением, колебания этого частотного диапазона часто именуются респираторными осцилляциями (Kay, Stopfer, 2006). Их частота составляет от 1 до 10 (12) кол/с, а когерентность с ритмом дыхания – от 0.5 и выше на отдельных частотах, представленных в спектре этого ритма. У наркотизированных животных частота тета-ритма составляет 0.5–1.5 кол/с (Kay, 2015), а мощность под действием разных видов наркоза изменяется по-разному (Li et al., 2012); под действием пентобарбитала и хлоралгидрата она (по сравнению с бодрствованием) практически не меняется, под действием уретана значимо снижается мощность быстрых (5–12 кол/с) и увеличивает – медленных (1–4 Гц) тета-колебаний. Происхождение тета-ритма связывают с активностью обонятельных сенсорных нейронов (Grosmaitre et al., 2007), центральными механизмами (Ravel, Pager, 1990), пейсмекерными нейронами (внешними тафтовыми клетками) ОЛ, которые спонтанно разряжаются на частоте около 2 Гц (Fukunaga et al., 2014; Hayar et al., 2004; Schoppa, Westbrook, 2001; Wachowiak, Shipley, 2006), наконец, гиппокампом, который может являться драйвером тета-ритма обонятельной луковицы, в частности, во время принюхивания (Kay, 2005). Вероятно, дыхательный ритм служит квантующим механизмом, обеспечивающим согласованную обработку информации о запахах всеми заинтересованными структурами мозга (Buonviso et al., 2003; Kepecs et al., 2006; Wachowiak, 2011).
Синхронные с дыхательной активностью тета-колебания, обнаруженные в экспериментах, исследовались в одной из классических работ Кая (Kay, 2005), где доказывалось, что они являются ритмом обонятельной луковицы, который не является дыхательным артефактом. Также в бодрствовании на рис. 2 видно, что данный ритм не всегда синфазен дыханию.
Колебания с частотой 15–40 Гц, наиболее выраженные на частоте около 20 Гц (Martin, Gervais, et al., 2004), именуемые в литературе бета-ритмом и/или бета-осцилляциями, регистрируются в различных структурах обонятельного анализатора, демонстрируя при этом высокий уровень когерентности (Hermer-Vazquez et al., 2007; Kay, Beshel, 2010; Lowry, Kay, 2007; Martin et al., 2007). Генерация бета-колебаний, частота и амплитуда которых (в отличие от гамма) при регистрации от различных областей поверхности обонятельной луковицы различаются (Martin, Gervais et al., 2004), требует наличия центрофугальных входов в обонятельную луковицу (Martin et al., 2006), по крайней мере, не поврежденных двусторонних связей между ней и пириформной корой (Martin, Ravel, 2014). Полагают, что бета-ритм может обеспечивать создание условий, оптимальных для установления и поддержания взаимосвязи между удаленными структурами мозга (Kopell et al., 2000; von Stein, Sarnthein, 2000), механизм хеббовской пластичности (Cassenaer, Laurent, 2007). На это указывает, в частности, тот факт, что выраженность бета-осцилляций увеличивается при обучении животных выполнению задач на различение запахов (Martin et al., 2004; Ravel et al., 2003) и снижается во сне и наркозе (Fuentes et al., 2008; Lowry, Kay, 2007; Manabe, Mori, 2013; Plourde, Arseneau, 2017). Показанное нами снижение мощности бета-частот в ФА ОЛ крыс в условиях КТЗ-наркоза, с одной стороны, вполне укладывается в такие представления, с другой – учитывая центральную природу наркоза, подчеркивает роль центральных структур в генерации бета-активности в ОЛ крыс.
Осцилляции с частотой ~60–90 Гц, регистрируемые в бодрствовании, и до 100 Гц и более – в наркозе, являются наиболее изученной активностью структур обонятельного анализатора и вторым по выраженности ритмом, регистрируемым в ОЛ крыс (Adrian, 1942; Buonviso et al., 2003; Manabe, Mori, 2013; Rojas-Líbano, Kay, 2008). Как правило, эти осцилляции имеют сходные характеристики при регистрации от различных регионов в пределах ОЛ. Поскольку характеристики этого ритма изменяются при предъявлении запахов, предполагается, что он имеет существенное значение для обработки ольфакторной информации (Beshel et al., 2007; David et al., 2009; Friedman, Strowbridge, 2003; Gschwend et al., 2012; Kay et al., 2009; Lagier et al., 2004; Nusser et al., 2001; Saghatelyan et al., 2003; Schaefer et al., 2006). В частотном диапазоне гамма-ритм выделяет два поддиапазона (Kay, 2015). К первому относят колебания с частотой около 90 Гц, ко второму – порядка 70 Гц. Предполагается, что осцилляции первого типа связаны с активностью Т-клеток (Gire et al., 2012), тогда как осцилляции второго типа – М-клеток (Manabe, Mori, 2013).
ЗАКЛЮЧЕНИЕ
Полученные нами результаты указывают на то, что КТЗ-наркоз наиболее существенно влияет именно на активность МТ-нейронов ОЛ. Это влияние носит фазный характер. В начале наркоза резко усиливается активность Т-нейронов и тормозится – М. На более поздних стадиях наркоза, напротив, активность Т-нейронов тормозится, а М – повышается. При этом изменения мощности спектральных характеристик гамма-частот в динамике КТЗ-наркоза совпадают с изменением когерентности этих частот. С одной стороны, наблюдаемое нами перераспределение мощности внутри гамма-частот 90–140 Гц в динамике наркоза может быть связано с его центральной природой и торможением нисходящих (как правило, тормозных) влияний на нейронные сети ОЛ, следствием чего может являться повышение эффективности сенсорных входов и активности Т-клеток, тогда как при выходе из наркоза и восстановлении нисходящих влияний на ОЛ – М-нейронов, активность которых зависит от состояния непрямых входов от обонятельных нейронов и локального торможения. С другой стороны, повышение когерентности высоких частот в КТЗ-наркозе, по-видимому, следует рассматривать как отражение усиления взаимодействий внутри ОЛ, обусловленное снятием внешнего торможения, реализуемого нисходящими влияниями со стороны структур ЦНС.
Список литературы отсутствует.
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


