Теплофизика высоких температур, 2019, T. 57, № 2, стр. 212-220
Термодинамические параметры сплавов литий–олово, важные с точки зрения их использования в токамаках
В. П. Красин 1, *, С. И. Союстова 1
1 ФГБО ВО “Московский политехнический университет”
Москва, Россия
* E-mail: vkrasin@rambler.ru
Поступила в редакцию 09.02.2018
После доработки 10.10.2018
Принята к публикации 12.07.2018
Аннотация
Наряду с другими жидкими металлами литий-оловянные сплавы рассматриваются как альтернатива использованию твердых материалов при разработке обращенных к плазме внутрикамерных компонентов будущего термоядерного реактора. Возможность практического использования этих сплавов в токамаках определяется термодинамическими параметрами, их способностью удерживать изотопы водорода в расплаве, а также свойствами, определяющими те принципы, по которым может быть осуществлено извлечение изотопов водорода из жидкого сплава Li–Sn. С помощью уравнений координационно-кластерной модели рассчитаны константы Сивертса для разбавленных растворов водорода в расплавах данной системы. Результаты теоретических расчетов сравниваются с ранее опубликованными экспериментальными значениями для двух сплавов системы Li–Sn. Для нахождения состава поверхности жидких сплавов применяется метод расчета, основанный на использовании уравнения Батлера совместно с экспериментально полученными концентрационными зависимостями термодинамических потенциалов компонентов бинарной системы.
ВВЕДЕНИЕ
Изучение физико-химических процессов в системах с жидкометаллическими теплоносителями является актуальной задачей, что подтверждается значительным количеством научных публикаций [1–5]. В последние десятилетия ведутся интенсивные исследования, направленные на разработку новой концепции дивертора для термоядерного реактора типа ДЕМО, в котором традиционные твердые материалы предполагается заменить на капиллярно-пористые системы (КПС) с жидкими металлами [6]. Литий, галлий и олово рассматриваются в качестве возможных жидкометаллических компонентов КПС для применения в токамаках [7, 8].
Из перечисленных металлов и сплавов литий является наиболее исследованным, если рассматривать его свойства с точки зрения требований, предъявляемых к жидкометаллическому компоненту КПС. Хотя по своим свойствам литий обладает рядом преимуществ перед другими легкоплавкими металлами, следует упомянуть о существовании двух еще не полностью решенных проблем, связанных с возможностью накопления в литии высоких концентраций трития и повышенным давлением пара над его расплавом. Фактор давления приходится учитывать при использовании жидкого лития как материала, контактирующего с плазмой. В качестве возможных жидкометаллических компонентов КПС рассматриваются также сплавы олова с литием, в которых содержание лития варьируется от 20 до 30 ат. %. Сплавы Li–Sn стали возможной альтернативой литию из-за отсутствия двух упомянутых выше проблем, но существует ряд обстоятельств, которые требуют дополнительных исследований. В частности, использование расплавов, содержащих олово, которое обладает высоким по сравнению с литием значением зарядового числа Z, вызывает озабоченность с точки зрения возможного загрязнения плазмы. Другая особенность этих сплавов связана с тем, что при использовании сплавов литий–олово возникает необходимость соблюдения дополнительных требований к состоянию контактирующих с расплавом металлических поверхностей для обеспечения смачивания [9]. Заслуживает внимания тот факт, что при контакте поверхности жидкого Li–Sn-сплава с плазмой токамака имеет место адсорбция лития на поверхности Li–Sn-сплава [10]. Также необходимы более систематические исследования стойкости конструкционных материалов КПС к коррозионному воздействию со стороны жидких Li–Sn-сплавов. Выбор жидкометаллического компонента для КПС должен быть сделан с учетом возможности восстановления испаренного с поверхности металла, а также взаимодействия между ионизированными компонентами жидкометаллического расплава (после того как они покинут последний) и поверхностью расплава, принимая во внимание вероятность распыления в условиях токамака.
Для жидкометаллического расплава, который предполагается использовать в обращенных к плазме внутрикамерных компонентах токамака, особое значение приобретают физико-химические параметры, характеризующие способность удерживать изотопы водорода и определяющие те принципы, на которых может быть осуществлено извлечение изотопов водорода из жидкого металла. В настоящей работе внимание уделено изучению ряда таких параметров для жидких сплавов системы Li–Sn. Выбор олова как одного из компонентов сплава обусловлен чрезвычайно низкой растворимостью водорода в этом металле и нестабильностью гидридов (SnH4 характеризуется температурой разложения, близкой к 100°C). Результаты экспериментов на установке с горячей дейтериевой плазмой [8, 11] можно рассматривать как некоторое предварительное подтверждение того, что жидкое олово и расплав Li–Sn (30/70 ат. %) характеризуются низкими значениями параметров, отвечающих за способность удерживать изотопы водорода в жидкометаллическом расплаве. Ценность таких исследований с точки зрения изучения свойств системы Li–Sn–H велика, если принять во внимание ограниченность информации о термодинамике этой системы.
КРАТКАЯ ХАРАКТЕРИСТИКА СИСТЕМЫ Li–Sn
Из имеющихся в литературе концентрационных зависимостей интегральной молярной энтальпии смешения для системы Li–Sn следует, что жидкие сплавы системы Li–Pb принадлежат к классу расплавов с сильным химическим взаимодействием компонентов, для которых характерны значительные отрицательные отклонения от идеального поведения [12]. Интегральная молярная энтропия смешения для жидких сплавов отрицательна в той области (xLi > 0.5), где в твердом состоянии, согласно диаграмме состояния, отмечено образование нескольких интерметаллидных соединений [13]. О существовании ближнего порядка в расплавах свидетельствуют результаты измерения электрического сопротивления ρ жидких сплавов Li–Sn и температурного коэффициента сопротивления dρ/dT [14]. При температурах на 10°C выше линии ликвидуса удельное электрическое сопротивление демонстрирует максимум для состава, близкого к стехиометрическому для соединения Li4Sn. Для расплавов, имеющих состав, близкий к стехиометрическому (4 : 1), измерения показали, что dρ/dT отрицателен. Проведенные в [15, 16] нейтронографические и рентгенографические исследования сплавов, содержащих 35 и 50 ат. % лития, показали, что на графиках функции радиального распределения атомов имеются особенности, характерные для солеподобных систем. С ростом температуры степень ближнего порядка в жидком сплаве снижается, а металлический характер проводимости постепенно восстанавливается.
Отмеченные особенности бинарной системы Li–Sn, по мнению авторов настоящей работы, должны отразиться на характере изменения константы Сивертса для растворов водорода в расплавах системы Li–Sn. Такое предположение основывается на близости системы Li–Sn по своим свойствам к системе Li–Pb, для которой аномальный характер зависимости константы Сивертса от состава детально исследован в [17]. Так же как и в системе литий–свинец, в системе Li–Sn с большой долей вероятности можно ожидать, что при переходе от сплавов с высоким содержанием лития к сплавам с низким содержанием Li должен меняться характер реакции поглощения водорода расплавами с экзотермического на эндотермический.
Из литературы известна только одна работа [18], в которой сообщается об измерениях константы Сивертса для растворов водорода в бинарных расплавах системы Li–Sn. Автор этой публикации, исследуя зависимость растворимости водорода в двух расплавах: ${\text{L}}{{{\text{i}}}_{{57}}}{\text{S}}{{{\text{n}}}_{{43}}}$11 и ${\text{L}}{{{\text{i}}}_{{62}}}{\text{S}}{{{\text{n}}}_{{38}}}$ – от парциального давления водорода над расплавом, показал, что для растворов водорода в бинарном растворителе литий–олово выполняется закон Сивертса.
Необходимо условиться, что в процессе дальнейшего рассмотрения под постоянной Сивертса понимается следующая термодинамическая характеристика:
ТЕРМОДИНАМИКА РАСТВОРОВ ВОДОРОДА В РАСПЛАВАХ Li–Sn
В настоящей работе ставится задача на основе очень ограниченных экспериментальных данных, имеющихся для двух составов системы литий–олово, с помощью математического аппарата координационно-кластерной модели расчетным путем получить значения констант Сивертса для всего диапазона составов бинарной системы Li–Sn.
Принимая во внимание низкие значения растворимости водорода в жидком олове [19] и двух сплавах Li–Sn [18], а также основываясь на том, что бинарные системы Li–Sn и Li–Pb принадлежат к одному и тому же классу систем с сильным химическим взаимодействием, сделано предположение о том, что растворы водорода в двойных расплавах Li–Sn должны удовлетворять основным допущениям координационно-кластерной модели (ККМ) [20]. Следует отметить, что хорошее согласие между расчетными оценками по уравнениям ККМ и экспериментальными результатами отмечалось ранее для растворов водорода в жидких сплавах Li–Pb [17, 21], а также для растворов кислорода в расплавах Pb–Bi [22].
Детальное описание как самой ККМ, так и особенностей ее применения для расчета константы Сивертса приведено в [20, 23]. В рассматриваемой модели предполагается, что термодинамические свойства трехкомпонентного (многокомпонентного) жидкометаллического раствора зависят от распределения атомов водорода по кластерам и выражаются через термодинамические параметры соответствующих бинарных систем, которые могут быть составлены из компонентов тройной (многокомпонентной) системы. Для коэффициента термодинамической активности водорода в бинарном расплаве Li–Sn можно записать следующее выражение:
(1)
$\begin{gathered} \mathop {{\text{lim}}}\limits_{{{x}_{{\text{H}}}} \to {\text{0}}} {{\gamma }_{{\text{H}}}} = \left\{ {\sum\limits_{j{\text{ = 0}}}^z {\frac{{z{\text{!}}}}{{j{\text{!(}}z - j{\text{)!}}}}} {{{\left[ {\frac{{{{x}_{{{\text{Sn}}}}}\gamma _{{{\text{Sn(Li}} - {\text{Sn)}}}}^{t}}}{{\gamma _{{{\text{H(Sn)}}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} z}} \right. \kern-0em} z}}}}}} \right]}}^{j}}} \right. \times \\ \times \,\,{{\left. {{{{\left[ {\frac{{{{x}_{{{\text{Li}}}}}\gamma _{{{\text{Li(Li}} - {\text{Sn)}}}}^{t}}}{{\gamma _{{{\text{H(Li)}}}}^{{{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} z}} \right. \kern-0em} z}}}}}} \right]}}^{{z - j}}}{\text{exp}}\left( { - \frac{{j{\text{(}}z - j{\text{)}}{{h}_{B}}}}{{{\text{2}}RT{\text{ }}}}} \right)} \right\}}^{{ - 1}}}. \\ \end{gathered} $Здесь ${{\gamma }_{{\text{H}}}},{{\gamma }_{{{\text{H(Li)}}}}},{{\gamma }_{{{\text{H(Sn)}}}}}$ – коэффициенты термодинамической активности водорода в разбавленных растворах водорода в тройной системе Li–Sn–H и бинарных системах Li–H и Sn–H соответственно; γSn(Li + Sn), γLi(Li + Sn) – коэффициенты активности Sn и Li в сплаве Li–Sn; ${{x}_{{{\text{Sn}}}}},{{x}_{{{\text{Li}}}}}$ – мольные доли компонентов в расплаве Li–Sn–H; z – координационное число для атомов водорода в жидком сплаве; j – число атомов Sn в координационном кластере ${\text{H}}({\text{L}}{{{\text{i}}}_{{z - j}}},{\text{S}}{{{\text{n}}}_{j}})$ (в первой координационной сфере вокруг атома водорода в определенной атомной конфигурации); ${{h}_{B}}$ – энергетический параметр, значение которого выбирается из условия наилучшего совпадения результатов расчета с экспериментальными данными; t – параметр, учитывающий относительное ослабление прочности металлической связи для атомов, находящихся в кластере; R – универсальная газовая постоянная; T – абсолютная температура.
От коэффициентов активности водорода можно перейти к константам Сивертса, если воспользоваться предложенным в [17] уравнением
(2)
${{\gamma }_{{{\text{H}}\left( {\text{М }} \right)}}} = \frac{{{{K}_{{{\text{H}}\left( {\text{М }} \right)}}}}}{{f_{{\text{H}}}^{0}}},$Комбинируя формулы (1) и (2), исключаем фугитивность $f_{{\text{H}}}^{{\text{0}}}$ и выражаем константу Сивертса для раствора водорода в системе Li–Sn через термодинамические данные для бинарных систем
(3)
$\begin{gathered} {{K}_{{\text{H}}}} = \left\{ {\sum\limits_{j = 0}^z {\frac{{z!}}{{j!(z - j)!}}} {{{\left[ {\frac{{{{x}_{{{\text{Sn}}}}}\gamma _{{{\text{Sn(Li}} - {\text{Sn)}}}}^{t}}}{{K_{{{\text{H}}\left( {{\text{Sn}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 z}} \right. \kern-0em} z}}}}}} \right]}}^{j}}} \right. \times \\ \times \,\,{{\left. {{{{\left[ {\frac{{{{x}_{{{\text{Li}}}}}\gamma _{{{\text{Li(Li}} - {\text{Sn)}}}}^{t}}}{{K_{{{\text{H}}\left( {{\text{Li}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 z}} \right. \kern-0em} z}}}}}} \right]}}^{{z - j}}}\exp \left( { - \frac{{j(z - j){{h}_{B}}}}{{2RT{\text{ }}}}} \right)} \right\}}^{{ - 1}}}, \\ \end{gathered} $где KH(Sn) и KH(Li) – константы Сивертса водорода в двойных системах Sn–H и Li–H соответственно.
Исходные данные для расчета приведены в табл. 1 и 2.
Таблица 2.
Параметры зависимости ${\gamma } = {\text{exp}}(A + {B \mathord{\left/ {\vphantom {B T}} \right. \kern-0em} T})$ в жидких сплавах Li–Sn, полученные на основе данных [12]
| Содержание лития в сплаве, ат. % | Элемент | А | B, K | Диапазон температур, °C |
|---|---|---|---|---|
| 20 | Li | 0.693 | –6676 | 320–900 |
| 20 | Sn | –0.057 | 28.3 | 320–900 |
| 30 | Li | 0.98 | –6549 | 400–900 |
| 30 | Sn | 0.014 | –169.6 | 400–900 |
| 50 | Li | 1.588 | –5788 | 490–900 |
| 50 | Sn | –0.811 | 28.2 | 490–900 |
Для ККМ наилучшее соответствие между экспериментальными и расчетными величинами термодинамических характеристик для систем с водородом наблюдается при z = 4 и t = 0.25 [17]. Эти же значения z и t использовались в настоящей работе. Здесь же во всех расчетах по уравнению (3) применялось значение hB = 6900 Дж/моль, как обеспечивающее наименьшее расхождение между результатами настоящих расчетов и данными [18].
На рис. 1 приведены результаты расчетов по уравнению (3) и значения константы Сивертса, взятые из литературы. Также было проведено сравнение экспериментально полученных значений константы Сивертса для системы Li–Sn–H с результатами расчета, выполненного в приближении, когда жидкометаллический расплав Li–Sn (растворитель) рассматривается как идеальный раствор. В этом случае для вычислений использовалось следующее уравнение:
(4)
$\ln {{K}_{{\text{H}}}} = {{x}_{{{\text{Sn}}}}}\ln {{K}_{{{\text{H(Sn)}}}}} + {{x}_{{{\text{Li}}}}}\ln {{K}_{{{\text{H(Li)}}}}}.$Рис. 1.
Температурная зависимость константы Сивертса растворов водорода в металлических расплавах: 1 – Li [17]; 2 – ${\text{L}}{{{\text{i}}}_{{62}}}{\text{S}}{{{\text{n}}}_{{38}}};$ 3 – ${\text{L}}{{{\text{i}}}_{{62}}}{\text{S}}{{{\text{n}}}_{{38}}},$ эксперимент [18]; 4 – ${\text{L}}{{{\text{i}}}_{{57}}}{\text{S}}{{{\text{n}}}_{{43}}},$ [18]; 5 – ${\text{L}}{{{\text{i}}}_{{57}}}{\text{S}}{{{\text{n}}}_{{43}}};$ 6 – ${\text{L}}{{{\text{i}}}_{{30}}}{\text{S}}{{{\text{n}}}_{{70}}};$ 7 – ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}};$ 8 – Sn [19].
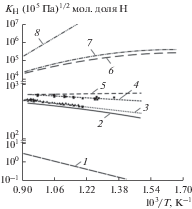
Расчет по уравнению (4) показал, что использование этого уравнения для растворов водорода в расплавах ${\text{L}}{{{\text{i}}}_{{57}}}{\text{S}}{{{\text{n}}}_{{43}}}$ и ${\text{L}}{{{\text{i}}}_{{62}}}{\text{S}}{{{\text{n}}}_{{38}}}$ приводит к результатам, не согласующимся с экспериментальными данными из [18]. В частности, при рассмотрении расплава Li–Sn как идеального раствора из (4) следует, что $d\ln {{{{K}_{{\text{H}}}}} \mathord{\left/ {\vphantom {{{{K}_{{\text{H}}}}} {d{\text{(}}{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} T}} \right. \kern-0em} T}{\text{)}}}}} \right. \kern-0em} {d{\text{(}}{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} T}} \right. \kern-0em} T}{\text{)}}}}$ для этих двух сплавов должна принимать положительные значения, что противоречит данным [18].
Несостоятельность прогнозных оценок по модели с идеальным растворителем можно считать ожидаемой, если принять во внимание сделанные выше замечания о том, что Li–Sn принадлежат к классу расплавов с сильным химическим взаимодействием компонентов.
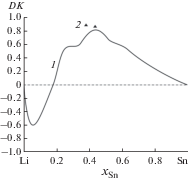
Чтобы количественно оценивать степень отклонения свойств растворов водорода в трехкомпонентном растворе от идеальности, в [17] предложен вспомогательный параметр DK, который определялся следующим образом:
(5)
$DK = \ln {{K}_{{\text{H}}}} - {{x}_{{{\text{Sn}}}}}\ln {{K}_{{{\text{H(Sn)}}}}} - {{x}_{{{\text{Li}}}}}\ln {{K}_{{{\text{H(Li)}}}}}.$В настоящей работе параметр DK также использовался в качестве характеристики растворов водорода в расплавах Li–Sn. Как следует из результатов расчета, проведенного для 800°С (рис. 2), отрицательные отклонения от идеальности, свидетельствующие о сильном взаимодействии между металлическими компонентами, должны наблюдаться в области высоких содержаний лития в бинарном металлическом растворителе $\left( {0.82 \leqslant {{x}_{{{\text{Li}}}}} < 1.0} \right)$. В этой области малые значения ${{K}_{{\text{H}}}}$ (большие значения растворимости водорода) в расплаве Li–Sn обусловлены высоким химическим сродством лития к водороду. При увеличении содержания олова в расплаве Li–Sn этот эффект ослабевает и ${{K}_{{\text{H}}}}$ растет, а растворимость водорода убывает. Для расплавов с $0.18 < {{x}_{{{\text{Sn}}}}} < 1.0$ характерны положительные отклонения от идеальности.
Рис. 2.
Зависимость параметра DK для растворов водорода от состава бинарного расплава Li–Sn при 800°С: 1 – расчет по (5), 2 – эксперимент [18].
Равновесие между газовой фазой, состоящей из молекул двухатомного водорода, и фазой из атомов водорода, растворенного в расплаве Li–Sn, можно записать в виде реакции
(6)
$\left( {{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}} \right){{{\text{H}}}_{2}}\left( {\text{г }} \right) \leftrightarrow {\text{H}}\left( {{\text{р а с п л а в }}} \right).$Константа этой реакции ${{K}_{{\text{P}}}}$ выражается следующим образом:
(7)
${{K}_{{\text{P}}}} = \frac{{{{a}_{{\text{H}}}}}}{{\sqrt {{{P}_{{{{{\text{H}}}_{2}}}}}} }} = \exp \left( { - \frac{{\Delta G^\circ }}{{RT}}} \right),$Нетрудно видеть, что
Изменение знака производной $d\ln {{{{K}_{{\text{H}}}}} \mathord{\left/ {\vphantom {{{{K}_{{\text{H}}}}} d}} \right. \kern-0em} d}{\text{(}}{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} T}} \right. \kern-0em} T}{\text{)}}$ непосредственно связано с тепловым эффектом реакции растворения водорода в расплавах Li–Sn. В той области составов бинарной системы, где эта производная принимает отрицательные значения, реакция растворения водорода является экзотермической и наоборот.
Расчеты для всего диапазона концентраций системы Li–Sn показали, что в зависимости от содержания лития в расплаве значения производной претерпевают изменения от отрицательных до положительных величин. Установлено, что при 800°С вблизи ${{x}_{{{\text{Sn}}}}} = 0.68$ для сплавов должен меняться характер реакции поглощения водорода с экзотермического при ${{x}_{{{\text{Sn}}}}} < 0.68$ на эндотермический при ${{x}_{{{\text{Sn}}}}} > 0.68.$ Приведенные в [12] термодинамические данные указывают на то, что величина активности лития в системе Li–Sn существенно меняется при изменении температуры расплава. По-видимому, с этим связано изменение граничной концентрации, разделяющей области экзотермической и эндотермической реакций. Расчеты, проведенные для 500°С, показали, что значение граничной концентрации, разделяющей две области, сместилось в область более высоких значений (${{x}_{{{\text{Sn}}}}} = 0.88$).
Растворимость водорода S в расплаве Li–Sn может быть выражена через постоянную Сивертса следующим образом:
Показанные на рис. 3 концентрационные зависимости наглядно иллюстрируют связь между снижением термодинамической активности лития в сплаве и ростом ${{K}_{{\text{H}}}}$ для растворов водорода в расплавах Li–Sn различного состава.
Рис. 3.
Изотерма константы Сивертса для растворов водорода в сплавах Li–Sn и термодинамическая активность лития aLi как функция состава сплава при 800°C.

С помощью уравнений ККМ легко показать33, что рост растворимости водорода (и снижение ${{K}_{{\text{H}}}}$) при увеличении содержания лития в расплаве Li–Sn связан с тем, что распределение атомов Li и Sn в первой координационной сфере вокруг атома водорода существенно отличается от случайного, которое имело бы место в случае идеального раствора. Причиной этого роста растворимости является увеличение доли атомных конфигураций, в которых первая координационная сфера вокруг атома водорода содержит атомов Li больше, чем это следовало бы из случайного распределения атомов водорода в металлическом расплаве.
ОЦЕНКА СОСТАВА ПОВЕРХНОСТИ РАСПЛАВОВ Li–Sn НА ОСНОВЕ ТЕРМОДИНАМИЧЕСКИХ ДАННЫХ ДЛЯ БИНАРНОЙ СИСТЕМЫ
Как уже отмечалось ранее, для использования в КПС в качестве наиболее перспективных рассматриваются два жидких сплава: ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ и ${\text{L}}{{{\text{i}}}_{{30}}}{\text{S}}{{{\text{n}}}_{{70}}}.$ Однако, как отмечено в [8], существует несколько факторов, результатом действия которых будет образование на границе раздела жидкий сплав–плазма поверхностного слоя с отличным от первоначального соотношением компонентов (Li и Sn). В частности, изменение состава поверхности расплава может происходить вследствие процесса адсорбции [25]. Как известно, стремление любой термодинамической системы понизить свою энергию приводит к тому, что в бинарном расплаве концентрация атомов компонента с низким поверхностным натяжением в большинстве случаев оказывается выше на поверхности расплава по сравнению с концентрацией того же компонента в объеме. В случае бинарного расплава из двух металлов величина поверхностной концентрации компонента с более низким значением поверхностного натяжения в значительной степени зависит от того, является избыточная энергия Гиббса бинарного расплава величиной положительной или отрицательной [26, 27]. В данном случае это замечание относится к избыточной энергии Гиббса для объемной фазы.
Для расчета параметров поверхностного натяжения и адсорбции успешно применяются термодинамические модели, которые, как правило, позволяют добиваться хорошего согласия с экспериментальными данными. В настоящее время наиболее часто, исходя из мономолекулярной толщины поверхностного слоя, для нахождения состава поверхности и поверхностного натяжения применяется метод расчета [26–28], который по своей сути является комбинацией уравнения Батлера [29] с концентрационными зависимостями термодинамических потенциалов, рассчитываемых с помощью моделей металлических растворов.
В случае бинарного жидкого сплава Li–Sn модель монослоя [26] позволяет записать следующие уравнения:
(8)
$\sigma = {{\sigma }_{{{\text{Li}}}}} + \frac{{RT}}{A}\ln \frac{{x_{{{\text{Li}}}}^{S}}}{{{{x}_{{{\text{Li}}}}}}} + \frac{{RT}}{A}\ln \frac{{\gamma _{{{\text{Li}}}}^{S}}}{{{{\gamma }_{{{\text{Li}}}}}}},$Здесь σ – поверхностное натяжение бинарного расплава; σLi, σSn – поверхностное натяжение чистого жидкого лития и олова соответственно; ${{x}_{{{\text{Li}}}}}$ и $x_{{{\text{Li}}}}^{S}$ – мольные доли лития в объеме и на поверхности расплава; ${{A}_{{{\text{Li}}}}}$ и ${{A}_{{{\text{Sn}}}}}$ – площадь поверхности в монослое одного моля лития и олова соответственно; $A = {{\left( {{{A}_{{{\text{Li}}}}} + {{A}_{{{\text{Sn}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{A}_{{{\text{Li}}}}} + {{A}_{{{\text{Sn}}}}}} \right)} 2}} \right. \kern-0em} 2};$ ${{\gamma }_{{{\text{Li}}}}},{{\gamma }_{{{\text{Sn}}}}},$ $\gamma _{{{\text{Li}}}}^{S}$ и $\gamma _{{{\text{Sn}}}}^{S}$ – коэффициенты термодинамической активности компонентов бинарного расплава Li–Sn в объеме и на поверхности расплава соответственно.
Уравнения, позволяющие связать коэффициент термодинамической активности компонента бинарного расплава Li–Sn в объеме и на поверхности расплава, имеют следующий вид:
Здесь β – полуэмпирический численный коэффициент, учитывающий относительное уменьшение количества связей у атомов, находящихся на поверхности, по сравнению с атомами, находящимися в объеме расплава, а также другие эффекты, обусловленные перестройкой атомных конфигураций при переходе атомов из объема сплава в поверхностный слой [27]. В [30] сообщалось, что наилучшее согласие между расчетами и экспериментами для бинарных жидких сплавов наблюдается для значения β = 0.83. Это же значение β использовалось в настоящей работе при прогнозировании состава поверхности для расплавов системы Li–Sn.
Соотношения (10) позволяют переписать систему уравнений (8), (9) в виде
С использованием данных о парциальных избыточных энергиях Гиббса лития и олова в расплавах Li–Sn [12] в настоящей работе рассчитаны концентрационные зависимости ${{{\gamma }}_{{{\text{Li}}}}}$ и ${{{\gamma }}_{{{\text{Sn}}}}}$ при 500 и 800°C. Последние необходимы для вычисления σ и $x_{{{\text{Li}}}}^{S}$ по уравнениям (11), (12).
Другие исходные данные для расчета σ и $x_{{{\text{Li}}}}^{S}$ приведены в табл. 3.
Для сравнения величины σ и $x_{{{\text{Li}}}}^{S}$ рассчитывались также в приближении, когда бинарный Li–Sn расплав рассматривался в качестве идеального раствора и данные о термодинамических потенциалах компонентов в объеме расплава не требовались при выполнении расчетов. В этом случае с учетом дополнительного допущения о том, что A ≈ ALi ≈ ASn ≈ (ALi + ASn)/2, необходимые уравнения могут быть записаны в следующем виде [28]:
(14)
$\sigma = {{\sigma }_{{{\text{Sn}}}}} + \frac{{RT}}{A}\ln \frac{{1 - x_{{{\text{Li}}}}^{S}}}{{1 - {{x}_{{{\text{Li}}}}}}}.$Результаты расчета по обеим моделям показывают, что поверхность бинарного расплава Li–Sn должна быть обогащена литием как элементом, обладающим более низким по сравнению с оловом поверхностным натяжением (рис. 4). Этот факт находится в полном соответствии с фундаментальной теорией поверхностных явлений Гиббса. Однако значения σ и $x_{{{\text{Li}}}}^{S},$ рассчитанные по уравнениям (11), (12) и по модели идеальных растворов, существенно различаются. Например, для сплава ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ поверхностная концентрация лития при 500°С составляет 22.9 ат. % в случае более строгого расчета по (11), (12), тогда как вычисления по уравнениям (13), (14) приводят к величине 54 ат. % лития. Принадлежность расплавов Li–Sn к классу расплавов с сильным химическим взаимодействием компонентов, по мнению авторов настоящей работы, указывает на то, что величины σ и $x_{{{\text{Li}}}}^{S},$ рассчитанные по (13), (14), учитывающим изменение ${{{\gamma }}_{{{\text{Li}}}}}$ и ${{{\gamma }}_{{{\text{Sn}}}}}$от температуры и состава, должны рассматриваться как более достоверные по сравнению с результатами, полученными в приближении идеальных растворов.
Рис. 4.
Поверхностное натяжение и состав поверхности жидких сплавов Sn–Li различного состава при 500°C (а) и 800°C (б), рассчитанные по уравнениям идеальных растворов (1) и модели псевдорегулярных растворов (2); 3 – вспомогательная линия, иллюстрирующая зависимость $x_{{{\text{Li}}}}^{S} = {{x}_{{{\text{Li}}}}}.$
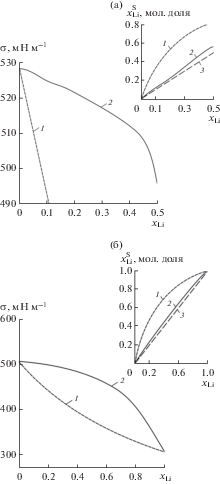
Таким образом, из результатов выполненных расчетов следует, что на границе раздела сплава Li–Sn с вакуумом в поверхностном слое расплава должна наблюдаться адсорбция лития. Движущей силой этой адсорбции является уменьшение поверхностной энергии. Однако величина этого эффекта оказывается существенно меньшей по сравнению с тем, что могло бы иметь место, если бы система Li–Sn не относилась к системам с отрицательными отклонениями от идеального поведения. В частности, для расплава ${\text{S}}{{{\text{n}}}_{{80}}}{\text{L}}{{{\text{i}}}_{{20}}}$ при 500°С эффект увеличения концентрации Li мог быть в 2.4 раза бо́льшим, в случае если по своим свойствам этот расплав был бы близок к идеальному раствору (рис. 4а).
Поверхностные эффекты, связанные с адсорбционными процессами вблизи межфазных границ, существование которых может быть спрогнозировано с помощью рассмотренных выше уравнений, зафиксированы в ряде экспериментальных исследований. В частности, полученные в [25] данные о составе поверхности образца расплава ${\text{S}}{{{\text{n}}}_{{80}}}{\text{L}}{{{\text{i}}}_{{20}}}$после нахождения в вакуумной камере показывают, что концентрация лития на поверхности расплава существенно превышает значение этого параметра в объеме расплава. Похожие изменения состава поверхности отмечены и в [10].
ЗАКЛЮЧЕНИЕ
Показано, что термодинамические расчеты c использованием уравнений координационно-кластерной модели для растворов водорода в расплавах Li–Sn приводят к теоретическим значениям константы Сивертса, которые находятся в удовлетворительном согласии с экспериментальными данными для расплавов ${\text{L}}{{{\text{i}}}_{{57}}}{\text{S}}{{{\text{n}}}_{{43}}}$ и ${\text{L}}{{{\text{i}}}_{{62}}}{\text{S}}{{{\text{n}}}_{{38}}}.$
Реакция растворения водорода в расплавах Li–Sn в зависимости от состава может по своему характеру быть как экзотермической, так и эндотермической. Основываясь на прогнозных оценках, полученных с помощью уравнений ККМ, можно заключить, что при 800°C в расплавах Li–Sn с $0.32 < {{x}_{{{\text{Li}}}}} < 1.0$ водород должен растворяться экзотермически, а для расплавов с составом в диапазоне $0 < {{x}_{{{\text{Li}}}}} < 0.32$ реакция растворения становится эндотермической.
Расчет по уравнениям ККМ показывает, что поведение расплавов ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ и ${\text{L}}{{{\text{i}}}_{{30}}}{\text{S}}{{{\text{n}}}_{{70}}}$ по способности поглощать водород более близко́ к поведению чистого Sn. Помимо низких уровней растворимости водорода, два этих сплава объединяет с чистым оловом эндотермический характер реакции растворения водорода.
В результате расчетов, проведенных с использованием уравнений Батлера и концентрационных зависимостей термодинамических потенциалов для Li–Pb, показано, что на поверхности бинарного расплава будет происходить адсорбция лития. Однако вследствие того, что жидкие сплавы системы Li–Pb относятся к классу расплавов с сильным химическим взаимодействием компонентов, величина этого эффекта оказывается существенно меньшей по сравнению с той, которая должна была наблюдаться, если бы к этой системе был примени́м закон Рауля. В частности, в сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ при 500°C величина поверхностной концентрации лития, рассчитанная по модели псевдорегулярных растворов, отличается от значения, полученного с использованием более грубого приближения идеальных растворов, примерно на 30%. Этот результат следует учитывать при анализе экспериментальных данных, поскольку за изменение состава поверхности жидкого сплава, кроме описанного выше процесса, могут отвечать и другие процессы (например, избирательное испарение компонентов сплава).
Обоснованный выбор легкоплавкого металла (или сплава) для применения в стационарных токамаках-реакторах требует проведения значительного объема экспериментальных исследований. Применительно к бинарным расплавам Li–Sn среди других важных проблем должен быть рассмотрен вопрос об изменении состава и свойств жидкого сплава в результате контакта с конструкционными материалами в процессе эксплуатации жидкометаллической системы токамака.
Статья подготовлена в рамках выполнения базовой части государственного задания ФГБОУ ВО “Московский политехнический университет” (проект № 3.4880.2017/8.9).
Список литературы
Асхадуллин Р.Ш., Мартынов П.Н., Рачков В.И. и др. Контроль и регулирование содержания кислорода в тяжелых жидкометаллических теплоносителях для противокоррозионной защиты сталей // ТВТ. 2016. Т. 54. № 4. С. 595.
Алчагиров Б.Б., Дышекова Ф.Ф. Поверхностное натяжение расплавов свинец-висмутовой эвтектики с литием // ТВТ. 2016. Т. 54. № 6. С. 866.
Круглов А.Б., Круглов В.Б., Рачков В.И. и др. Методика измерения теплопроводности жидкого свинца в диапазоне температур 350–1000°C // ТВТ. 2015. Т. 53. № 4. С. 596.
Камболов Д.А., Кашежев А.З., Кутуев Р.А. и др. Политермы плотности, поверхностного натяжения висмутистого свинца и угла смачивания высоконикелевых и ферритно-мартенситных сталей сплавом Pb–Bi // ТВТ. 2014. Т. 52. № 3. С. 392.
Красин В.П., Союстова С.И. Оценка параметров коррозионных процессов в эвтектическом расплаве Na–K с использованием моделей металлических растворов // ТВТ. 2018. Т. 56. № 4. С. 532.
Apicella M.L., Lazarev V., Lyublinski I., Mazzitelli G., Mirnov S., Vertkov A. Lithium Capillary Porous System Behavior as PFM in FTU Tokamak Experiments // J. Nucl. Mater. 2009. V. 386–388. P. 821.
Gomes R.B., Silva C., Fernandes H., Montemor M.F., Silva C., Fernandes H., Duarte P. ISTTOK Tokamak Plasmas Influence on a Liquid Gallium Jet Dynamic Behavior // J. Nucl. Mater. 2011. V. 415. P. 989.
Tabares F.L., Oyarzabal E., Martin-Rojo A.B., Tafalla D., de Castro A., Medina F., Ochando M.A., Zurro B., McCarthy K. Reactor Plasma Facing Component Designs Based on Liquid Metal Concepts Supported in Porous Systems // Nucl. Mater. Energy. 2017. V. 12. P. 1368.
Lyublinski I.E., Vertkov A.V., Zharkov M.Yu., Sevryukov O.N., Dzhumaev P.S., Shumskiy V.A., Ivannikov A.A. Selection of Materials for Tokamak Plasma Facing Elements Based on a Liquid Tin Capillary Pore System // J. Phys.: Conf. Ser. 2016. 012014.
Loureiro J.P.S., Tabares F.L., Fernandes H., Silva C., Gomes R., Alves E., Mateus R., Pereira T., Alves H., Figueiredo H. Behavior of Liquid Li–Sn Alloy as Plasma Facing Material on ISTTOKJ // Fusion Eng. Des. 2017. V. 117. P. 208.
Loureiro J.P.S., Fernandes H., Tabares F.L., Mazzitelli G., Silva C., Gomes R., Alves E., Mateus R., Pereira T., Figueiredo H., Alves H. Deuterium Retention in Tin (Sn) and Lithium–Tin (Li–Sn) Samples Exposed to ISTTOK Plasmas // Nucl. Mater. Energy. 2017. V. 12. P. 709.
Морачевский А.Г. Термодинамические свойства и электрохимические исследования сплавов системы литий–олово (Обзор) // Журн. прикл. химии. 2015. Т. 88. № 7. С. 993.
Moser Z., Gasior W., Sommer F., Schwitzgebel G., Predel B. Calorimetric and emf Studies on Liquid Li–Sn Alloys // Metall. Trans. B. 1986. V. 17B. P. 791.
Hubberstey P., Roberts P.G., Dadd A.T. Solutions of Group IV Elements in Liquid Lithium: Electrical Resistivities // J. Less-Common Met. 1984. V. 98. P. 141.
Alblas B.P., van der Lugtt W., Dijkstra J., Geertsma W., van Dijk C. Structure of Liquid Li–Sn Alloys // J. Phys. F.: Met. Phys. 1983. V. 13. P. 2465.
Alblas B.P., van der Marel C., Geertsma W., Meijer J.A., van Oosten A.B., Dijkstra J., Stein P.C., van der Lugt W. Experimental Results for Liquid Alkali-group IV Alloys // J. Non-Cryst. Solids. 1984. V. 61–62. P. 201.
Chan Y.C., Veleckis E. A Thermodynamic Investigation of Dilute Solutions of Hydrogen in Liquid Li–Pb Alloys // J. Nucl. Mater. 1984. V. 122–123. P. 935.
Schumacher R., Weiss A. Hydrogen Solubility in the Liquid Alloys Lithium–Indium, Lithium–Lead, and Lithium–Tin // Ber. Bunsenges. Phys. Chem. 1990. V. 94. P. 684.
Fromm E., Gebhardt E. Gase und Kohlenstoff in Metallen. Berlin: Springer, 1976. 747 p.
Saboungi M.-L., Caveny D., Bloom I., Blander M. The Coordination Cluster Theory: Extension to Multicomponent Systems // Metall. Trans. A. 1987. V. 18A. P. 1779.
Pierini G., Polcaro A.M., Ricci P.F., Viola A. Solubility of Hydrogen in the Molten Li17Pb83 Alloy // J. Chem. Eng. Data. 1984. V. 29. P. 250.
Kishimoto A., Wada A., Michimoto T., Furukawa T. Solubility and Activity of Oxygen in Pb–Bi Melts // Mater. Trans. 2006. V. 47. P. 122.
Krasin V.P., Soyustova S.I., Lyublinskii I.E. Coordination Cluster Model for Calculating Sieverts’ Constant of Hydrogen Solutions in Melts of the Pb–Bi–Li System // Inorg. Mater.: Appl. Res. 2010. V. 1. P. 324.
Krasin V.P., Soyustova S.I. Thermodynamic Analysis of Chromium Solubility Data in Liquid Lithium Containing Nitrogen: Comparison between Experimental Data and Computer Simulation // J. Nucl. Mater. 2015. V. 465. P. 674.
Bastasz R., Whaley J.A. Surface Composition of Liquid Metals and Alloys // Fusion Eng. Des. 2004. V. 72. P. 111.
Yeum K.S., Speiser R., Poirier D.R. Estimation of the Surface Tensions of Binary Liquid Alloys // Metall. Trans. B. 1989. V. 20B. P. 693.
Tanaka T., Hack K., Hara S. Use of Thermodynamic Data to Determine Surface Tension and Viscosity of Metallic Alloys // MRS Bulletin/April. 1999. P. 45.
Overbury S.H., Bertrand P.A., Somorjai G.A. The Surface Composition of Binary Systems. Prediction of Surface Phase Diagrams of Solid Solutions // Chem. Rev. 1975. V. 75. P. 547.
Butler J.A.V. The Thermodynamics of the Surfaces of Solutions // Proc. Roy. Soc. (London). 1935. V. A135. P. 348.
Tanaka T., Hack K., Iida T., Hara S. Application of Thermodynamic Databases to the Evaluation of Surface Tensions of Molten Alloys, Salt Mixtures, and Oxide Mixtures // Z. Metallkd. 1996. Bd. 87. S. 380.
Du Z., Jiang Z., Guo C. Thermodynamic Optimizing of the Li–Sn System // Z. Metallkd. 2006. Bd. 97. S. 10.
Lu H.M., Jiang Q. Surface Tension and Its Temperature Coefficient for Liquid Metals // J. Phys. Chem. B. 2005. V. 109. P. 15463.
Tanaka T., Nakamoto M., Oguni R., Lee J., Hara S. Measurement of the Surface Tension of Liquid Ga, Bi, Sn, In, and Pb by the Constrained Drop Method // Z. Metallkd. 2004. Bd. 95. S. 818.
Keene B.J. Review of Data for the Surface Tension of Pure Metals // Int. Mater. Rev. 1993. V. 38. P. 157.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


