Теплофизика высоких температур, 2019, T. 57, № 4, стр. 560-571
Моделирование детонации металлогазовых горючих смесей в высокоскоростном потоке за ударной волной
В. Ю. Гидаспов 1, Н. С. Северина 1, *
1 Московский авиационный институт
Москва, Россия
* E-mail: severina@mail.ru
Поступила в редакцию 28.01.2019
После доработки 28.02.2019
Принята к публикации 27.03.2019
Аннотация
Приводится физико-математическая модель, позволяющая описывать процессы самовоспламенения, горения и детонации горючих металлогазовых смесей. Разработана упрощенная физико-математическая модель процесса. Дисперсные частицы считаются многокомпонентными, учитываются процессы плавления, испарения материала частиц, а также поверхностные реакции, в которых могут участвовать как жидкие, так и газообразные компоненты. Несущий газ считается многокомпонентным с возможностью протекания произвольного числа химических реакций. Рассматривается случай, когда продукты сгорания находятся в состоянии термодинамического равновесия, при этом в них учитывается наличие мелкодисперсных частиц металлов, оксидов и нитридов металлов. Расчетным путем определены структура и минимальная скорость распространения стационарной детонационной волны. Показано, что вычисленные в волнах параметры асимптотически стремятся к своим равновесным значениям. Разработанные физико-математическая модель и вычислительные алгоритмы могут быть использованы при создании методик моделирования горения и детонации металлогазовых смесей в многомерной постановке.
ВВЕДЕНИЕ
В настоящее время большой теоретический и практический интерес вызывают задачи образования и распространения волн горения и детонации в многофазных средах, состоящих из частиц горючего и газообразного окислителя. Особый интерес среди них представляют проблемы, связанные с горением и детонацией воздушных смесей с углеводородами и частицами металлов, в частности алюминия, магния и бора. Горение металлизированных топлив и углеводородов имеет как много общих закономерностей, так и ряд принципиальных отличий. Горение капель углеводородного топлива происходит в газовой фазе: горят продукты испарения, при этом температура самих капель существенно ниже температуры продуктов сгорания. Горение газовзвесей металлических частиц сопровождается протеканием поверхностных и газофазных химических реакций, а также образованием конденсированных продуктов на поверхности частицы и в продуктах сгорания, в то время как температура частиц может превышать температуру окружающих газов. Оригинальные результаты и обзоры экспериментальных и расчетно-теоретических исследований горения металлогазовых и углеводородных топлив содержатся в большом количестве статей и монографий [1–32 ].
Из обзора литературы, в частности, следует, что экспериментально изучалась в основном детонация смесей мелкодисперсного алюминия в воздухе, детонация магниево-воздушных смесей исследовалась в небольшом числе работ, анализ детонации боро-воздушных смесей практически отсутствует. В случае смесей магния и бора имеется значительное число экспериментальных и расчетно-теоретических исследований горения частиц в воздухе и кислороде. Необходимо отметить, что детонационная (равновесная ударная) адиабата для горючих смесей является объективной характеристикой процесса горения. Детонационная адиабата содержит точки Чепмена–Жуге детонации и дефлаграции, а также точки, соответствующие адиабатическому сгоранию топлива при заданных удельном объеме и давлении, что позволяет рассчитывать величину тепловыделения в соответствующих идеальных реакторах.
В предлагаемой работе исследуется процесс самовоспламенения, горения и детонации взвесей алюминия, магния и бора в воздухе [2, 5, 8, 22–24]. Считается, что материал частиц испаряется и одновременно участвует в реакциях изменения состава капли (образовании оксидов алюминия, магния, бора). В газовой фазе происходят химические превращения, приводящие к образованию различных соединений, состоящих из элементов, входящих в состав горючего и воздуха, количество и фазовый состав которых существенно зависит от соотношения горючего и окислителя. Процесс сгорания заканчивается установлением скоростного, температурного, фазового и химического равновесий.
Разработанные математические модели, вычислительные алгоритмы и компьютерные программы апробированы на задачах расчета высокоскоростного горения в газокапельных углеводородных и металлогазовых топливных смесях [13, 18, 23, 25, 27–32, 37].
ФИЗИКО-МАТЕМАТИЧЕСКАЯ МОДЕЛЬ
Исследуется процесс самовоспламенения, горения и детонации мелкодисперсной взвеси алюминия, магния и бора в воздухе в канале постоянного сечения. Рассматривается течение за ударной волной, распространяющейся с постоянной скоростью [13, 18, 23, 25]. При построении физико-математической модели процесса считается, что течение одномерное, объемная доля частиц в газе мала, эффекты вязкости теплопроводности и диффузии существенны только при взаимодействии частиц с газом, химические реакции протекают в газовой фазе и на поверхности частиц. Дробление и коагуляция частиц не рассматриваются. Стационарные двухфазные течения, возникающие в канале постоянного сечения за стационарной ударной волной (УВ), распространяющейся по горючей смеси со скоростью D, при сделанных выше предположениях описываются аналогичной, используемой в [13, 18, 23, 25] системой дифференциально-алгебраических уравнений
(1)
$\begin{gathered} \rho \text{v} + {{n}_{s}}{{m}_{s}}{{\text{v}}_{s}} = {{\rho }_{0}}{{\text{v}}_{0}} + {{n}_{{s0}}}{{m}_{{s0}}}{{\text{v}}_{{s0}}}, \\ \rho {{\text{v}}^{2}} + p + {{n}_{s}}{{m}_{s}}\text{v}_{s}^{2} = {{\rho }_{0}}\text{v}_{0}^{2} + {{p}_{0}} + {{n}_{{s0}}}{{m}_{{s0}}}\text{v}_{{s0}}^{2}, \\ \rho \text{v}\left( {e + \frac{p}{\rho } + \frac{{{{\text{v}}^{2}}}}{2}} \right) + {{n}_{s}}{{m}_{s}}{{\text{v}}_{s}}\left( {{{e}_{s}} + \frac{{\text{v}_{s}^{2}}}{2}} \right) = \\ = {{\rho }_{0}}{{\text{v}}_{0}}\left( {{{e}_{0}} + \frac{{{{p}_{0}}}}{{{{\rho }_{0}}}} + \frac{{\text{v}_{0}^{2}}}{2}} \right) + {{n}_{{s0}}}{{m}_{{s0}}}{{\text{v}}_{{s0}}}\left( {{{e}_{{s0}}} + \frac{{\text{v}_{{s0}}^{2}}}{2}} \right), \\ {{n}_{s}}{{\text{v}}_{s}} = {{n}_{{s0}}}{{\text{v}}_{{s0}}}. \\ \end{gathered} $(2)
$\begin{gathered} \frac{{d\rho \text{v}{{\gamma }_{i}} + {{n}_{s}}{{m}_{s}}{{\text{v}}_{s}}{{\gamma }_{{is}}}}}{{d\xi }} = {{W}_{i}},\quad i = 1,...,N, \\ {{\text{v}}_{s}}\frac{{d{{m}_{{si}}}}}{{d\xi }} = {{{\dot {m}}}_{{si}}} = {{{{W}_{i}}{{\mu }_{i}}} \mathord{\left/ {\vphantom {{{{W}_{i}}{{\mu }_{i}}} {{{n}_{s}}}}} \right. \kern-0em} {{{n}_{s}}}},\,\,\,\,i = {{N}_{s}} + 1,...,N + {{N}_{s}}, \\ {{\text{v}}_{s}}\frac{{d{{u}_{s}}}}{{d\xi }} = {{{\dot {u}}}_{s}},\,\,\,\,{{\text{v}}_{s}}\frac{{d{{m}_{s}}{{H}_{s}}}}{{d\xi }} = {{{\dot {H}}}_{s}}. \\ \end{gathered} $При рассмотрении течения за УВ $\xi = Dt - x$ (расстояние от ударной волны до рассматриваемой точки x, t – время), $\text{v} = D - u,$ ${{\text{v}}_{s}} = D - {{u}_{s}}$ – скорость газа и частиц относительно УВ, индексом 0 обозначены параметры перед УВ.
Из системы (1), (2) может быть получено дифференциальное уравнение для скорости потока:
Для замыкания системы (1), (2) используются модели термодинамики, химической кинетики, сопротивления и тепломассообмена, аналогичные приведенным в [13, 18, 23, 25, 28, 36]. В рассматриваемом случае газовая смесь представляет собой смесь совершенных газов, термодинамические свойства которой описываются заданием потенциала Гиббса [37] вида
Потенциал Гиббса веществ, входящих в состав частиц, считается зависящим от температуры и в ряде случаев от давления:
Произвольный механизм химических реакций и фазовых переходов при участии в том числе и жидких компонентов может быть записан в следующем виде [5, 33, 35]:
(3)
$\begin{gathered} \frac{{{{P}_{0}}V}}{{RT}}\sum\limits_{i = 1}^N {A_{K}^{i}\exp \left( {\sum\limits_{l = 1}^{{{N}_{e}}} {{{A_{l}^{i}{{Z}_{l}} - G_{i}^{0}(T)} \mathord{\left/ {\vphantom {{A_{l}^{i}{{Z}_{l}} - G_{i}^{0}(T)} {RT}}} \right. \kern-0em} {RT}}} } \right)} = \gamma _{K}^{0}, \\ k = 1,...,{{N}_{e}}, \\ \end{gathered} $(4)
${{\gamma }_{i}} = \frac{{{{P}_{0}}V}}{{RT}}\exp \left( {\sum\limits_{K = 1}^{{{N}_{e}}} {{{A_{K}^{i}{{Z}_{K}} - G_{i}^{0}(T)} \mathord{\left/ {\vphantom {{A_{K}^{i}{{Z}_{K}} - G_{i}^{0}(T)} {RT}}} \right. \kern-0em} {RT}}} } \right),\,\,\,\,V = \frac{1}{\rho }.$Если записать условие химического равновесия для кластера, то при больших $K$ оно автоматически переходит в условие равновесия между газовой и жидкой фазами. В реальных расчетах уже при $K = 500$ ошибка при определении массовой доли жидкой фазы не превышает 1%.
Модели сопротивления и тепломассообмена испаряющейся частицы характеризуют зависимости ${{\dot {u}}_{S}},{{\dot {m}}_{S}},{{\dot {H}}_{S}}$ от текущих значений параметров капель и обтекающего их газа. Применены полуэмпирические критериальные зависимости для квазистационарных, континуальных режимов тепломассообмена и сопротивления одиночных испаряющихся капель, обтекаемых многокомпонентным газом [5, 36, 38].
Неравновесными считаются процессы тепломассообмена между газом и частицами
Выражение для потока i-го компонента в реакции испарения (конденсации) в соответствии с диффузионной моделью [5, 18, 36] может быть записано в виде
(5)
$\begin{gathered} \dot {m}_{i}^{r} = - 2\pi d\frac{{{{m}_{{Si}}}{{\rho }_{S}}}}{{{{\rho }_{{Si}}}{{m}_{S}}}}{{{\bar {D}}}_{i}}\bar {\rho }\delta _{{mi}}^{0}\ln \left( {\frac{{1 - {{{{\alpha }_{i}}{{\rho }_{i}}} \mathord{\left/ {\vphantom {{{{\alpha }_{i}}{{\rho }_{i}}} \rho }} \right. \kern-0em} \rho }}}{{1 - {{\alpha }_{i}}{{\rho _{i}^{H}} \mathord{\left/ {\vphantom {{\rho _{i}^{H}} \rho }} \right. \kern-0em} \rho }}}} \right) = \\ = - 2\pi d\frac{{{{m}_{{Si}}}{{\rho }_{S}}}}{{{{\rho }_{{Si}}}{{m}_{S}}}}{{{\bar {D}}}_{i}}\bar {\rho }\delta _{{mi}}^{0}\ln \left( {\frac{{1 - {{\alpha }_{i}}{{{\bar {\gamma }}}_{i}}{{\mu }_{i}}}}{{1 - {{\alpha }_{i}}\gamma _{i}^{S}{{\mu }_{i}}}}} \right). \\ \end{gathered} $Для описания межфазного массообмена и поверхностных реакций рассматриваются три реакции:
(7)
${{{\text{M}}}_{X}}{\text{O}}_{Y}^{{\text{c}}} \Leftrightarrow {{{\text{M}}}_{X}}{{{\text{O}}}_{Y}}$(8)
$X{{{\text{M}}}^{{\text{C}}}} + \frac{Y}{2}{{{\text{O}}}_{2}} \Leftrightarrow {{{\text{M}}}_{X}}{\text{O}}_{Y}^{{\text{c}}},$(9)
$\begin{gathered} \dot {m}_{{{{{\text{O}}}_{2}}}}^{{R3}} = \pi d_{S}^{2}\frac{{{{m}_{J}}{{\rho }_{S}}}}{{{{\rho }_{J}}{{m}_{S}}}}\delta _{{m{{{\text{O}}}_{2}}}}^{0}KT_{S}^{m}{{\left( {\frac{{{{d}_{S}}}}{{d_{S}^{0}}}} \right)}^{n}}\rho \times \\ \times \,\,\exp ({{ - E} \mathord{\left/ {\vphantom {{ - E} {{{T}_{S}}}}} \right. \kern-0em} {{{T}_{S}}}})\left( {{{\gamma }_{{{{{\text{O}}}_{2}}}}} - \gamma _{{{{{\text{O}}}_{2}}}}^{S}} \right), \\ J = \left\{ \begin{gathered} {\text{M}},\,\,\,\,{{\gamma }_{{{{{\text{O}}}_{2}}}}} > \gamma _{{{{{\text{O}}}_{2}}}}^{S}, \hfill \\ {{{\text{M}}}_{X}}{{{\text{O}}}_{Y}},\,\,\,\,{{\gamma }_{{{{{\text{O}}}_{2}}}}} < \gamma _{{{{{\text{O}}}_{2}}}}^{S}. \hfill \\ \end{gathered} \right. \\ \end{gathered} $Здесь K, n, m, E – константы, подбираемые из условия согласия скорости массообмена с экспериментальными данными.
Выражение для потока тепла Q от газа к частице может быть записано [5, 18, 36] как
При наличии химических реакций уравнение для нахождения температуры частицы имеет вид [13, 18, 23]
(10)
$\begin{gathered} \frac{{d{{m}_{s}}{{H}_{S}}}}{{dt}} = Q + \sum\limits_{r = {{N}_{r}}}^{{{N}_{r}} + {{N}_{{rS}}}} {\sum\limits_{i = 1}^N {\left( {\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{\nu } _{i}^{{(r)}} - \vec {\nu }_{i}^{{(r)}}} \right)} } \times \\ \times \,\,({{{\vec {W}}}^{{(r)}}} - {{{\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\leftarrow}$}}{W} }}^{{(r)}}})\frac{{{{\mu }_{i}}}}{{{{n}_{S}}}}{{H}_{i}}({{T}_{s}}). \\ \end{gathered} $В процессе теплообмена материалы, входящие в состав частицы, могут переходить из твердого агрегатного состояния в жидкое и обратно. В работе считается, что процессы плавления и кристаллизации протекают равновесно. В этом случае суммарная энтальпия частиц может быть записана как
(11)
${{H}_{s}}(T) = \sum\limits_{i = 1}^{{{N}_{S}}} {\left( {\gamma _{i}^{s}H_{i}^{s}(T) + \gamma _{i}^{l}H_{i}^{l}(T)} \right){\kern 1pt} } .$Здесь верхние индексы s и l относятся к твердой и жидкой фазам, содержание i-го компонента в частице равно сумме соответствующих концентраций
Значение энтальпии ${{H}_{s}}$ может быть найдено из (10), а температура частицы ${{T}_{s}}$ и концентрации $\gamma _{i}^{s},$ $\gamma _{i}^{l}$ из (11). При фиксированных концентрациях ${{\gamma }_{i}}$ энтальпия частицы (11) является монотонно-возрастающей функцией температуры и для вычисления температуры и концентраций $\gamma _{i}^{s},$ $\gamma _{i}^{l}$ может использоваться приведенный ниже алгоритм. Вещества, входящие в состав частицы, нумеруются в порядке возрастания температуры плавления $T_{m}^{i}.$ В нижеприведенных формулах, если индекс начала суммирования больше индекса конца суммирования, суммирование не производится.
Для интегрирования системы обыкновенных дифференциальных уравнений (2) используется модифицированный метод У.Г. Пирумова [25, 29–32, 35], на каждой итерации которого с высокой точностью решается система нелинейных алгебраических уравнений (1), (3). Метод интегрирования обеспечивает точное выполнение законов сохранения элементного состава.
Рассматриваемая система дифференциально-алгебраических уравнений в случае, когда частицы полностью испаряются, имеет предельное равновесное решение: точку, лежащую на равновесной адиабате, удовлетворяющей системе нелинейных алгебраических уравнений:
Из данной системы уравнений могут быть получены предельные значения ${{\text{v}}_{0}},$ при которых данная система имеет решение и которые являются для двухфазной смеси аналогами скорости детонации Чепмена–Жуге [13, 18, 23, 25, 32].
РЕЗУЛЬТАТЫ ЧИСЛЕННОГО МОДЕЛИРОВАНИЯ
Моделирование детонации частиц алюминия в воздухе. Исследуется процесс самовоспламенения и детонации взвеси алюминия в воздухе [1–13] за ударной волной, распространяющейся с постоянной скоростью. За УВ происходит прогрев частиц до температуры воспламенения за счет теплообмена с газовой фазой, а также гетерогенной экзотермической химической реакции образования окисной пленки Al2O3. После воспламенения алюминий одновременно участвует в реакциях изменения состава капли (образования оксида алюминия) и испарения, при этом температура частиц может существенно превышать температуру окружающей среды. В газовой фазе происходят химические превращения, приводящие к образованию соединений алюминия с кислородом и азотом, количество и фазовый состав которых существенно зависит от соотношения алюминия и кислорода в горючей смеси. Процесс сгорания заканчивается установлением скоростного, температурного, фазового и химического равновесий. В процессе окисления капля становится многокомпонентной и состоит из алюминия и оксида алюминия (Al2O3). В интересных для практики случаях в процессе нагрева частиц могут достигаться температуры плавления и кипения алюминия ($T_{m}^{{{\text{Al}}}}$ = 933.61, $T_{b}^{{{\text{Al}}}}$ = 2792 К) и оксида алюминия ($T_{m}^{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}$ = 2327, $T_{b}^{{{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}}}$ = 3253 К).
Для описания межфазного тепломассообмена и изменения состава частиц используется сокращенный по сравнению с [4] кинетический механизм поверхностных реакций, включающий реакции испарения (конденсации) и окисления алюминия (6)–(8) с X = 2, Y = 3. Стехиометрическое соотношение: ${{({{{{m}_{{{\text{Al}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Al}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}})}_{{CT}}}$ = 0.262. Скорости реакций (6)–(8) в первом приближении можно найти из соотношений (5).
Рассматривалась горючая смесь, состоящая из воздуха (0.21O2 + 0.79N2) и твердых частиц алюминия, продукты сгорания включали 14 компонент [6]: AlO2, Al2O3, Al2O, Al2O2, N2, O2, NO, AlN, Al2O3(ж), Al(ж), AlN(ж), O, N, Al, термодинамические свойства которых заимствовались из [37]. На рис. 1 приведены результаты численного моделирования параметров детонационной волны (ДВ) Чепмена–Жуге для смеси, состоящей из частиц алюминия и воздуха при нормальных условиях (p0 = 101325 Па, T0 = 298.15 К). Полученные результаты хорошо согласуются с данными экспериментальных и расчетно-теоретических исследований, которые приводятся в [7]. Графики параметров (рис. 1а) имеют максимум при отношении начальных массовых расходов алюминия и воздуха ${{{{m}_{{{\text{Al}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Al}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}},$ близком к стехиометрическому. В рассмотренном диапазоне значений ${{{{m}_{{{\text{Al}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Al}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ в равновесном составе в газовой фазе (рис. 1б) могут присутствовать мелкодисперсные алюминий, нитрат алюминия и окись алюминия. Точка минимума на графике температуры (рис. 1а, кривая 3) при ${{{{m}_{{{\text{Al}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Al}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ ~ 0.65 связана с появлением в продуктах сгорания жидкого нитрата алюминия.
Рис. 1.
Зависимость параметров ДВ Чепмена–Жуге от отношения расходов частиц алюминия и воздуха; (а): 1 – скорость ДВ Чепмена–Жуге, 2 – давление/1000, 3 – температура (простые маркеры – двухфазный расчет, закрашенные – эксперимент [33]); (б), (в): массовые концентрации компонент, (б) – равновесный расчет, (в) – двухфазный.
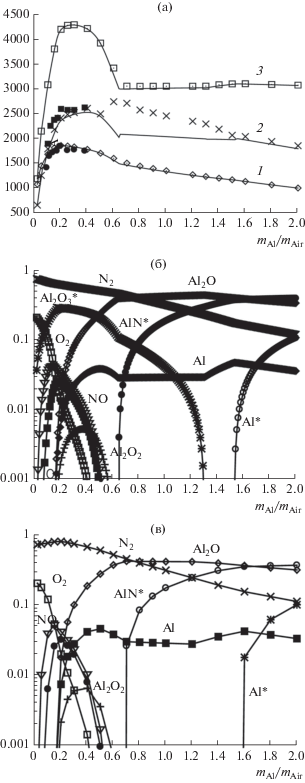
Исследовалось влияние на параметры детонации Чепмена–Жуге скоростной и температурной неравновесности газовой и дисперсной фаз. Рассчитанные минимальная скорость детонации (рис. 1а, маркеры 1) и температура (рис. 1а, маркеры 3) отличаются от равновесных (рис. 1, сплошные кривые 1, 3) менее чем на 0.5%. Давление (рис. 1а, маркеры 2) в области ${{{{m}_{{{\text{Al}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Al}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ > 0.5 отличается более существенно, что связано с неполным испарением частиц.
На рис. 2 приведены рассчитанные зависимости параметров продуктов сгорания в пересжатой детонационной волне при соотношении алюминий/воздух, близком к стехиометрическому, от лабораторного времени (время, отсчитываемое от момента прохождения ударной волны через точку пространства, где расположен наблюдатель). Расчет проводился до достижения состояния термодинамического равновесия. Скоростное и температурное равновесия (кривые 1–4), наступало примерно через 10 мкс. Расход частиц в процессе расчета увеличивался, а газа уменьшался (кривые 5, 6). Алюминий, содержащийся (рис. 2, кривая 7) в частице, через 30 мкс полностью израсходовался, при этом количество окисла (кривая 8) в частице росло за счет конденсации из газовой фазы вплоть до выхода на равновесие. В равновесном составе в газовой фазе при mAl/mAir= 0.2 в однофазном расчете (рис. 1б) присутствует жидкий оксид алюминия, а в двухфазном (рис. 1в) – нет, так как он входит в состав частицы.
Рис. 2.
Зависимость параметров течения в детонационной волне от лабораторного времени (D = 2000 м/с, mAl/mAir = 0.2): 1, 3, 5 – U, T, ρU продуктов сгорания; 2, 4, 6 – U, T, ρU частиц; 7 – mAl × 108 в частице, 8 – ${{m}_{{{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}$ × 108 в частице.

Моделирование детонации частиц магния [1–8, 14–18] в воздухе. Температура воздуха, приводящая к воспламенению газовзвеси частиц магния в воздухе, может быть ниже температуры плавления магния [1], поэтому в работе предполагается, что в химических реакциях с кислородом участвует как “жидкий”, так и “твердый” магний. В процессе окисления частица становится многокомпонентной и состоит из магния (Mg) и оксида магния (MgO). В процессе теплого взаимодействия с воздухом частица нагревается и ее температура может достигать температур плавления и испарения магния ($T_{m}^{{{\text{Mg}}}}$ = 923, $T_{b}^{{{\text{Mg}}}}$ = 1363 К) и оксида магния ($T_{m}^{{{\text{MgO}}}}$ = 3100, $T_{b}^{{{\text{MgO}}}}$ = 3600 К).
Для описания поверхностных реакций используется кинетический механизм, включающий реакции испарения (конденсации) и окисления магния по механизму (6)–(8) с X = 1, Y = 2. Стехиометрическое соотношение ${{({{{{m}_{{{\text{Mg}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Mg}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}})}_{{CT}}}$ = = 0.354. Скорости реакций (6), (7) в первом приближении можно найти из соотношений (5). Для нахождения скорости реакции (8) можно использовать диффузионную (5) и кинетическую (9) модели [14, 15]. Считается, что скорость притока кислорода к частице магния прямо пропорциональна объемной концентрации кислорода и площади поверхности капли, занятой магнием. Значение приведенной энергии активации E = = 12 535 К заимствовано из [15]. Значение константы K = 59 подбиралось из условия совпадения рассчитанной предельной температуры воспламенения одиночных сферических частиц магния ($d_{S}^{0}$ = 15–50 мкм) с экспериментальными данными, приведенными в [15]. Отличие не превысило 0.5%. В формуле (9) использовались следующие параметры: $d_{S}^{0}$ = 1 мкм, n = 2, m = 0.
Кинетическая модель (9) позволяет достаточно точно определить параметры воспламенения частиц магния, однако дает сильно завышенное значение температуры горения [15]. Диффузионная модель (5), наоборот, не позволяет корректно определять предельную температуру воспламенения, но дает достоверную температуру сгорания частиц при высоких температурах газа [1].
В настоящей работе в качестве скорости притока кислорода к частице выбирается минимальная из рассчитанных по кинетической и диффузионной моделям – кинетически-диффузионная модель [14]. Для тестирования модели в [18] расчетным путем воспроизведены три режима нагрева частиц магния: без воспламенения частиц, воспламенение с погасанием, воспламенение [14].
Изучалась горючая смесь, состоящая из воздуха (0.21O2 + 0.79N2) и частиц магния, продукты сгорания включали десять компонент: MgO, O2, N2, NO, MgO(ж), Mg(ж), Mg3N2(ж), O, N, Mg, термодинамические свойства которых заимствовались из [37]. На рис. 3 приведены результаты расчетов параметров равновесной детонации Чепмена–Жуге для рассматриваемой смеси при нормальных условиях. Пиковые значения скорости детонации и температуры при сгорании частиц магния ниже, чем у алюминия (рис. 1а, 3а), при этом при большом массовом содержании металла скорость детонации выше в смеси магния с воздухом. В равновесных продуктах сгорания магния (рис. 3б) присутствуют в виде мелких частиц оксид магния, а при ${{{{m}_{{{\text{Mg}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Mg}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ > 1.35 нитрид магния, в неравновесных расчетах (рис. 3в) при ${{{{m}_{{{\text{Mg}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Mg}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ > 1.1 мелкодисперсный оксид магния отсутствует.
Рис. 3.
Зависимость параметров ДВ Чепмена–Жуге от отношения расходов частиц магния и воздуха: (а)–(в) – см. рис. 1; * – жидкое состояние.
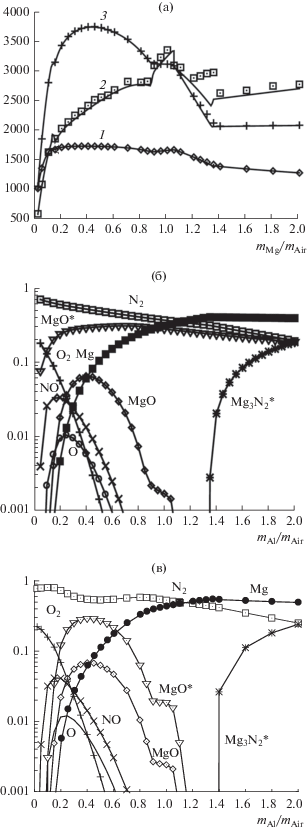
Исследовалось влияние на параметры детонации Чепмена–Жуге скоростной и температурной неравновесности газовой и дисперсной фаз. Рассматривались частицы магния с начальным диаметром 1 мкм.
На рис. 4 приведены графики изменения параметров продуктов сгорания в пересжатой ДВ при соотношении магний/воздух, близком к стехиометрическому. Скоростное и температурное равновесия (кривые 1–4) наступали примерно через 6 мкс. На графике температуры содержатся полочки, соответствующие температурам плавления магния и оксида магния. Магний, содержащийся (рис. 4, кривая 7) в частице, через 10 мкс полностью израсходовался, при этом количество оксида магния (рис. 2, кривая 8) в частице выросло, а затем уменьшилось из-за испарения. В газовой фазе при ${{{{m}_{{{\text{Mg}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Mg}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ < 1.1 в двухфазном расчете (рис. 3в) присутствует мелкодисперсный оксид магния.
Рис. 4.
Зависимость параметров течения в детонационной волне от лабораторного времени (D = 2000 м/с, mMg/mAir = 0.2): 1–6 – см. рис. 2; 7 – mMg × 108 кг в частице, 8 – mMgO × 108 кг в частице.

Моделирование детонации частиц бора [1, 8, 9, 19–24] в воздухе. Особенностью горения бора по сравнению с магнием и алюминием является то, что температуры плавления и кипения оксида бора ($T_{m}^{{{{{\text{B}}}_{2}}{{{\text{O}}}_{3}}}}$ = 723 К, $T_{b}^{{{{{\text{B}}}_{2}}{{{\text{O}}}_{3}}}}$ = 1953 К), образующегося в процессе окисления бора кислородом, существенно ниже температур плавления и кипения бора ($T_{m}^{{\text{B}}}$ = 2348, $T_{b}^{{\text{B}}}$ = 3931 К). Характерные температуры горения бора составляют 2700–3200 К (при детонации 3000–3700 К), при этом пиковые значения достигаются в узкой зоне в окрестности стехиометрии (${{({{{{m}_{{\text{B}}}}} \mathord{\left/ {\vphantom {{{{m}_{{\text{B}}}}} {{{m}_{{{\text{air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{air}}}}}}})}_{{CT}}}$ = 0.105). Таким образом, при избытке окислителя частица может либо полностью испариться, либо состоять из жидкого оксида бора, а при недостатке окислителя на момент окончания горения частица будет состоять из трудно испаряющегося бора [8, 19–24]. Разработанная модель тестировалась в [23] моделированием горения бора в кислороде при различных давлениях. Полученные результаты хорошо согласуются с данными [8] по значениям температуры и массовой концентрации конденсированного бора в продуктах сгорания.
При математическом моделировании считается, что продукты сгорания бора в воздухе включают 14 компонент: BO2, B2O3, B2O, B2O2, N2, O2, NO, BN, B2O3(ж), B(ж), BN(ж), O, N, B. Для описания поверхностных реакций используется кинетический механизм, включающий реакции испарения (конденсации) и окисления бора по механизму (6)–(8) с X = 2 и Y = 3. Скорости реакций (6) и (7) в первом приближении можно найти из соотношений (5). Для нахождения скорости реакции (8) используется диффузионно-кинетическая модель (5), (9). Считается, что скорость притока кислорода к частице бора прямо пропорциональна объемной концентрации кислорода, площади поверхности капли, занятой бором. Также в экспериментальных работах отмечается, что скорость воспламенения возрастает при увеличении размера частицы. Константы K, n, m, E подбираются из условия совпадения рассчитанных минимальных температур воздуха, необходимых для самовоспламенения частиц, с экспериментальными данными из [17–22]. В расчетах E = 13 002 К, n = 1, m = 2, $d_{S}^{0}$ = 100 мкм, K = 198 [23].
Параметры детонации Чепмена–Жуге, рассчитанные по газофазной равновесной и двухфазной моделям (рис. 5, 6), близки при ${{{{m}_{{\text{B}}}}} \mathord{\left/ {\vphantom {{{{m}_{{\text{B}}}}} {{{m}_{{{\text{air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{air}}}}}}}$ < 0.5. Из вычислительного эксперимента следует, что диапазон отношений масс бора к массе воздуха, при котором существует высокоскоростная детонация, существенно уже, чем в случае с алюминием и магнием. В состав продуктов сгорания, рассчитанных по однофазной модели (рис. 5б), входят конденсированные компоненты: при избытке окислителя – B2O3, при избытке горючего – BN и B. В окрестности стехиометрии существует узкая зона, в которой состав продуктов сгорания полностью газофазный. В двухфазном расчете в равновесном составе присутствует только конденсированный нитрид бора при ${{{{m}_{{\text{B}}}}} \mathord{\left/ {\vphantom {{{{m}_{{\text{B}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ > 0.3.
Рис. 5.
Зависимость параметров ДВ Чепмена–Жуге от отношения расходов частиц бора и воздуха: (а)–(в) – см. рис. 1.

Рис. 6.
Зависимость параметров течения в детонационной волне от лабораторного времени (D = 2000 м/с, mB/mAir = 0.1): 1–6 – см. рис. 2; 7 – mB × 108 кг в частице, 8 – ${{m}_{{{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}$ × 108 кг в частице.
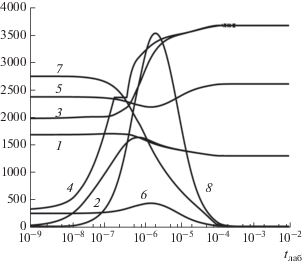
На рис. 6 приведены зависимости параметров продуктов сгорания в пересжатой детонационной волне при соотношении бор/воздух, близком к стехиометрическому, от лабораторного времени. Расчет проводился до достижения состояния термодинамического равновесия. Скоростное и температурное равновесия (кривые 1–4) наступало примерно через 30 мкс. На графике температуры частиц (кривая 4) имеется полочка, соответствующая температуре плавления бора. Расход частиц в процессе расчета сначала увеличивался из-за реакции окисления бора и образования оксида бора (кривые 7, 8), а затем уменьшался до нуля, так как весь бор переходил в оксид бора, который испарялся (кривая 8). В газовой фазе при этом твердая фаза отсутствует. Необходимо отметить, что экспериментальных данных о детонации в смеси дисперсных частиц бора с воздухом нет, полученные численные результаты, соответственно, носят качественный характер.
Особенности структуры волны детонации при избытке частиц металла. При численном исследовании детонации смесей алюминия с воздухом (табл. 1) и бора с воздухом (табл. 2) при избытке металла полное равновесие наступает на значительных расстояниях от ударной волны. Вблизи волны наблюдается состояние частичного равновесия, которое, по-видимому, более соответствует реальным значениям параметров, достигаемым при детонации. Так для смеси алюминий–воздух температура и давление в состоянии частичного равновесия на 4–7% выше, чем при полном, диаметр частиц и концентрация мелкодисперсного алюминия существенно больше. Это связано с частичным испарением алюминия и окисла алюминия и, как следствие, образованием Al2O в потоке, а также с конденсацией нитрида алюминия (AlN).
Таблица 1.
Частичное и полное равновесие. Алюминий + воздух
| Величина | Равновесие | ${{{{m}_{{{\text{Al}}}}}} \mathord{\left/ {\vphantom {{{{m}_{{{\text{Al}}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ | ||||
|---|---|---|---|---|---|---|
| 0.6 | 0.8 | 1.2 | 1.6 | 2.0 | ||
| dS, мкм | Частичное | 0.66 | 0.63 | 0.59 | 0.82 | 0.9 |
| Полное | 0.63 | 0.47 | 0.37 | 0.04 | 0.008 | |
| T, К | Частичное | 3375 | 3225 | 3245 | 3245 | 3245 |
| Полное | 3425 | 3057 | 3050 | 3105 | 3071 | |
| P, МПа | Частичное | 2.80 | 2.59 | 2.66 | 2.73 | 2.56 |
| Полное | 2.74 | 2.46 | 2.35 | 2.1 | 1.86 | |
| AlN* | Частичное | 0 | 0.1 | 0.14 | 0.23 | 0.34 |
| Полное | 0 | 0.09 | 0.26 | 0.37 | 0.39 | |
| Al* | Частичное | 0 | 0.06 | 0.27 | 0.25 | 0.23 |
| Полное | 0 | 0 | 0 | 0.02 | 0.11 | |
| Al2O | Частичное | 0.35 | 0.25 | 0.13 | 0.08 | 0.04 |
| Полное | 0.40 | 0.45 | 0.44 | 0.39 | 0.34 | |
Таблица 2.
Частичное и полное равновесие. Бор + воздух
| Величина | Равновесие | ${{{{m}_{{\text{B}}}}} \mathord{\left/ {\vphantom {{{{m}_{{\text{B}}}}} {{{m}_{{{\text{Air}}}}}}}} \right. \kern-0em} {{{m}_{{{\text{Air}}}}}}}$ | ||||
|---|---|---|---|---|---|---|
| 0.3 | 0.5 | 1.8 | 1.0 | 1.4 | ||
| dS, мкм | Частичное | 0.86 | 1.0 | 1.0 | 1.0 | 1.0 |
| Полное | 0.64 | 0.73 | 0.77 | 0.78 | 0.8 | |
| T, K | Частичное | 2675 | 2355 | 2314 | 2175 | 1845 |
| Полное | 3090 | 3060 | 3036 | 3035 | 2961 | |
| P, МПа | Частичное | 2.60 | 2.43 | 1.50 | 1.47 | 1.27 |
| Полное | 1.9 | 1.66 | 1.44 | 1.62 | 1.64 | |
| BN* | Частичное | 0 | 0 | 0 | 0 | 0 |
| Полное | 0.12 | 0.27 | 0.45 | 0.54 | 0.7 | |
| B2O2 | Частичное | 0 | 0 | 0 | 0 | 0 |
| Полное | 0.27 | 0.25 | 0.23 | 0.22 | 0.2 | |
Для смеси бор + воздух (табл. 2) при переходе от состояния частичного равновесия к полному наблюдается существенный рост температуры от 15 до 60%, связанный с конденсацией нитрида бора. Данный факт указывает на то, что наблюдаемая температура при детонации частиц бора в воздухе (с избытком бора) должна быть существенно ниже, чем предсказывает равновесная теория.
Необходимо отметить, что детонация горючих смесей частиц металлов в воздухе является чрезвычайно сложным многомерным процессом [1–34 ], который может быть адекватно описан только с использованием средств многомерного моделирования, элементом которого являются приведенные в работе физико-математическая модель и вычислительные алгоритмы.
ЗАКЛЮЧЕНИЕ
Предложенная в работе физико-математическая модель апробирована в широком диапазоне отношений начальных массовых расходов частиц алюминия, магния и бора в воздухе. Расчетным путем получена тонкая структура стационарной детонационной волны, включающая нагрев, плавление, испарение, воспламенение и изменение состава частиц, воспламенение и соответствующее изменение состава газофазных продуктов сгорания, образование мелкодисперсных частиц алюминия, магния и бора, а также их оксидов и нитридов.
Исследовано влияние массового расхода частиц металлов на минимальную скорость стационарной детонации. Показано, что параметры стационарной детонационной волны асимптотически стремятся к равновесным значениям – точке на равновесной детонационной адиабате. При избытке алюминия и бора в воздухе может реализоваться состояние частичного равновесия, параметры в котором заметно отличаются от соответствующих параметров при полном равновесии. В целом показано, что разработанная модель является физически непротиворечивой и внутренне согласованной, которая позволяет получать результаты, качественно совпадающие (в ряде случаев и количественно) с экспериментальными данными.
Работа выполнена в соответствии с государственным заданием № 9.7555.2017/БЧ.
Список литературы
Похил П.Ф., Беляев А.Ф., Фролов Ю.В., Логачаев В.С., Коротков А.И. Горение порошкообразных металлов в активных средах. М.: Наука, 1972. 294 с.
Митрофанов В.В. Детонация гомогенных и гетерогенных систем. Новосибирск: Изд-во Института гидродинамики им. М.А. Лаврентьева СО РАН, 2003. 200 с.
Медведев А.Е., Федоров А.В., Фомин В.М. Описание горения смесей газа и твердых частиц методами механики сплошной среды // ФГВ. 1984. Т. 20. № 2. С. 3.
Гремячкин В.М., Истратов А.Г., Лейпунский О.И. Модель горения мелких капель металла // ФГВ. 1975. Т. 11. № 3. С. 366.
Дрегалин А.Ф., Зенуков И.А., Крюков В.Г., Наумов В.И. Математическое моделирование высокотемпературных процессов в энергоустановках / Под ред. Алемасова В.Е. Изд-во Казанского университета, 1985. 263 с.
Федоров А.В., Фомин В.М., Хмель Т.А. Гетерогенная детонация. В кн.: Законы горения / Под ред. Полежаева Ю.В. М.: Энергомаш, 2006. С. 276.
Физика взрыва / Под ред. Орленко Л.П. Т. 1. М.: Физматлит, 2004. 832 с.
Ягодников Д.А. Воспламенение и горение порошкообразных металлов. М.: Изд-во МГТУ им. Н.Э. Баумана, 2009. 432 с.
Ильин А.П., Громов А.А. Горение порошков алюминия и бора в сверхтонком состоянии. Томск: ТГУ, 2002. 154 с.
Афанасьева Е.А., Левин В.А. Воспламенение и горение частиц алюминия за ударными и детонационными волнами // ФГВ. 1987. Т. 23. № 1. С. 8.
Кратова Ю.В., Федоров А.В., Хмель Т.А. Особенности ячеистой детонации в полидисперсных газовзвесях частиц алюминия // ФГВ. 2011. Т. 47. № 5. С. 85.
Кратова Ю.В., Хмель Т.А., Федоров А.В. Осесимметричная расширяющаяся гетерогенная детонация в газовзвесях частиц алюминия // ФГВ. 2016. Т. 52. № 1. С. 84.
Гидаспов В.Ю. Численное моделирование стационарных детонационных волн в смеси частиц алюминия с воздухом // Труды МАИ. 2011. № 49.
Попов В.Н., Федоров А.В., Шульгин А.В. Численное моделирование воспламенения частицы магния в неоднородном тепловом поле // Математическое моделирование. 2007. Т. 19. № 6. С. 109.
Авдеев К.А., Фролов Ф.С., Басевич А.А., Фролов С.М. Модифицированная модель воспламенения частицы магния // Химическая физика. 2008. Т. 27. № 6. С. 47.
Федоров А.В., Тропин Д.А. Математическая модель воспламенения магния в расширенном диапазоне параметров // ФГВ. 2008. Т. 44. № 5. С. 64.
Андреев М.А., Степанов А.М. Инициированная детонация в аэровзвеси металлических частиц // ФГВ. 1986. Т. 22. № 1. С. 103.
Гидаспов В.Ю. Численное моделирование стационарных волн горения и детонации в смеси частиц магния с воздухом // Труды МАИ. 2013. № 66.
Гремячкин В.М., Истратов А.Г., Лейпунский О.И. К теории горения частицы бора в кислороде при высоких температурах // ФГВ. 1979. Т. 15. № 6. С. 5.
Гуревич М.А., Кирьянов И.М., Озеров Е.С. Горение одиночных частиц бора // ФГВ. 1969. Т. 5. № 2. С. 217.
Давидчук Е.Л., Димитров В.И., Рафалович М.Л., Тулупов Ю.И., Славинская Н.А. Кинетика горения бора в сухом воздухе // ФГВ. 1991. Т. 27. № 1. С. 45.
Давидчук Е.Л., Димитров В.И., Залож В.А., Славинская Н.А., Тулупов Ю.И. Коэффициенты переноса продуктов горения бора в сухом воздухе // ФГВ. 1991. Т. 27. № 1. С. 52.
Гидаспов В.Ю. Численное моделирование стационарных волн горения и детонации в смеси частиц бора с воздухом // Труды МАИ. 2016. № 91.
Рашковский С.А., Милёхин Ю.М., Федорычев А.В. Влияние распределенного подвода воздуха в камеру дожигания ракетно-прямоточного двигателя на полноту сгорания частиц бора // ФГВ. 2017. Т. 53. № 6. С. 38.
Гидаспов В.Ю., Москаленко О.А., Пирумов У.Г. Численное моделирование стационарных детонационных волн в газовых и газокапельных реагирующих смесях // Вестник МАИ. М.: Изд-во МАИ-ПРИНТ, 2009. Т. 16. № 2. С. 51.
Ленкевич Д.А., Головастов С.В., Голуб В.В., Бочарников В.М., Бивол Г.Ю. Параметрическое исследование распространения детонации в узких каналах, заполненных смесью пропан–бутан–кислород // ТВТ. 2014. Т. 52. № 6. С. 916.
Бивол Г.Ю., Головастов С.В., Голуб В.В. Формирование пересжатой волны детонации в потоке метано-кислородных смесей в канале переменного сечения // ТВТ. 2017. Т. 55. № 4. С. 576.
Волков В.А., Гидаспов В.Ю., Пирумов У.Г., Стрельцов В.Ю. Численное моделирование течений реагирующих газокапельных и газовых смесей в экспериментах по воспламенению метанола // ТВТ. 1998. Т. 36. № 3. С. 424.
Гидаспов В.Ю., Северина Н.С. Численное моделирование экспериментов по определению времени задержки воспламенения за падающими ударными волнами // ФГВ. 2013. Т. 49. № 4. С. 31.
Гидаспов В.Ю., Северина Н.С. Численное моделирование тонкой структуры цилиндрической детонационной волны в водородно-воздушной горючей смеси // ТВТ. 2015. Т. 53. № 4. С. 556.
Гидаспов В.Ю., Северина Н.С. Численное моделирование детонации пропано-воздушной горючей смеси с учетом необратимых химических реакций // ТВТ. 2017. Т. 55. № 5. С. 795.
Гидаспов В.Ю., Москаленко О.А., Северина Н.С. Численное исследование влияния капель воды на структуру детонационной волны в водородо-воздушной горючей смеси // ТВТ. 2018. Т. 56. № 5. С. 829.
Лунев В.В. Течение реальных газов с большими скоростями. М.: Физматлит, 2007. 760 с.
Франк-Каменецкий А.А. Диффузия и теплопередача в химической кинетике. М.: Наука, 1967.
Зельдович Я.Б. Теория горения и детонации газов. М.: Изд-во АН СССР, 1944.
Термодинамические свойства индивидуальных веществ: Справочное издание в 4-х томах / Л.В. Гурвич, И.В. Вейц, В.А. Медведев и др. М.: Наука, 1982.
Гидаспов В.Ю., Северина Н.С. Некоторые задачи физической газовой динамики. М.: Изд-во МАИ, 2016. 196 с.
Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей. Л.: Химия, 1982. 592 с.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


