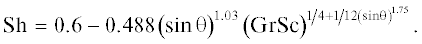Теплофизика высоких температур, 2020, T. 58, № 2, стр. 238-243
Модель для расчета скорости диссоциации нитридного топлива при высоких температурах
Э. В. Усов 1, *, В. И. Чухно 1, И. Г. Кудашов 1, Т. В. Сычева 1
1 ИБРАЭ РАН, Новосибирский филиал
г. Новосибирск, Россия
* E-mail: usovev@gmail.com
Поступила в редакцию 19.08.2019
После доработки 15.10.2019
Принята к публикации 22.10.2019
Аннотация
В настоящей работе на основе анализа доступных в открытой литературе экспериментальных данных предложена простая теоретическая модель, описывающая скорость потери массы при диссоциации нитрида урана в вакууме и в газовой атмосфере за счет испарения веществ с поверхности материалов. Предложенная модель может использоваться для оценки степени диссоциации нитрида урана, которая является одной из основных причин разрушения топлива, поскольку конгруэнтное плавление наблюдается только при высоких давлениях азота.
ВВЕДЕНИЕ
Одним из наиболее перспективных топлив для быстрых реакторов является нитридное топливо, имеющее высокую плотность и теплопроводность, а также более высокую радиационную стойкость. Концепция развития атомной энергетики в России предполагает строительство реакторов на быстрых нейтронах с натриевым (БН-1200) и свинцовым (БРЕСТ-ОД-300) теплоносителями. При этом проекты реакторов предполагают использование нитридного топлива в качестве основы. Проектирование подразумевает в том числе рассмотрение сценариев аварий с разрушением твэлов и активной зоны реактора.
Известно, что при относительно низких давлениях азота над поверхностью нитрида урана конгруэтного плавления последнего не наблюдается [1]. Происходит разложение на уран и азот. Конгруэтное плавление начинается при температуре 3123 К и давлении азота над поверхностью выше 2.5 × 105 Па [2]. Таким образом, в реакторных условиях возможна только термическая диссоциация топлива, поскольку давление азота в твэле существенно меньше критического. В связи с этим существующие подходы для расчета плавления топлива не могут быть использованы для моделирования разрушения нитридов.
Большинство представленных работ по разложению нитридов посвящено определению зависимости давления азота и урана над поверхностью от температуры диссоциации [3–9]. Азот и пар урана появляются в результате протекания следующих реакций:
Здесь индексы тв, ж и г обозначают вещества в твердом, жидком и газообразном состояниях. При этом азот над поверхностью топлива появляется в результате реакции (1). Источником пара урана над поверхностью нитрида является реакция (2). Сумма реакций (1) и (2) описывает диссоциацию нитрида до начала его конгруэтного плавления.
Наиболее важным для моделирования диссоциации является определение скорости потери массы из-за выделения азота и пара урана. Установившаяся скорость потери массы в условиях вакуума измерялась в работах [5, 10], а в атмосфере гелия в условиях, близких к реакторным, изучалась в [11–14].
К сожалению, ни в одной из работ не представлены алгоритмы расчета скорости диссоциации, что особенно актуально для численного моделирования процессов, которые происходят при тяжелых авариях в реакторных установках на быстрых нейтронах с нитридным топливом. Настоящая работа посвящена развитию подходов для моделирования термического разрушения нитридного топлива во время тяжелых аварий в реакторах на быстрых нейтронах.
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ ДИССОЦИАЦИИ
В результате реакций (1) и (2) над поверхностью нитрида появляется азот и пар урана. Массовый поток молекул урана и азота (в кг с–1 м–2), покидающих поверхность вещества, может быть найден по формуле Герца–Кнудсена в форме [15]
(3)
${{j}_{i}} = \frac{{2{{\beta }_{i}}}}{{2 - {{\beta }_{i}}}}\sqrt {\frac{{{{M}_{i}}}}{{2\pi R}}} \left( {\frac{{{{p}_{{si}}}\left( T \right)}}{{\sqrt T }} - \frac{{{{p}_{\infty }}}}{{\sqrt {{{T}_{\infty }}} }}} \right).$В условиях испарения в вакуум или при испарении в газовую среду, не содержащую паров вещества, парциальное давление равно нулю ${{p}_{\infty }} = 0,$ и формула (3) упрощается:
(4)
$\begin{gathered} - \frac{1}{S}\frac{{d{{m}_{{{\text{UN}}}}}}}{{dt}} = {{j}_{{\text{U}}}} + {{j}_{{{{{\text{N}}}_{{\text{2}}}}}}} = \\ = {{\lambda }_{{\text{U}}}}\sqrt {\frac{{{{M}_{{\text{U}}}}}}{{2\pi R}}} \frac{{p_{{\text{U}}}^{{{\text{UN}}}}\left( T \right)}}{{\sqrt T }} + {{\lambda }_{{{{{\text{N}}}_{{\text{2}}}}}}}\sqrt {\frac{{{{M}_{{{{{\text{N}}}_{{\text{2}}}}}}}}}{{2\pi R}}} \frac{{p_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{UN}}}}\left( T \right)}}{{\sqrt T }}. \\ \end{gathered} $(5)
$\lg p_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{UN}}}}\left( T \right) = 1.8216 + 1.882 \times {{10}^{{ - 3}}}T - {{23{\kern 1pt} 543.4} \mathord{\left/ {\vphantom {{23{\kern 1pt} 543.4} T}} \right. \kern-0em} T},$(6)
$\lg p_{{\text{U}}}^{{{\text{UN}}}}\left( T \right) = 6.9654 - 5.137 \times {{10}^{{ - 4}}}T - {{26{\kern 1pt} 616.1} \mathord{\left/ {\vphantom {{26{\kern 1pt} 616.1} T}} \right. \kern-0em} T}.$Для урана и азота отсутствуют достоверные значения коэффициентов λ. В работах [5, 6] для азота предложено значение 0.01, а для урана – 0.2. Указанные значения не могут быть использованы, так как при выводе их предполагалась близость величин давления насыщенных паров урана и азота. Последующие измерения показали, что давление пара урана более чем на порядок ниже. С использованием метода наименьших квадратов и доступных экспериментальных данных по скорости диссоциации нитрида урана [5, 10] получены следующие значения коэффициентов конденсации:
На рис. 1 представлено сравнение экспериментальных данных [5, 10] и результатов расчета по формулам (4)–(7).В том случае, если разложение протекает в атмосфере, скорость массоотдачи αi определяется скоростью конвективно-диффузионного переноса вещества в атмосферном газе. Коэффициент массоотдачи в этом случае должен определяться сложением обратных коэффициентов массопереноса за счет молекулярно-кинетического и конвективно-диффузионного механизмов [16]:
(8)
${{\alpha }_{{i\,{\text{eff}}}}}\frac{{{{M}_{i}}}}{{RT}} = \frac{{{{\lambda }_{i}}\sqrt {\frac{{{{M}_{i}}}}{{2\pi RT}}} {{\alpha }_{i}}\frac{{{{M}_{i}}}}{{RT}}}}{{{{\lambda }_{i}}\sqrt {\frac{{{{M}_{i}}}}{{2\pi RT}}} + {{\alpha }_{i}}\frac{{{{M}_{i}}}}{{RT}}}},$(9)
${{j}_{i}} = {{\alpha }_{{i\,{\text{eff}}}}}\frac{{{{M}_{i}}}}{{RT}}\left( {{{p}_{{si}}}\left( T \right) - {{p}_{i}}} \right),$В условиях вынужденной конвекции число Шервуда является функцией от числа Рейнольдса и Шмидта и может быть рассчитано, например, по соотношению из [17]:
(11)
$\begin{gathered} {\text{Sh}} = 2 + {\text{Gr}} + {\text{G}}{{{\text{r}}}^{2}} \times \\ \times \,\,\left( {0.139 - 0.4519{\text{Sc}} + 1.1902{\text{S}}{{{\text{c}}}^{2}}} \right), \\ {\text{Gr}} = \frac{{g{{d}^{3}}}}{{\nu _{{{\text{He}}}}^{2}}},\,\,\,\,{\text{Sc}} = \frac{{{{\nu }_{{{\text{He}}}}}}}{{{{D}_{i}}}}, \\ \end{gathered} $Для наклонных цилиндров при свободной конвекции [19]:
Коэффициент массоотдачи за счет конвективно-диффузионного переноса обычно гораздо меньше коэффициента, соответствующего молекулярно-кинетическому механизму, поэтому формула (9) может быть упрощена и записана в виде(13)
${{j}_{i}} = {{\alpha }_{i}}\frac{{{{M}_{i}}}}{{RT}}\left( {{{p}_{{si}}}\left( T \right) - {{p}_{i}}} \right).$В этом случае скорость диссоциации нитрида урана определяется по формуле
(14)
$\begin{gathered} - \frac{1}{S}\frac{{d{{m}_{{{\text{UN}}}}}}}{{dt}} = {{j}_{{\text{U}}}} + {{j}_{{{{{\text{N}}}_{{\text{2}}}}}}} = {{\alpha }_{{\text{U}}}}\frac{{{{M}_{{\text{U}}}}}}{{RT}}p_{{\text{U}}}^{{{\text{UN}}}}\left( T \right) + \\ + \,\,{{\alpha }_{{{{{\text{N}}}_{{\text{2}}}}}}}\frac{{{{M}_{{{{{\text{N}}}_{{\text{2}}}}}}}}}{{RT}}p_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{UN}}}}\left( T \right), \\ \end{gathered} $Сравним результаты расчета с экспериментальными данными [11]. В эксперименте использовались цилиндрические образцы из нитрида урана диаметром 3–4 мм, длиной от 2 до 3 мм. Для расчета безразмерного коэффициента теплоотдачи таких образцов применялись соотношения для шара (11). Эквивалентный диаметр шара вычислялся по объему образцов. Сравнение результатов расчета и экспериментальных данных по скорости потери массы приведено на рис. 2. Результаты эксперимента при низких температурах лежат выше теоретической оценки. К сожалению, в экспериментах не представлено обоснования немонотонности скорости диссоциации при низких температурах. Одной из причин отклонения расчета от эксперимента является большая ошибка в определении скорости потери массы при низкой температуре. Действительно, в соответствии с [11], погрешность эксперимента при относительно невысоких температурах составляет ~50%. Также возможно, что дополнительный вклад в скорость диссоциации вносит не учитываемая в настоящей модели диссоциация полуторного нитрида в соответствии с реакцией
Коэффициенты диффузии атомов урана и молекул азота в гелии для указанного диапазона температур отсутствуют, поэтому была использована упрощенная формула, полученная для идеальных газов [20]:
Здесь kB – постоянная Больцмана; di, dHe – диаметры i-го атома (молекулы) и атома гелия; NA – постоянная Авогадро. Если нитрид находится не в атмосфере гелия, должны быть использованы свойства указанной атмосферы.
В том случае, если в качестве топлива рассматривается смешанное уран-плутониевое нитридное топливо (U1 –xPux)N, давления азота, урана и плутония могут быть рассчитаны по известным активностям UN и PuN в смеси и давлениям насыщения азота, урана и плутония над чистыми нитридами.
Давление (в атм) насыщения азота над нитридом плутония рассчитывается как [21]
ЧИСЛЕННАЯ РЕАЛИЗАЦИЯ МОДЕЛИ ТЕРМИЧЕСКОЙ ДИССОЦИАЦИИ НИТРИДНОГО ТОПЛИВА
Для моделирования термической диссоциации нитрида в твэле во время аварии с плавлением активной зоны реализована численная модель. Основу численной модели составляют уравнения (5), (6), (8)–(14). Для определения температурного поля в твэле решается тепловая задача. При этом в качестве граничного условия на свободной границе используется условие по массовому потоку.
Рассмотрим общую реакцию вида
(15)
$\begin{gathered} ({{{\text{U}}}_{{1--x}}}{\text{P}}{{{\text{u}}}_{x}}){\text{N(тв)}} = {{U}_{{1--x}}}({\text{ж}}) + {\text{P}}{{{\text{u}}}_{x}}({\text{ж}}) + 0.5{{{\text{N}}}_{2}}({\text{г}}), \\ {\text{U(ж)}} = {\text{U(г)}},\,\,\,\,{\text{Pu(ж)}} = {\text{Pu(г)}}. \\ \end{gathered} $Массовый поток азота с поверхности нитрида при диссоциации
(16)
$\begin{gathered} j_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{UN}}}} = {{\alpha }_{{{{{\text{N}}}_{{\text{2}}}}}}}\frac{{{{M}_{{{{{\text{N}}}_{{\text{2}}}}}}}}}{{RT}}{{a}_{{{\text{UN}}}}}\left( {1 - x} \right)p_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{UN}}}}, \\ j_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{PuN}}}} = {{\alpha }_{{{{{\text{N}}}_{{\text{2}}}}}}}\frac{{{{M}_{{{{{\text{N}}}_{{\text{2}}}}}}}}}{{RT}}{{a}_{{{\text{PuN}}}}}xp_{{{{{\text{N}}}_{{\text{2}}}}}}^{{{\text{PuN}}}}. \\ \end{gathered} $(17)
${{j}_{{\text{U}}}} = {{\alpha }_{{\text{U}}}}\frac{{{{M}_{{\text{U}}}}}}{{RT}}\left( {{{p}_{{\text{U}}}}\left( T \right) - {{p}_{{\text{U}}}}} \right).$Массовый поток пара плутония
(18)
${{j}_{{{\text{Pu}}}}} = {{\alpha }_{{{\text{Pu}}}}}\frac{{{{M}_{{{\text{Pu}}}}}}}{{RT}}\left( {{{p}_{{{\text{Pu}}}}}\left( T \right) - {{p}_{{{\text{Pu}}}}}} \right).$Удельная теплота испарения плутония rPu = = 344 кДж/моль.
Удельную энтальпию реакции найдем как сумму удельных энтальпий разложения нитрида урана и нитрида плутония с учетом доли веществ. Для определения энтальпии разложения нитрида урана по реакции используем значение из [7]: rUN = 281 кДж/моль. Зависимость энтальпии разложения от температуры достаточно слабая, поэтому положим, что энтальпия не изменяется. Для нитрида плутония, как указано в [21], энергия активации для реакции с образованием твердого нитрида плутония равна 293 кДж/моль. Удельная теплота плавления плутония – 2.8 кДж/моль. Значит, удельная теплота для реакции разложения нитрида с образованием жидкого плутония rPuN = 296 кДж/моль.
Таким образом, на граничной поверхности должно быть поставлено следующее условие:
(19)
$\begin{gathered} {{\left. {{{\kappa }_{{\left( {{{{\text{U}}}_{{{\text{1}} - x}}}{\text{P}}{{{\text{u}}}_{x}}} \right){\text{N}}}}}\frac{{\partial T}}{{\partial r}}} \right|}_{\Gamma }} = \frac{2}{{{{M}_{{{{{\text{N}}}_{{\text{2}}}}}}}}}\left( {x{{r}_{{{\text{PuN}}}}} + (1 - x){{r}_{{{\text{UN}}}}}} \right){{j}_{{{{{\text{N}}}_{{\text{2}}}}}}} + \\ + \,\,\frac{1}{{{{M}_{{\text{U}}}}}}{{j}_{{\text{U}}}}{{r}_{{\text{U}}}} + \frac{1}{{{{M}_{{\text{U}}}}}}{{j}_{{{\text{Pu}}}}}{{r}_{{{\text{Pu}}}}} \\ \end{gathered} $В соответствии с реакцией (15) в расчетной ячейке оказываются жидкий уран и плутоний. Если Δt – величина расчетного шага, S – площадь поверхности граничной ячейки, то масса образовавшегося жидкого урана составляет
В соответствии с новыми значениями массы должны быть пересчитаны объемы расчетных ячеек. Описанная модель была внедрена в расчетный модуль SAFR/V1 [22, 23] интегрального кода ЕВКЛИД/V2 [24].
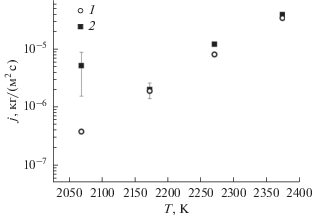
Для верификации реализованной модели проведены расчеты для экспериментов, проведенных в НИЯУ МИФИ [13]. В представленных экспериментах изучалась диссоциация нитрида урана. Для проведения экспериментов использовался образец массой 1.38 × 10–3 кг. Образец помещался в тигль из вольфрама, нагревался до определенной температуры, которая выдерживалась для 1900°С и 2100°С в течение 2 ч, а для 2300°С – в течение получаса. Результаты экспериментов в сравнении с результатами расчета для указанных температур приведены на рис. 3.
ЗАКЛЮЧЕНИЕ
Представлена модель для расчета скорости термической диссоциации нитридного топлива в вакууме и в атмосфере газа. Последнее важно для моделирования аварий с разрушением твэла перспективных реакторов на быстрых нейтронах. Указанная модель внедрена в расчетный модуль SAFR/V1 интегрального кода ЕВКЛИД/V2, с использованием которого проведено моделирование экспериментов, выполненных в НИЯУ МИФИ. Получено удовлетворительное соответствие результатов расчета и экспериментальных данных. Среднеарифметическая погрешность расчета потери массы образца составила 30%. Текущая версия модели предполагает основным механизмом диссоциацию на поверхности топливных таблеток. Дальнейшее развитие модели и повышение точности ее предсказаний должно учитывать также диссоциацию на поверхности внутренних зерен топлива и образование полуторного нитрида.
Список литературы
Кириллов П.Л., Терентьева М.И., Денискина Н.Б. Теплофизические свойства материалов ядерной техники. М.: ИздАт, 2007. 200 с.
Olson W.M., Mulford R.N.R. The Decomposition Pressure and Melting Point of Uranium Mononitride // J. Phys. Chem. 1963. V. 67. № 4. P. 952.
Benz R., Bowman M.G. Some Phase Equilibria in the Uranium-Nitrogen System // J. Am. Chem. Soc. 1966. V. 88. № 2. P. 264.
Bugl J., Bauer A.A. Phase Relations in the System Uranium–Nitrogen // J. Am. Ceram. Soc. 1964. V. 47. № 9. P. 425.
Alexander C.A., Ogden J.S., Pardue W.M. Volatilization Characteristics of Uranium Mononitride // J. Nucl. Mat. 1969. V. 31. P. 13.
Gingerich K.A. Vaporization of Uranium Mononitride and Heat of Sublimation of Sublimation of Uranium // J. Chem. Phys. 1969. V. 51. № 10. P. 4433.
Prins G., Cordfunke E.H.P., Depaus R. Investigations of Uranium Carbonitrides III. Nitrogen Vapour Pressure and Thermodynamic Property // J. Nucl. Mater. 1980. V. 89. P. 221.
Hayes S.L., Thomas J.K., Peddicord K.L. Material Property Correlations for Uranium Mononitride IV. Thermodynamic Properties // J. Nucl. Mater. 1990. V. 171. P. 300.
Suzuki Ya., Maeda A., Arai Ya., Ohmichi T. Vaporization Behavior of Uranium-Plutonium Mixed Nitride // J. Nucl. Mater. 1992. V. 188. P. 239.
Balankin S.A., Loshmanov L.P., Skorov D.M., Sokolov V.S. Thermodynamic Stability of Uranium Mononitride // Sov. Atomic Energy. 1978. V. 44. Iss. 4. P. 327.
Lunev A.V., Mikhalchik V.V., Tenishev A.V., Baranov V.G. Kinetic and Microstructural Studies of Thermal Decomposition in Uranium Mononitride Compacts Subjected to Heating in High-purity Helium // J. Nucl. Mater. 2016. V. 475. P. 266.
Baranov V.G., Lunev A.V., Mickhalchik V.V. et al. High Temperature Behavior of Simulated Mixed Nitrides // IOP Conf. Ser.: Mater. Sci. Eng. 2016. V. 130. P. 012022.
Baranov V.G., Tenishev A.V., Kuzmin R.S. et al. Thermal Stability Investigation Technique for Uranium Nitride // Ann. Nucl. Energy. 2014. V. 87(2). P. 784.
Mikhalchik V.V., Tenishev A.V., Baranov V.G., Kuzmin R.S. Hight Temperature Uranium Nitride Decomposition // Adv. Mater. Res. 2014. V. 1040. P. 47.
Кучеров Р.Я., Рикенглаз Р.Э. О гидродинамических граничных условиях при испарении и конденсации // ЖЭТФ. 1959. Т. 37. Вып. 1(7). С. 125.
Кнаке С., Странский И.Н. Механизм испарения // УФН. 1959. Т. LXVIII. Вып. 2. С. 261.
Garner F.H., Suckling R.D. Mass Transfer from a Soluble Solid Sphere // AIChE. J. 1958. V. 4. № 1. P. 114.
Churchill S.W. Comprehensive, Theoretical Based, Correlating Equations for Free Convection from Isothermal Spheres // Chem. Eng. Commun. 1983. V. 24. P. 339.
Al-Arabi M., Salman Y. Laminar Natural Convection Heat Transfer from an Inclined Cylinder // Int. J. Heat Mass Transfer. 1980. V. 23. P. 45.
Ландау Л.Д., Лифшиц Е.М. Теоретическая физика. Физическая кинетика. Т. 10. М.: Физматлит, 2002. 536 с.
Olson W.M., Mulford R.N.R. The Decomposition Pressure of Plutonium Nitride // J. Phys. Chem. 1964. V. 68. № 5. P. 1048.
Усов Э.В., Бутов А.А., Чухно В.И. и др. Моделирование плавления твэла быстрого реактора и затвердевания образующегося расплава с помощью модуля SAFR/V1 интегрального кода ЕВКЛИД/V2 // Атомная энергия. 2018. Т. 124. № 3. С. 123.
Усов Э.В., Бутов А.А., Чухно В.И. и др. Моделирование перемещения расплава по поверхности твэла быстрого реактора при тяжелой аварии с помощью модуля SAFR/V1 интегрального кода ЕВКЛИД/V2 // Атомная энергия. 2018. Т. 124. № 4. С. 197.
Бутов А.А., Жданов В.С., Климонов И.А. и др. Физические модели для расчета разрушений твэла и активной зоны реактора с жидкометаллическим теплоносителем, реализованные в коде ЕВКЛИД/V2 // Теплоэнергетика. 2019. № 5. С. 5.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур