Теплофизика высоких температур, 2020, T. 58, № 3, стр. 365-375
Термодинамическая оценка стабильности металлических и керамических материалов в бинарном расплаве Sn–20% Li
В. П. Красин 1, *, С. И. Союстова 1
1 ФГБО ВО “Московский политехнический университет”
Москва, Россия
* E-mail: vkrasin@rambler.ru
Поступила в редакцию 05.11.2019
После доработки 09.02.2020
Принята к публикации 10.03.2020
Аннотация
На основе информации об избыточных энергиях Гиббса смешения для жидкой фазы в форме полиноминального разложения Редлиха–Кистера для соответствующих бинарных систем методом термодинамического моделирования рассчитаны температурные зависимости растворимости никеля, железа, хрома, молибдена и вольфрама в жидком сплаве Sn–20% Li. Также проведена термодинамическая оценка стабильности ряда двойных и тройных оксидов металлов в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ при температурах 500 и 800°С.
ВВЕДЕНИЕ
Развитие технологий, в которых используются легкоплавкие металлы, невозможно без расширения базы исследований физико-химических свойств жидких металлов [1–4].
Жидкие сплавы литий–олово обладают таким набором физико-химических свойств, который делает их привлекательными с точки зрения возможного использования в качестве жидкометаллического компонента капиллярно-пористых систем (КПС) в токамаках [5]. По сравнению с жидким литием, с которого и началась реализация идеи использования жидких металлов при проектировании внутрикамерных компонентов токамака, сплавы Li–Sn характеризуются более низкими значениями давления пара над расплавом [6]. Это может позволить повысить максимально допустимую температуру при их использовании в КПС.
Сплавы Li–Sn стали возможной альтернативой литию, но существует ряд обстоятельств, которые требуют дополнительных исследований для обоснования возможности применения этих сплавов во внутрикамерных компонентах токамака. В частности, одной из таких проблем может оказаться загрязнение плазмы токамака оловом как элементом с высоким значением зарядового числа Z вследствие ионного распыления. При использовании сплавов литий–олово следует учитывать, что олово является одним из наиболее агрессивных жидких металлов по отношению к конструкционным материалам. В частности, в работах [7, 8] отмечается, что олово реагирует со сталями с образованием интерметаллидов FeSn2 и FeSn, вследствие чего жидкое олово или жидкие сплавы, содержащие Sn, не могут использоваться в качестве теплоносителя в контурах, изготовленных из ферритной или аустенитной стали, при температурах, существенно превышающих температуру плавления жидкого сплава. По оценкам авторов работы [8], удовлетворительной коррозионной стойкостью в жидком олове в более широком диапазоне температур должны обладать материалы на основе Mo, W и Re. Результаты кратковременных (1 ч) изотермических коррозионных испытаний образцов аустенитной нержавеющей стали, молибдена и вольфрама [9] также показали, что только Mo и W оказались устойчивыми к воздействию жидкого олова при температурах выше 400°C.
Одним из основных параметров, определяющих кинетику и динамику массообмена в контуре с жидким металлом, является растворимость компонентов конструкционного материала в легкоплавком металле или сплаве. Отсутствие достоверных данных о равновесной растворимости компонентов конструкционных материалов в жидком металле затрудняет определение температурного диапазона применимости этих материалов.
Если несистематизированные данные по растворимости железа, хрома, никеля и молибдена в жидком олове можно найти в литературе, то для растворимости перечисленных выше металлов, а также вольфрама в бинарных расплавах Li–Sn такая информация отсутствует. Экспериментальные работы, в которых имелась бы достоверная информация о растворимости вольфрама в жидком литии и жидком олове также неизвестны, что объясняется чрезвычайно низкими значениями растворимости этого металла практически во всех жидких металлах [10]. Отсутствие надежных термодинамических данных о растворимостях и активностях компонентов конструкционных материалов в расплавах Li–Sn существенно затрудняет понимание механизмов коррозионных процессов в таких системах.
Среди возможных кандидатов для использования во внутрикамерных компонентах токамака рассматриваются сплавы Li–Sn, в которых содержание лития варьируется от 20 до 30 ат. %. В настоящей работе в качестве объекта исследования выбран жидкий сплав с содержанием компонентов 20 ат. % Li и 80 ат. % Sn, для которого в дальнейшем будет использоваться обозначение ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}.$
С помощью термодинамического моделирования сделана попытка расчетным путем получить информацию о растворимостях компонентов конструкционных материалов в расплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ в диапазоне температур, представляющем практический интерес. В качестве таких компонентов рассмотрены следующие металлы: Fe, Ni, Cr, Mo, W. Таким образом, поставленная задача сводится к рассмотрению фазовых равновесий с участием жидкой фазы в определенных диапазонах концентраций в следующих трехкомпонентных системах: Li–Sn–Fe, Li–Sn–Ni, Li–Sn–Cr, Li–Sn–Mo и Li–Sn–W.
Одной из задач настоящей работы является проведение термодинамической оценки влияния температуры и содержания лития в жидком сплаве Li–Sn на стабильность ряда двойных и тройных оксидов в жидкометаллической среде. Как известно, нанесение оксидных (или других керамических) покрытий на внутренние поверхности каналов охлаждения бланкета термоядерного реактора – один из способов преодоления магнитогидродинамических перепадов давления в жидкометаллическом контуре. В последние десятилетия проводятся интенсивные исследования по созданию керамических покрытий, выполняющих функцию барьера от проникновения трития через материалы, из которых предполагается изготавливать трубы контуров и другие поверхности, контактирующие с бланкетом [11].
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
Состояние чистого элемента в твердом состоянии в его стабильной форме при T0 = 298.15 К выбиралось для сравнения в рассматриваемой системе. Энергия Гиббса ${}^{^\circ }{{G}_{i}}(T) - H_{i}^{{{\text{SER}}}}(T)$ для элемента i (i = Li, Sn, Fe, Ni, Cr, Mo, W) в фазе φ описывается следующим уравнением:
Жидкометаллические растворы так же, как и твердые растворы, рассматривались как растворы замещения. Молярная энергия Гиббса $G_{m}^{\varphi }$ раствора (фаза φ) может быть записана в следующем виде:
(1)
$\begin{gathered} G_{m}^{\varphi } - {{H}^{{{\text{SER}}}}} = {}^{{{\text{ref}}}}G + {}^{{{\text{id}}}}{{G}^{\varphi }} + {}^{{xs}}{{G}^{\varphi }}, \\ {}^{{{\text{ref}}}}G = \sum\limits_i {\left( {{{G}_{i}}(T) - H_{i}^{{{\text{SER}}}}({{T}_{0}})} \right){{x}_{i}},} \\ {}^{{{\text{id}}}}{{G}^{\varphi }} = RT\sum\limits_i {{{x}_{i}}\ln ({{x}_{i}}} ),\,\,\,\,{}^{{xs}}{{G}^{\varphi }} = \sum\limits_{i \ne j} {{{x}_{i}}{{x}_{j}}} \times \\ \times \,\,\left[ {L_{{ij}}^{0} + \left( {{{x}_{i}} - {{x}_{j}}} \right)L_{{ij}}^{1} + {{{\left( {{{x}_{i}} - {{x}_{j}}} \right)}}^{2}}L_{{ij}}^{2} + ...} \right], \\ \end{gathered} $В случае, когда в полиноминальном разложении (см. последнее уравнение в (1)) оставляются только члены с коэффициентами $L_{{ij}}^{0}$ и $\,L_{{ij}}^{1}$ и при этом сохраняется зависимость этих коэффициентов от температуры, такая модель раствора называется псевдо-субрегулярной [15, 16]. Тогда последнее уравнение в (1) переписывается в следующем виде:
(2)
${}^{{xs}}{{G}^{\varphi }} = \sum\limits_{i \ne j} {{{x}_{i}}{{x}_{j}}} \left[ {\Omega _{{ij}}^{i}\left( T \right){{x}_{i}} + \Omega _{{ij}}^{j}\left( T \right){{x}_{j}}} \right],$В качестве некоторого преимущества, которое дает использование уравнения (2), следует отметить возможность получения аналитических зависимостей коэффициентов термодинамической активности компонентов металлических растворов в виде функции температуры и состава в случае трехкомпонентной системы $(i,j = 1{\kern 1pt} - {\kern 1pt} 3;\,\,i \ne j).$ В частности, для коэффициента термодинамической активности третьего компонента A3 в системе Li–Sn–A3 справедливо следующее соотношение:
В данном случае A3 = Fe, Ni, Cr, Mo, W.
Поскольку в литературе отсутствуют экспериментальные данные о коэффициентах термодинамической активности таких элементов, как Li, Sn, Fe, Ni, Cr, Mo и W в жидкометаллических расплавах Li–Sn–Fe, Li–Sn–Ni, Li–Sn–Cr, Li–Sn–Mo и Li–Sn–W, для нахождения необходимых термодинамических параметров перечисленных выше трехкомпонентных систем использовались полученные из литературы экспериментальные данные соответствующих бинарных систем.
Величины парных параметров взаимодействия для жидкой фазы в бинарных системах, которые применялись в расчете по уравнениям псевдосубрегулярной модели, приведены в табл. 1.
Таблица 1.
Парные параметры взаимодействия для жидкой фазы в бинарных системах
| Система | Парные параметры, Дж/моль | Диапазон концентраций | Источник |
|---|---|---|---|
| Li–Sn | $\Omega _{{{\text{LiSn}}}}^{{{\text{Li}}}}\left( T \right) = - 1.4252 \times {{10}^{5}} + 22.0141Т$ $\Omega _{{{\text{LiSn}}}}^{{{\text{Sn}}}}\left( T \right) = - 4.936 \times {{10}^{4}} + 0.28945Т$ |
$0 \leqslant {{x}_{{{\text{Li}}}}} \leqslant 0.5$ | [17] |
| Li–Fe | $\Omega _{{{\text{LiFe}}}}^{{{\text{Li}}}} = \Omega _{{{\text{LiFe}}}}^{{{\text{Fe}}}} = 58{\kern 1pt} 059.7 + 44.950Т$ | $0 \leqslant {{x}_{{{\text{Fe}}}}} \leqslant 0.1$ | [18] |
| Sn–Fe | $\Omega _{{{\text{SnFe}}}}^{{{\text{Sn}}}} = 28{\kern 1pt} 659 - 1.7881Т$ $\Omega _{{{\text{SnFe}}}}^{{{\text{Fe}}}} = 20{\kern 1pt} 054{\text{ }} - 1.7881Т$ |
$0 \leqslant {{x}_{{{\text{Fe}}}}} \leqslant 0.25$ | [19] |
| Li–Ni | $\Omega _{{{\text{LiNi}}}}^{{{\text{Li}}}} = \Omega _{{{\text{LiNi}}}}^{{{\text{Ni}}}} = 60{\kern 1pt} 732.8 - 0.8386T$ | $0 \leqslant {{x}_{{{\text{Ni}}}}} \leqslant 0.1$ | [20] |
| Sn–Ni | $\Omega _{{{\text{SnNi}}}}^{{{\text{Sn}}}} = ---87{\kern 1pt} 255 + 280.03Т - 31.934Т1{\text{n}}\left( Т \right)$ $\Omega _{{{\text{SnNi}}}}^{{{\text{Ni}}}} = - 205{\kern 1pt} 955 + 528.66Т - 63.868Т{\text{ln}}\left( Т \right)$ |
$0 \leqslant {{x}_{{{\text{Ni}}}}} \leqslant 0.5$ | [19] |
| Li–Cr | $\Omega _{{{\text{LiCr}}}}^{{{\text{Li}}}} = \Omega _{{{\text{LiCr}}}}^{{{\text{Cr}}}} = 170{\kern 1pt} 966.6 - 52.341T$ | $0 \leqslant {{x}_{{{\text{Cr}}}}} \leqslant 0.1$ | [20] |
| Sn–Cr | $\Omega _{{{\text{SnCr}}}}^{{{\text{Sn}}}} = 37{\kern 1pt} 105 + 8.566T$ $\Omega _{{{\text{SnCr}}}}^{{{\text{Cr}}}} = 21{\kern 1pt} 257 + 1.196Т$ |
$0 \leqslant {{x}_{{{\text{Cr}}}}} \leqslant 0.5$ | [19] |
| Li–Mo* | $\Omega _{{{\text{LiMo}}}}^{{{\text{Li}}}} = \Omega _{{{\text{LiMo}}}}^{{{\text{Mo}}}} = 2.5085 \times {{10}^{5}} - 55.4900Т$ | $0 \leqslant {{x}_{{{\text{Mo}}}}} \leqslant 0.1$ | [21] |
| Sn–Mo | $\Omega _{{{\text{LiMo}}}}^{{{\text{Li}}}} = \Omega _{{{\text{LiMo}}}}^{{{\text{Mo}}}} = 69{\kern 1pt} 000 + 11.72Т$ | $0 \leqslant {{x}_{{{\text{Mo}}}}} \leqslant 0.1$ | [22] |
| Li–W* | $\Omega _{{{\text{LiW}}}}^{{{\text{Li}}}} = \Omega _{{{\text{LiW}}}}^{{\text{W}}} = 219{\kern 1pt} 001.7 - 61.187Т$ | $0 \leqslant {{x}_{{\text{W}}}} \leqslant 0.1$ | [21] |
| Sn–W* | $\Omega _{{{\text{SnW}}}}^{{{\text{Sn}}}} = \Omega _{{{\text{SnW}}}}^{{\text{W}}} = 244{\kern 1pt} 970.5 - 62.367Т$ | $0 \leqslant {{x}_{{\text{W}}}} \leqslant 0.1$ | [21] |
* Теоретическая оценка по модели А. Миедемы [21].
Представленные в табл. 1 температурные зависимости парных параметров взаимодействия являются результатом применения уравнений регрессионной модели к массиву экспериментальных данных, относящихся к конкретной бинарной системе, включая информацию, полученную из соответствующих фазовых диаграмм [10]. Метод оптимизации, разработанный авторами работы [23], использовался при получении полиномиальных выражений избыточной энергии Гиббса как функции состава и температуры для всех исследуемых здесь бинарных систем.
Если рассматривать диаграммы бинарных систем Fe–Sn, Ni–Sn, Cr–Sn, Mo–Sn и Sn–W, то только для двух последних из перечисленных характерно отсутствие областей растворимости более тугоплавкого металла в жидком олове (рис. 1 и 2). Как видно из диаграммы состояния Sn–W (рис. 2), эта система относится к классу систем с практически полным отсутствием взаимодействия между компонентами в твердом и жидком состояниях, что заметно выделяет ее среди других рассматриваемых здесь бинарных систем, в которых помимо областей взаимной растворимости еще зафиксировано образование промежуточных фаз [10].
Также в качестве исходных данных для расчетов в настоящей работе использовались полученные из анализа экспериментальных данных температурные зависимости растворимости металлов в жидком литии и жидком олове (табл. 2).
Таблица 2.
Температурная зависимость растворимости металлов (мол. дол.) в жидком литии и жидком олове при 673–1173 К
| Металл | Растворитель | Источник | |
|---|---|---|---|
| Li | Sn | ||
| Fe | $x_{{{\text{Fe(Li}})}}^{{{\text{sat}}}} = \exp (5.409 - 6.987 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | $x_{{{\text{Fe(Sn}})}}^{{{\text{sat}}}} = \exp (3.974 - 8.001 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | [18, 26] |
| Cr | $x_{{{\text{Cr(Li}})}}^{{{\text{sat}}}} = \exp (6.299 - 20.57 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | $x_{{{\text{Cr(Sn}})}}^{{{\text{sat}}}} = \exp (4.053 - 8.474 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | [20, 27] |
| Ni | $x_{{{\text{Ni(Li}})}}^{{{\text{sat}}}} = \exp (0.1009 - {{7.308 \times {{{10}}^{3}}} \mathord{\left/ {\vphantom {{7.308 \times {{{10}}^{3}}} T}} \right. \kern-0em} T})$ | $x_{{{\text{Ni(Sn}})}}^{{{\text{sat}}}} = \exp (2.335 - 5.523 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | [20, 28] |
| Mo | $x_{{{\text{Mo(Li}})}}^{{{\text{sat}}}} = \exp (6.678 - 30.19 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | $x_{{{\text{Mo(Sn}})}}^{{{\text{sat}}}} = \exp (1.203 - 12.89 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | [21]*, [22] |
| W | $x_{{{\text{W(Li}})}}^{{{\text{sat}}}} = \exp (7.363 - 26.35 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | $x_{{{\text{W(Sn}})}}^{{{\text{sat}}}} = \exp (7.505 - 29.48 \times {{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} T}} \right. \kern-0em} T})$ | [21]* |
Как результат термодинамического моделирования ниже приводятся полученные зависимости предельных растворимостей Fe, Ni, Cr, Mo и W в расплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ в диапазоне температур 623–1173 К:
(3)
$\begin{gathered} x_{{{\text{Fe}}}}^{{{\text{sat}}}} = \exp \left( {2.851 - \frac{{9951}}{T}} \right), \\ x_{{{\text{Ni}}}}^{{{\text{sat}}}} = \exp \left( {3.330 - \frac{{9746}}{T}} \right), \\ x_{{{\text{Cr}}}}^{{{\text{sat}}}} = \exp \left( {3.794 - \frac{{11{\kern 1pt} 520}}{T}} \right), \\ x_{{{\text{Mo}}}}^{{{\text{sat}}}} = \exp \left( {2.612 - \frac{{18{\kern 1pt} 260}}{T}} \right), \\ x_{{\text{W}}}^{{{\text{sat}}}} = \exp \left( { - 8.0 \times {{{10}}^{{ - 4}}} - \frac{{23{\kern 1pt} 940}}{T}} \right). \\ \end{gathered} $Из представленных на рис. 3 и 4 зависимостей следует, что из пяти переходных металлов, исследуемых в настоящей работе, никель обладает наибольшей растворимостью в расплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ в указанном диапазоне температур. Результаты термодинамического моделирования показывают, что из рассмотренных металлов только Mo и W характеризуются приемлемыми уровнями растворимости в ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ при температурах выше 600°C.
Рис. 3.
Температурные зависимости растворимости хрома (1), железа (2) и никеля (3) в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}},$ полученные в результате термодинамического моделирования, и растворимости Fe в ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}},$ рассчитанной по модели, в которой бинарный растворитель рассматривался как идеальный (4), а также растворимости Fe в жидком олове (5) по данным [26] (эксперимент).

Рис. 4.
Температурные зависимости растворимости вольфрама (1) и молибдена (2) в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}},$ полученные в результате термодинамического моделирования, а также растворимости Mo в жидком олове (3) по данным [22] (эксперимент).
Можно оценить, как отклонение жидкой фазы в какой-либо из рассматриваемых здесь трехкомпонентных систем от идеального поведения повлияло на величину растворимости компонента конструкционных материалов в жидкометаллическом расплаве. Остановимся, например, на системе Li–Sn–Fe и выберем в качестве такой фазы разбавленный раствор железа в жидкой фазе Li–Sn, в которой мольные доли компонентов удовлетворяют соотношению ${{x}_{{{\text{Li}}}}}:{{x}_{{{\text{Sn}}}}}$ = $20:80.$ Если предположить, что раствор лития в олове является идеальным, то, в соответствии с [29], для оценки растворимости Fe в расплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ применимо следующее уравнение:
(4)
$\ln x_{{{\text{Fe(Li}} - {\text{Sn}})}}^{{{\text{sat}}}} = {{x}_{{{\text{Li}}}}}\ln x_{{{\text{Fe(Li)}}}}^{{{\text{sat}}}} + {{x}_{{{\text{Sn}}}}}\ln x_{{{\text{Fe(Sn)}}}}^{{{\text{sat}}}},$Расчет по уравнению (4) приводит к завышенным значениям (рис. 3) растворимости железа в сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ по сравнению с данными, полученными в результате строгого термодинамического моделирования (3). Это представляется вполне объяснимым, если принять во внимание, что жидкие сплавы системы Li–Sn принадлежат к классу расплавов с сильным химическим взаимодействием компонентов, для которых характерны значительные отрицательные отклонения от идеального поведения [17]. Следует отметить, что растворимость Fe в ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ даже при 1000°С не превышает 2 ат. %. Рассматривая трехкомпонентный раствор Li–Sn–Fe с позиции модели центрального атома [30, 31], можно отметить особенность системы Li–Sn $\left( {{{\gamma }_{{{\text{Li}}}}} \ll 1} \right).$ Она определенно указывает на то, что в растворе существует тенденция к образованию таких атомных группировок22, в которых в первой координационной сфере вокруг атома Sn преимущественно располагаются атомы Li. Соответственно, снижается доля атомных группировок, в которых в первой координационной сфере вокруг атома Sn преимущественно располагаются атомы Fe, и, таким образом, в реальном расплаве Li–Sn–Fe уменьшается величина $x_{{{\text{Fe(Li}} - {\text{Sn}})}}^{{{\text{sat}}}}$ по сравнению с тем уровнем растворимости, который мог бы иметь место в случае, если жидкий раствор Li–Sn по своим свойствам можно было бы считать идеальным.
Об исследованиях совместимости конструкционных материалов с жидкими сплавами Li–Sn из литературы известно крайне мало. О высоком уровне растворимости Fe в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ сообщают авторы работы [33], в которой изучалась коррозия ферритно-мартенситной стали JLF-1 (Fe–9Cr–2W–0.1C) в сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ при 600°С. Эти данные хорошо согласуются с результатами настоящей работы, из которых следует, что по такому параметру, как растворимость основных компонентов конструкционных материалов, жидкий сплав ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ близок к жидкому олову.
Рассматривая настоящие расчеты (рис. 3 и 4) с точки зрения их возможного практического применения к промышленным сплавам на основе молибдена и вольфрама, необходимо учитывать влияние химических реакций между оксидами этих тугоплавких металлов и оксидом лития на процесс растворения компонентов конструкционного материала в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}.$ Возможность протекания таких реакций не может быть исключена, поскольку присутствие небольшого количества оксидов по границам зерен и на поверхности сплавов непосредственно связано с современными технологиями получения этих материалов. Из анализа литературы следует, что в качестве наиболее термодинамически стабильных соединений среди других сложных оксидов, являющихся продуктами реакций с участием простых оксидов тугоплавких металлов и ${\text{L}}{{{\text{i}}}_{2}}{\text{O,}}$ в системах Li–Mo–O и Li–W–O можно рассматривать ${\text{L}}{{{\text{i}}}_{2}}{\text{Mo}}{{{\text{O}}}_{4}}$ и ${\text{L}}{{{\text{i}}}_{2}}{\text{W}}{{{\text{O}}}_{4}}.$ В [34] показана возможность образования сложного оксида лития и молибдена в результате следующей реакции:
ТЕРМОДИНАМИКА ВЗАИМОДЕЙСТВИЯ ЖИДКИХ СПЛАВОВ Li–Sn С БИНАРНЫМИ И ТРОЙНЫМИ ОКСИДАМИ МЕТАЛЛОВ
Для решения ряда вопросов (см. Введение), связанных с возможным использованием жидких сплавов Li–Sn в жидкометаллических системах токамаков, возникает потребность в прогнозировании химической стабильности керамических материалов при контакте с этими сплавами. Термодинамический анализ взаимодействий между сплавом Li–Sn и тройными оксидами металлов (в состав которых входит литий) также представляет практический интерес, поскольку тройные оксиды, как известно из работ по изучению процессов с участием жидких сплавов ${\text{L}}{{{\text{i}}}_{{17}}}{\text{P}}{{{\text{b}}}_{{83}}},$ могут являться продуктами коррозионных процессов при контакте конструкционных материалов с жидкими металлами [37].
Из литературы известна только одна работа [33], посвященная изучению коррозионного поведения конструкционных материалов в жидких сплавах Li–Sn. Некоторый опыт при исследовании растворов водорода в расплавах литий–олово [38], а также наличие общих черт, характерных для диаграмм состояния двух бинарных систем Li–Sn и Li–Pb, указывает на то, что именно кислород в расплаве Li–Sn, несмотря на свою чрезвычайно низкую растворимость, является той примесью, значение термодинамического потенциала которой определяет направление протекания многих химических процессов в этой жидкометаллической среде. В этом сплавы Li–Sn близки к сплавам системы Li–Pb и отличаются от жидкого лития, в котором роль коррозионно-активной примеси принадлежит азоту [39, 40].
В двухкомпонентном расплаве Li–Sn именно химическая активность лития как одного из компонентов расплава определяет термодинамику и кинетику взаимодействия этого сплава с оксидами других металлов, включая и тройные оксиды с участием лития. Это объясняется достаточно просто, если принять во внимание, что оксид лития Li2O является высокостабильным соединением, которое характеризуется значительной по абсолютной величине отрицательной стандартной энергией Гиббса образования соединения ${{\Delta }_{f}}G_{{298}}^{0}(L{{i}_{2}}O)$ = = $ - 561.2\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {(г\,\, - \,\,атом\,\,кислорода)}}} \right. \kern-0em} {(г\,\, - \,\,атом\,\,кислорода)}}.$ Олово образует существенно менее стабильный, с точки зрения термодинамики, оксид SnO2, для которого ${{\Delta }_{f}}G_{{298}}^{0}(Sn{{O}_{2}})$ = $ - 259.9\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {(г}}} \right. \kern-0em} {(г}}$ – атом кислорода).
Термодинамический анализ взаимодействий между жидкими сплавами Li–Sn и оксидами металлов существенно облегчается, если использовать методику, предложенную в [39] для прогнозирования совместимости различных керамик с эвтектическим расплавом ${\text{L}}{{{\text{i}}}_{{17}}}{\text{P}}{{{\text{b}}}_{{83}}}.$ Сделать обоснованный прогноз о том, будет ли тот или иной оксид стабилен при контакте с жидким сплавом Li–Sn, можно, рассчитав изменение энергии Гиббса ${{\Delta }_{r}}G$ реакции одного из двух типов. В первом случае, когда исследуется совместимость двойного оксида ${{{\text{M}}}_{x}}{{{\text{O}}}_{y}}$ с расплавом ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}},$ рассматривается следующая реакция:
(5)
${{{\text{M}}}_{x}}{{{\text{O}}}_{y}}\xrightarrow{{{\text{жидкий}}\,\,{\text{сплав}}\,\,{\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}}}y{{{\text{O}}}_{{\left( {{\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}} \right)}}} + x{\text{M,}}$(6)
$\begin{gathered} {{\Delta }_{r}}G = ({1 \mathord{\left/ {\vphantom {1 x}} \right. \kern-0em} x})[y{{\Delta }_{f}}{{G}^{0}}({\text{L}}{{{\text{i}}}_{2}}{\text{O}}) - 2yRT\ln ({{a}_{{{\text{Li}}}}}) + \\ + \,\,2yRT\ln ({{{{x}_{{\text{O}}}}} \mathord{\left/ {\vphantom {{{{x}_{{\text{O}}}}} {x_{{\text{O}}}^{{{\text{sat}}}}}}} \right. \kern-0em} {x_{{\text{O}}}^{{{\text{sat}}}}}}) - {{\Delta }_{f}}{{G}^{0}}({{{\text{M}}}_{x}}{{{\text{O}}}_{y}})], \\ \end{gathered} $Во втором случае для оценки стабильности тройного оксида ${\text{L}}{{{\text{i}}}_{w}}{{{\text{M}}}_{x}}{{{\text{O}}}_{y}}$ при контакте с жидким ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ необходимо рассмотреть следующую реакцию:
(7)
$\begin{gathered} {\text{L}}{{{\text{i}}}_{w}}{{{\text{M}}}_{x}}{{{\text{O}}}_{y}}\xrightarrow{{{\text{жидкий}}\,\,{\text{сплав}}\,\,{\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}}} \\ \to y{{{\text{O}}}_{{\left( {{\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}} \right)}}} + w{\text{L}}{{{\text{i}}}_{{\left( {{\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}} \right)}}} + x{\text{M,}} \\ \end{gathered} $(8)
$\begin{gathered} {{\Delta }_{r}}G = \left( {{1 \mathord{\left/ {\vphantom {1 x}} \right. \kern-0em} x}} \right)\left[ {y{{\Delta }_{f}}{{G}^{0}}\left( {{\text{L}}{{{\text{i}}}_{2}}{\text{O}}} \right) - \left( {2y - w} \right)RT} \right. \times \\ \times \,\,\left. {\ln ({{a}_{{{\text{Li}}}}}) + 2yRT\ln \left( {{{{{x}_{{\text{O}}}}} \mathord{\left/ {\vphantom {{{{x}_{{\text{O}}}}} {x_{{\text{O}}}^{{{\text{sat}}}}}}} \right. \kern-0em} {x_{{\text{O}}}^{{{\text{sat}}}}}}} \right) - {{\Delta }_{f}}{{G}^{0}}\left( {{\text{L}}{{{\text{i}}}_{w}}{{{\text{M}}}_{x}}{{{\text{O}}}_{y}}} \right)} \right]. \\ \end{gathered} $В обоих случаях получаемые по уравнениям (6) и (8) значения ${{\Delta }_{r}}G$ отнесены к одному молю металла M. При проведении расчетов по обоим уравнениям использовалась следующая зависимость термодинамической активности лития в жидком ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}{\text{:}}$
(9)
${{a}_{{{\text{Li}}}}} = \exp ( - 0.91789 - {{6674.64} \mathord{\left/ {\vphantom {{6674.64} T}} \right. \kern-0em} T}).$Формула (9) является уравнением регрессии, полученным на основании обработки большого массива экспериментальных данных для Li–Sn, систематизированных в обзоре [17].
Следует отметить, что данные о растворимости кислорода в двойных сплавах Li–Sn в литературе отсутствуют. Однако, исходя из уже отмеченного сходства между двумя системами Li–Sn и Li–Pb, а также учитывая низкие значения растворимости кислорода в двух жидких металлах Li, Sn и сплаве ${\text{L}}{{{\text{i}}}_{{17}}}{\text{P}}{{{\text{b}}}_{{83}}}$ (при 700°С для Sn $x_{{\text{O}}}^{{{\text{sat}}}}$ = 4.1 × × ${{10}^{{ - 5}}}\,\,{\text{мол}}{\text{.}}\,\,{\text{дол}}{\text{.,}}$ для Li $x_{{\text{O}}}^{{{\text{sat}}}} = 2.0 \times {{10}^{{ - 3}}}\,\,{\text{мол}}{\text{.}}\,\,{\text{дол}}{\text{.,}}$ для ${\text{L}}{{{\text{i}}}_{{17}}}{\text{P}}{{{\text{b}}}_{{83}}}$ $x_{{\text{O}}}^{{{\text{sat}}}} = 3.0 \times {{10}^{{ - 7}}}\,\,{\text{мол}}{\text{.}}\,\,{\text{дол}}{\text{.}}$) [39, 41], можно предположить, что растворимость кислорода в ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ будет также низкой. Таким образом, в реальных условиях, близких к условиям функционирования жидкометаллических систем энергетических установок, раствор кислорода в жидком ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ близок к насыщенному, когда рассматриваемый расплав находится в равновесии с кристаллами Li2O. Это позволяет при проведении вычислений по уравнениям (6) и (8) принять отношение ${x \mathord{\left/ {\vphantom {x {{{x}_{{{\text{sat}}}}}}}} \right. \kern-0em} {{{x}_{{{\text{sat}}}}}}}$ равным единице.
В качестве источника данных об энтальпиях и энтропиях образования оксидов металлов использовалось справочное издание [42].
Поскольку при проектировании внутрикамерных компонентов токамака в качестве возможного жидкометаллического компонента рассматриваются и жидкий литий, и сплавы Li–Sn, то представляется полезным провести сравнение результатов термодинамической оценки стабильности керамик в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ с аналогичными оценками для тех же керамик в среде жидкого лития.
В отличие от оценок, проводимых для сплавов Li–Sn, в том случае, когда оценивается стабильность соединений в среде жидкого лития, расчеты ${{\Delta }_{r}}G$ соответствующей реакции следует проводить при концентрации кислорода в литии, отличной от концентрации насыщения. Так же как это было сделано авторами работы [39], в настоящей работе ${{\Delta }_{r}}G$ рассчитывались при значении концентрации кислорода в литии, которое в жидкометаллическом контуре обеспечивается работой холодной ловушки, функционирующей при температуре 473 К (это соответствует ${{x}_{{\text{O}}}} = x_{{\text{O}}}^{{{\text{CT}}}}(473)$ ≈ ≈ $3.21 \times {{10}^{{ - 6}}}\,\,{\text{мол}}{\text{.}}\,\,{\text{дол}}{\text{.}}$). Также учитывалось, что в сильно разбавленных растворах лития можно принять ${{a}_{{{\text{Li}}}}} = 1.$ С учетом этих замечаний при рассмотрении реакций (5) и (7) в среде жидкого лития уравнения (6) и (8) должны быть преобразованы к следующему виду:
Результаты расчета ${{\Delta }_{r}}G$ для обеих жидкометаллических сред приведены в табл. 3. Положительные значения ${{\Delta }_{r}}G$ свидетельствуют о стабильности оксида при контакте с жидкометаллическим расплавом, и, наоборот, в случае отрицательных величин ${{\Delta }_{r}}G$ следует ожидать, что равновесие в реакциях (5) и (7) будет смещаться вправо, т.е. будет проходить процесс восстановления оксида до металла.
Таблица 3.
Энергия Гиббса ${{\Delta }_{r}}G$ реакций между различными оксидами и жидким литием и сплавом ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ при температурах 773 и 1073 К (в кДж на моль металла)
| Соединение | ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$, насыщенный по кислороду | Li, содержащий ${{x}_{{\text{O}}}} \approx 3.21 \times {{10}^{{ - 6}}}\;$ мол. дол. O (холодная ловушка при 473 К) | ||
|---|---|---|---|---|
| 773 К | 1073 К | 773 К | 1073 К | |
| Y2O3 | 275.0 | 299.0 | 38.3 | 2.8 |
| Sc2O3 | 276.4 | 300.1 | 39.7 | 3.9 |
| Er2O3 | 270.8 | 294.2 | 34.0 | –2.0 |
| BeO | 158.9 | 175.1 | 1.1 | –22.3 |
| LiAlO2 | 228.7 | 259.6 | –25.5 | –71.8 |
| Al2O3 | 154.9 | 176.5 | –81.8 | –119.7 |
| Li2Si2O5 | 95.9 | 135.6 | –237.2 | –294.5 |
| LiCrO2 | –18.3 | 18.6 | –272.6 | –312.7 |
| Cr2O3 | –95.7 | –65.8 | –332.4 | –362.1 |
| LiVO3 | –210.6 | –160.2 | –622.6 | –689.0 |
| Fe2O3 | –257.0 | –229.6 | –493.7 | –525.8 |
| NiO | –207.8 | –190.4 | –365.6 | –387.9 |
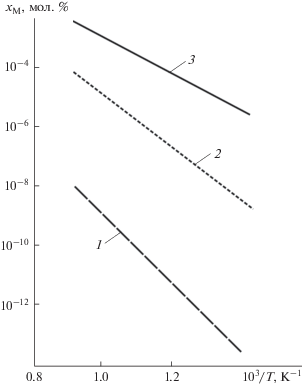
Рис. 5 показывает, как при увеличении содержания лития в бинарном расплаве Li–Sn изменяется энергия Гиббса ${{\Delta }_{r}}G$ реакций между Er2O3, Cr2O3, LiCrO2, с одной стороны, и расплавами Li–Sn, с другой. Выбор температуры 800°С для построения концентрационной зависимости ${{\Delta }_{r}}G$ обусловлен тем, что при температурах ниже 783°С рассматриваемая бинарная система не находится полностью в жидком состоянии, поскольку в ней зафиксировано образование интерметаллического соединения Li7Sn2 [17]. Значения энергии Гиббса реакций получены для расплавов Li–Sn, насыщенных по кислороду (${x \mathord{\left/ {\vphantom {x {{{x}_{{{\text{sat}}}}}}}} \right. \kern-0em} {{{x}_{{{\text{sat}}}}}}} = 1$). Стабильность оксидов уменьшается с увеличением содержания лития в сплаве (рис. 5).
Рис. 5.
Зависимость изменения энергии Гиббса реакции между оксидами металлов и насыщенными по кислороду жидкими сплавами Li–Sn от содержания лития в бинарном расплаве: 1 – Cr2O3, 2 – LiCr2O3, 3 – Er2O3.

Как видно из табл. 3, при повышении температуры стабильность керамик в сплавах ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}},$ насыщенных по кислороду, возрастает, о чем свидетельствует увеличение значений ${{\Delta }_{r}}G$ для всех рассмотренных здесь соединений. Точно такая же закономерность отмечена в работе [39], в которой оценивалась стойкость оксидов металлов в жидком сплаве ${\text{L}}{{{\text{i}}}_{{17}}}{\text{P}}{{{\text{b}}}_{{83}}}.$ В обеих системах это можно объяснить тем, что при повышении температуры содержание кислорода в жидкой фазе увеличивалось, чтобы обеспечить выполнение условия ${x \mathord{\left/ {\vphantom {x {{{x}_{{{\text{sat}}}}}}}} \right. \kern-0em} {{{x}_{{{\text{sat}}}}}}} = 1.$
Из вычислений следует, что в насыщенном кислородом жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ большинство двойных оксидов металлов (например, Y2O3, Al2O3, Er2O3, BeO) стабильны в отношении восстановления до металла и только некоторые (например, Cr2O3, Fe2O3, NiO) не стабильны. Значения ${{\Delta }_{r}}G$ для реакций между оксидами металлов и литием реакторной чистоты (очищенным холодной ловушкой при 473 К) свидетельствуют о том, что только небольшая часть из всех рассмотренных соединений (Y2O3, Er2O3, Sc2O3) стабильны в жидком литии при температурах 773 К и 1073 К.
Известна более ранняя работа [43] по прогнозированию стабильности различных керамик в бинарном расплаве Li–25% Sn, но, как отмечено самими авторами [43], в их расчетах вместо термодинамических данных для системы Li–Sn использовались приближенные оценки. Получение более достоверных прогнозных оценок о стабильности керамик в жидком сплаве Li–Sn стало возможным в настоящей работе благодаря использованию концентрационных и температурных зависимостей термодинамической активности лития в бинарной системе Li–Sn, полученных из анализа экспериментальных работ [17, 44].
ЗАКЛЮЧЕНИЕ
На основе информации об энергиях Гиббса компонентов в различных фазах бинарных систем, а также с использованием базы термодинамических данных для чистых элементов методом термодинамического моделирования рассчитаны температурные зависимости для растворимости никеля, железа, хрома, молибдена и вольфрама в жидком сплаве Sn–20% Li. Среди рассмотренных переходных металлов только Mo и W характеризуются приемлемыми уровнями растворимости в ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ при температурах выше 600°C. Результаты расчетов хорошо согласуются с известными из литературы данными коррозионных испытаний ферритно-мартенситной стали JLF-1 (Fe–9Cr–2W–0.1C) в сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}.$
Анализ результатов расчета энергии Гиббса реакций между оксидами металлов и жидкими сплавами Li–Sn позволил оценить влияние температуры и содержания лития в сплаве на стабильность некоторых керамик в жидкометаллической среде. С учетом низких значений растворимости кислорода в расплавах литий–олово, решения приводились для условий, близких к условиям функционирования жидкометаллических систем энергетических установок, когда раствор кислорода в жидком сплаве Li–Sn близок к насыщенному по этому химическому элементу.
Сравнение результатов термодинамической оценки стабильности керамик в жидком сплаве ${\text{L}}{{{\text{i}}}_{{20}}}{\text{S}}{{{\text{n}}}_{{80}}}$ с аналогичными оценками для тех же керамик в среде жидкого лития показало, что количество оксидов, подверженных разложению при взаимодействии с жидким литием, существенно превышает число соединений, которые будут восстанавливаться до металла в расплаве Li–20% Sn. Отличия в поведении оксидных керамик в этих двух жидкометаллических средах связано с отрицательными отклонениями жидких растворов системы Li–Sn от идеальности, о чем свидетельствуют низкие значения термодинамической активности лития в данных растворах.
Статья подготовлена в рамках выполнения базовой части государственного задания ФГБОУ ВО “Московский политехнический университет” (проект FZRR-2020-027).
Список литературы
Асхадуллин Р.Ш., Мартынов П.Н., Рачков В.И. и др. Контроль и регулирование содержания кислорода в тяжелых жидкометаллических теплоносителях для противокоррозионной защиты сталей // ТВТ. 2016. Т. 54. № 4. С. 595.
Алчагиров Б.Б., Дышекова Ф.Ф. Поверхностное натяжение расплавов свинец-висмутовой эвтектики с литием // ТВТ. 2016. Т. 54. № 6. С. 866.
Круглов А.Б., Круглов В.Б., Рачков В.И. и др. Методика измерения теплопроводности жидкого свинца в диапазоне температур 350–1000°C // ТВТ. 2015. Т. 53. № 4. С. 596.
Красин В.П., Союстова С.И. Оценка параметров коррозионных процессов в эвтектическом расплаве Na–K с использованием моделей металлических растворов // ТВТ. 2018. Т. 56. № 4. С. 533.
Tabarés F.L., Oyarzabal E., Martin-Rojo A.B., Tafalla D., de Castro A., Soleto A. Reactor Plasma Facing Component Designs Based on Liquid Metal Concepts Supported in Porous Systems // Nuclear Fusion. 2017. V. 57. № 1. https://doi.org/10.1088/0029-5515/57/1/016029
Красин В.П., Союстова С.И. Термодинамические параметры сплавов литий–олово, важные с точки зрения их использования в токамаках // ТВТ. 2019. Т. 57. № 2. С. 212.
Weeks J.R. Lead, Bismuth, Tin, and Their Alloys as Nuclear Coolants // Nucl. Eng. Des. 1971. V. 15. P. 363.
Fütterer M.A., Aiello G., Barbier F., Giancarli L., Poitevin Y., Sardain P., Szczepanski J., Puma A.L., Ruvutuso G., Vella G. On the Use of Tin–Lithium Alloys as Breeder Material for Blankets of Fusion Power Plants // J. Nucl. Mater. 2000. V. 283–287. P. 1375.
Vertkov A., Lyublinski I., Zharkov M., Mazzitelli G., Apicella M.L., Iafrati M. Liquid Tin Limiter for FTU Tokamak // Fusion Eng. Des. 2017. V. 117. P. 130.
Binary Alloy Phase Diagrams. 2nd ed. / Ed. Massalski T.B. In 3 vols. Materials Park, Ohio, USA: ASM International, 1990. 3589 p.
Levchuk D., Levchuk S., Maier H., Bolt H., Suzuki A. Erbium Oxide as a New Promising Tritium Permeation Barrier // J. Nucl. Mater. 2007. V. 367–370. P. 1033.
SGTE Unary Database. Version 4.4. 20 July 2001. http://www.sgte.org
Redlich E., Kister A.K. Algebraic Representation of Thermodynamic Properties and the Classification of Solutions // Industr. Eng. Chem. 1948. V. 40. P. 345.
Lukas H., Fries S.G., Sundman B. Computational Thermodynamics: The Calphad Method. Cambridge. UK: Cambridge University Press., 2007. 324 p.
Kaufman L., Bernstein H. Computer Calculation of Phase Diagrams. N.Y.: Acad. Press Inc., 1970. 334 p.
Алпатов А.В., Падерин С.Н. Модели и расчеты жидких металлических растворов. Металлы. 2009. № 5. С. 21.
Morachevskii A.G. Thermodynamic Properties and Electrochemical Studies of Lithium–Tin Alloys // Rus. J. Appl. Chem. 2015. V. 88. P. 1087.
Leavenworth H., Cleary R.E., Bratton W.D. Solubility of Structural Metals in Lithium. Tech. Rep. PWAC-356. Middletown. CT. USA: Pratt and Whitney Aircraft, 1961.
Heuzey M.C., Pelton A. Critical Evaluation and Optimization of the Thermodynamic Properties of Liquid Tin Solutions // Metall. Trans. B. 1996. V. 27B. P. 810.
Lyublinski I.E., Evtikhin V.A., Pankratov V.Yu., Krasin V.P. Numerical and Experimental Determination of Metallic Solubilities in Liquid Lithium, Lithium Containing Nonmetallic Impurities, Lead and Lead–Lithium Eutectic // J. Nucl. Mater. 1995. V. 224. № 3. P. 288.
Niessen A.K., de Boer F.R., Miedema A.R. Model Predictions for the Enthalpy of Formation of Transition Metal Alloys II // CALPHAD. 1983. V. 7. № 1. P. 51.
Kawabata R., Myochin M., Iwase M. Solubilities of Molybdenum in Liquid Tin // Metall. Trans. B. 1995. V. 26B. P. 654.
Bale C.W., Pelton A.D. Optimization of Binary Thermodynamic and Phase Diagram Data // Metall. Trans. B. 1983. V. 14B. P. 77.
Brewer L., Lamoreaux R.H. The Mo–Sn (Molybdenum–Tin) System // Bull. Alloy Phase Diagrams. 1980. V. 1. № 2. P. 96.
Williams M.E., Moon K.W., Boettinger W.J., Josell D., Deal A.D. Hillock and Whisker Growth on Sn and SnCu Electrodeposits on a Substrate Not Forming Interfacial Intermetallic Compounds // J. Electr. Mater. 2007. V. 36. P. 214.
Kubaschewski O. Iron Binary Phase Diagrams. Berlin–Heidelberg: Springer, GmbH, 1982. 185 p.
Venkatraman M., Neumann J.P. The Cr–Sn (Chromium–Tin) System // Bull. Alloy Phase Diagrams. 1988. V. 9. P. 161.
Pashechko M.I., Vasyliv Kh.B. Solubility of Metals in Fusible Melts // Mater. Sci. 1996 V. 31. P. 485.
O’Connell J.P., Prausnitz J.M. Thermodynamics of Gas Solubility in Mixed Solvents // Industr. Eng. Chem. Fundamentals. 1964. V. 3 .P. 347.
Saboungi M.-L., Caveny D., Bloom I., Blander M. The Coordination Cluster Theory: Extension to Multicomponent Systems // Metallurgical Trans. A. 1987. V. 18. P. 1779.
Krasin V.P., Soyustova S.I., Lyublinskii I.E. Coordination Cluster Model for Calculating Sievert’s Constant of Hydrogen Solutions in Melts of the Pb–Bi–Li System // Inorganic Mater.: Appl. Res. 2010. V. 1. P. 324.
Островский О.И., Григорян В.А., Вишкарев А.Ф. Свойства металлических расплавов. М.: Металлургия, 1988. 304 с.
Kondo M., Ishii M., Muroga T. Corrosion of Steels in Molten Gallium (Ga), Tin (Sn) and Tin Lithium Alloy (Sn–20Li) // Fusion Eng. Des. 2015. V. 98–99. P. 2003.
Shukla N.K., Prasad R., Roy K.N., Sood D.D. Thermochemistry of Lithium Chromate Li2CrO4(cr) and Lithium Molybdate Li2MoO4(cr) // J. Chem. Thermodyn. 1992. V. 24. P. 897.
Sharma S., Choudhary R.P.N. Phase Transition in Li2WO4 // Ferroelectrics. 1999. V. 234. P. 129.
Borgstedt H.U., Guminski C. Solubilities and Solution Chemistry in Liquid Alkali Metals // Monatshefte für Chemie. 2000. Bd. 131. S. 917.
Sample T., Coen V., Kolbe H., Orecchia L. Selective Surface Preoxidation to Inhibit the Corrosion of AISI Type 316L Stainless Steel by Liquid Pb–17Li // J. Nucl. Mater. 1992. V. 191–194. P. 979.
Schumacher R., Weiss A. Hydrogen Solubility in the Liquid Alloys Lithium–Indium, Lithium–Lead, and Lithium–Tin // Ber. Bunsenges. Phys. Chem. 1990. V. 94. P. 684.
Hubberstey P. Pb–17Li and Lithium: A Thermodynamic Rationalisation of Their Radically Different Chemistry // J. Nucl. Mater. 1997. V. 247. P. 208.
Krasin V.P., Soyustova S.I. Thermodynamic Analysis of Chromium Solubility Data in Liquid Lithium Containing Nitrogen: Comparison between Experimental Data and Computer Simulation // J. Nucl. Mater. 2015. V. 465. P. 674.
Fromm E., Gebhardt E. Gase und Kohlenstoff in Metallen. Berlin: Springer. 1976. 747 p.
Chase M.W. Jr. NIST-JANAF Thermochemical Tables. Fourth Edition // J. Phys. Chem. Ref. Data. Monograph № 9. 1998. 1951 p.
Sharafat S., Ghoniem N., Zinkle S. Thermodynamic Stability of Qxide, Nitride, and Carbide Coating Materials in Liquid Sn–25Li // J. Nucl. Mater. 2004. V. 329–333. P. 1429.
Du Z., Jiang Z., Guo C. Thermodynamic Optimizing of the Li–Sn System // Z. Metallkd. 2006. V. 97. P. 10.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур




