Теплофизика высоких температур, 2020, T. 58, № 3, стр. 344-354
Скорость ультразвука в расслаивающихся солевых расплавах на линии насыщения
В. П. Степанов *
Институт высокотемпературной электрохимии УрО РАН
г. Екатеринбург, Россия
* E-mail: v.stepanov@ihte.uran.ru
Поступила в редакцию 23.08.2019
После доработки 09.12.2019
Принята к публикации 24.12.2019
Аннотация
Исследовано распространение звуковых колебаний в двухфазных расплавленных смесях галогенидов щелочных металлов друг с другом и с галогенидами серебра. Описаны особенности экспериментальной установки и методики измерений скорости звука при высоких температурах. Экспериментальные данные представлены в виде таблиц и графиков. Приведены критические показатели смешивания систем. Результаты обсуждаются с позиций модели заряженных твердых сфер произвольного диаметра.
ВВЕДЕНИЕ
В представленной работе приведены результаты исследования довольно редкого для смесей галогенидов щелочных металлов между собой и с галогенидами серебра явления − ограниченной смешиваемости компонентов в жидком состоянии. Учитывая известный принцип полной совместимости подобного с подобным, можно считать явление редким, поскольку данные соли являются наиболее яркими представителями систем с преимущественно кулоновским характером взаимодействия составляющих их частиц [1]. В связи с этим возникает масса вопросов о причинах и закономерностях сегрегации, характере изменения физико-химических свойств сосуществующих фаз на линии насыщения, типе критичности и зависимости критических показателей от параметров системы.
До сих пор представления о проявлении ионного типа межчастичного взаимодействия в равновесии жидкость–жидкость базировались на результатах исследования фазовых диаграмм, поглощения и рассеяния света растворами (в полярных растворителях) плавящихся при комнатной температуре солей с органическим катионом и неорганическим анионом (ионных жидкостей [2]). Многолетняя дискуссия в отношении типа критичности этих систем, содержащаяся в обзорах [3–7], не привела к единой точке зрения. Для одних систем найдено среднеполевое (классическое) поведение, тогда как в других системах наблюдается изинговая (Ising) критичность.
Важным источником информации об особенностях фазовых переходов смешение–расслаивание в ионных системах могут быть акустические исследования, недостаточно проводившиеся до последнего времени. Наиболее полные сведения по этой проблеме для предельных и галогенозамещенных углеводородов, ароматических углеводородов и их производных, а также спиртов содержатся в обзоре [8]. Данные [8] использованы для расчета важнейших теплофизических и упругих свойств перечисленных веществ, необходимых для построения молекулярно-кинетической модели жидкостей и решения обостряющихся проблем энергетики.
Расплавленные галогениды щелочных металлов (ГЩМ), рассматриваемые в данной работе, безусловно, далеки по своей природе от рассмотренных в литературе молекулярных и ионных жидкостей. Они представляют собой особый класс ионных систем, между частицами которых проявляется в основном дальнодействующее кулоновское притяжение и отталкивание. В них между частицами нет растворителя с высокой диэлектрической постоянной. Они практически полностью диссоциируют выше точки плавления, а их ионы с большой долей вероятности могут быть уподоблены жестким сферам. Галогениды серебра, как следует из работ [9–13], занимают промежуточное положение между соединениями с чисто ионной и ковалентной природой химической связи.
Многочисленные исследования акустических свойств ионных солевых расплавов в однофазной области, систематизированные в обзорах [14, 15], показывают, что среди этих систем с общим ионом не нашлось ни одной, удовлетворяющей закону аддитивного смешения. Экспериментально установлено, что реальная скорость звука в смеси всегда меньше величины, вычисленной по правилу аддитивности. Разность данных значений тем больше, чем сильнее различаются размеры замещающих друг друга ионов.
К сожалению, в литературе мало представлены работы, посвященные модельным расчетам скорости звука в расплавленных солях. Лишь в одной работе [16] это сделано для фторидов щелочных металлов в рамках сферической модели. Весьма перспективной для предсказания акустических свойств выглядит модель ионного расплава, которая предусматривает отсутствие дальнего порядка в распределении ионов и существование преимущественно кулоновских сил притяжения и отталкивания между частицами. Такая модель хорошо зарекомендовала себя при расчетах мольного объема и транспортных свойств расплавленных солей [17–19].
В предлагаемой работе на основании измерений скорости звука ионных расплавов сделана попытка разобраться в некоторых вопросах жидкофазной сегрегации, что послужит развитию теории жидкости и поможет в полной мере раскрыть практические возможности таких двухфазных систем [20, 21]. К настоящему времени достаточно подробно изучены фазовые диаграммы тройных взаимных солевых смесей галогенидов щелочных металлов и серебра [22–24]. Определено положение купола несмешиваемости, установлена ширина области ограниченной растворимости и составы сосуществующих жидких фаз.
Решение проблемы, связанной с природой расслаивания ионных расплавов, найдено в [25] в рамках модели заряженных твердых сфер с различающимися диаметрами. Здесь свободная энергия Гельмгольца представлена в виде суммы трех слагаемых F = Fid+ Fq + Fhs, где Fid – вклад в свободную энергию, обусловленный поступательными степенями свободы движения частиц, а Fhs и Fq являются вкладами в энергию за счет сил исключенного объема и электростатического взаимодействия частиц соответственно. Согласно этой модели, разделение расплавленной смеси ионных солей происходит из-за различной экранирующей способности ионов, которая тем больше, чем меньше их радиус ri и больше заряд ze. Поэтому ионы с наибольшими ионными моментами (ze/ri) стремятся максимально сблизиться при данных условиях, формируя ниже критической температуры смешивания легкую фазу, в которой растворяется небольшое количество ионов с большим размером. Основная часть компонента с более слабыми химическими связями вытесняется из этой фазы, образуя более тяжелую фазу с небольшим содержанием легких ионов.
Сведения о физико-химических свойствах двухфазных ионных расплавов весьма скудны. Целью настоящей работы является получение первичных данных о скорости звука в сосуществующих фазах в расслаивающихся расплавленных смесях галогенидов щелочных металлов и серебра, а также анализ ее изменения при приближении к критической точке смешивания.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Подготовка солей. Успех любого физико-химического эксперимента определяется чистотой объектов исследования. Поэтому промышленные реактивы нуждаются в тщательной очистке от продуктов, образующихся при их взаимодействии с кислородом и адсорбированной водой, а также технологических загрязнителей. Опыт показывает, что хороших результатов можно добиться использованием двухстадийной очистки. На первом этапе галогениды серебра и щелочных металлов сушились в вакууме при 673 К в течение 4 ч и затем медленно доводились до температуры на 50 К выше их температур плавления в атмосфере аргона. После охлаждения соли подвергались зонной плавке [26]. Такая очистка повторялась три–пять раз в зависимости от природы соли. Анализ показывает, что рН водного раствора солей из головной части слитка близок к нейтральному значению, а для конца слитка реакция щелочная. Для экспериментов использовалась только головная часть слитка. Измеренные температуры плавления солей хорошо совпадают с наиболее точными значениями [9], что указывает на высокую чистоту образцов. Соли хранились в герметично закрытых сосудах. Исходный состав солевой смеси для эксперимента всегда соответствовал соотношению концентраций компонентов в вершине купола несмешиваемости.
Методика измерения. В основу экспериментальной установки для измерения скорости ультразвука положен импульсно-временной метод [27, 28]. Исследуемый расплав помещался в тигель из кварца или платины, ко дну которого присоединен волновод из переплавленного кварца (рис. 1). Сверху в расплав соли погружался цилиндрический стержень из оптически прозрачного кварца или сапфира длиной 250 и диаметром 20 мм. Плоскости его торцов перпендикулярны оси и параллельны между собой. Перемещение верхнего волновода по вертикали коаксиально по отношению к нижнему волноводу осуществляется при помощи катетометра на определенное расстояние с точностью до 0.005 мм. Коаксиальная установка стержней контролируется по максимуму звукового сигнала. На торцах волноводов крепятся пьезоэлементы из монокристалла ниобата лития. Эта ячейка помещалась в герметичный кварцевый контейнер с контролируемым газовым пространством, нижняя часть которого находилась в зоне нагрева. Нагревательная часть экспериментальной установки представляет собой трубчатую электрическую печь сопротивления с тремя нихромовыми обмотками. Они питаются токами разной силы, чтобы создать в зазоре между торцами звуководов в исследуемых расплавах изотермическую зону нагрева протяженностью не менее 80 мм по вертикали. Посредством платина-платинородиевых термопар, горячие концы которых находятся в непосредственной близости от секций обмотки, сила тока в обмотках автоматически регулируется таким образом, чтобы при задаваемых значениях температура расплава поддерживалась постоянной в пределах ±1 К. Большое внимание уделено точному фиксированию температуры системы с помощью калиброванной платина-платинородиевой термопары непосредственно в расплаве с точностью до 1 К.
Рис. 1.
Схема ячейки для измерения скорости ультразвука в расслаивающихся солевых расплавах: 1 – передатчик импульсов звуковой волны и пьезоэлектрическая ячейка, 2 – нижний звуковод из плавленого кварца или монокристаллического вольфрама, 3 – кварцевый (платиновый) тигель с солевым расплавом, 4 – мобильный верхний волновод из монокристалла оксида алюминия или кварца, 5 – пьезоэлектрические преобразователи.

Частота ультразвуковых волн, используемых для измерений, составляла 5 МГц. Электронная часть экспериментальной установки включает блок измерения интервалов времени и прецизионный источник временных интервалов для измерения приращения времени ∆t при прохождении звуком заданного отрезка пути ∆h в исследуемом веществе с точностью до ±10–8 с. Скорость звука при желаемых температурах рассчитывалась как u = Δh/Δt. Погрешность измерения скорости звука складывается из погрешностей измерения длины пути звука в расплаве (0.1–0.05%), времени его прохождения (0.06–0.17%), определения температуры (0.04–0.06%). В целом относительная погрешность измерения скорости звука не превышает ±0.3%.
Зондированию подвергалась вся толща жидкой системы с малыми перемещениями верхнего звуковода начиная с произвольно выбранной точки внутри одной из фаз. На рис. 2 показано, как для разных температур меняется скорость ультразвука по мере погружения звуковода в расплав. График демонстрирует неизменность скоростей звука в каждой из фаз на некотором расстоянии от границы раздела, что свидетельствует о достижении системой термодинамического равновесия.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Смеси галогенидов щелочных металлов. Первые в мире измерения скорости звука в расслаивающихся ионных расплавах галогенидов металлов выполнены группой исследователей Института высокотемпературной электрохимии УрО РАН на примере смеси LiF + KBr [29]. Позднее эти исследования были расширены на все смеси галогенидов щелочных металлов, где наблюдается сегрегация в жидкой фазе. Первичные экспериментальные результаты для исследованных расплавов на линии насыщения [29–34] приведены в табл. 1 в зависимости от температуры. Здесь же показаны значения скоростей звука в расплавах нескольких индивидуальных компонентов систем [15].
Таблица 1.
Скорость звука (м/с) для верхней u1 и нижней u2 фаз в расслаивающихся жидких смесях галогенидов щелочных металлов при разных температурах
| LiF + KBr | LiF + RbBr | LiF + CsBr | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T, К | uLiF | u1 | u2 | uKBr | T, К | u1 | u2 | uRbBr | T, К | u1 | u2 | uCsBr |
| 1126 | 2566 | 2105 | 1231 | 1193 | 1135 | 2247 | 1010 | 1004 | 1133 | 2462 | 900 | 889 |
| 1153 | 2534 | 2010 | 1247 | 1173 | 1144 | 2200 | 1015 | 998 | 1143 | 2416 | 892 | 884 |
| 1168 | 2517 | 1914 | 1256 | 1162 | 1156 | 2183 | 1011 | 990 | 1166 | 2222 | 870 | 871 |
| 1185 | 2497 | 1834 | 1322 | 1150 | 1165 | 2152 | 1018 | 985 | 1183 | 2200 | 876 | 861 |
| 1195 | 2493 | 1766 | 1322 | 1148 | 1186 | 2084 | 1025 | 971 | 1203 | 2120 | 863 | 849 |
| 1199 | 2480 | 1670 | 1360 | 1140 | 1200 | 2023 | 1033 | 962 | 1220 | 2020 | 857 | 840 |
| 1213 | 2464 | 1525 | 1350 | 1130 | 1219 | 1950 | 1037 | 950 | 1243 | 2000 | 855 | 826 |
| 1225 | 2457 | 1515 | 1370 | 1125 | 1236 | 1885 | 1070 | 939 | ||||
| 1227 | 2445 | 1492 | 1392 | 1118 | 1251 | 1800 | 1100 | 930 | ||||
| 1237 | 2436 | 1440 | 1400 | 1112 | 1278 | 1595 | 1190 | 911 | ||||
| 1243 | 2429 | 1408 | 1408 | 1108 | 1295 | 1465 | 1270 | |||||
| 1254 | 2416 | 1394 | 1394 | 1100 | ||||||||
| LiF + KI | LiF + RbI | LiF + CsI | LiF + CsCl | |||||||||
| T, К | u1 | u2 | T, К | u1 | u2 | T, К | u1 | u2 | T, К | u1 | u2 | |
| 1123 | 2339 | 1031 | 1128 | 2400 | 915 | 1135 | 2520 | 830 | 1143 | 2105 | 1100 | |
| 1133 | 2310 | 1033 | 1143 | 2365 | 904 | 1146 | 2501 | 824 | 1173 | 2000 | 1126 | |
| 1153 | 2242 | 1020 | 1164 | 2330 | 880 | 1165 | 2462 | 814 | 1203 | 1850 | 1160 | |
| 1173 | 2212 | 1002 | 1183 | 2300 | 865 | 1183 | 2405 | 803 | 1215 | 1695 | 1175 | |
| 1193 | 2150 | 1005 | 1201 | 2260 | 854 | 1201 | 2347 | 795 | 1225 | 1600 | 1190 | |
| 1211 | 2115 | 1000 | 1219 | 2225 | 840 | 1220 | 2290 | 785 | 1237 | 1440 | 1210 | |
| 1228 | 2074 | 987 | 1241 | 2180 | 835 | 1243 | 2240 | 780 | 1252 | 1289 | 1229 | |
| 1243 | 1992 | 978 | 1258 | 2140 | 831 | 1253 | 2200 | 781 | 1255 | 1262 | 1236 | |
| 1251 | 1984 | 980 | 1258 | 1255 | 1255 | |||||||
Величины скоростей в обеих фазах расположены между значениями, характерными для расплавов их индивидуальных компонентов, что свидетельствует о взаимной растворимости составляющих систему галогенидных солей. Из таблицы также следует, что скорость в верхней фазе всегда убывает с увеличением температуры, тогда как в нижней фазе она меняется по-разному в зависимости от размеров ионов. Так, в расплавах, содержащих бромиды и иодиды рубидия и цезия, скорость уменьшается, тогда как для систем с галогенидами калия и хлоридом цезия найдено увеличение скорости с ростом температуры. В тяжелой фазе темп изменения скорости с увеличением температуры менее резко выражен, чем темп снижения скорости с температурой в легкой фазе. Интересно также, что при одной и той же температуре скорость в легкой фазе больше отличается от скорости в расплаве чистого фторида лития, чем скорость в тяжелой фазе от ее значения для галогенида щелочного металла с большими ионами. Это может быть объяснено влиянием, которое оказывает тот или иной компонент на свойства однофазных расплавленных смесей. Действительно, увеличение концентрации в расплаве более тяжелого щелочного галогенида сопровождается снижением скорости звука [15]. Этот эффект для верхней фазы усиливает характерное для ионных расплавов уменьшение скорости с ростом температуры. Для нижней фазы увеличение температуры и связанный с этим рост концентрации в ней фторида лития действуют в отношении скорости разнонаправлено. Поэтому в расплавах с бромидами и иодидами рубидия и цезия, где растворимость фторида лития мала, основную роль в температурной зависимости играет фактор, связанный с ослаблением межчастичных связей по мере нагревания. Концентрационный фактор, обусловленный увеличением содержания фторида лития в нижней фазе, начинает преобладать для смесей фторида лития с хлоридом цезия и галогенидами калия. Заметим, что в расплавах с наименьшей суммой радиусов ионов этот фактор проявляется более ярко.
Экспериментальные величины скорости звука на линии насыщения хорошо подтверждаются теоретическими расчетами в рамках модели заряженных твердых сфер с учетом разного размера ионов [25]. Так, для расплава LiF + KBr [35] найдено, что скорость звука на вершине купола несмешиваемости равна 1420 м с–1, тогда как эксперимент дает 1408 м с–1 (табл. 1). Неплохо передается и характер изменения скорости звука при удалении температуры от точки полного смешивания фаз: скорость увеличивается для легкой фазы, но уменьшается для нижней. Причем наблюдается и хорошее количественное совпадение рассчитанных и экспериментальных значений для фазы, обогащенной бромидом калия; несколько хуже обстоит дело с легкой фазой, где экранирующий эффект выражен наиболее ярко. Возможно, ситуацию можно улучшить, учтя поляризацию ионов [36].
Обращает на себя внимание монотонный характер температурной зависимости скорости звука для тяжелых фаз вдали от точки смешивания и вблизи нее. Практически такой же характер наблюдается и для легкой фазы при температурах, далеких от критической. Однако температурный ход скорости в фазах резко меняется при приближении к критической температуре смешивания Тк, что видно на примере смесей LiF + KBr и LiF + CsCl. Здесь темп снижения скорости резко возрастает, по-видимому, из-за увеличения в верхней фазе концентрации галогенида тяжелого щелочного металла. Этот процесс, скорее всего, и определяет тип критичности системы.
Разность скоростей в равновесных фазах уменьшается с ростом температуры, о чем свидетельствуют графики рис. 3. В области низких температур характер этих зависимостей для всех рассматриваемых в статье расплавов практически одинаков и хорошо передается прямыми линиями. При одной и той же температуре разность скоростей в соприкасающихся фазах системы, как видно, наибольшая в расплавах LiF + CsI и наименьшая в смесях LiF + КBr и LiF + CsCl. Это свидетельствует о меньшей взаимной растворимости компонентов во фторидно-иодидном расплаве, где разница в размерах катионов наибольшая.
Рис. 3.
Разность скоростей звука в равновесных фазах на линии насыщения для расплавов LiF + KBr (1), LiF + CsCl (2), LiF + RbBr (3), LiF + KI (4), LiF + CsBr (5), LiF + RbI (6), LiF + CsI (7).
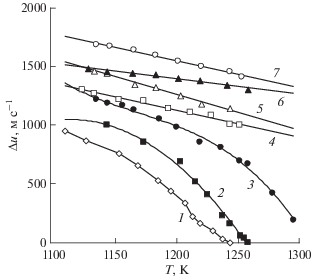
Для понимания роли размерного фактора в механизме фазового перехода жидкость–жидкость в случае расплавленных солевых смесей с кулоновским характером межчастичных связей представляется показательным рис. 4. Он демонстрирует взаимозависимость между разностью скоростей звука в сосуществующих фазах расслоившихся расплавов при одной температуре и разностью радиусов катиона и аниона тяжелого галогенида ∆ = RRX – RLiF. Из нее следует, что различия в состоянии жидких фаз ионных солевых смесей, находящихся в условиях термодинамического равновесия, тем значительнее, чем больше различаются размерами смешиваемые ионы. По-видимому, в рассматриваемом случае компонент с большими ионами не может предотвратить образование ассоциатов с наиболее прочными связями на основе фторида лития. Этот компонент в сильном поле фторида лития должен “выжиматься” за пределы фазы. Сообщение системе кинетической энергии способствует сближению составов и энергий связи частиц в фазах, а при определенном ее значении приводит к полному смешиванию компонентов.
Рис. 4.
Зависимость разности величин скорости звука на линии насыщения при 1150 К от размерного фактора ∆ = RRX– RLiF для смесей LiF + KBr (1), LiF + + CsCl (2), LiF + RbBr (3), LiF + KI (4), LiF + CsBr (5), LiF + RbI (6), LiF + CsI (7).

Смеси галогенидов щелочных металлов и серебра. Все известные к настоящему времени результаты измерений скорости звука в сосуществующих равновесных фазах расплавленных смесей галогенидов лития, натрия и серебра [37–41] сведены в табл. 2.
Таблица 2.
Скорость звука вдоль линии насыщения для расслаивающихся расплавленных смесей галогенидов лития, натрия и серебра
| LiF + AgI | LiCl + AgI | LiBr + AgI | NaCl + AgI | LiCl + AgBr | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T, К | u1 | u2 | T, К | u1 | u2 | T, К | u1 | u2 | T, К | u1 | u2 | T, К | u1 | u2 |
| 1130 | 2553 | 1021 | 930 | 1980 | 1098 | 850 | 1450 | 1137 | 1035 | 1440 | 1274 | 818 | 1695 | 1555 |
| 1139 | 2542 | 1017 | 980 | 1940 | 1100 | 867 | 1440 | 1140 | 1038 | 1435 | 1283 | 820 | 1686 | 1559 |
| 1146 | 2536 | 1015 | 1035 | 1875 | 1105 | 891 | 1428 | 1148 | 1039 | 1430 | 1290 | 822 | 1676 | 1563 |
| 1158 | 2520 | 1010 | 1082 | 1810 | 1108 | 912 | 1414 | 1158 | 1043 | 1420 | 1295 | 824 | 1666 | 1566 |
| 1170 | 2507 | 1006 | 1138 | 1715 | 1130 | 931 | 1397 | 1171 | 1046 | 1412 | 1307 | 827 | 1660 | 1574 |
| 1182 | 2490 | 1001 | 1156 | 1647 | 1150 | 948 | 1376 | 1181 | 1050 | 1398 | 1319 | 831 | 1646 | 1578 |
| 1193 | 2478 | 997 | 1178 | 1557 | 1168 | 950 | 1360 | 1187 | 1053 | 1392 | 1324 | 834 | 1638 | 1586 |
| 1205 | 2465 | 992 | 1189 | 1527 | 1185 | 959 | 1346 | 1191 | 1056 | 1383 | 1330 | 838 | 1629 | 1595 |
| 1218 | 2447 | 988 | 1198 | 1477 | 1200 | 967 | 1307 | 1200 | 1059 | 1372 | 1340 | 840 | 1622 | 1600 |
| 1209 | 1445 | 1208 | 968 | 1294 | 1205 | 1062 | 1368 | 1353 | 842 | 1614 | 1606 | |||
| 1220 | 1400 | 1214 | 973 | 1273 | 1208 | 1063 | 1365 | 1357 | 843 | 1612 | 1612 | |||
| 1225 | 1375 | 1240 | 979 | 1250 | 1218 | 1065 | 1360 | 1360 | ||||||
| 1230 | 1357 | 1228 | 982 | 1236 | 1220 | 1075 | 1354 | 1354 | ||||||
| 1237 | 1326 | 1260 | 984 | 1228 | 1228 | |||||||||
| 1238 | 1338 | 1270 | ||||||||||||
| 1243 | 1304 | 1270 | ||||||||||||
| 1247 | 1292 | 1272 | ||||||||||||
| 1248 | 1290 | 1276 | ||||||||||||
| 1250 | 1281 | 1281 | ||||||||||||
Для наглядности температурные зависимости скорости звука в сосуществующих равновесных фазах показаны на рис. 5. Результаты оценки энергии реакций обмена с участием галогенидов серебра показывают, что равновесие реакций смещено в сторону формирования стабильной диагонали. При допущении, что серебросодержащие расплавы, состоящие из ионов Ag+, I–, Na+, Li+ и X– (где X– – F–, Cl– или Br–), характеризуются преимущественно электростатическим межионным взаимодействием, их состояние можно объяснить различной экранирующей способностью ионов: чем меньше радиус иона, тем лучше его способность к экранированию. Поэтому катион Li+ (или Na+) и анион F– (Cl– или Br–), у которых наименьшие размеры, имеют тенденцию к обособлению ниже критической точки смешения. Эта пара катион–анион образует в данных условиях легкую фазу с максимальным внутренним электрическим полем, обогащенную ионами Ag+ и I–. Легкой фазе соответствуют более высокие значения скорости звука (верхние части u–T-зависимостей на рис. 5). Компонент с более слабыми химическими связями вытесняется из этой фазы, образуя более тяжелую фазу, которая обеднена катионами Li+ (или Na+) и анионами F– (Cl– или Br–).
Рис. 5.
Скорость звука вдоль линии насыщения в расплавах LiF + AgI (1), LiCl + AgI (2), NaCl + AgI (3), LiBr + AgI (4), LiCl + AgBr (5).

Изученные системы в двухфазной области при постоянном давлении инвариантны: изменение температуры вдоль линии насыщения обязательно сопровождается изменением состава равновесных фаз [24]. Экспериментальные величины скорости звука на линии насыщения отражают поэтому суперпозицию как теплового, так и концентрационного факторов. В исследованных системах скорость звука в легкой фазе всегда уменьшается с ростом температуры в результате как ослабления ион-ионных связей, так и увеличения концентрации галогенидов серебра, в которых скорость звука мала. Изменение скорости звука с температурой в нижней фазе зависит от размера иона. Она уменьшается с ростом температуры в расплавах, содержащих LiF, потому что фторид лития имеет самую низкую растворимость в жидком йодиде серебра, тогда как скорость звука увеличивается с ростом температуры для расплавов, содержащих хлорид лития и бромид лития. Ослабление межчастичных связей является основным фактором, определяющим температурную зависимость расплава LiF + AgI. В расплавах LiCl + AgI и LiBr + AgI рост температуры и повышенная концентрация галогенида лития в расплаве AgI оказывают противоположное влияние на скорость звука. Фактор концентрации, обусловленный повышенной концентрацией галогенида лития в нижней фазе, становится доминирующим для этих смесей. Величины скорости звука в легкой и тяжелой фазах системы LiF + AgI лишь незначительно отличаются от известных значений скорости звука в отдельных расплавах LiF и AgI. Скорость звука в легкой фазе оказывается на 0.3% ниже, чем у расплавленного фторида лития, а в тяжелой фазе – на 0.5% выше, чем у расплава иодида серебра; эти значения близки к экспериментальной ошибке. Причина такого явления заключается в очень низкой взаимной растворимости компонентов системы. Для всех исследованных систем значения скорости звука в равновесных фазах сближаются друг с другом при увеличении температуры, поскольку составы фаз выравниваются.
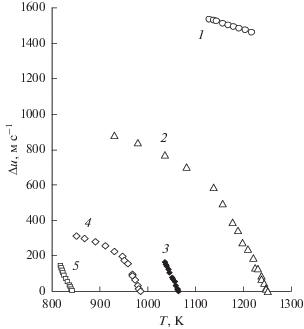
Температурная зависимость разности скоростей звука в двух сосуществующих фазах исследованных систем показана на рис. 6. Эта разница уменьшается с ростом температуры. В окрестностях температуры полного смешивания участки кривых имеют одинаковые тренды для четырех систем. Эта корреляция значительно изменяется при относительно низких температурах (на 50–100 К ниже критической температуры смешивания) для расплавов LiCl + AgI и LiBr + AgI. В данном интервале температур скорости звука в фазах меняются существенно медленнее. Скорости звука в сосуществующих фазах становятся одинаковыми при 1250 К в расплаве LiCl + AgI, 1065 К в системе NaCl + AgI, 984 К в LiBr + AgI и 843 К в LiCl + AgBr; выше этих температур происходит полное смешивание компонентов. Состояние расплава LiF + AgI далеко от критического во всем исследованном интервале температур.
Рис. 6.
Температурная зависимость разности скоростей звука вдоль линии насыщения для расплавов LiF + AgI (1), LiCl + AgI (2), NaCl + AgI (3), LiBr + AgI (4), LiCl + AgBr (5).
На рис. 7 разность скоростей звука в сосуществующих фазах систем с галогенидом серебра при 950 К представлена как функция размерного фактора ∆= RAgX– RRX, где RAgX – сумма радиусов катиона серебра и галогенидного аниона, RRX – сумма размеров ионов галогена и щелочного металла. При прочих равных условиях устойчивость двухфазных систем тем выше, чем значительнее разность в размерах ионов компонентов стабильной диагонали. Это наблюдается при замене как одного катиона щелочного металла другим (Li+ на Na+), так и аниона при катионе щелочного металла (F– на Cl– или Br–) и аниона при катионе серебра (Br– на I–). Более того, зависимость ∆u–∆ для систем, содержащих галогенид лития, можно с хорошим приближением аппроксимировать одной плавной кривой, как и для случая смесей галогенидов щелочных металлов между собой (см. рис. 4).
Рис. 7.
Соотношение между разностью величин скорости звука на линии насыщения при 950 К и размерным фактором ∆ = RAgX – RRX для смесей: 1 – LiF + + AgI (экстраполяция), 2 – LiCl + AgI, 3 – NaCl + AgI (экстраполяция), 4 – LiBr + AgI, 5 – LiCl + AgBr.

Вместе с тем сравнение рис. 4 и 7 дает возможность выявить существенное отличие в поведении этих двух семейств расслаивающихся систем. Так, в смесях фторида лития с другими галогенидами щелочных металлов сегрегации не обнаруживается, если ∆ < 0.128 нм (система LiF + KBr). Рис. 7, однако, свидетельствует, что расплавы с галогенидом серебра склонны к расслаиванию в жидком состоянии при существенно меньших значениях размерного фактора. Так, например, для смесей AgI + NaCl и AgI + LiCl разность в суммах радиусов тяжелых и легких компонентов, составляющих стабильную диагональ, равна 0.066 и 0.101 нм соответственно. По-видимому, дополнительным фактором, который способствует расслаиванию расплавов с галогенидом серебра, является более низкая плотность зарядов вокруг катиона серебра в расплаве по сравнению с галогенидом щелочного металла [37]. Обращает на себя внимание поведение системы AgI + NaCl (рис. 7). Из-за небольшой разности размеров составляющих ее ионов ∆ = (${{r}_{{{\text{A}}{{{\text{g}}}^{{\text{ + }}}}}}}$ + ${{r}_{{{{{\text{I}}}^{ - }}}}}$) – (${{r}_{{{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}}$ +${{r}_{{{\text{C}}{{{\text{l}}}^{ - }}}}}$) можно было бы ожидать, что при указанной на рис. 7 температуре расплав будет однофазным. Возможно, это связано с разной степенью ионности связи иона галогена с ионом лития или натрия [1].
Таким образом, свойства фаз на линии насыщения изученных систем зависят как от соотношения размеров ионов, так и от характера химической связи между ними.
Критические характеристики ионных расплавов. Графики на рис. 3 и 6 свидетельствуют о том, что с ростом температуры величины скорости звука сближаются. Для ряда расплавов (LiF + KBr, LiF + CsCl, LiCl + AgI, NaCl + AgI, LiBr + AgI и LiCl + AgBr) при некотором значении температуры скорости становятся неразличимыми, когда составы фаз выравниваются и системы становятся однофазными. Эта температура, следовательно, соответствует верхней критической точке фазового перехода жидкость–жидкость. Значения критических температур смешивания приведены в табл. 3 вместе с литературными данными [23, 24]. Здесь же даны величины критической скорости звука и размерного фактора Δ, вычисленного с использованием значений радиусов ионов, рекомендованных Шенноном [42].
Найденные акустическим методом величины критической температуры смешивания в пределах 0.5% совпадают с известными значениями, соответствующими вершине купола несмешиваемости [24] для смесей, содержащих галогенид серебра. Для смесей галогенидов щелочных металлов акустические измерения дали более высокие значения Тк (на 14 и 72 К для LiF + KBr и LiF + + CsCl соответственно). Как сообщают авторы [23, 24], момент фазового перехода жидкость–жидкость фиксировался визуально по помутнению расплава. Этот метод, несомненно, уступает в точности инструментальному способу.
Данные табл. 3 демонстрируют существенную зависимость критической температуры смешивания от состава солевого расплава. В рамках модели заряженных твердых сфер произвольного диаметра [25] показано, что при увеличении размерного фактора Δ должны происходить уширение двухфазной области и рост критической температуры смешивания. Экспериментальные величины критической температуры смешивания в целом находятся в соответствии с предсказаниями теории. Действительно, наблюдается увеличение значений Тк, полученных ультразвуковыми исследованиями, с ростом размерного фактора ∆. В эту корреляцию вписывается и уточненное значение критической температуры для LiF + CsCl. Значение Тк для расплава NaCl + AgI является естественным продолжением ряда смесей с преимущественно кулоновским типом химической связи ($Т_{{\text{к}}}^{{{\text{LiF}} + {\text{CsCl}}}}$ > $T_{{\text{к}}}^{{{\text{LiF}} + {\text{KBr}}}}$ > $T_{{\text{к}}}^{{{\text{NaCl}} + {\text{AgI}}}}$), но существенно выше ожидаемой величины для ряда расплавов, содержащих галогенид серебра, занимающий промежуточное положение между кулоновскими и ковалентными соединениями.
Знание критической температуры смешивания дает возможность проверить применимость закона соответственных состояний к описанию поведения ионных расплавов в окрестностях критической точки. Анализ кривых на рис. 3 и 6 показывает, что наиболее интенсивное сближение скоростей звука в сосуществующих фазах происходит примерно за 70 К до критической точки смешивания. Вблизи критической точки температурная зависимость разности скоростей звука на линии насыщения с хорошим приближением описывается универсальным уравнением Δu = = (Tк − T)γ (рис. 8):
Рис. 8.
Соотношение между разностью скоростей звука в сосуществующих фазах ∆u и разностью температур ∆T = (Tк – T) в логарифмических координатах для расплавов AgBr + LiCl (1), AgI + NaCl (2), AgI + LiCl (3), AgI + LiBr (4), LiF + KBr (5), LiF + CsCl (6), LiF + + RbBr (7); 8 – расчет по (1), 9 – (2).

За пределами указанного выше интервала температур это уравнение не выполняется.
Для обеих смесей галогенидов щелочных металлов критическая экспонента γ равна 1.007, что соответствует среднеполевому (классическому) поведению ионных расплавов [3]. Семейство расплавов с галогенидом серебра также описывается одним уравнением, но для них критическая экспонента оказалась на 13% меньше. Подобное соотношение между критическими экспонентами для двух рассматриваемых семейств солевых систем найдено и при выборе других параметров порядка. Так, для плотности фаз на линии насыщения для галогенидов щелочных металлов экспериментальное и найденная в рамках модели заряженных твердых сфер критическая экспонента составляет 0.50 [42], тогда как для смесей, содержащих галогенид серебра, она равна 0.43 [43]. Температурная зависимость электропроводности на линии насыщения в окрестностях критической точки смешивания также подчиняется экспоненциальному уравнению с критическими индексами для указанных семейств расплавов 0.98 и 0.89 соответственно [44, 45].
Отсюда следует важный вывод, что закон соответственных состояний строго выполняется для семейств ионных систем с одинаковым типом парного потенциала. Возможно, в этом кроется корень противоречия в описании критичности систем на основе ионных жидкостей [3, 4]: учет только кулоновских сил предсказывает классическое поведение систем в окрестностях критической точки смешивания жидкостей, тогда как введение в парный потенциал короткодействующих сил предписывает изинговское поведение расслаивающихся жидкостей.
ЗАКЛЮЧЕНИЕ
Скорость распространения звуковой волны измерена для двухфазной области расплавленных смесей галогенидов щелочных металлов друг с другом и с галогенидами серебра для исследования роли размера ионов в фазовом переходе жидкость–жидкость. Показано, что причиной изменения скорости звука вдоль линии насыщения является совместное влияние теплового движения частиц и состава фаз. Разница в величинах скорости звука для сосуществующих фаз увеличивается с разницей в размерах замещающих друг друга ионов как для щелочно-галоидных расплавов, так и в смесях с галогенидом серебра. Изменения свойства вдоль линии насыщения хорошо описываются в рамках модели заряженных твердых сфер, учитывающей разную экранирующую способность ионов. В окрестности критической точки смешения для изученных систем строго соблюдается теорема о соответственных состояниях. Но критический показатель для расплавов, содержащих галогениды серебра, оказался меньше, чем для щелочно-галогенидных расплавов, в которых доминируют дальние кулоновские силы. Различия в поведении упомянутых несмешивающихся расплавов могут быть следствием того факта, что галогениды серебра занимают промежуточное положение между типичными ионными солями и полностью ковалентными соединениями.
Список литературы
Бацанов С.С. Электроотрицательность элементов и химическая связь. Новосибирск: АН СССР, 1962.
Hallett J.P., Welton T. Room-Temperature Ionic Liquids: Solvents for Synthesis and Catalysis // Chem. Rev. 2011. V. 111. P. 3508.
Fisher M.E. The Story of Coulombic Criticality // J. Stat. Phys. 1994. V. 75. P. 1.
Stell S. Criticality and Phase Transitions in Ionic Fluids // J. Stat. Phys. 1995. V. 78. P. 197.
Wiegand S., Briggs M.E., Levelt Sengers J.M.N., Kleemeier M., Schröer W. Turbidity, Light Scattering and Coexistence Curve Data for the Ionic Binary Mixture Triethyl n-Hexyl Ammonium Triethyl n-Hexyl Borate in Diphenyl Ether // J. Chem. Phys. 1998. V. 109. P. 9038.
Schröer W. Criticality of Ionic Liquids in Solution. In: Ionic Soft Matter: Modern Trends in Theory and Applications / Ed. Henderson D. Berlin: Springer, 2005. P. 143.
Schröer W. A Short History of Phase Transitions in Ionic Fluids // Contrib. Plasma Phys. 2012. V. 52. P. 78.
Неручев Ю.А., Болотников М.Ф., Зотов В.В. Исследования скорости ультразвука в органических жидкостях на линии насыщения // ТВТ. 2005. Т. 43. № 2. С. 274.
Janz G.J., Dampier F.W., Lakshminarayan G.R., Lorenz P.K., Tomkins R.P.T. Molten Salts. National Standard Reference Data, NBS; National Institute of Standards and Techno1ogy. Gaithersburg, 1968. V. 15. P. 1.
Schinke H., Sauervald F. Über die Volumenänderung beim Schmelzen und den Schmelzprozess bei Salzen // Z. Anorg. Allgem. Chem. 1956. Bd. 287. S. 313.
Gagliardi L., Bonella S. Charge Transport in Superionic and Melted AgI under a Magnetic Field Studied via Molecular Dynamics // Phys. Rev. B. 2016. V. 94. 134 426.
Паддефет Р. Химия золота. М.: Мир, 1982. 259 с.
Wilson M., Madden P.A., Costa-Cabral B.J. Quadrupole Polarization in Simulations of Ionic Systems: Application to AgCl // J. Phys. Chem. 1996. V. 100. P. 1227.
Присяжный В.Д., Кириллов С.Л., Василеску В.В. Скорость ультразвука и сжимаемость смешанных солевых расплавов. В кн.: Ионные расплавы. Вып. 1. Киев: Наукова думка, 1974. С. 167.
Минченко В.И., Степанов В.П. Ионные расплавы: упругие и калорические свойства. Екатеринбург: УрО РАН, 2008.
Griffard C., Penoncello S.G., Crepeau J.C. The Thermophysical Properties of Binary Mixtures of Molten Alkali Fluoride Salts. Part I: Prediction of Thermodynamic Properties through Use of the Soft-Sphere Equation of State // Progr. Nuclear Energy. 2013. V. 68. P. 130.
Wang J., Wu J., Sun Z., Lu G., Yu J. Molecular Dynamics Study of the Transport Properties and Local Structures of Molten Binary Systems (Li, Na)Cl, (Li, K)Cl, and (Na, K) Cl // J. Mol. Liq. 2015. V. 209. P. 498.
Wang J., Wu J., Lu G., Yu J. Molecular Dynamics Study of the Transport Properties and Local Structures of Molten Alkali Metal Chlorides. Part III. Four Binary Systems LiCl–RbCl, LiCl–CsCl, NaCl–RbCl, and NaCl–CsCl // J. Mol. Liq. 2017. V. 238. P. 236.
Ткачев Н.К. К уравнению состояния расплавленных галогенидов щелочных металлов // ТВТ. 1998. Т. 36. № 4. С. 583.
Moore R.H. Distribution Coefficients for Certain Actinide and Fission Product Chlorides in the Immiscible Salt System LiCl–KAlCl4 // J. Chem. Eng. Data. 1964. V. 9. P. 502.
Volkovich V.A., Maltsev D.S., Melchakov S.Yu., Yamshchikov L.F., Novoselova A.V., Smolenski V.V. Separation of Lanthanides and Actinides in a Chloride Melt-Liquid Metal System: The Effect of Phase Composition // ECS Transactions. 2016. V. 75. P. 397.
Бергман А.Г., Домбровская Н.С. Об обменном разложении в отсутствие растворителя // Журн. рус. физ.-хим. об-ва. 1929. Т. 61. № 8. С. 1451.
Margheritis Ch., Flor G., Sinistri C. Miscibility Gap in Fused Salts. VII. Systems of LiF with Alkali Halides // Z. Naturforsch. 1973. Bd. 28a. S. 1329.
Flor G., Margheritis Ch., Vigano G.C., Sinistri C. Miscibility Gap in Fused Salts. XI. Systems Formed with Silver Halides and Lithium or Sodium Halides // Z. Naturforsch. 1982. Bd. 37a. S. 1068.
Ткачев Н.К. Ограниченная растворимость солевых расплавов и различия в размерах ионов // Расплавы. 1999. № 4. С. 90.
Warren R.W. Procedures and Apparatus for Zone Purification of the Alkali Halides // Rev. Sci. Instrum. 1965. V. 36. P. 731.
Минченко В.И., Степанов В.П., Краснов Ю.Н. Измерение скорости ультразвука в расплавленных солях // Тр. Ин-та электрохимии УНЦ АН СССР. 1974. Вып. 21. С.19.
Smirnov M.V., Minchenko V.I., Bukharov A.N. Sound Absorption in Molten Alkali Chlorides, Bromides, Iodides, and Their Mixtures // Electrochim. Acta. 1988. V. 33. № 2. P. 213.
Минченко В.И., Степанов В.П., Лоскутов Е.О. Скорость ультразвука в расслаивающихся солевых расплавах // Расплавы. 2007. № 3. С.14.
Минченко В.И., Степанов В.П. Скорость звука в расслаивающихся расплавах LiF–CsBr // Расплавы. 2008. № 1. С. 8.
Минченко В.И., Степанов В.П. Акустические свойства расплавов фторидов и бромидов щелочных металлов с ограниченной смешиваемостью // ЖФХ. 2009. Т. 83. № 1. С. 147.
Степанов В.П., Минченко В.И. Влияние размера аниона на скорость звука в расслаивающихся смесях галогенидов щелочных металлов // ЖФХ. 2009. Т. 83. № 12. С. 2375.
Минченко В.И., Степанов В.П. Скорость ультразвука в расслаивающихся фторидно-иодидных расплавах // ЖФХ. 2009. Т. 83. № 12. С. 2380.
Stepanov V.P., Minchenko V.I. Ultrasound Velocity in Dissolving Alkali Halide Melts // J. Chem. Thermodyn. 2011. V. 43. № 3. P. 467.
Зинатулина А.Р., Ткачев Н.К. Методы расчета скорости звука в расслаивающихся солевых бинарных смесях // ЖФХ. 2011. Т. 85. № 10. С. 1983.
Wilson M., Madden P.A. Polarization Effects in Ionic Systems from First Principles // J. Phys.: Condens. Matter. 1993. V. 5. P. 2687.
Stepanov V.P., Minchenko V.I. Ultrasonic Velocity for an Equimolar Mixture of Molten AgI and NaCl in the Biphasic Region // J. Chem. Thermodyn. 2013. V. 59. № 4. P. 250.
Stepanov V.P., Minchenko V.I. Sound Velocities for a Dissolving AgI + LiCl Melts // J. Chem. Eng. Data. 2014. V. 59. № 11. P. 3888.
Stepanov V.P., Minchenko V.I. An Anion Effect on the Separation of AgI-Containing Melts Using Sound Waves // J. Chem. Thermodyn. 2015. V. 87. P. 65.
Степанов В.П., Минченко В.И. Скорость ультразвука в двухфазных расплавах галогенидов лития и серебра // Тр. ХIV Рос. конф. ''Строение и свойства металлических и шлаковых расплавов''. Екатеринбург: УрО РАН, 2015. С. 263.
Stepanov V.P., Minchenko V.I. Sound Wave Propagation in Immiscible AgBr + LiCl Melts // Z. Phys. Chem. 2017. V. 231. № 5. P. 971.
Huheey J.E., Keiter E.A., Keiter R.L. Inorganic Chemistry: Principles of Structure and Reactivity. 4th ed. N.Y.: Harper Collins, 1993.
Ткачев Н.К., Рукавишникова И.В., Локетт В.Н., Степанов В.П. Плотность расслаивающихся ионных расплавов: эксперимент и теория // Электрохимия. 2007. Т. 43. № 8. С. 1004.
Stepanov V.P., Kulik N.P. Density and Adiabatic Compressibility of the Immiscible Molten AgBr + LiCl Mixture // Z. Naturforsch. 2017. Bd. 72a. S. 359.
Stepanov V.P., Babushkina L.M., Dokashenko S.I. Liquid + Liquid Equilibrium in Mixtures of Lithium Fluoride with Potassium and Rubidium Halides // J. Chem. Thermodyn. 2012. V. 51. P. 12.
Stepanov V.P. Electrical Conductivity of Biphasic Mixtures of Molten Silver Iodide and Lithium Fluoride, Chloride, and Bromide // Ionics. 2017. V. 23. P. 2055.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур



