Теоретические основы химической технологии, 2019, T. 53, № 3, стр. 276-281
Графическое исследование дигидратно-полугидратного процесса получения фосфорной кислоты по диаграмме системы CаO–P2O5–SO3–H2O
И. А. Петропавловский 1, И. А. Почиталкина 1, *, А. И. Ряшко 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Россия
* E-mail: pochitalkina@list.ru
Поступила в редакцию 09.10.2018
После доработки 26.11.2018
Принята к публикации 30.11.2018
Аннотация
В настоящей работе проведен графический анализ процесса переработки фосфоритов Коксу (месторождение Каратау) на экстракционную фосфорную кислоту (ЭФК) дигидратно-полугидратным способом по диаграмме равновесной растворимости системы CаO–P2O5–SO3–H2O. Показана теоретическая возможность и практическая целесообразность получения ЭФК с содержанием 30.0% P2O5 из рядового фосфатного сырья Коксу (24.5% P2O5), оценены основные концентрационные и массовые параметры, положенные в основу проведения экспериментов по разработке технологического процесса.
ВВЕДЕНИЕ
Экстракционная фосфорная кислота (ЭФК) – основной полупродукт при производстве концентрированных фосфорсодержащих удобрений, кормовых и пищевых фосфатов и др. Ее производят сернокислотной переработкой природного фосфатного сырья [1]. Важным методом выявления и оценки возможности осуществления технологического процесса кислотной переработки различных видов фосфатного сырья служит графический анализ статики полных циклов процессов на основе диаграмм равновесной растворимости соответствующих водно-солевых систем [2–4]. Объектом проведенного исследования являлся рядовой фосфорит Коксу (месторождение Каратау) – сырье относительно бедное по содержанию фосфора однако достаточно перспективное с точки зрения имеющихся запасов. На его основе с использованием одностадийной дигидратной технологии возможно получение слабой (до 24% Р2О5) ЭФК и отхода – фосфогипса с высоким содержанием примесей (Р2О5, SО3), затрудняющих его утилизацию в строительной технике. Реализация двухстадийной дигидратно–полугидратной технологии с перекристаллизацией сульфата кальция в определенных температурно-концентрационных условиях дает возможность повысить концентрацию продукционной ЭФК до 30% и удалить из осадка сульфата кальция при перекристаллизации основную часть примесей [5–8]. Большинство исследовательских работ в этой области ведут путем экспериментального подбора параметров и количественных соотношений реагентов и фаз без физико-химического анализа по фазовым диаграммам.
Целью представленного ниже графического анализа по диаграмме системы CaO–P2O5–SO3–H2O процесса получения ЭФК из фосфоритов Коксу дигидратно-полугидратным способом является определение и оценка концентрационно-массовых параметров технологического цикла процесса: составов фаз (ж, Т), отношения жидкой и твердой фаз (Ж : Т), дигидратной стадии процесса (разложение сырья), расхода воды на промывку осадка сульфата кальция, массовых потоков на всех стадиях и др. Получение таких данных практически важно для разработки процесса, а также способствует экономии времени и средств при постановке экспериментальных исследований.
ИСХОДНЫЕ ПОЛОЖЕНЯ ДЛЯ АНАЛИЗА ПРОЦЕССА
Дигидратно-полугидратный процесс получения ЭФК описывается следующими основными реакциями (1, 2):
(1)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{5}}{{\left( {{\text{P}}{{{\text{O}}}_{4}}} \right)}_{3}}{\kern 1pt} {\text{F}} + {\text{5}}{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} + 20{{{\text{H}}}_{2}}{\text{O}} = \\ = 5{\text{CaS}}{{{\text{O}}}_{4}} \cdot 2{{{\text{H}}}_{2}}{\text{O}} + 3{{{\text{H}}}_{3}}{\text{P}}{{{\text{O}}}_{4}} + {\text{HF,}} \\ \end{gathered} $(2)
${\text{С а S}}{{{\text{O}}}_{4}} \cdot 2{{{\text{H}}}_{2}}{\text{O}} \to {\text{С а S}}{{{\text{O}}}_{4}} \cdot 0.5{{{\text{H}}}_{2}}{\text{O}} + 1.5{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$В области концентраций P2O5 в жидкой фазе от 20.0 до 35.0% абсолютные значения растворимости сульфата кальция являются весьма малыми (от 0.5 до 1.7%), и с увеличением температуры от 80 до 95°C снижаются [2] до величин 0.05–0.15%, сопоставимых с точностью аналитического определения содержания CaSO4 в растворе. Таким образом, практически весь образующийся сульфат кальция находится в твердой фазе. Для проведения графоаналитического исследования дигидратно-полугидратного процесса было решено использовать данные по наиболее изученной изотерме растворимости базовой (без примесей) четырехкомпонентной системы CaO–P2O5–SO3–H2O при 80°C [9, 10].
Графические построения изотермы равновесной растворимости проводились с использованием метода вторичных проекций [11] адаптированного к графическому анализу полных циклов технологических процессов, в частности, получения ЭФК из различных видов фосфатного сырья [2, 3, 12]. Указанный метод использует преимущества диаграмм, построенных в прямоугольных координатах с одновременным сочетанием на одной и той же координатной плоскости ортогональных и центральных проекций.
Все основные стадии процесса анализируются с помощью соответствующих графических построений, сопровождаемых материальными расчетами по потокам и по компонентам системы согласно блок-схеме (рис. 1).
Рис. 1.
Блок-схема дигидратно-полугидратного процесса: 1 – фосфорит; 2 – серная кислота (I); 3 – раствор разбавления; 4 – дигидратная пульпа; 5 – отходящие газы (I); 6 – фосфогипс; 7 – ЭФК; 8 – продукционная ЭФК; 9 – оборотная ЭФК; 10 – серная кислота (II); 11 – полугидратная пульпа; 12 – отходящие газы (II); 13 – фильтрат; 14 – фосфополугидрат; 15 – вода на промывку; 16 – отмытый фосфополугидрат; 17 – промывные воды.
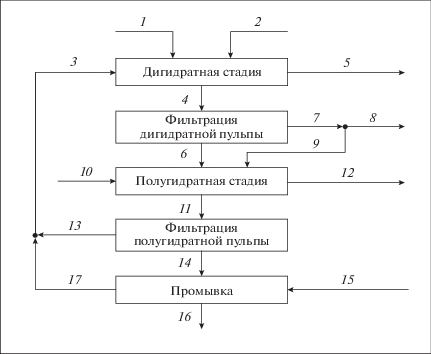
Исходные данные для графического анализа дигидратно-полугидратного процесса, приводимые ниже, были взяты из опубликованных работ [6] для дигидратной (I) стадии и на основании выполненных в работе предварительных исследований для полугидратной (II) стадии.
Для графического анализа приняты: рядовое фосфатное сырье Коксу следующего состава по основным компонентам, мас. %: P2O5 – 24.5, CaO – 37.0, MgO – 1.3, F – 2.4, CO2 – 5.4, нерастворимый остаток (н.о., SiO2) – 24.0; серная кислота: концентрация – 94.0 мас. % H2SO4; норма (от стехиометрической, рассчитанной на суммарное содержание CaO и MgO в фосфате [9, 13]), % – 102.0; распределение серной кислоты (СК) по стадиям, I : II = 0.5 : 0.5.
Содержания основных компонентов в жидкой и твердой фазах систем (Р2О5, СаО, SО3) определены предварительными опытами. Отношение жидкой и твердой фаз в пульпе на полугидратной стадии Ж : Т = 3. Общая влажность осадка ФПГ составляет 22.0%.
Фосфатное вещество фосфоритов Каратау представлено преимущественно разновидностью фторкарбонатапатита, близкой к франколиту, – Ca10(PO4)5.3(CO3)0.6F1.9OH [6]. Взаимодействие фосфоритов Каратау с серной кислотой в дигидратном режиме происходит по следующим основным реакциям:
(3)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{10}}}{{({\text{P}}{{{\text{O}}}_{4}})}_{{5.3}}}{{({\text{C}}{{{\text{O}}}_{3}})}_{{0.6}}}{{{\text{F}}}_{{{\text{1}}{\text{.9}}}}}{\text{OH}} + 10{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} + \\ + \,\,18.4{{{\text{H}}}_{2}}{\text{O}} = 10{\text{CaS}}{{{\text{O}}}_{4}} \cdot 2{{{\text{H}}}_{2}}{\text{O}} + \\ + \,\,5.3{{{\text{H}}}_{3}}{\text{P}}{{{\text{O}}}_{4}} + 0.6{\text{C}}{{{\text{O}}}_{2}} + 1.9{\text{HF,}} \\ \end{gathered} $(4)
$\begin{gathered} {\text{CaC}}{{{\text{O}}}_{3}} \cdot {\text{MgC}}{{{\text{O}}}_{3}} + 2{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} = \\ = {\text{CaS}}{{{\text{O}}}_{4}} \cdot 2{{{\text{H}}}_{2}}{\text{O}} + {\text{MgS}}{{{\text{O}}}_{4}} + 2{\text{C}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Соединения алюминия и железа, а также перешедший в раствор магний реагируют с образующейся фосфорной кислотой и переходят в соответствующие труднорастворимые ортофосфаты железа, алюминия, а также Mg(H2PO4)2. Дигидрофосфат магния частично вступает в реакцию с образованием осадка фторсиликата магния по реакции:
(5)
$\begin{gathered} {\text{Mg}}{{\left( {{{{\text{H}}}_{2}}{\text{P}}{{{\text{O}}}_{4}}} \right)}_{2}} + 6{\text{HF}} + {\text{Si}}{{{\text{O}}}_{2}} = \\ = {\text{MgSi}}{{{\text{F}}}_{6}} + 2{{{\text{H}}}_{3}}{\text{P}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{2}}{\text{O}}{\text{.}} \\ \end{gathered} $Однако бóльшая доля магния остается в жидкой фазе. Поэтому для графического анализа и расчетов приняты допущения: 1) весь магний остается в растворе, 2) фтор распределяется между жидкой, твердой и газообразной фазами в отношении: 0.8 : 0.08 : 0.12, 3), прочие примеси отнесены к твердой фазе.
Для упрощения расчетов принято, что коэффициент извлечения фосфора из сырья в раствор (Кизвл) и коэффициент отмывки осадка сульфата кальция от фосфорной кислоты (Котм) составляют 100.0%.
Гипсовое число (выход фосфогипса, ФГ), полученное расчетным путем [10], на I стадии составляет 141.0 кг, а в пересчете на конечный фосфополугидрат кальция (ФПГ) – 119.0 на 100.0 кг исходного фосфорита.
На 2-й стадии в определенных условиях в соответствии с реакцией 2 осуществляется перекристаллизация дигидрата сульфата кальция в полугидрат. При этом вводимая на этой стадии серная кислота способствует более полному разложению (доразложению) исходного фосфата, а сокристаллизованный с гипсом фосфор по механизму изоморфного замещения ${\text{SO}}_{4}^{{2 - }} \leftrightarrow {\text{HPO}}_{4}^{{2 - }}$ в силу близости размеров ионных радиусов, при фазовом переходе кристаллогидратов высвобождается обратным замещением и переходит в раствор в виде фосфорной кислоты.
Таблица 1.
Общий материальный баланс процесса получения ЭФК из фосфатного сырья Коксу дигидратно-полугидратным способом
| № потока | Приход | Кол-во, кг | № потока | Расход | Кол-во, кг |
|---|---|---|---|---|---|
| 1 | Фосфорит, | 100.000 | 5 | Отходящие газы (I), | 5.400 |
| в т.ч. P2O5 | 24.500 | в т.ч. CO2 | 5.400 | ||
| 2 | Серная кислота (I), | 36.844 | пары воды | 0.000 | |
| в т.ч. SO3 | 28.272 | 7 | Продукционная ЭФК, | 81.301 | |
| 9 | Серная кислота (II), | 36.844 | в т.ч. P2O5 | 24.390 | |
| в т.ч. SO3 | 28.272 | SO3 | 1.301 | ||
| 14 | Вода на промывку | 123.160 | 10 | Отходящие газы (II), | 0.000 |
| пары воды | 0.000 | ||||
| 16 | Отмытый фосфополугидрат, | 150.195 | |||
| в т.ч. ж.ф., | 27.035 | ||||
| в т.ч. P2O5 | 0.000 | ||||
| SO3 | 0.000 | ||||
| тв.ф., | 123.160 | ||||
| в т.ч. P2O5 | 0.369 | ||||
| SO3 | 55.457 | ||||
| Итого, | 296.849 | Итого, | 236.896 | ||
| в т.ч. P2O5 | 24.500 | в т.ч. P2O5 | 24.759 | ||
| SO3 | 56.545 | SO3 | 56.758 |
ГРАФИЧЕСКИЙ АНАЛИЗ ПРОЦЕССА
Принимаем, что перешедшие в раствор при кислотном разложении исходного фосфорита примеси (MgO, F, R2O3, а также труднорастворимый СаSO4) в сравнительно незначительных количествах не оказывают существенного влияния на графическое положение изотерм растворимости используемой базовой системы СаО–Р2О5–SО3–Н2О.
Фигуративные точки составов наносятся на диаграмму в соответствии с исходными данными, расчетами и построениями. При изложении графического анализа текущие расчеты материальных потоков и составов фаз (на 100.0 кг исходного фосфатного сырья) не приводятся из-за их объемности, но учитываются в сводном балансе.
На рис. 2 приведена проекция изотермы (80°С) системы СаО–Р2О5–SО3–Н2О, построенная по методу вторичных проекций (пунктирная – безводная, сплошные линии – водная проекции).
Рис. 2.
Анализ дигидратно-полугидратного процесса получения ЭФК из фосфоритов Коксу по изотерме (80°C) системы CaO–P2O5–SO3–H2O.
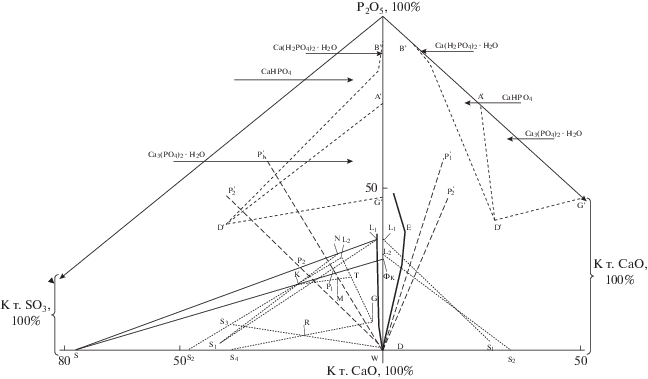
В связи с тем, что начальная дигидратная стадия (I) проводится с введением в процесс оборотной фосфорной кислоты (ОФК), получаемой от промывки ФПГ на второй полугидратной стадии (II), анализ начинается именно с полугидратной стадии процесса.
После перекристаллизации ФГ на полугидратной стадии образуется суспензия, состоящая из сернофосфорнокислотного раствора (L2) и твердой фазы – ФПГ (S2) с н.о. сырья. Задаваясь необходимым с практической точки зрения перемешивания и транспортирования суспензии отношением (Ж : Т)II = 3 : 1 на полугидратной стадии, определим положение точки состава суспензии P2 на рис. 2 на соответствующих соединительных прямых S2L2 из условия (Ж : Т)II = S2P2 : L2P2 = 3 : 1.
Система P2 в то же время образуется при смешении ФГ, полученного на стадии фильтрования дигидратной пульпы, части полученной ЭФК (“оборотная ЭФК”) и cерной кислоты (СК)II. Для упрощения расчетов принимаем, что осадок ФГ не захватывает фосфорную кислоту при фильтрации дигидратной пульпы, т.к. ее количество несравнимо ниже количества оборотной ЭФК (L1), подаваемой на стадию перекристаллизации. Определим положение т. N, которая соответствует системе, полученной при смешении 94.0%-ой (СК)II (S) и оборотной ЭФК (L1) проведением луча из S1 через P2 до пересечения с отрезком SL1. Получаем массу mL1 из соотношения: mL1 : mS = SN : NL1.
Промывка образовавшегося на полугидратной стадии влажного ФПГ (S3) осуществляется водой (W). Положение точки S3 определим исходя из того, что на основании многих практических данных общая влажность промытых образцов ФПГ не превышает 22.0%, что фактически моделирует процесс с наиболее плохими показателями по фильтрации. При смешении влажного ФПГ (S3) с водой (W) в соответствии с соединительной прямой S3W образуется система состава R.
Количество воды, подаваемой на промывку ФПГ, определяется опытным путем в конкретных производственных условиях и влияет на содержание остаточных водорастворимых примесей в отмытом ФПГ, что в свою очередь в значительной степени определяет его вяжущие свойства при последующей утилизации. Принимаем, что количество подаваемой на промывку воды равно количеству твердой фазы во влажном ФПГ, что, в общем случае, согласуется с практическими данными [10]. Соотношение между массой воды, поданной на промывку, и массой влажного ФПГ: mW : mS3 = S3P : PW.
Отмытый ФПГ соответствует ф. т. с. S4, причем мы принимаем, что фильтрация проходит в режиме идеального вытеснения. Так как воды на промывку подано примерно в 3 раза больше по массе, чем содержится жидкой фазы во влажном ФПГ, последняя практически полностью вытесняется из осадка, и, таким образом, в жидкой фазе отмытого ФПГ практически не содержится примесных P2O5 и SO3. Точка состава промывных вод определяется путем проведения луча из т. S4 через R до т. G, отрезок RG соответствует массе S4 из соотношения: mS4 : mG = GR : RS4.
Проведение дигидратной стадии процесса осуществляется при смешении фосфорита (ФК), 94.0%-ой (СК)I (т. S) и раствора разбавления. Для обеспечения необходимой заданной концентрации P2O5 в жидкой фазе системы промывные воды (G) смешиваются с фильтратом полугидратной стадии (L2) по соединительной прямой GL2 с получением раствора разбавления состава т. Т, массы которых вычисляются из соотношения: mG : mL2 = L2T : TG.
Положение т. K (смесь фосфорита и (СК)I) на соединительной прямой SФК определяется, исходя из массового соотношения исходных реагентов данной смеси и в соответствии с реакцией разложения и принятой нормой серной кислоты: mS : mФК = KФК : KS.
При смешении раствора разбавления T с системой K в соответствии с соединительной прямой KT получаем систему состава т. M, соответствующую реакционной массе, находящейся на дигидратной стадии. Положение т. M определяется из соотношения: mT : mK = MK : MT.
Так как система M, должна одновременно принадлежать и прямой S1L1, которая соответствует смеси ФГ (S1) и ЭФК (L1) в конце дигидратной стадии, для замыкания баланса системы и перевода т. М на прямую S1L1 из системы M необходимо удалить избыточную воду, что осуществляется по лучу испарения, исходящему из водного угла W через т. M до пересечения с прямой S1L1в т. P1. Масса удаляемой воды определяется соотношением: mW : mM = P1M : WP1. При этом отношение Ж : Т в дигидратной пульпе составляет: S1P1 : P1L1 = 2.8 : 1, что согласуется с известными практическими данными [9] – 2.33–3.00:1.
Отметим, что значения составов реакционных смесей дигидратной (P1) и полугидратной (P2) стадий отложены на диаграмме в натуральном выражении. В пересчете на сухое вещество соответствующие системы представлены точками $P_{1}^{'}$ и $P_{2}^{'},$ которые располагаются на безводной части диаграммы в поле кристаллизации CaSO4, что является подтверждением его образования в твердой фазе при достижении равновесных условий в системе CaO–P2O5–SO3–H2O.
На основании графических исследований, сопровождаемых материальными расчетами, составлены постадийные и общий (таблица) материальные балансы исследуемого процесса. Расхождение результатов балансовых расчетов по основным компонентам (P2O5, SO3) не превышает 0.53% отн. Ошибка балансовых расчетов (20.19%) связана с влагой системы, которая должна быть упарена в количестве ~60 кг, что реально осуществляется в реакторах на обеих стадиях процесса.
Графический анализ процесса выявляет его предельные возможности и показатели для состояния равновесия. Однако на практике приходится учитывать ограничения, вносимые кинетикой реакций растворения минералов, кристаллизации солей и т.п. В рассмотренном в настоящей статье случае основным ограничением является кинетика разложения (растворение с химической реакцией) фосфата растворами кислот [14–16]. Фосфорит Коксу – карбонатизированная руда осадочного происхождения [14], он может быть отнесен к достаточно высокореактивным фосфатам по сравнению с трудноразлагаемым апатитовым сырьем [15, 16].
Исследования кинетики кислотного разложения фосфоритов, подобных каратауским, показало, что карбонатизированное сырье достаточно быстро и полно разлагается кислотами, а в описании кинетики процесса вполне удовлетворительно проявляет себя модель равномерного униформного уменьшения размеров частиц исходного фосфата в процессе разложения.
ЗАКЛЮЧЕНИЕ
Выполненный графический анализ показал теоретическую возможность и практическую целесообразность получения ЭФК с содержанием 30.0% P2O5 из рядового фосфатного сырья Коксу (24.5% P2O5) при соответствующих температурно-концентрационных условиях проведения дигидратно-полугидратного процесса и позволил априори оценить его конкретные фазовые, концентрационные и массовые характеристики на всех этапах. В частности, определить практически важные показатели: количества оборотной фосфорной кислоты, промывной воды и степень необходимой упарки реакционной пульпы. Полученные данные были использованы при постановке технологических исследований и в основном подтвердились при разработке дигидратно-полугидратного процесса [6].
Методика графического анализа полных технологических циклов процессов переработки минерального сырья в водно-солевых системах может быть успешно использована для сырья различного состава при наличии надежных данных по соответствующим равновесным системам.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ, в рамках реализации Федеральной целевой программы “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014-2020 годы”. Уникальный идентификатор соглашения RFMEFI58317X0068.
ОБОЗНАЧЕНИЯ
Список литературы
Шпунт С.Я. Физико-химические исследования в области сернокислотного разложения природных фосфатов // Исследования по химии и технологии удобрений, пестицидов, солей. М.: Наука, 1966. С. 32.
Яхонтова Е.Л., Петропавловский И.А., Кармышов В.Ф., Спиридонова И.А. Кислотные методы переработки фосфатного сырья. М.: Химия, 1988.
Соколовский А.А., Яхонтова Е.Л. Применение равновесных диаграмм растворимости в технологии минеральных солей. М.: Химия, 1982.
Соколовский А.А. Равновесные диаграммы растворимости в прямоугольных координатах и их применение в технологии минеральных веществ. Дис. ... докт. техн. наук. М.: ЛТИ им. Ленсовета, 1955.
Гриневич А.В., Кузнецов Е.М., Киселев А.А. Усовершенствованный процесс получения ЭФК из фосфоритов Каратау месторождения Коксу // Труды НИУИФ. М., 2014. С. 207.
Гриневич А.В., Киселев А.А., Кузнецов Е.М., Ряшко А.И., Петропавловский И.А. Дигидратно-полугидратный способ получения ЭФК из фосфорита месторождения Коксу // Хим. технология. 2014. № 12. С. 705.
Гриневич А.В., Петропавловский И.А., Киселев А.А., Кузнецов Е.М., Ряшко А.И. Исследование процесса перекристаллизации дигидрата сульфата кальция в полугидрат в условиях получения экстракционной фосфорной кислоты из фосфорита Коксу // Известия вузов. Серия “Химия и химическая технология”. 2015. Т. 58. № 2. С. 27.
Зияна К., Шапкин М.А., Зинюк Р.Ю. Растворимость и кристаллизация в системе CaO–P2O5–H2O при 110–140° // ЖПХ. 1988. Т. 61. № 4. С. 874.
Красильникова И.Г. Минеральный состав фосфоритов Казахстана как сырья для получения экстракционной фосфорной кислоты. Дис. ... канд. геол.-минерал. наук. М.: Моск. геологоразвед. ин-т им. С. Орджоникидзе, 1979.
Белопольский А.П., Таперова А.А., Серебренникова М.Т., Шульгина М.Н. Физико-химический анализ в области сернокислотной переработки фосфатов. Сообщение II. Четверная система CaO–P2O5–SO3–H2O при 80° // Журнал химической промышленности. 1937. № 9. С. 660.
Кашкаров О.Д. Графические расчеты солевых систем. Л.: Госхимиздат, 1960.
Классен П.В., Самигуллина Л.И. Создание современных ресурсосберегающих технологий ЭФК // Химическая промышленность. 1989. № 11. С. 814.
Технология фосфорных и комплексных удобрений / Под ред. С.Д. Эвенчика и А.А. Бродского. М.: Химия, 1987.
Петропавловский И.А., Беспалов А.В. Кинетика кислотного растворения высокореактивных природных фосфатов // Теорет. основы хим. технологии. 1988. Т. 22. № 3. С. 397.
Добрыднев С.В., Бесков В.С., Богач В.В., Почиталкина И.А. Ионометрическое изучение реакции кислотного вскрытия фосфорсодержащего сырья // Теорет. основы хим. технологии. 2001. Т. 35. № 3. С. 310.
Добрыднев С.В., Богач В.В., Бесков В.С. Влияние поверхностно-активных веществ на скорость разложения апатитов минеральными кислотами // Теорет. основы хим. технологии. 2003. Т. 37. № 4. С. 441. [Dobrydnev S.V., Bogach V.V., Beskov V.S. Influence of surfactants on the rate of decomposition of apatites by mineral acids // Theor. Found. Chem. Eng. 2003. V. 37. № 4. P. 412.]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


