Теоретические основы химической технологии, 2019, T. 53, № 4, стр. 387-401
Расчет растворимости ароматических углеводородов в сверхкритических средах на основе энтропийного метода теории подобия
Т. Р. Билалов 1, *, Ф. М. Гумеров 2
1 Казанский национальный исследовательский технологический университет
Казань, Россия
2 Государственный научно-исследовательский институт химических продуктов
Казань, Россия
* E-mail: t.bilalov@yandex.ru
Поступила в редакцию 27.09.2018
После доработки 21.01.2019
Принята к публикации 07.02.2019
Аннотация
Представлены результаты обобщения растворимости ароматических углеводородов в сверхкритическом диоксиде углерода с применением энтропийного метода теории подобия. Предметом обобщения явились экспериментальные данные различных авторов по растворимости 11 веществ, исследованных в диапазоне температур от 300 до 350 К (всего 728 экспериментальных точек и 50 изотерм). Показано, что полученная в результате обобщения зависимость позволяет с приемлемой точностью рассчитывать растворимость ароматических углеводородов, для которых было проведено обобщение, в сверхкритическом диоксиде углерода.
ВВЕДЕНИЕ
Критические явления привлекают неизменный интерес [1–3], оставаясь не в полной мере исследованными, а новые сверхкритические флюидные (СКФ) технологии одна за другой [4–6] движутся в направлении коммерциализации.
Именно величина и характер изменения растворимости веществ в средах, находящихся в СКФ-состоянии, в частности аномальный характер изменения дифференциальной растворимости, во многом определяют целесообразность, достоинства и жизнеспособность ключевых процессов СКФ-технологий.
Основным источником информации по растворимости веществ в СКФ-средах, по-прежнему, остается затратный по средствам и времени эксперимент в рамках различных методов, методик и подходов [7]. В то же время различные исследователи разрабатывают математические модели [8–21], призванные не только обобщить имеющиеся на сегодняшний день многочисленные экспериментальные данные, но и дать возможность прогнозировать растворимость тех или иных веществ с минимальным привлечением экспериментальных данных. Эти модели, в свою очередь, можно условно разделить на два типа. Первый тип моделей основан на различных уравнениях состояния реального газа, таких как уравнение Пенга–Робинсона, Соавва–Редлиха–Квонга, Ван-дер-Ваальса и ряд других [8–16]. Модели этого типа в качестве входных параметров используют критические свойства (температура и давление), фактор ацентричности и давление насыщенных паров или сублимации растворяемого вещества. Экспериментальное определение этих параметров зачастую затруднено или невозможно в силу ряда причин, вследствие чего приходится использовать различные расчетные методы определения этих величин, что часто является причиной некорректностей на этапах описания, обобщения и, тем более, прогнозирования в рамках применяемых моделей. Кроме того, в моделях этого типа для корректного описания растворимости используются так называемые параметры бинарного взаимодействия, вид и количество которых определяет принятый в модели закон смешивания. Имеющийся у авторов настоящей работы опыт подобных расчетов [22–26] показывает, что для получения корректного описания необходим достаточно значимый и не всегда имеющийся в наличии объем экспериментальных данных по растворимости.
Ко второму типу относятся эмпирические модели [17–21], увязывающие растворимость вещества в сверхкритическом флюидном растворителе с его плотностью. Они представляют собой уравнения, константы которых устанавливаются на основе экспериментальных данных по растворимости и являются сугубо индивидуальными. Хотя эти модели и просты, нельзя не обратить внимания на такую некорректность, как оперирование в качестве ключевого фактором термодинамического поведения лишь растворителя, а не раствора в целом. Как следствие, подобные модели способны лишь описывать результаты исследования растворимости. Они не дают качественной информации о взаимодействии растворитель–растворяемое вещество и практически не позволяют корректно предсказывать поведение растворимости.
Таким образом, задача разработки моделей описания и прогнозирования растворимости в сверхкритических флюидных растворителях, позволяющая использовать минимально возможный объем экспериментальных данных и использующая в своей основе альтернативные подходы, является актуальной. К одному из таких подходов можно отнести и энтропийный метод теории подобия, разработанный А.Г. Усмановым [27], позволяющий описывать и обобщать поведение теплофизических свойств веществ и их смесей с достаточно высокой точностью.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Исходными предпосылками для разработки энтропийного метода теории подобия явилась необходимость обобщения опытных данных по теплопроводности, вязкости и диффузии различных веществ [27].
Анализ условий подобия любого процесса заключается в выяснении предпосылок инвариантности уравнений, описывающих этот процесс, по отношению к подобному преобразованию переменных. Если при этом иметь в виду процессы переноса, то здесь уравнения Фурье, Ньютона и Фика оказываются непригодными для решения такой задачи, так как вид их зависимости от температуры и давления в общем случае не известен. Это обстоятельство заставляет искать другие пути анализа условий подобия процессов переноса, которые будут рассмотрены далее.
Процессы переноса относятся к категории неравновесных, поэтому для того чтобы описать состояние системы, в которой протекают эти процессы, в работе [27] предложено разбить ее на ряд макроскопических подсистем. Когда градиенты параметров не слишком велики, состояние каждой такой подсистемы в любой момент времени можно характеризовать определенным значением параметров состояния Р, Т, S и т.д.
В то же время, если рассматриваемая подсистема изменяется, то ее фазовая точка перемещается, описывая какую-то траекторию. Если подсистема составляет часть системы, находящейся в термодинамическом равновесии, траектория фазовой точки лежит в тонком слое вблизи поверхности постоянной энергии. В том случае, когда подсистема составляет часть неравновесной системы, фазовая траектория не остается в пределах этого слоя. В настоящее время записать уравнение движения фазовой точки в явном виде невозможно. Однако, поскольку ее движение происходит в некотором изменяющемся поле плотностей распределения вероятностей, естественно предположить, что относительная скорость перемещения фазовой точки $\overline {{{U}_{{{\text{о т н }}}}}} $ определяется зависимостью вида
(1)
$\overline {{{U}_{{{\text{о т н }}}}}} = \varphi \left( {{\text{grad}}\quad\bar {\rho }} \right),$Очевидно, что зависимость (1) в равной мере относится ко всем молекулярным процессам, так как в этом отношении авторы работы [27] не вводили никаких ограничений.
Средняя относительная скорость движения фазовой точки, или, что равнозначно, средняя относительная скорость молекулярного процесса, будет
(2)
$\overline {{{U}_{{{\text{о т н }}}}}} = \varphi \left( {\frac{{{{S}_{1}} - {{S}_{2}}}}{R}} \right),$Последнее и принимается за основу при обобщении опытных данных по молекулярному переносу. В этом уравнении скорость $\overline {{{U}_{{{\text{о т н }}}}}} $ сохраняет свой прежний смысл и применительно к различным частным проявлениям эффекта переноса должна пониматься как отношения потоков тепла, количества движения и диффузионных потоков. Обобщения этих величин, полученные на основе формулы (2), представлены в работе [27].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В случае с растворимостью в работе [28] предложено уравнение для обобщения полученных автором работы экспериментальных данных по растворимости моно-, ди- и триэтиленгликоля в сверхкритическом диоксиде углерода вида
(3)
$\frac{{y\Delta \mu }}{{{{y}_{{\Delta S}}}\Delta {{\mu }_{{\Delta S}}}}} = \varphi \left( {\frac{{{{S}_{1}} - {{S}_{i}}}}{R}} \right),$Одной из сложностей при разработке модели явилось то, что для определения масштабного коэффициента уΔSΔµΔS необходимо для каждой системы располагать экспериментальными точками, в которых энтропии S1 и S2 имели бы одну и ту же величину. В отсутствие таких данных авторы метода в работе [30] предложили для определения масштабного коэффициента уравнение, которое для разрабатываемой модели примет следующий вид:
(4)
${{y}_{{\Delta S}}}\Delta {{\mu }_{{\Delta S}}} = \frac{{{{y}_{k}}\Delta {{\mu }_{k}}}}{{{{S}_{1}} - {{S}_{k}}}},$Как и в работе [28], химический потенциал и энтропия диоксида углерода при параметрах обобщаемых систем определялись из уравнения состояния Алтунина [31]. Так как большая часть обобщаемых изотерм находится в диапазоне 308–338 К, то в качестве начального значения энтропии S1 было принято значение S1 = 3.5 кДж/(кг К), которое входит в диапазон энтропий этих систем. Масштабный поток определялся в соответствии с уравнением (4).
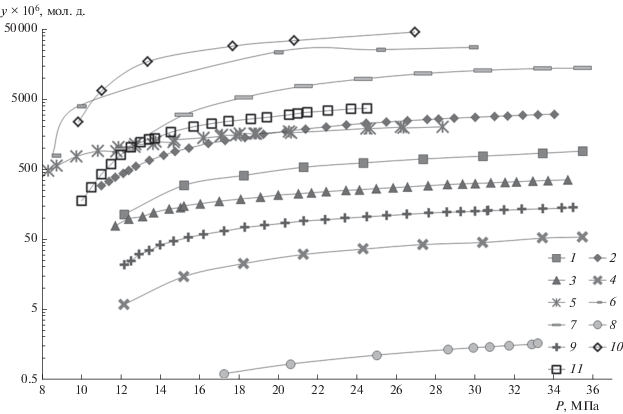
При выборе экспериментальных систем, на основании которых планировалось проводить обобщение, мы ориентировались на работу [18], также посвященную описанию и обобщению растворимости ароматических соединений. Данные по растворимости выбранных нами веществ были взяты из книги [29]. Таким образом, на начальном этапе работ в расчеты было включено 11 веществ, по которым были найдены данные по растворимости на 59 изотермах, исследованных различными авторами, что составило в общей сложности 840 экспериментальных точек, представленных в табл. 1. В графическом виде эти изотермы представлены на рис. 1. Из графика видно, что разброс обобщаемых данных составляет 4 порядка – минимальные значения имеют порядок 10–6, а максимальные – 10–2 мол. д.
Таблица 1.
Исходные системы при разработке модели
| № п/п | Название вещества | Т, К | Источник | № п/п | Название вещества | Т, К | Источник |
|---|---|---|---|---|---|---|---|
| 1 | Флуорантен | 308 | [32] | 31 | Аценафтен | 308 | [32] |
| 2 | 318 | 32 | 318 | ||||
| 3 | 328 | 33 | 328 | ||||
| 4 | 338 | 34 | 338 | ||||
| 5 | 348 | 35 | 348 | ||||
| 6 | Фенантрен | 313 | [33] | 36 | Перилен | 323 | [33] |
| 7 | 323 | 37 | 333 | ||||
| 8 | 333 | 38 | Антрацен | 308 | [34] | ||
| 9 | 308 | [34] | 39 | 313 | [33] | ||
| 10 | 318 | [35] | 40 | 323 | |||
| 11 | 328 | 41 | 333 | ||||
| 12 | 308 | [36] | 42 | 308 | [41] | ||
| 13 | 328 | 43 | 318 | ||||
| 14 | Пирен | 323 | [35] | 44 | 328 | ||
| 15 | 333 | 45 | 313 | [42] | |||
| 16 | 308 | 46 | Бифенил | 308 | [43] | ||
| 17 | Трифенилен | 318 | [32] | 47 | 328 | ||
| 18 | 328 | 48 | 308 | [44] | |||
| 19 | 338 | 49 | 314 | ||||
| 20 | 308 | 50 | 323 | ||||
| 21 | 328 | 51 | 328 | ||||
| 22 | Трифенилметан | 308 | [37] | 52 | Флуорен | 308 | [45] |
| 23 | 318 | 53 | 318 | ||||
| 24 | 318 | 54 | 323 | ||||
| 25 | Нафталин | 348 | [38] | 55 | 328 | ||
| 26 | 333 | 56 | 303 | [46] | |||
| 27 | 338 | [39] | 57 | 308 | |||
| 28 | 313 | [40] | 58 | 323 | |||
| 29 | 323 | 59 | 343 | ||||
| 30 | 333 | [37] | |||||
Рис. 1.
Примеры растворимости (логарифмическая шкала) веществ из табл. 1 в сверхкритическом диоксиде углерода при различных температурах и давлениях (по одной изотерме для каждого вещества): 1 – флуорантен, Т = 328 К, 2 – фенантрен, Т = 323 К, 3 – пирен, Т = 313 К, 4 – трифенилен, Т = 328 К, 5 – трифенилметан, T = 308 К, 6 – нафталин, T = 318 К, 7 – аценафтен, T = 348 К, 8 – перилен, Т = 323 К, 9 – антрацен, Т = 323 К, 10 – бифенил, Т = 328 К, 11 – флуорен, Т = 328 К.
Анализ предварительных результатов, полученных в соответствии с уравнением (3) и представленных на рис. 2, выявил следующее.
Рис. 2.
Результаты обобщения растворимости исследуемых в работе систем: 1 – экспериментальные данные по растворимости из табл. 1, 2 – обобщение растворимости на основе уравнения (3).
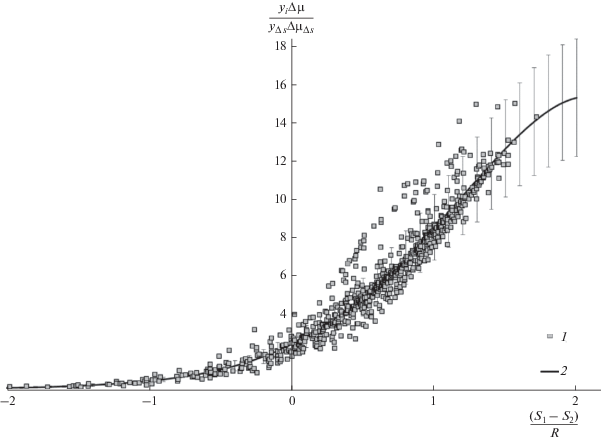
1. Полученный в результате обобщения массив данных описывается полиномом 8-й степени с достаточно большой точностью, однако разброс экспериментальных точек относительно описывающей их кривой превышает 30%.
2. С ростом температуры системы погрешность обратного пересчета растворимости в соответствии с полученным полиномом экспоненциально увеличивается и при температурах более 343 К превышает 40%, а при температуре выше 390 К обратный пересчет дает отрицательные значения растворимости. Это связано с тем, что выбранное нами начальное значение энтропии S1 меньше минимальной энтропии диоксида углерода при температурах и давлениях соответствующих систем.
3. Для большинства веществ растворимость на одних и тех же изотермах была измерена в разное время разными авторами. В большинстве случаев результаты разных измерений коррелировали друг с другом, однако бывали и случаи, когда результаты измерений одного автора значительно отличались от результатов других авторов. В этом случае результаты, которые явно выбивались из общего тренда, исключались из расчетов. В случае, если заметно отличающиеся друг от друга измерения были сделаны только двумя авторами, то оставлялись лишь те результаты, которые вписывались в общую тенденцию изменения растворимости и уравнения обобщающей модели. Анализ исключенных из расчетов работ показал, что основными причинами некорректных с нашей точки зрения данных в них явились, в первую очередь, недостаточная чистота исследуемого авторами вещества, а также неточности в проведении экспериментов. Ранее эти факторы были детально изучены нами на примере растворимости антрацена в сверхкритическом диоксиде углерода. Результаты представлены в работе [23]. Таким образом, из расчетов были исключены системы № 21, 30, 33, 38, 47, 48, 51, 58, 59, а итоговый перечень систем, вошедших в обобщенную модель, представлен в табл. 2.
Таблица 2.
Системы, использованные при разработке модели
| № п/п | Название вещества | Т, К | Количество эксперимен-тальных точек | Источ-ник | № п/п | Название вещества | Т, К | Количество эксперимен-тальных точек | Источ-ник |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Флуорантен | 308 | 9 | [32] | 26 | Нафталин | 338 | 15 | [39] |
| 2 | 318 | 9 | 27 | 313 | 10 | [40] | |||
| 3 | 328 | 9 | 28 | 323 | 5 | ||||
| 4 | 338 | 9 | 29 | Аценафтен | 308 | 9 | [32] | ||
| 5 | 348 | 9 | 30 | 318 | 9 | ||||
| 6 | Фенантрен | 313 | 26 | [33] | 31 | 338 | 9 | ||
| 7 | 323 | 30 | 32 | 348 | 9 | ||||
| 8 | 333 | 30 | 33 | Перилен | 323 | 9 | [33] | ||
| 9 | 308 | 5 | [34] | 34 | 333 | 10 | |||
| 10 | 318 | 6 | [35] | 35 | Антрацен | 313 | 30 | [33] | |
| 11 | 328 | 6 | 36 | 323 | 29 | ||||
| 12 | 308 | 5 | [36] | 37 | 333 | 30 | |||
| 13 | 328 | 5 | 38 | 308 | 5 | [41] | |||
| 14 | Пирен | 323 | 30 | [35] | 39 | 318 | 5 | ||
| 15 | 333 | 32 | 40 | 328 | 5 | ||||
| 16 | 308 | 31 | 41 | 313 | 5 | [42] | |||
| 17 | Трифенилен | 318 | 9 | [32] | 42 | Бифенил | 308 | 6 | [43] |
| 18 | 328 | 9 | 43 | 314 | 6 | [44] | |||
| 19 | 338 | 9 | 44 | 323 | 5 | ||||
| 20 | 308 | 8 | 45 | Флуорен | 308 | 47 | [45] | ||
| 21 | Трифенилметан | 308 | 27 | [37] | 46 | 318 | 21 | ||
| 22 | 318 | 31 | 47 | 323 | 38 | ||||
| 23 | 318 | 28 | 48 | 328 | 21 | ||||
| 24 | Нафталин | 348 | 5 | [38] | 49 | 303 | 5 | [46] | |
| 25 | 333 | 4 | 50 | 308 | 4 |
Кроме того, для повышения точности расчетов был проведен ряд преобразований уравнения (3).
Поскольку в настоящей работе был исследован более широкий температурный диапазон, чем в работе [28], в уравнение (3) была дополнительно введена приведенная температура ${{T}_{r}} = \frac{T}{{{{T}_{c}}}}$ – отношение температуры системы к критической температуре растворяемого вещества. Это позволило снизить разброс экспериментальных точек относительно обобщающей кривой, однако график принял веерообразную форму. Для нивелирования этого эффекта авторами используемого метода в работе [30] был предложен эмпирический коэффициент, позволяющий выровнять обобщаемые кривые. Применительно к настоящей работе, физический смысл этого коэффициента связан с различием в структуре обобщаемых веществ и их полярности.
В результате всех преобразований уравнение (3) приняло следующий вид:
(5)
${\text{ln}}\left( {\frac{{y{\Delta }\mu }}{{{{y}_{{\Delta S}}}{\Delta }{{\mu }_{{{\Delta }S}}}}}\frac{{{{\rho }_{r}}}}{{{{T}_{r}}}}} \right) = {{\varphi }_{i}}{{\left( {\frac{{{{S}_{1}} - {{S}_{2}}}}{R}} \right)}^{i}},$На рис. 3 представлены результаты итогового обобщения растворимости ароматических соединений в сверхкритическом диоксиде углерода. Расчеты позволили вывести следующую функциональную обобщающую зависимость между $\frac{{y\Delta \mu }}{{{{T}_{r}}{{y}_{{\Delta S}}}\Delta {{\mu }_{{\Delta S}}}}}$ и $\frac{{{{S}_{1}} - {{S}_{i}}}}{R}{\text{:}}$
(6)
$\begin{gathered} f(x) = 0.0{\text{141}}{{x}^{{\text{6}}}}--0.0{\text{1}}{{x}^{{\text{5}}}}--0.0{\text{416}}{{x}^{{\text{4}}}}-- \\ - \,\,0.0{\text{521}}{{x}^{{\text{3}}}}--0.{\text{1777}}{{x}^{{\text{2}}}} + {\text{1}}.{\text{8443}}x + {\text{2}}.{\text{1468}}, \\ \end{gathered} $Рис. 3.
Результаты обобщения растворимости исследуемых в работе систем: 1 – экспериментальные данные по растворимости из табл. 2, 2 – обобщение растворимости на основе уравнения (5).
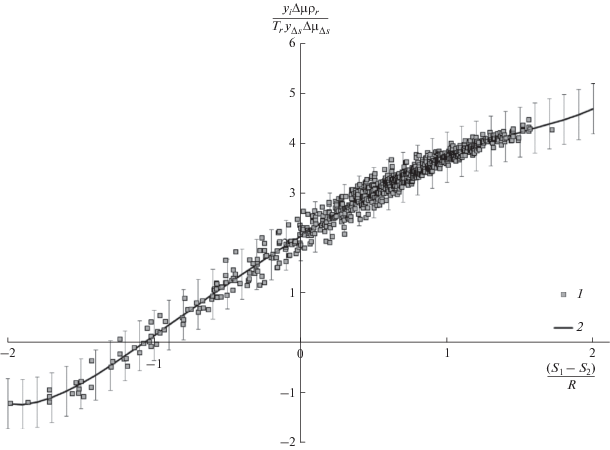
Из рис. 3 видно, что за редким исключением все точки с относительно небольшой погрешностью описываются уравнением (6), что соответствует погрешности экспериментов соответствующих систем [32–43].
В табл. 3 представлены результаты обратного пересчета растворимости некоторых систем из табл. 2 по уравнению
(7)
${{y}_{i}} = \left( {{{e}^{{f\left( x \right)}}}} \right)\frac{{{{T}_{r}}{{y}_{{\Delta S}}}\Delta {{\mu }_{{\Delta S}}}}}{{\Delta \mu {{\rho }_{r}}}},$Таблица 3.
Примеры расчета растворимости по уравнениям (6) и (7)
| Номер системы из табл. 1 | 1 | Номер системы из табл. 1 | 7 | ||||
|---|---|---|---|---|---|---|---|
| Т = 308 К | yexp, мол. д. | ycalc, мол. д. | F, % | Т = 323 К | yexp, мол. д. | ycalc, мол. д. | F, % |
| 12.16 | 236 | 221.6250 | 6.0911 | 11.02 | 299 | 433.5064 | –44.9854 |
| 15.2 | 284 | 275.2282 | 3.0887 | 11.39 | 340 | 504.4542 | –48.3689 |
| 18.24 | 328 | 317.4208 | 3.2254 | 11.71 | 390 | 565.9930 | –45.1264 |
| 21.28 | 363 | 354.0916 | 2.4541 | 12.13 | 446 | 645.4609 | –44.7222 |
| 24.32 | 399 | 388.2458 | 2.6953 | 12.4 | 487 | 695.4225 | –42.7972 |
| 27.36 | 423 | 421.8254 | 0.2777 | 12.77 | 560 | 762.2592 | –36.1177 |
| 30.4 | 465 | 456.2874 | 1.8737 | 13.45 | 680 | 880.3003 | –29.4559 |
| 33.44 | 468 | 492.8015 | –5.2995 | 14.17 | 805 | 999.0776 | –24.1090 |
| 35.46 | 497 | 518.7163 | –4.3695 | 14.76 | 911 | 1092.2017 | –19.8904 |
| Номер системы из табл. 1 | 10 | 15.45 | 1020 | 1196.8565 | –17.3389 | ||
| Т = 303 К | yexp, мол. д. | ycalc, мол. д. | F, % | 16.45 | 1188 | 1341.3214 | –12.9058 |
| 12 | 732 | 612.9204 | 16.2677 | 17.29 | 1302 | 1456.8398 | –11.8925 |
| 16 | 1130 | 1057.2132 | 6.4413 | 18.3 | 1451 | 1589.5977 | –9.5519 |
| 20 | 1390 | 1386.7196 | 0.2360 | 19.24 | 1600 | 1707.7753 | –6.7360 |
| 24 | 1680 | 1657.7274 | 1.3258 | 20.38 | 1770 | 1844.8333 | –4.2279 |
| 25.5 | 1780 | 1749.3718 | 1.7207 | 21.38 | 1915 | 1959.9376 | –2.3466 |
| 27 | 1840 | 1836.8732 | 0.1699 | 22.43 | 2048 | 2076.2002 | –1.3770 |
| Номер системы из табл. 1 | 16 | 23.47 | 2189 | 2187.0880 | 0.0873 | ||
| Т = 333 К | yexp, мол. д. | ycalc, мол. д. | F, % | 24.46 | 2300 | 2289.0001 | 0.4783 |
| 17.41 | 0.82 | 0.7292 | 11.0783 | 25.49 | 2400 | 2391.6488 | 0.3480 |
| 20.9 | 1.11 | 1.0495 | 5.4461 | 26.57 | 2514 | 2495.8613 | 0.7215 |
| 25 | 1.49 | 1.4061 | 5.6311 | 27.56 | 2600 | 2588.5108 | 0.4419 |
| 28.73 | 1.8 | 1.7098 | 5.0120 | 28.15 | 2666 | 2642.5338 | 0.8802 |
| 30.11 | 1.84 | 1.8173 | 1.2361 | 28.94 | 2727 | 2713.5654 | 0.4927 |
| 30.34 | 1.86 | 1.8349 | 1.3486 | 30 | 2811 | 2806.7109 | 0.1526 |
| 31.19 | 2 | 1.8996 | 5.0215 | 30.99 | 2893 | 2891.6298 | 0.0474 |
| 33.12 | 2.07 | 2.0429 | 1.3095 | 31.65 | 2940 | 2947.1799 | –0.2442 |
| 34.61 | 2.15 | 2.1505 | –0.0221 | 32.42 | 3000 | 3011.0849 | –0.3695 |
| 35 | 2.2 | 2.1782 | 0.9907 | 33.2 | 3058 | 3074.7543 | –0.5479 |
| – | 34.03 | 3102 | 3141.5812 | –1.2760 | |||
а также отклонение расчетных значений растворимости от экспериментальных и среднеквадратичное значение этой величины F, рассчитанное как
(8)
$F = \sqrt {\frac{1}{n}\sum\limits_{i = 1}^n {{{{\left( {\frac{{y_{i}^{{{\text{calc}}}} - y_{i}^{{{\text{exp}}}}}}{{y_{i}^{{{\text{exp}}}}}}} \right)}}^{2}}} } .$Из табл. 3 видно, что модель имеет тенденцию к занижению расчетных значений растворимости при низких давлениях и завышению при высоких. Такое поведение характерно для большинства исследованных в работе систем и связано с методом расчета масштабного коэффициента уΔSΔµΔS для различных систем.
Среднее значение величины F для всех исследованных систем из табл. 2 составляет 11.0707%, что также соответствует точности моделей, основанных на различных уравнениях 1состояния вещества [8–21], однако предлагаемый метод значительно проще в расчетах и требует только одно значение растворимости.
Интересной является возможность сравнить точность расчетов растворимости по предложенному методу с точностью описания растворимости, проводимого с использованием уравнения состояния. Для сравнения была выбрана модель описания растворимости, представленная в работе [47]:
а точнее ее логарифмический вид
(10)
$\ln (y)\,\, = \ln \left( {\frac{{{{P}_{v}}}}{P}} \right) - \ln (\Phi )\quad\, + \,\quad\frac{{PV}}{{RT}},$В приведенном уравнении рассчитываемой величиной является летучесть растворяемого вещества во флюиде, тогда как остальные величины, входящие в уравнение (9), определяются экспериментально. Расчет летучести проводится согласно методике, описанной в работе [47].
Сложность проводимых расчетов связана с величиной давления насыщенных паров исследуемого вещества при выбранной температуре. В случае с жидкостями эта величина, как правило, известна с достаточно большой точностью, тогда как в случае с твердыми веществами эта величина часто является неизвестной и трудноопределимой. В связи с этим приходится прибегать к различным расчетным методам и методикам.
Как правило, расчетные методы определения растворимости основаны на использовании принципа соответственных состояний [48].
Если паровая фаза исследуемой жидкости находится в равновесии с ее жидкой фазой, то, исходя из условия равенства химических потенциалов, температуры и давления для обеих фаз, получается уравнение Клаузиуса–Клапейрона (здесь и далее ${{T}_{{{{b}_{r}}}}} = \frac{{{{T}_{b}}}}{{{{T}_{c}}}},$ ${{T}_{r}} = \frac{T}{{{{T}_{c}}}},$ Pv – давление насыщенных паров, Тc и Рc – критические параметры вещества, Т – температура):
(11)
$\frac{{d{{P}_{v}}}}{{dT}} = \frac{{\Delta {{H}_{v}}}}{{T\Delta {{V}_{v}}}} = \frac{{\Delta {{H}_{v}}}}{{({{R{{T}^{2}}} \mathord{\left/ {\vphantom {{R{{T}^{2}}} {{{P}_{v}}}}} \right. \kern-0em} {{{P}_{v}}}})\Delta {{Z}_{v}}}}$или
(12)
$\frac{{d{\text{ln}}({{P}_{v}})}}{{d\left( {{1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T}} \right)}} = - \frac{{\Delta {{H}_{v}}}}{{R\Delta {{Z}_{v}}}}\quad.$Большинство уравнений для расчета корреляции давлений паров получаются путем интегрирования уравнения (12). После интегрирования должна быть выбрана форма зависимости для ΔHv/ΔZv от температуры, а константа, получаемая при интегрировании, определяется по одной точке давление паров–температура. Различные исследователи предлагали свои интерпретации решения этого уравнения. В табл. 4 представлены только некоторые из многих опубликованных уравнений для давлений паров. Упор сделан на уравнения, которые представляются наиболее точными и общими. Для их использования почти во всех случаях необходимо знать только температуру кипения (обычно это нормальная температура кипения) и значения критических параметров (Тc и Рc). Речь идет об уравнениях Клапейрона, Ли–Кеслера, Риделя, Фроста–Колкуорфа–Тодоса и Риделя–Планка–Миллера, которые могут быть представлены в общем виде как
Таблица 4.
Методы расчета давления насыщенных паров, разработанные на базе уравнения (12)
| № п/п | Авторы методики | Расчетное уравнение |
|---|---|---|
| 1 | Уравнение Клайперона | ${\text{ln}}({{P}_{{{{v}_{r}}}}}) = h\left( {1 - \frac{1}{{{{T}_{r}}}}} \right),$ где h = ${{T}_{{{{b}_{r}}}}}\frac{{{\text{ln}}{{P}_{c}}}}{{1 - {{T}_{{{{b}_{r}}}}}}}$ |
| 2 | Метод Ли–Кеслера | ${\text{ln}}({{P}_{{{{v}_{r}}}}}) = {{f}^{{\left( 0 \right)}}}\left( {{{T}_{r}}} \right) + w{{f}^{{\left( 1 \right)}}}\left( {{{T}_{r}}} \right),$ где ${{f}^{{\left( 0 \right)}}} = 5.92714 - \frac{{6.09648}}{{{{T}_{r}}}} - 1.28862\ln \left( {{{T}_{r}}} \right) + 0.169347T_{r}^{6}$ ${{f}^{{\left( 1 \right)}}} = 15.2518 - \frac{{15.6875}}{{{{T}_{r}}}} - 13.4721\ln \left( {{{T}_{r}}} \right) + \quad0.43577T_{r}^{6}$ |
| 3 | Метод Риделя | ${\text{ln}}({{P}_{v}}) = {{A}^{ + }} + \frac{{{{B}^{ + }}}}{T} + {{C}^{ + }}{\text{ln}}T + {{D}^{ + }}{{T}^{6}},$ где ${{A}^{ + }} = - 35Q;\,\,\,\,\quad{{B}^{ + }} = - 36Q;\,\,\,\,{{C}^{ + }} = 42Q + {{\alpha }_{c}};\,\,\,\,{{D}^{ + }} = - Q;$ $Q = 0.0838\left( {3.758 - {{\alpha }_{c}}} \right)$ ${{\alpha }_{c}} = \frac{{0.315{{\psi }_{b}} + {\text{ln}}{{P}_{с }}}}{{0.0838{{\psi }_{b}} - {\text{ln}}{{T}_{{{{b}_{r}}}}}}},$${{\psi }_{b}} = - 35 + \frac{{36}}{{{{T}_{{{{b}_{r}}}}}}} + 42{\text{ln}}{{T}_{{{{b}_{r}}}}} - T_{{{{b}_{r}}}}^{6}$ |
| 4 | Метод Фроста–Колкуорфа–Тодоса | ${\text{ln}}({{P}_{{{{v}_{r}}}}}) = B\left( {\frac{1}{{{{T}_{r}}}} - 1} \right) + \quad\,C{\text{ln}}{{T}_{r}} + \frac{{27}}{{64}}\left( {\frac{{{{P}_{{{{\text{v}}_{r}}}}}}}{{T_{r}^{2}}} - 1} \right),$ где $B = \frac{{{\text{ln}}{{P}_{c}} + 2.67{\text{ln}}{{T}_{{{{b}_{r}}}}} + \frac{{27}}{{64}}\left[ {\left( {\frac{1}{{{{P}_{c}}T_{{{{b}_{r}}}}^{2}}} - 1} \right)} \right]}}{{{{1 - 1} \mathord{\left/ {\vphantom {{1 - 1} {{{T}_{{{{b}_{R}}}}}}}} \right. \kern-0em} {{{T}_{{{{b}_{R}}}}}}} - 0.7816{\text{ln}}{{T}_{{{{b}_{r}}}}}}},$ $C = 0.7816B + 2.67$ |
| 5 | Метод Риделя–Планка–Миллера | ${\text{ln}}({{P}_{{{{v}_{r}}}}}) = - \frac{G}{{{{T}_{r}}}}\left[ {1 - T_{r}^{2} + k\left( {3 + {{T}_{r}}} \right){{{\left( {1 - {{T}_{r}}} \right)}}^{3}}} \right],$ где h = ${{T}_{{{{b}_{r}}}}}\frac{{{\text{ln}}{{P}_{{cr}}}}}{{1 - {{T}_{{{{b}_{r}}}}}}},$$G = 0.4835 + 0.4605h,$$k = \frac{{{h \mathord{\left/ {\vphantom {h G}} \right. \kern-0em} G} - \left( {1 + {{T}_{r}}} \right)}}{{\left( {3 + {{T}_{r}}} \right){{{\left( {1 - {{T}_{r}}} \right)}}^{2}}}}$ |
Результаты сравнения результатов расчетов представлены в табл. 5. Из нее видно, что практически во всех случаях точность расчетов растворимости по предложенному в работе методу существенно выше, чем результаты, получаемые при описании растворимости. Это связано, во-первых, с большим разбросом значений давления насыщенных паров исследуемых веществ, получаемым при применении того или иного метода из табл. 3. Кроме того, на качество описания оказывает влияние точность определения критических параметров исследуемых веществ, и при отсутствии экспериментальных данных по этим величинам приходится также прибегать к различным расчетным методикам. В то же время предложенный в работе метод использует в своей основе только растворимость исследуемого вещества и энтропию диоксида углерода. Эти величины можно определить с достаточно высокой точностью, что позволяет расчетным методом определить значение растворимости того или иного ароматического соединения из табл. 1 в широком интервале давлений и температурах до 350 К, а интерполяция, проведенная таким образом, существенно расширяет возможности применения данных по растворимости ароматических соединений в сверхкритическом диоксиде углерода на области, не охваченные экспериментами.
Таблица 5.
Среднеквадратичные отклонения расчетных значений растворимости, полученных по уравнениям (6) и (9), от экспериментальных значений растворимости
| Название вещества | № сис-темы | Расчет растворимости по уравнению (6) | Расчет растворимости по уравнению (9) с давлением насыщенных паров, рассчитанным по разным методам | |||||
|---|---|---|---|---|---|---|---|---|
| Уравнение Клапейрона | Метод Ли–Кеслера | Метод Риделя | Метод Фроста–Колкуорфа-Тодоса | Метод Риделя–Планка–Миллера | Метод Питерсона | |||
| Флуорантен | 1 | 3.2639 | 17.6294 | 14.0403 | 13.2181 | 13.2181 | 13.2181 | 13.2181 |
| 2 | 5.6598 | 15.4838 | 13.5396 | 13.5396 | 13.5396 | 13.5396 | 13.5396 | |
| 3 | 7.5745 | 15.2529 | 14.5381 | 14.5381 | 14.5381 | 14.5381 | 14.5381 | |
| 4 | 6.1886 | 14.0207 | 13.5521 | 13.5521 | 13.5521 | 13.5521 | 13.5521 | |
| 5 | 15.4798 | 18.9436 | 18.9137 | 18.9137 | 18.9137 | 18.9137 | 17.6074 | |
| Фенантрен | 6 | 11.1206 | 50.4697 | 34.4468 | 32.5895 | 32.5895 | 31.0474 | 31.0474 |
| 7 | 13.6012 | 54.7235 | 34.8431 | 32.3174 | 32.3174 | 30.3243 | 30.3243 | |
| 8 | 18.4210 | 52.0774 | 29.1129 | 26.3710 | 26.3710 | 24.6724 | 24.6724 | |
| 9 | 8.4644 | 26.1827 | 15.1164 | 13.9877 | 13.6257 | 12.4466 | 12.4466 | |
| 10 | 4.3602 | 28.8188 | 13.3348 | 12.2489 | 11.7745 | 11.0112 | 11.0112 | |
| 11 | 6.6986 | 39.8647 | 14.0062 | 11.2084 | 11.2084 | 9.4421 | 9.4421 | |
| 12 | 1.9256 | 31.9764 | 19.3030 | 18.2628 | 18.2628 | 16.9449 | 16.9449 | |
| 13 | 7.7626 | 39.6199 | 14.9255 | 12.2461 | 12.2461 | 10.5886 | 10.5886 | |
| Пирен | 14 | 11.9802 | 61.8374 | 45.8948 | 39.4253 | 39.3903 | 35.7202 | 35.7202 |
| 15 | 10.8415 | 64.4720 | 44.1628 | 35.1439 | 35.1439 | 30.5598 | 30.5598 | |
| 16 | 22.9716 | 69.4595 | 41.8486 | 30.0246 | 30.0246 | 24.7123 | 24.7123 | |
| Трифинилен | 17 | 3.9990 | 10100 | 31.3731 | 31.3731 | 31.3731 | 10100 | 32.4860 |
| 18 | 8.2526 | 10100 | 30.6235 | 30.6235 | 30.6235 | 10100 | 33.5712 | |
| 19 | 12.0935 | 10100 | 30.8543 | 30.8543 | 30.8543 | 10100 | 31.1792 | |
| 20 | 10.6443 | 10100 | 29.5245 | 29.5245 | 29.5245 | 10100 | 30.7210 | |
| Трифенилметан | 21 | 3.1259 | 52.9613 | 32.1053 | 28.9582 | 28.7577 | 20.8547 | 20.8547 |
| 22 | 10.8002 | 73.2215 | 37.8691 | 31.7085 | 31.5409 | 18.2942 | 18.2942 | |
| 23 | 11.0003 | 52.4175 | 29.2305 | 27.3065 | 26.9933 | 26.8107 | 26.8107 | |
| Нафталин | 24 | 9.7158 | 17.9264 | 13.9729 | 13.7875 | 13.7875 | 13.7875 | 13.7875 |
| 25 | 14.3768 | 26.5916 | 22.2942 | 22.0689 | 22.0689 | 22.0689 | 22.0689 | |
| 26 | 8.2355 | 21.6640 | 18.0904 | 17.8425 | 17.8425 | 17.8425 | 17.8425 | |
| 27 | 17.8185 | 32.9473 | 25.5328 | 25.3803 | 25.3803 | 25.3803 | 25.3803 | |
| 28 | 17.2042 | 55.9265 | 31.9769 | 31.2571 | 31.2571 | 31.2571 | 31.2571 | |
| Аценафтен | 29 | 7.8742 | 34.8039 | 19.1916 | 19.1916 | 19.1916 | 19.1916 | 19.1916 |
| 30 | 12.3026 | 28.3661 | 11.7068 | 11.7068 | 11.7068 | 11.7068 | 11.7068 | |
| 31 | 23.7940 | 26.6511 | 7.9334 | 7.9334 | 7.9334 | 7.9334 | 7.9334 | |
| 32 | 25.1743 | 27.7358 | 9.0347 | 9.0347 | 9.0347 | 9.0347 | 9.0347 | |
| Перилен | 33 | 6.0856 | 7.3751 | 7.3751 | 7.3751 | 7.3751 | 7.3751 | 7.3751 |
| 34 | 3.7096 | 18.8044 | 18.8044 | 18.8044 | 18.8044 | 18.8044 | 16.6033 | |
| Антрацен | 35 | 5.5431 | 56.7908 | 43.1965 | 43.1965 | 43.1965 | 42.6510 | 42.6510 |
| 36 | 4.8236 | 71.7962 | 56.7932 | 56.7932 | 56.7932 | 56.0623 | 56.0623 | |
| 37 | 14.4963 | 71.6216 | 52.1737 | 52.1737 | 52.1737 | 51.3292 | 51.3292 | |
| 38 | 12.2865 | 51.6219 | 33.4419 | 33.4419 | 33.4419 | 32.7535 | 32.7535 | |
| 39 | 15.7181 | 69.9520 | 39.3998 | 39.3998 | 39.3998 | 38.1046 | 38.1046 | |
| 40 | 21.2621 | 71.7028 | 26.5743 | 26.5743 | 26.5743 | 25.4591 | 25.4591 | |
| 41 | 11.8885 | 50.6662 | 36.0347 | 36.0347 | 36.0347 | 35.4332 | 35.4332 | |
| Бифенил | 42 | 6.7837 | 29.5219 | 22.2019 | 20.4696 | 20.4696 | 19.1145 | 19.1145 |
| 43 | 5.0012 | 24.3916 | 21.5142 | 20.4865 | 20.4865 | 20.0980 | 20.0980 | |
| 44 | 9.7398 | 30.7306 | 27.7513 | 26.8141 | 26.8141 | 26.4994 | 26.4994 | |
| Флуорен | 45 | 9.5730 | 33.0266 | 10.5801 | 10.5801 | 10.5801 | 9.8399 | 9.8399 |
| 46 | 15.0578 | 53.2331 | 6.4829 | 6.4829 | 6.4829 | 6.0341 | 6.0341 | |
| 47 | 23.7644 | 48.1140 | 6.0593 | 6.0593 | 6.0593 | 5.6691 | 5.6691 | |
| 48 | 22.9577 | 37.4852 | 4.7474 | 3.6542 | 3.4634 | 3.4634 | 3.4634 | |
| 49 | 2.8385 | 19.8776 | 5.8803 | 5.8803 | 5.8803 | 4.9126 | 4.9126 | |
| 50 | 9.2803 | 45.0687 | 18.7311 | 18.7311 | 18.7311 | 17.3876 | 17.3876 | |
ЗАКЛЮЧЕНИЕ
В работе представлена основанная на энтропийном методе теории подобия модель описания и обобщения растворимости ароматических углеводородов в сверхкритическом диоксиде углерода. В отличие от ранее разработанных моделей, представленная модель использует для описания и обобщения растворимости термодинамические параметры сверхкритического диоксида углерода и одно значение растворимости исследуемого вещества в крайней точке на изотерме. Определены граничные условия применимости модели.
Показано, что среднеквадратичное отклонение результатов описания модели в интервале температур от 300 до 350 К в большинстве случаев не превышает 16%, а среднее значение этой величины составляет 11.1%, что сопоставимо с возможностями альтернативных моделей, а также с экспериментальными методами определения растворимости.
Проведено сравнение точности расчета растворимости предложенным методом с методом описания растворимости, использующим в своей основе критические параметры описываемого вещества и его давление насыщенных паров. Показано, что предложенная модель позволяет получить более качественное описание растворимости, а временные затраты на проведение расчетов существенно снижаются за счет прямого расчета искомой величины.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 18-19-00478).
ОБОЗНАЧЕНИЯ
| F | среднеквадратичное отклонение расчетных значений растворимости от экспериментальных, % |
| f(x) | обобщающая функция |
| ΔHv | теплота парообразования, Дж/кг |
| Р | давление, Па |
| R | универсальная газовая постоянная, Дж/(моль К) |
| S | энтропия, Дж/(моль К) |
| Т | температура, К |
| $\overline {{{U}_{{{\text{о т н }}}}}} $ | относительная скорость перемещения фазовой точки |
| V | молярный объем исследуемого вещества, м3/моль |
| ΔVv | изменение молярного объема при парообразовании, м3/моль |
| w | фактор ацентричности |
| x | аргумент обобщающей функции |
| y | растворимость, мол. д. |
| Z | коэффициент сжимаемости |
| Δµ | химический потенциал сверхкритического флюида при параметрах процесса, Дж/моль |
| $\bar {\rho }{\;}$ | распределение плотности вероятности |
| Φ | летучесть растворяемого вещества во флюиде |
ИНДЕКСЫ
| 1 | начальное значение энтропии |
| 2 | конечное значение энтропии |
| b | кипение |
| CO2 | свойства диоксида углерода |
| c | критические параметры вещества |
| calc | расчетное значение |
| exp | экспериментальное значение |
| i | порядковый номер экспериментальной точки на описываемой изотерме |
| k | последняя экспериментальная точка на описываемой изотерме |
| n | количество экспериментальных точек |
| r | приведенная величина |
| ΔS | индекс масштабного коэффициента |
| $v$ | процесс парообразования |
Список литературы
Gumerov F.M., Amirchanov D.G., Usmanov A.G., Le Neindre B. The thermal diffusivity of argon in the critical region // Int. J. Thermophys. 1991. V. 12. № 1. P. 67.
Le Neindre B., Garrabos Y., Gumerov F., Sabirzianov A. Measurements of the thermal conductivity of HFC-134a in the supercritical region // J. Chem. Eng. Data. 2009. V. 54. № 9. P. 2678.
Le Neindre B., Lombardi G., Desmarest P.H., Kayser M., Zaripov Z.I., Gumerov F.M., Garrabos Y. Measurements of the thermal conductivity of ethene in the supercritical region // Fluid Phase Equilibria. 2018. V. 459. P. 119.
Hung T.N., Gumerov F., Gabitov F., Usmanov R., Hairutdinov V., Le Neindre B. Improvement of the water brewing of Vietnamese green tea by pretreatment with supercritical carbon dioxide // J. Supercrit. Fluids. 2012. V. 62. P. 73.
Usmanov R.A., Gumerov F.M., Gabitov F.R., Zaripov Z.I., Shamsetdinov F.N., Abdulagatov I.M. High yield biofuel production from vegetable oils with supercritical alcohols // Liquid Fuels: Types, Properties and Production. N.Y.: Nova Science Publisher, Inc., 2012. Ch. 3. P. 99.
Khairutdinov V.F., Akhmetzyanov T.R., Gumerov F.M., Khabriev I.Sh., Farakhov M.I. Supercritical fluid propane–butane extraction treatment of oil-bearing sands // Theor. Found. Chem. Eng. 2017. V. 51. № 3. P. 299. [Хайрутдинов В.Ф., Ахметзянов Т.Р., Гумеров Ф.М., Хабриев И.Ш., Фарахов М.И. Сверхкритическая флюидная пропан-бутановая экстракционная обработка нефтеносных песков // Теорет. основы хим. технологии. 2017. Т. 51. № 3. С. 288.]
Gumerov F.M., Sagdeev A.A., Amirkhanov D.G. Solubility of substances in supercritical fluid media. Saarbrücken: LAP LAMBERT Academic Publishing GmbH & Co. KG, 2016.
Li H., Jia D., Li S., Liu R. Correlating and predicting the solubilities of structurally similar organic solid compounds in supercritical CO2 using the compressed gas model and the reference solubilities // Fluid Phase Equilibria. 2013. V. 350. P. 13. https://doi.org/10.1016/j.fluid.2013.04.010
Nasri L., Bensaad S., Bensetiti Z. Correlation and prediction of the solubility of solid solutes in chemically diverse supercritical fluids based on the expanded liquid theory // Advances in Chemical Engineering and Science. 2013. V. 3. № 4. P. 255. https://doi.org/10.4236/aces.2013.34033
Trabelsi F., Abaroudi K., Recasens F. Predicting the approximate solubilities of solids in dense carbon dioxide // J. Supercritical Fluids. 1999. V. 14. № 2. P. 151.
da Silva M.V., Barbosa D. Prediction of the solubility of aromatic components of wine in carbon dioxide // J. Supercritical Fluids. 2004. V. 31. № 1. P. 9.
Hartono R., Mansoori G.A., Suwono A. Prediction of solubility of biomolecules in supercritical solvents // Chem. Eng. Sci. 2001. V. 56. P. 6949.
Manohar B., Sankar K.U. Prediction of solubility of Psoralea corylifolia L. Seed extract in supercritical carbon dioxide by equation of state models // Theor. Found. Chem. Eng. 2011. V. 45. P. 409.
Ajchariyapagorn A., Douglas P.L., Douglas S., Pongamphai S., Teppaitoon W. Prediction of solubility of solid biomolecules in supercritical solvents using group contribution methods and equations of state // American J. Food Technology. 2008. V. 3. P. 275.
Madras G., Kulkarni C., Modak J. Modeling the solubilities of fatty acids in supercritical carbon dioxide // Fluid Phase Equilib. 2003. V. 209. P. 207.
Coimbra P., Duarte C.M.M., de Sousa H.C. Cubic equation-of-state correlation of the solubility of some anti-inflammatory drugs in supercritical carbon dioxide // Fluid Phase Equilib. 2006. V. 239. P. 188. https://doi.org/10.1016/j.fluid.2005.11.028
Del Valle J.M., Aguilera J.M. An improved equation for predicting the solubility of vegetable oils in supercritical carbon dioxide // Ind. Eng. Chem. Res. 1988. V. 27. P. 1551.
Nasri L., Bensetiti Z., Bensaad S. Correlation of the solubility of some organic aromatic pollutants in supercritical carbon dioxide based on the UNIQUAC equation // Energy Procedia. 2012. V. 18. P. 1261.https://doi.org/10.1016/j.egypro.2012.05.142
Rathnam V.M., Lamba N., Madras G. Evaluation of new density based model to correlate the solubilities of ricinoleic acid, methyl ricinoleate and methyl 10-undecenoate in supercritical carbon dioxide // Journal of Supercritical Fluids. 2017. V. 130. P. 357.
Tomberli B., Goldman S., Gray C. Predicting solubility in supercritical solvents using estimated virial coefficients and fluctuation theory // Fluid Phase Equilibria. 2001. V. 187. P. 111.
Sparks D.L., Hernandez R., Estévez L.A. Evaluation of density-based models for the solubility of solids in supercritical carbon dioxide and formulation of a new model // Chemical Engineering Science. 2008. V. 63. № 17. P. 4292. https://doi.org/10.1016/j.ces.2008.05.031
Zakharov A.A., Bilalov T.R., Gumerov F.M. Solubility of ammonium palmitate in supercritical carbon dioxide // Russ. J. Phys. Chem. В. 2016. V. 10. P. 1092. [Заха-ров А.А., Билалов Т.Р., Гумеров Ф.М. Растворимость пальмитата аммония в сверхкритическом диоксиде углерода // Сверхкритические флюиды: теория и практика. 2015. Т. 10. № 2. С. 60.]https://doi.org/10.1134/S1990793116070204
Jaddoa A.A., Zakharov A.A., Bilalov T.R., Nakipov R.R., Gabitov I.R., Zaripov Z.I., Gumerov F.M. Some thermodynamic processes of anthracite–carbon dioxide mixture in supercritical fluid state // Russ. J. Phys. Chem. В. 2016. V. 10. P. 1180. [Jaddoa A.A., Захаров А.А., Билалов Т.Р., Накипов Р.Р., Габитов И.Р., Зарипов З.И., Гумеров Ф.М. Некоторые термодинамические свойства смеси “антрацен–диоксид углерода” в сверхкритической флюидной области состояния // Сверхкритические флюиды: теория и практика. 2015. Т. 10. № 4. С. 18.]https://doi.org/10.1134/S1990793116080029
Билалов Т.Р., Гумеров Ф.М., Гатина Р.Ф. Растворимости тротила и его экстракционное извлечение из жестких сгорающих картузов с использованием чистого и модифицированного сверхкритического СО2 // Сверхкритические флюиды: теория и практика. 2016. Т. 11. № 4. С. 17.
Gumerov F.M., Le Neindre B., Bilalov T.R. et al. Regeneration of spent catalyst and impregnation of catalyst by supercritical fluid. N.Y.: Nova Science Publisher, Inc., 2016.
Bilalov T.R., Zakharov A.A., Jaddoa A.A., Gumerov F.M., Le Neindre B. Treatment of different types of cotton fabrics by ammonium palmitate in a supercritical CO2 environment // J. Supercritical Fluids. 2017. V. 130. P. 47.
Усманов А.Г. Об одном дополнительном условии подобия молекулярных процессов // Теплофизика и тепловое моделирование. М.: АН СССР, 1959. С. 298.
Sabirzyanov A.N., Gumerov F.M. Generalizing binary solubility data for low-volatile liquids in supercritical fluids // Theor. Found. Chem. Eng. 2001. V. 35. № 2. P. 129. [Сабирзянов А.Н., Гумеров Ф.М. Обобщение бинарной растворимости низколетучих жидкостей в сверхкритических флюидах // Теорет. основы хим. технологии. 2001. Т. 35. № 2. С. 138.]https://doi.org/10.1023/A:1010373321731
Gupta R.B., Shim J.-J. Solubility in Supercritical Carbon Dioxide. Boca Raton, Fla.: CRC, 2006.
Усманов А.Г., Бережной А.Н. Применение метода подобия при исследовании процессов переноса массы // Журн. физ. химии. 1960. Т. 34. № 4. С. 907.
Алтунин В.В. Теплофизические свойства двуокиси углерода. М.: Изд-во стандартов, 1975.
Yamini Y., Bahramifar N. Solubility of polycyclic aromatic hydrocarbons in supercritical carbon dioxide // J. Chem. Eng. Data. 2000. V. 41. № 1. P. 53.
Anitescu G., Tavlarides L.L. Solubilities of solids in supercritical fluids–I. New quasistatic experimental method for polycyclic aromatic hydrocarbons (PAHs) + pure fluids // J. Supercrit. Fluids. 1997. V. 10. P. 175.
Goodarznia I., Esmaeilzadeh F. Solubility of an anthracene, phenanthrene, and carbazole mixture in supercritical carbon dioxide // J. Chem. Eng. Data. 2002. V. 47. № 2. P. 333.
Lee L.-S. Huang J.-F., Zhu O.-X. Solubilities of solid benzoic acid, phenanthrene, and 2,3-dimethylhexane in supercritical carbon dioxide // J. Chem. Eng. Data. 2001. V. 46. № 5. P. 1156.
Sane A., Taylor S., Sun Y.-P., Thies M.C. A semicontinuous flow apparatus for measuring the solubility of opaque solids in supercritical solutions // J. Supercrit. Fluids. 2004. V. 28. № 2–3. P. 277.
Pauchon V., Cisse Z., Chavret M., Jose J. A new apparatus for the dynamic determination of solid compounds solubility in supercritical carbon dioxide: Solubility determination of triphenylmethane // J. Supercrit. Fluids. 2004. V. 32. № 1–3. P. 115.
Diefenbacher A., Turk M. Phase equilibria of organic solid solutes and supercritical fluids with respect to the RESS process // J. Supercrit. Fluids. 2002. V. 22. № 3. P. 175.
Kalaga A., Trebble M. Density changes in supercritical solvent + hydrocarbon solute binary mixtures // J. Chem. Eng. Data. 1999. V. 44. № 5. P. 1063.
Sauceau M., Fages J., Letoumeau J.J., Richon D. A novel apparatus for accurate measurements of solid solubilities in supercritical phases // Ind. Eng. Chem. Res. 2000. V. 39. № 12. P. 4609.
Li Q., Zhang Z., Zhong C., Liu Y., Zhou Q. Solubility of solid solutes in supercritical carbon dioxide with and without cosolvents // Fluid Phase Equilib. 2003. V. 207. № 1–2. P. 183.
Ngo T.T., Bush D., Eckert C.A., Liotta C.L. Spectroscopic measurement of solid solubility in supercritical fluids // AIChE J. 2001. V. 47. № 11. P. 2566.
Chung S.T., Shing K.S. Multiphase behavior of binary and ternary systems of heavy aromatic hydrocarbons with supercritical carbon dioxide: Part I. Experimental results // Fluid Phase Equilib. 1992. V. 81. P. 321.
McHugh M., Paulaitis M.E. Solid solubilities of naphthalene and biphenyl in supercritical carbon dioxide // J. Chem. Eng. Data. 1980. V. 25. № 4. P. 326.
Bartle K.D., Clifford A.A., Jafar S.A. Measurement of solubility in supercritical fluids using chromatographic retention: The solubility of fluorene, phenanthrene, and pyrene in carbon dioxide // J. Chem. Eng. Data. 1990. V. 35. № 3. P. 355.
Johnston K.P., Ziger D.H., Eckert C.A. Solubilities of hydrocarbon solids in supercritical fluids. The augmented van der Waals treatment // Ind. Eng. Chem. Fundam. 1982. V. 21. № 3. P. 191.
Mukhopadhyay M. Natural Extracts Using Supercritical Carbon Dioxide. Boca Raton, Fla.: CRC, 2000.
Рид Р., Праусниц Д., Шервуд Т. Свойства газов и жидкостей. Л.: Химия, 1982.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


