Теоретические основы химической технологии, 2019, T. 53, № 4, стр. 440-445
Окисление паров иодметана в воздушной среде
А. О. Меркушкин 1, А. В. Обручиков 1, *, Э. П. Магомедбеков 1
1 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: alexobruch@mail.ru
Поступила в редакцию 20.03.2019
После доработки 21.03.2019
Принята к публикации 27.03.2019
Аннотация
Изучено термическое разложение и химическое окисление иодметана в динамических условиях. Методом дифференциального термогравиметрического анализа с последующей масс-спектрометрией установлено, что продуктом химического взаимодействия иодметана с озоном является оксид иода(V), который может быть эффективно уловлен на инертном керамическом носителе при сравнительно невысокой температуре.
ВВЕДЕНИЕ
Поступление радионуклидов в воздух помещений атомных электростанций (АЭС) и в технологическую газовую среду происходит как в условиях нормальных технологических процессов, так и в аварийных ситуациях, когда выбросы радионуклидов могут быть особенно значительными. Главную опасность представляют пары элементарного радиоиода и пары его органических соединений – алкилиодидов. Одной из наиболее опасных и труднолокализуемых летучих форм радиоиода является иодметан CH3I [1, 2]. Для его локализации в условиях нормальной эксплуатации АЭС широкое применение нашли сорбенты на основе импрегнированного активированного угля [3, 4]. Однако его сорбционная способность по отношению к CH3I резко снижается в условиях повышенной влажности газовой среды и особенно при аварийных ситуациях, связанных с разрывом трубопроводов и выходом водного теплоносителя в воздух рабочих помещений АЭС [5, 6]. Широкое применение также находят неорганические серебросодержащие сорбенты на основе цеолитов, силикагелей, оксида алюминия и др. [7, 8], способные эффективно улавливать радиоиод в условиях аварийных ситуаций. На наш взгляд, проблему локализации радиоактивного CH3I можно решить путем его разложения с последующим улавливанием иодсодержащих продуктов. Известно, что разложение CH3I происходит под действием ультрафиолетового излучения, при высоких температурах, а также под воздействием озона [9]. Задачей настоящей работы было исследование процесса разложения паров иодметана при различных температурах, а также процесса окисления CH3I под воздействием озона в потоке воздуха.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изучения термического разложения и окисления паров иодметана был разработан стенд (рис. 1).
Рис. 1.
Схема установки для изучения термического и химического разложения иодметана: 1 – компрессор; 2 – испаритель CH3I; 3 – смеситель; 4 – обогреваемая колонка; 5 – термостат; 6 – ротаметр; 7 – колонка с сигнальным силикагелем; 8 – перистальтический насос; 9 – колонка с магниевой стружкой; 10 – озонатор; 11 – трубчатая печь; 12 – регулирующие вентили; 13 – запорные вентили.
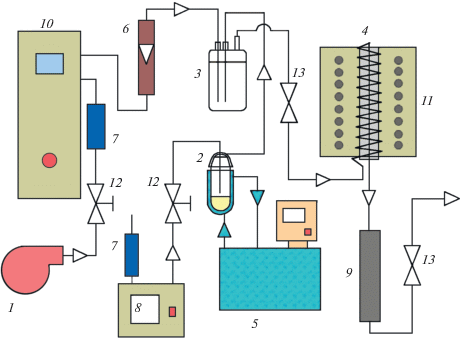
В испаритель 2, к рубашке которого подключен жидкостный термостат 5, помещали порцию (1.5–2.0 мл) иодметана. Пары CH3I, увлекаемые предварительно осушенным потоком воздуха, создаваемым перистальтическим насосом 8, поступали в стеклянный смеситель 3 объемом 250 см3, где смешивались с основным потоком газа-носителя (воздуха). Основной поток воздуха нагнетался компрессором 1 и осушался в колонке с сигнальным силикагелем 7. Далее сухой воздух через озонатор 10 и регулируемый ротаметр 6 направлялся в смеситель. Из смесителя воздух подавался в нагреваемую трубчатой печью 11 стальную колонку 4 высотой 300 мм и внутренним диаметром 32 мм, заполненную дробленой керамикой на основе оксида алюминия (размер зерен 2.5 ± 0.5 мм). На выходе из колонки 4 была установлена контрольная колонка 9, заполненная магниевой стружкой, предназначенная для локализации молекулярного иода с образованием MgI2 (пары иодметана с магнием не взаимодействуют).
Степень конверсии (α) иодметана в молекулярный иод рассчитывали, исходя из общей массы поданного CH3I и приращения массы I2 на колонке с магнием:
(1)
$\alpha = \frac{{M\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{I}}} \right)\Delta m\left( {{\text{Mg}}} \right)}}{{A\left( {\text{I}} \right)\Delta m\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{I}}} \right)}} \times 100{\% ,}$На начальном этапе было исследовано разложение иодметана при различных температурах. Объемный расход газа-носителя составлял 1 л/мин, концентрация паров CH3I в воздушном потоке – 7.5–8.0 мг/л. Продолжительность каждого эксперимента составляла 30 ± 2 мин. После проведения эксперимента фиксировали изменение массы испарителя с иодметаном, а также прирост массы колонки с магнием, свидетельствующий о разложении CH3I с образованием молекулярного иода.
Далее было изучено поведение продуктов химического разложения CH3I в газовом потоке в присутствии озона и влияние повышенных температур на их улавливание в колонке 4 с инертным наполнителем. Концентрацию озона в воздухе при различных скоростях газового потока определяли косвенным титриметрическим методом, основанным на реакции озона с иодидом калия в кислой среде и последующим титрованием выделившегося молекулярного иода тиосульфатом натрия в присутствии водного раствора крахмала в качестве индикатора [10]. При рабочем расходе воздуха 1 л/мин содержание озона составляло 0.41 ± 0.03 об. %.
Продукты химического разложения иодметана при действии на него избытка озона определяли методом дифференциально-термогравиметрического анализа, который выполняли на приборе EXSTAR TG/DTA 7300 SII (платиновые тигли). Образцы нагревали с постоянной скоростью 5°С/мин. Состав газообразных продуктов, выделяющихся при нагревании, определяли при помощи квадроупольного масс-спектрометра THERMOSTAR (Pfeiffer Vacuum).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В соответствии с описанной методикой провели исследование разложения иодметана при температуре от 30 до 550°С. Результаты исследования представлены в табл. 1. Видно, что разложение иодметана начинается только при температуре 250°С. При дальнейшем увеличении температуры степень конверсии резко возрастает. Для расчета времени пребывания газового потока (t1) в нагретой колонке 4 использовали уравнение
где t0 – время пребывания газа в колонке при температуре в лаборатории, с; Tlab – температура в лаборатории, °С; Tcol – средняя температура в колонке 4, °С.Таблица 1.
Степень конверсии CH3I при различных температурах
| Tcol, °С | t1, с | Δm(CH3I), мг | Δm(Mg), мг | α, % |
|---|---|---|---|---|
| 30 | 12.1 | 192.1 | 0.0 | 0.0 |
| 200 | 7.7 | 231.1 | 0.0 | 0.0 |
| 250 | 7.0 | 232.2 | 0.6 | 0.3 |
| 300 | 6.4 | 214.4 | 1.6 | 0.8 |
| 350 | 5.9 | 247.4 | 6.9 | 3.1 |
| 400 | 5.4 | 249.6 | 24.5 | 11.0 |
| 450 | 5.1 | 261.1 | 57.5 | 24.6 |
| 500 | 4.7 | 233.6 | 113.3 | 54.3 |
| 550 | 4.4 | 255.0 | 227.5 | 99.8 |
Время пребывания газа в колонке при температуре в лаборатории (t0) было рассчитано с учетом скорости газового потока, диаметра и общего свободного объема колонки с гранулированным наполнителем.
Таким образом, было установлено, что в условиях эксперимента термическое разложение иодметана полностью протекает только при температуре не менее 550°С.
При подаче избыточного над стехиометрическим количества озона в основной газовый поток было замечено, что смеситель покрывался тонким белым налетом. Нами было сделано предположение, что продуктами взаимодействия озона и иодметана являются оксиды иода. С целью идентификации полученного вещества было исследовано его поведение при нагревании методом дифференциальной термогравиметрии с параллельным масс-спектрометрическим анализом выделяющихся газообразных продуктов. В качестве эталона сравнения была использована иодноватая кислота HIO3, которая при относительно небольшом нагревании обезвоживается с образованием оксида иода(V).
На рис. 2 и 3 представлены результаты дифференциального термогравиметрического исследования термического разложения иодноватой кислоты с масс-спектрометрическим анализом продуктов разложения. На рис. 4 и 5 приведены аналогичные данные для твердого продукта окисления паров иодметана озоном. При температуре 100–140°C из эталонного образца улетучивается кристаллизационная вода, что соответствует первому пику (рис. 3). Второй пик соответствует выделению воды уже при разложении самой HIO3 до I2O5 при температуре 220°C. При температуре выше 380°C начинается разложение I2O5 и образование I2. В анализируемом веществе выделение I2, как видно на рис. 4 и 5, происходит в температурном интервале 380–440°C, что соответствует такому же температурному интервалу при анализе эталона. По нашему мнению, это указывает на то, что основным продуктом окисления иодметана является I2O5.
Рис. 2.
Дифференциально-термогравиметрический анализ чистой HIO3: 1 – изменение массы; 2 – дифференциальное изменение массы; 3 – кривая энергетических эффектов.
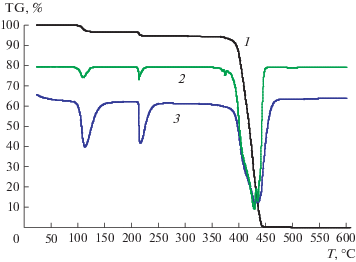
Рис. 3.
Масс-спектрометрический анализ продуктов разложения чистой HIO3: 1 – вода; 2 – кислород; 3 – иод.
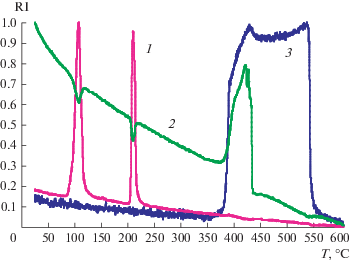
Рис. 4.
Дифференциально-термогравиметрический анализ твердого продукта взаимодействия иодметана с озоном: 1 – изменение массы; 2 – дифференциальное изменение массы; 3 – кривая энергетических эффектов.
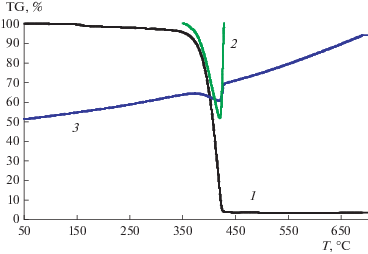
Рис. 5.
Масс-спектрометрический анализ газообразных продуктов термического разложения твердого продукта взаимодействия иодметана с озоном: 1 – вода; 2 – кислород; 3 – иод.
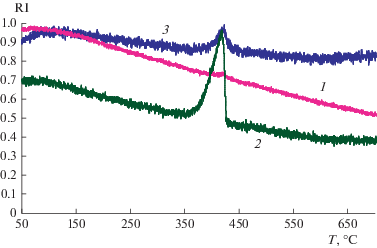
В табл. 2 представлены результаты экспериментов по окислению паров иодметана озоном с последующим улавливанием оксида иода(V). Для того чтобы определить количество оксида иода, локализованного на колонке с керамическим наполнителем, ее разогревали до 950°С и отгоняли образовавшийся молекулярный иод на колонку с магниевой стружкой до ее постоянной массы.
Таблица 2.
Химическое разложение CH3I c последующим улавливанием образовавшегося I2O5
| Tcol, °С | t1, с | Δm(CH3I), мг | n, % | ||
|---|---|---|---|---|---|
| Колонка 9 | Колонка 4 | Σ | |||
| 30 | 12.1 | 213.8 | 0.1 | 44.7 | 44.8 |
| 100 | 9.8 | 274.5 | 0.5 | 94.6 | 95.1 |
| 200 | 7.7 | 218.0 | 0.2 | 96.3 | 96.5 |
| 300 | 6.4 | 223.9 | 0.3 | 99.1 | 99.4 |
| 400 | 5.4 | 217.2 | 6.1 | 93.7 | 99.8 |
| 500 | 4.4 | 121.2 | 9.9 | 90.0 | 99.9 |
Эксперименты показали, что тонкодисперсный аэрозоль оксида иода задерживается на керамике. Причем с ростом температуры степень улавливания на Al2O3 заметно увеличивается. Уже при температуре 300°С суммарное количество уловленного иода составляет более 99%, тогда как при термическом разложении в тех же условиях степень конверсии иодметана составляла лишь 0.8%, а полное улавливание наблюдалось при температурах свыше 500°С.
Задерживание аэрозоля на керамике, по всей видимости, связано с сублимацией его частиц в горячей части колонки с последующей конденсацией пара на зернах керамики в холодной зоне. Следует отметить, что, начиная с температуры 400°С, увеличивается доля молекулярного иода, локализованного на колонке с магниевой стружкой. Это объясняется, очевидно, разложением оксида иода(V) при повышенных температурах и выносом I2 из колонки с оксидом алюминия.
ЗАКЛЮЧЕНИЕ
Результаты проведенных исследований показали, что полное термическое разложение иодметана в динамических условиях происходит при температуре 550°С. При этом наблюдается образование молекулярного I2 как единственного иодсодержащего продукта. Сравнительный ДТА-анализ и масс-спектрометрический анализ показали, что в присутствии сверхстехиометрического количества озона конечным продуктом окисления иодметана является I2O5. Установлено, что оксид иода(V) медленно разлагается при температуре выше 400°С. Предложен простой способ локализации образующегося оксида иода на нагретой до 300°С колонке с инертной засыпкой (степень локализации превышает 99%).
Работа выполнена при финансовой поддержке Российского химико-технологического университета им. Д.И. Менделеева (проект № 022-2018).
ОБОЗНАЧЕНИЯ
| A | атомная масса, г/моль |
| M | молярная масса, г/моль |
| Δm | приращение массы, мг |
| n | количество иода, уловленного в узлах 4 и 9 установки, % |
| RI | относительная интенсивность |
| T | температура, °С |
| TG | относительное значение массы, % |
| t | время контакта газового потока, с |
| α | степень конверсии, % |
| Σ | суммарное значение уловленного иода, % |
ИНДЕКСЫ
Список литературы
Kabat M.J. Chemical Behavior of Radioiodine under Loss of Coolant Accident Conditions // Proc. of the 16th DOE Nuclear Air Cleaning Conf., CONF-801038. 1981. P. 867.
Design of Off-Gas and Air Cleaning Systems at Nuclear Power Plants. IAEA Tech. Report Series № 274. 1987.
González-García C.M., González J.F., Román S. Removal Efficiency of Radioactive Methyl Iodide on TEDA-Impregnated Activated Carbons // Fuel Processing Technology. 2011. V. 92. № 2. P. 247.
Obruchikov A.V., Lebedev S.M. Study on Adsorption Removal of Radioactive Methyl Iodide by Modified Busofit Carbon Fibers // Inorganic Materials: Applied Research. 2012. V. 3. № 5. P. 398.
Rastunov L.N., Magomedbekov E.P., Obruchikov A.V., Lomazova L.A. Evaluation of the Sorbent Layer Thickness in Iodine Filters // Atomic Energy. 2011. V. 110. № 1. P. 68.
Park G.-I., Kim I.-T., Lee J.K., Ryu S.K., Kim J.H. Effect of Temperature on the Adsorption and Desorption Characteristics of Methyl Iodide over TEDA-Impregnated Activated Carbon // Carbon Science. 2001. V. 2. № 1. P. 9.
Faghihian H., Ghannadi Maragheh M., Malekpour A. Adsorption of Radioactive Iodide by Natural Zeolites // J. Radioanalytical and Nuclear Chemistry. 2002. V. 254. № 3. P. 545.
Chapman K.W., Chupas P.J., Nenoff T.M. Radioactive Iodine Capture in Silver-Containing Mordenites through Nanoscale Silver Iodide Formation // J. American Chemical Society. 2010. V. 132. № 26. P. 8897.
Kulyukhin S.A., Mizina L.V., Rumer I.A., Konovalova N.A. Thermal Decomposition of CH3131I in a Gas Flow // Radiochemistry. 2013. V. 55. № 4. P. 404.
Rakness K., Gordon G., Langlais B., Masschelein W., Matsumoto N., Richard Y., Robson C.M., Somiya I. Guideline for Measurement of Ozone Concentration in the Process Gas From an Ozone Generator // Ozone: Science & Engineering. 1996. V. 18. № 3. P. 209.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


