Теоретические основы химической технологии, 2019, T. 53, № 4, стр. 446-451
Влияние характеристик комплексных соединений никеля на скорость химического осаждения и состав сплава никель–фосфор
Е. Г. Винокуров 1, *, Г. М. Мухаметова 1, В. В. Васильев 1, Т. Ф. Бурухина 1, В. Д. Скопинцев 2
1 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
2 Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Москва, Россия
* E-mail: vin-62@mail.ru
Поступила в редакцию 04.02.2019
После доработки 04.03.2019
Принята к публикации 06.03.2019
Аннотация
Рассмотрено влияние характеристик лигандов и комплексных соединений никеля на скорость автокаталитического (химического) осаждения покрытий никель–фосфор и содержание в них фосфора. Установлено, что наибольшее влияние на скорость процесса оказывают заряд комплекса и дентатность лиганда, а на содержание фосфора в покрытии – зарядовое число и устойчивость комплексного иона. Получены математические модели, описывающие взаимосвязь между скоростью осаждения, составом покрытия и характеристиками лигандов. Предложены рекомендации по выбору лигандного состава растворов для химического осаждения сплава никель–фосфор.
ВВЕДЕНИЕ
Покрытия сплавом Ni–P, полученные химическим восстановлением, используются в качестве декоративных и функциональных покрытий в различных отраслях промышленности [1, 2].
Характерной особенностью процесса химического никелирования является многокомпонентность применяемых растворов, отражающая разнообразие и сложность процессов, протекающих в объеме раствора и на каталитически активной поверхности [1, 3]. Длительное использование раствора возможно только при наличии в нем лигандов, связывающих ионы никеля в комплексные соединения, что препятствует образованию малорастворимых фосфитов и основных соединений никеля, частицы которых являются инициаторами реакции в объеме раствора, а также наличия в растворе стабилизаторов, активаторов и буферных добавок [4–8].
Для проведения процесса предложено использование различных лигандов, образующих комплексы с ионами никеля, как в кислой, так и в щелочной среде [1, 3, 4, 9, 10]. В качестве лигандов предложены неорганические вещества (аммиак, борфтористоводородная кислота, пирофосфаты) и многочисленные органические монокарбоновые кислоты (уксусная, пропионовая), дикарбоновые кислоты (малоновая, янтарная, глутаровая), гидроксокислоты (молочная, лимонная, гликолевая) и аминокислоты (глицин, аспарагиновая, этилендиаминтетрауксусная), а также амины (например, этилендиамин). Скорость осаждения покрытий при данной температуре во многом определяется природой лиганда в составе раствора химического никелирования. Использование никелевых комплексов позволяет осуществлять процесс при высоких значениях рН, соответствующих нейтральной или слабощелочной среде, и высоких температурах (98–99°С), обеспечивая не только стабильность раствора, но и высокую скорость осаждения. Влияние лигандов также распространяется и на содержание фосфора в получаемом покрытии [10, 11]. Наиболее эффективными для обеспечения высокой скорости осаждения покрытий при длительном использовании являются билигандные растворы химического никелирования [12].
В предложенных различными учеными механизмах восстановления ионов никеля [13–15] не рассматривается влияние характеристик комплексных ионов никеля на параметры процесса химического осаждения покрытий. В то же время на примере электроосаждения хрома и различных сплавов показана значительная роль комплексных соединений и предложены модели выбора лигандов [16, 17].
Вопрос прогнозирования эффективности различных никелевых комплексов в отношении автокаталитического восстановления до сих пор остается открытым, и выбор лигандов для растворов, используемых в промышленности, осуществляется эмпирически. Предположение о зависимости скорости разряда никелевых комплексов от их константы устойчивости [3, 9] не подтверждается экспериментальными данными, согласно которым скорость осаждения Ni–P покрытий из растворов, содержащих комплексы различной прочности, близки [18]. По-видимому, никелевые комплексы не только присутствуют в растворе, но и входят в той или иной форме в состав интермедиата, адсорбированного на каталитически активной поверхности, скорость разряда которого и определяет скорость осаждения металла [6, 19]. Можно предположить, что на образование интермедиата и легкость его разряда могут влиять дентатность лиганда, заряд образующейся частицы и ее пространственное строение. Эти характеристики определяются как природой лиганда, так и величиной рН в объеме раствора и вблизи каталитической поверхности.
Целью данной работы является оценка влияния характеристик лигандов (дентатность D) и комплексных соединений (КС) (заряда Z и константы устойчивости КС lgβ) никеля на скорость осаждения покрытий Ni–P (V), никеля (VNi) и содержание фосфора в них (wP) при химическом восстановлении комплексов никеля гипофосфитом натрия.
МЕТОДИКА ЭКСПЕРИМЕНТА
Ввиду недостаточности сведений о составе и прочности КС никеля при повышенных температурах эксперименты проводились при комнатной температуре. В этих условиях ощутимых скоростей осаждения покрытий можно добиться только в щелочных растворах. Растворы для осаждения покрытий содержали [20]: сульфат никеля 0.12 М, гипофосфит натрия 0.36 М, аммиак NH3 ∙ H2O 0.24 М, а также лиганд c, где c – концентрация лиганда с 10% избытком, обеспечивающая насыщение внутренней координационной сферы КС (NH3c = 0.8 М; моноэтаноламин (МЭА) – 0.39 М; аминоуксусная кислота (NH2CH2COOH) – 0.39 М; аланин (NH2СH(СН3)СООН) – 0.39 М; сульфосалициловая кислота (C7H6O6S) – 0.26 М); пирофосфат натрия (Na4P2O7) – 0.39 М; цитрат натрия (Na3C6H5O7) – 0.26 М; иминодиуксусная кислота (ИДА) – 0.26 М; этилендиаминтетрауксусная кислота (ЭДТА) – 0.13 М. Для всех растворов устанавливали исходное значение рН, равное 8.5, с помощью корректировки раствором NaOH. Удельная площадь загрузки покрываемой поверхности составляла 2.5 дм2/л. Покрытия получали осаждением на стальные (сталь 08 кп) пластины при температуре раствора 22 ± 1°С.
Образцы обезжиривали четыреххлористым углеродом, а затем суспензией венской извести, промывали дистиллированной водой и высушивали до постоянной массы. Перед началом эксперимента стальную пластину активировали в растворе H2SO4 (10 мас. %), затем промывали дистиллированной водой и погружали в раствор для нанесения покрытий. Для быстрой инициализации выделения никеля образцы приводили в краткосрочный контакт в растворе с алюминиевым стержнем. Длительность осаждения покрытий составляла 22–24 ч. После осаждения покрытий образцы промывали дистиллированной водой и высушивали до постоянной массы.
Учитывая время (t, ч), в течение которого проводилось никелирование, массу выделившегося осадка (m, г), площадь образца (A, см2) и содержание фосфора в покрытии (wP, мас. %), вычисляли скорость осаждения покрытия сплавом (V, мг/(см2 ч)) и никеля (VNi, мг/(см2 ч)) по формулам
(1)
$V = m\,\, \times \,\,{{{{{10}}^{3}}} \mathord{\left/ {\vphantom {{{{{10}}^{3}}} {\left( {A \times t} \right)}}} \right. \kern-0em} {\left( {A \times t} \right)}},$(2)
${{V}_{{{\text{Ni}}}}} = \left( {100--{{w}_{{\text{P}}}}} \right)\,\, \times \,\,{V \mathord{\left/ {\vphantom {V {100}}} \right. \kern-0em} {100}}.$Содержание фосфора в покрытии определяли методом рентгенофлуоресцентной спектрометрии на энергодисперсионном спектрометре EDX-7000 (Shimadzu, Япония).
Для определения кажущейся энергии активации (Ea) проводили не менее четырех аналогичных экспериментов при температурах от 22 до 95°С. Кажущуюся энергию активации оценивали по тангенсу угла наклона, равному (–Ea/2.3R), прямолинейной зависимости lg V от 1/T.
Для построения математической модели, устанавливающей связь между характеристиками лигандов и комплексных соединений никеля, использовали методику пассивного эксперимента [21]. При построении модели все физические величины факторов нормировались и принимали значения от 0 до 1:
(3)
${{X}_{i}} = {{\left( {{{Z}_{i}}--{{Z}_{{{\text{min}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{Z}_{i}}--{{Z}_{{{\text{min}}}}}} \right)} {\left( {{{Z}_{{{\text{max}}}}}--{{Z}_{{{\text{min}}}}}} \right)}}} \right. \kern-0em} {\left( {{{Z}_{{{\text{max}}}}}--{{Z}_{{{\text{min}}}}}} \right)}},$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сравнение скоростей осаждения покрытий из растворов КС с одинаковым зарядовым числом и близкими константами устойчивости, но образованными с лигандами разной дентатности (аммиака с дентатностью 1 и МЭА с дентатностью 2), показывает, что V в аммиакатном растворе выше (0.837 мг/(см2 ч)), чем в растворе с МЭА (0.474 мг/(см2 ч)). Аналогичная зависимость наблюдается и при переходе от системы с глицинатными КС (дентатность 2) к цитратным КС (дентатность 3) (табл. 1). Более устойчивое КС с глицином (lgβ3 = 14.0) обеспечивает большую скорость осаждения по сравнению с цитрат-ионом (lgβ1 = = 7.1) (соответственно 0.300 и 0.245 мг/(см2 ч)). Можно предположить, что повышение дентатности лиганда понижает скорость осаждения покрытий, затрудняя разряд КС.
Таблица 1.
Влияние характеристик лигандов и комплексных соединений на скорость осаждения покрытий Ni–P
| Лиганд (молекула или ион) | D | Z | lg βn | V, мг/(см2 ч) | wP, мас. % |
|---|---|---|---|---|---|
| NH3 | 1 | +2 | 8.01 [22] | 0.837 | 9.25 |
| NH2CH2CH2OH (МЭА) | 2 | +2 | 7.10 [23] | 0.474 | 8.07 |
| NH2CH2COO– | 2 | –1 | 14.0 [24] | 0.300 | 10.77 |
| CH2CH(NH2)COO– | 2 | –1 | 13.05 [24] | 0.348 | 9.23 |
| (–SO3)C6H4(OH)COO– (сульфосалицилат-ион) | 2 | –2 | 10.81 [22] | 0.411 | 9.35 |
| ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{\text{4}}}$ – (пирофосфат-ион) | 2 | –6 | 7.19 [22] | 0.032 | 15.68 |
| ${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{{\text{7}}}^{{3 - }}$ (цитрат-ион) | 3 | –1 | 5.40 [22] | 0.245 | 14.02 |
| ИДА2– иминодиацетат-ион | 3 | –2 | 14.9 [24] | 0 | – |
| ЭДТА4– (этилендиаминтетра-ацетат-ион) | 6 | –2 | 18.60 [22] | 0 | – |
Для оценки влияния зарядового числа на скорость осаждения покрытия были исследованы растворы на основе КС никеля с бидентатными лигандами из ряда МЭА, ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{4--}}}}{\text{,}}$ обладающих близкими значениями констант устойчивости (lgβ3 = 7.1 для [Ni(МЭА)3]2+ и lgβ2 = 7.19 для [Ni(P2O7)2]6–). Предположение о том, что при близости констант устойчивости можно ожидать сопоставимых скоростей формирования покрытия, опровергается экспериментальными данными: скорость осаждения в растворах моноэтаноламиновых КС (0.474 мг/(см2 ч)) на порядок выше, чем в растворе пирофосфатных КС (0.032 мг/(см2 ч)). Такой эффект может быть обусловлен разным зарядовым числом комплекса (+2 для [Ni(МЭА)3]2+ и –6 для [Ni(P2O7)]6–). Подобный эффект наблюдается и при переходе от растворов с глицинатными КС (зарядовое число –1) к пирофосфатным (зарядовое число –6): скорость осаждения уменьшается от 0.300 до 0.032 мг/(см2 ч), в то время как комплексные соединения становятся менее прочными. Заряд пирофосфатного КС отрицательнее заряда глицинатного КС, что приводит к затруднению протекания реакции восстановления, вероятно, вызванному отталкиванием между одноименными зарядами пирофосфатного КС и гипофосфит-иона. Полученные результаты свидетельствуют о значительном влиянии зарядового числа восстанавливаемого комплекса на скорость осаждения покрытия.
Наименьшие величины кажущейся энергии активации восстановления металла получены при разряде КС с положительными значениями зарядового числа (рис. 1), что свидетельствует о значительном вкладе электростатической составляющей в кажущуюся энергию активации [25].
Рис. 1.
Влияние зарядового числа никелевого комплекса на кажущуюся энергию активации реакции осаждения покрытий сплавом Ni–P.
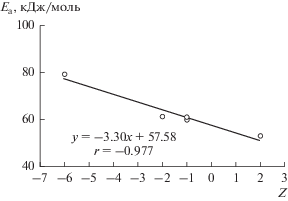
Сравнение растворов комплексов никеля с бидентатными лигандами (анионы глицина и сульфосалициловой кислоты), образующих КС с близкими значениями констант устойчивости, показывает, что скорость осаждения выше в растворе с сульфосалициловой кислотой, несмотря на более отрицательный заряд КС никеля с сульфосалициловой кислотой, что можно связать со специфическим влиянием бензольного кольца.
При этом содержание фосфора в получаемом покрытии мало зависит от дентатности лиганда и зарядового числа комплекса. Исключение составляют пирофосфат- и цитрат-ионы, разряд которых сопровождается значительным включением фосфора в покрытие с одновременным снижением скорости осаждения (табл. 1). Подобную закономерность можно объяснить стерическим фактором: к повышенному включению фосфора в покрытие приводят затруднения с восстановлением никеля из объемных комплексных частиц; кроме того, возможно частичное восстановление фосфора из ${{{\text{P}}}_{{\text{2}}}}{\text{O}}_{{\text{7}}}^{{{\text{4--}}}}$-иона.
Таким образом, основными факторами, влияющими на скорость осаждения покрытия, являются дентатность лиганда и заряд КС. Для оценки степени влияния каждого из рассматриваемых параметров была построена линейная математическая модель вида
устанавливающая связь между скоростью осаждения покрытия и нормированными значениями дентатности лиганда, зарядового числа и логарифма константы устойчивости КС никеля, преобладающего в растворе.
Методом регрессионного анализа [21] была получена зависимость
Для определения уровня значимости полученных коэффициентов регрессии на основании их значений и дисперсии воспроизводимости ($S_{{{\text{в о с п р }}}}^{2}$ = = 0.0043 с числом степеней свободы fвоспр = 5) был рассчитан t-критерий Стьюдента (с учетом элементов ковариационной матрицы). Вычисленные значения t-критерия для коэффициентов уравнения соответственно равны tо = 1.64, t1 = 4.19, t2 = = 7.20 и t3 = 0.53. Для коэффициентов а2, а3 они больше критического значения tкр = 2.57 (p = 0.95, f = 5), что удовлетворяет требованию значимости коэффициентов. Для коэффициентов а0 и а3 они меньше критического значения и, следовательно, как незначимые должны быть исключены из модели. После пересчета коэффициентов получено следующее уравнение:
Вычисленные значения t-критерия для коэффициентов этого уравнения соответственно принимают значения t1 = 6.01 и t2 = 16.32, что больше критической величины tкр = 2.57, и, следовательно, все коэффициенты этого уравнения значимы.
Для оценки адекватности модели с помощью критерия Фишера рассчитаны дисперсия воспроизводимости ($S_{{{\text{в о с п р }}}}^{2}$ = 0.0043; fвоспр = 5) и дисперсия адекватности ($S_{{{\text{а д }}}}^{2}$ = 0.0164; fад = 7), вычислено экспериментальное значение критерия Фишера Fэксп = 3.81, которое меньше критической величины Fкр(7; 5) = 4.88 для уровня значимости 0.05, что свидетельствует об адекватности модели.
После проведения подобных расчетов, оценки значимости коэффициентов и проверки адекватности модели (Fэксп = 3.89 меньше Fкр(7; 5) = 4.88) получено аналогичное уравнение, связывающее скорость осаждения никеля с дентатностью лиганда и зарядовым числом комплекса никеля:
Оба уравнения регрессии показывают, что наибольшее влияние на скорость осаждения покрытий и никеля из КС оказывают дентатность лиганда и зарядовое число комплексного иона, убывая по степени влияния, согласно абсолютным значениям коэффициентов в ряду: заряд комплекса никеля > > дентатность лиганда.
При исследовании осаждения покрытий Ni–P из растворов различных комплексов никеля установлено, что наибольшими скоростями характеризуются системы с аммиаком и МЭА. Скорость осаждения никель-фосфорных покрытий растет при снижении дентатности лиганда и увеличении алгебраического значения зарядового числа КС. По-видимому, формирование адсорбированного на каталитической поверхности интермедиата на основе положительно заряженных монодентатных КС никеля обусловливает повышенную склонность к разряду под действием гипофосфита. В то же время устойчивость КС в отношении его диссоциации в растворе не сказывается на склонности его к разряду с образованием никель-фосфорного покрытия.
Для оценки степени влияния каждого из рассматриваемых факторов была получена математическая модель, описывающая содержание фосфора в покрытии:
При известной дисперсии воспроизводимости определения содержания фосфора ($S_{{{\text{в о с п р }}}}^{2}$ = 0.3963; fвоспр = 3) проверка по критерию Стьюдента показала, что только коэффициент при X1 оказался незначимым (t1 = 1.52 меньше критического значения tкр = 3.18 для p = 0.95, fвоспр = 3). После исключения из модели фактора X1 (дентатность) и пересчета коэффициентов получено уравнение
все коэффициенты которого значимы и оно адекватно описывает экспериментальные данные (Fэксп = 6.52 меньше Fкр(4; 3) = 9.12 для p = 0.95).
Уравнение регрессии показывает, что наибольшее влияние на содержание фосфора в покрытии оказывают не дентатность лиганда, а зарядовое число и затем устойчивость комплексного иона.
При переходе от нормированных переменных к естественным числовым характеристикам факторов получены следующие уравнения математических моделей для скорости осаждения покрытий, никеля и содержания фосфора:
ЗАКЛЮЧЕНИЕ
Полученные данные о влиянии характеристик лигандов и комплексных соединений на скорость осаждения никель-фосфорных покрытий и их состав позволяют сформулировать следующие правила выбора лигандов и/или комплексных соединений никеля для разработки новых высокоэффективных растворов автокаталитического (химического) осаждения покрытий на основе никеля с различным содержанием фосфора:
1) для обеспечения высокой скорости осаждения покрытий необходимо выбирать лиганды с меньшей дентатностью и образующих КС с ионами никеля с положительным зарядовым числом (предпочтительно +2);
2) для осаждения покрытий с высоким содержанием фосфора необходимо выбирать лиганды, образующие с ионами никеля комплексные ионы, имеющими как можно более отрицательный заряд и обладающие наименьшей устойчивостью;
3) для обеспечения формирования покрытий с низким содержанием фосфора необходимо стремиться к выбору лигандов, которые образуют с ионами никеля комплексные ионы с высокой устойчивостью и положительным зарядовым числом.
Исследование проведено при поддержке Министерства образования и науки Российской Федерации в рамках выполнения базовой части государственного задания 10.4556.2017/6.7.
ОБОЗНАЧЕНИЯ
| A | площадь покрытия, см2 |
| D | дентатность лиганда |
| Ea | кажущаяся энергия активации, кДж/моль |
| F | критерий Фишера |
| f | число степеней свободы |
| m | масса покрытия, г |
| $S_{{{\text{а д }}}}^{2}$ | дисперсия адекватности |
| $S_{{{\text{в о с п р }}}}^{2}$ | дисперсия воспроизводимости |
| t | время, ч |
| V | скорость осаждения, мкм/ч |
| w | массовая доля, % |
| Z | зарядовое число (заряд) комплекса |
| β | константа устойчивости комплекса |
ИНДЕКСЫ
Список литературы
Скопинцев В.Д., Винокуров Е.Г. Теоретические и прикладные аспекты автокаталитического формирования покрытий на основе сплава никель–фосфор. М.: ВИНИТИ, 2018.
Sudagar J., Lian J., Sha W. Electroless nickel, alloy, composite and nano coatings – A critical review // J. Alloys and Compounds. 2013. V. 571. № 15. P. 183.
Mallory G.O., Hajdu J.B. Electroless Plating: Fundamentals and Applications. Norwich, N.Y.: American Electroplaters and Surface Finishing Society, 1996.
Шалкаускас М., Вашкялис А. Химическая металлизация пластмасс. 2-е изд. Л.: Химия, 1977.
Gokzhaev M.B., Morgunov A.V., Skopintsev V.D. Optimizing solution composition for the chemical deposition of nickel–copper–phosphorus alloys // Inorganic Materials. 2008. V. 44. № 12. P. 1319. [Гокжаев М.Б., Моргунов А.В., Скопинцев В.Д. Оптимизация состава раствора для получения химических никель-медь-фосфорных покрытий // Неорганические материалы. 2008. Т. 44. № 12. С. 1461.]
Cavallotti P.L., Magagnin L., Cavallotti C. Influence of added elements on autocatalytic chemical deposition electroless Ni–P // Electrochimica Acta. 2013. V. 114. P. 805. https://doi.org/10.1016/j.electacta.2013.09.083
Salvago G., Cavalotti P.L. Characteristics of the chemical reduction of nickel alloys with hypophosphite // Plating. 1972. V. 59. № 7. P. 665.
Vinokurov E.G., Morgunov A.V., Skopintsev V.D. Compositional optimization of chemical copper-doped nickel–phosphorus coatings // Inorganic Materials. 2015. V. 51. № 8. P. 788. [Винокуров Е.Г., Моргунов А.В., Скопинцев В.Д. Оптимизация состава химических никель-фосфорных покрытий, легированных медью // Неорганические материалы. 2015. Т. 51. № 8. С. 859.]
Schlesinger M. Electroless deposition of nickel // Modern Electroplating. Fifth Edition. Hoboken, N.J.: Wiley, 2011. P. 447.
Fujun L.I., Ding L.I.U., Tao Y.E. Effect of complexing agent on low phosphorus electroless nickel plating // Plat. Finish. 2018. V. 40. № 10. P. 6.
Ashtiani A.A., Faraji S., Iranagh S.A., et al. The study of electroless Ni-P alloys with different complexing agents on Ck45 steel substrate // Arabian Journal of Chemistry. 2017. V. 10. Suppl. 2. P. S1541. https://doi.org/10.1016/j.arabjc.2013.05.015
Скопинцев В.Д., Моргунов А.В., Винокуров Е.Г., Невмятуллина Х.А. Повышение производительности процесса химического никелирования // Гальванотехника и обработка поверхности. 2016. Т. 24. № 3. С. 26.
Bremner J.G.M. Nickel plating by chemical reduction // Nature. 1948. V. 162. P. 183. https://doi.org/10.1038/162183b0
Cavallotti P., Salvago G. Studies on chemical reduction of nickel and cobalt by hypophosphite. Pt. 2. Characteristics of process // Electrochem. Metall. 1968. V. 3. № 3. P. 239.
Горбунова К.М., Никифорова А.А. Восстановление никеля гипофосфитом. Вопросы механизма реакции // Журн. физ. химии. 1954. Т. 28. № 5. С. 896.
Vinokurov E.G. Thermodynamic probability model of ligand selection in solutions designed for electrodeposition of alloys and multivalent metals // Protection of Metals and Physical Chemistry of Surfaces. 2010. V. 46. № 5. P. 615. [Винокуров Е.Г. Вероятностно-термодинамическая модель выбора лигандов при разработке составов растворов для электроосаждения сплавов и мультивалентных металлов // Физикохимия поверхности и защита материалов. 2010. Т. 46. № 5. С. 543.]
Vinokurov E.G., Demidov A.V., Bondar’ V.V. Physicochemical model for choosing complexes for chromium-plating solutions based on Cr(III) compounds // Russian J. Coordination Chemistry. 2005. V. 31. № 1. P. 14. [Винокуров Е.Г., Демидов А.В., Бондарь В.В. Физико-химическая модель выбора комплексов для растворов хромирования на основе соединений Cr(III) // Координационная химия. 2005. Т. 31. № 1. С. 17.]
Винокуров Е.Г., Скопинцев В.Д., Невмятуллина Х.А., Моргунов А.В. Ресурсосберегающая технология химического никелирования // Хим. пром-сть сегодня. 2016. № 10. С. 18.
Djokic S.S., Cavallotti P.L. Electroless Deposition: Theory and Applications // Modern Aspects of Electrochemistry. 2010. V. 48. P. 251. https://doi.org/10.1007/978-1-4419-5589-0_6
Винокуров Е.Г., Жигунов Ф.Н., Моргунов А.В., Скопинцев В.Д. Осаждение химических покрытий никель-фосфор и никель-фосфор-медь из глицинатных растворов // Гальванотехника и обработка поверхности. 2015. Т. 23. № 3. С. 40.
Ахназарова С.Л., Кафаров В.В. Методы оптимизации эксперимента в химической технологии. М.: Высшая школа, 1985.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1971.
Тимофеева Е.Г., Галкина Г.И., Корочкина Е.А. Константы устойчивости комплексов никеля с моноэтаноламином в водных растворах // Тр. МХТИ им. Д.И. Менделеева. Вып. 62. М.: МХТИ им. Д.И. Менделеева, 1969. С. 262.
Perrin D.D. Stability Constants of Metal-Ion Complexes. Part B. Oxford: Pergamon Press, 1983.
Moelwyn-Hughes E.A. The Chemical Statics and Kinetics of Solutions. London: Academic Press, 1971.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


