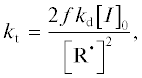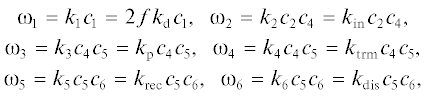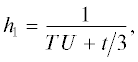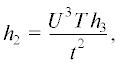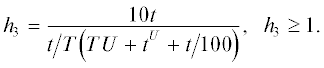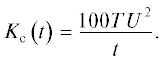Теоретические основы химической технологии, 2019, T. 53, № 4, стр. 410-415
Моделирование процесса радикальной полимеризации с использованием поправочных коэффициентов
М. Н. Патрушева 1, *, Э. Р. Мухамедзянова 1, Р. М. Хузаханов 1
1 Институт полимеров, Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: marina.patrol91@mail.ru
Поступила в редакцию 04.05.2018
После доработки 07.12.2018
Принята к публикации 06.02.2019
Аннотация
На примере радикальной полимеризации стирола, проводимой при 343, 348 и 353 К, рассмотрен расчет среднечисловой степени полимеризации. Для расчета применена система дифференциальных уравнений на графе с введением поправок, заданных в виде формул. При использовании минимального набора исходных данных погрешность вычисленного и экспериментального значения составила 40% при 343 К, 33.3% при 348 К и 37.5% при 353 К. Решена обратная кинетическая задача.
ВВЕДЕНИЕ
Несмотря на то, что непосредственные кинетические данные обычно представляют собой значения концентраций химических компонентов в различные моменты времени, математическое описание оперирует с другим понятием, а именно с производными концентраций (скоростью реакций). Совсем не случайно и не произвольно эмпирическое, а также теоретическое описание реагирующих систем имеют дело с параметрами, входящими в дифференциальное, а не в интегральное уравнение; эти параметры наиболее удобны. Текущие скорости изменения концентраций n-х веществ, т.е. $\frac{{{\text{d}}{{c}_{n}}}}{{{\text{d}}t}},$ имеют вполне определенный физический смысл. Эта производная по времени представляет физически многозначную величину, которая может описывать множество различных процессов, протекающих во времени, а именно: скорость реакции, скорость перемещения, скорость движения молекул [1, с. 19].
Основная идея описания схемы реакций с помощью двудольных ориентированных графов состоит в том, чтобы связать свойства решений системы с геометрическими свойствами графа. Многие важные свойства решений определяются только геометрией графа и не зависят от частного вида функций, выражающих зависимость скоростей стадий радикального процесса от концентраций реагентов. Это позволяет охватить широкий круг задач, не только задачи химической кинетики [2, с. 352].
Математическому моделированию процессов полимеризации посвящено много работ, среди которых можно отметить работу [3] по моделированию полимеризации бутилакрилата и работу [4] по расчету вязкости бутилкаучука. Нередко системой дифференциальных уравнений на графе описывают процессы с участием неорганических веществ. В основном, поправочные коэффициенты при моделировании задаются в численном виде либо в виде формул путем учета большого количества параметров процесса (как в работе [5]), в настоящей статье для описания процессов радикальной полимеризации органических веществ рассмотрено применение системы дифференциальных уравнений на графе, оптимизированной путем применения поправочных коэффициентов, которые являются зависимостями от температуры, конверсии и времени, прошедшего с начала полимеризационного процесса.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Исходные данные. В качестве примера возьмем процесс радикальной полимеризации стирола, проводимый при температурах 343, 348 и 353 К. Инициируется данный процесс азобисизобутиронитрилом, эффективность инициирования которого $f = {\text{89}}{\text{.91}}\quad{\text{exp}}\left( {\frac{{ - {\text{14240}}}}{{{\text{8}}{.314\;}T}}} \right),$ а константа скорости распада – ${{k}_{{\text{d}}}} = {\text{1}}{{{\text{0}}}^{{{\text{15}}{\text{.2}}}}}\quad{\text{exp}}\left( {\frac{{ - {\text{128960}}}}{{{\text{8}}{.314\;}T}}} \right).$ Концентрация мономера в начальный момент времени составляет [M]0 = 5.2 моль/л, а исходная концентрация инициатора – [I]0 = 0.015 моль/л (0.45 мас. % от стирола). При вычислении также использованы данные графиков конверсий мономера в зависимости от времени t [6].
Вычисление параметров процесса. Вычислим скорость полимеризации ${{\vartheta }_{{{\text{pm}}}}},$ концентрации мономера $\left[ M \right]$ и радикалов @$\left[ {{{{\text{R}}}^{\centerdot }}} \right],$ вступающих в реакцию роста, константу скорости обрыва ${{k}_{{\text{t}}}}$ и ее отношение к справочному значению ${\text{g}}$ по формулам (1) [7], (2), (3) [8, с. 13], (4) [6], (5) соответственно:
где $U$ – конверсия мономера;(3)
$\left[ {{{{\text{R}}}^{\centerdot }}} \right] = \frac{{{{\vartheta }_{{{\text{pm}}}}}}}{{{{k}_{{\text{р }}}}\quad\left[ M \right]}}{\text{,}}$(5)
${\text{g}} = {{{{k}_{{\text{t}}}}} \mathord{\left/ {\vphantom {{{{k}_{{\text{t}}}}} {{{k}_{{{{{\text{t}}}_{0}}}}}}}} \right. \kern-0em} {{{k}_{{{{{\text{t}}}_{0}}}}}}}{\text{,}}$Рассмотрим вычисление вышеперечисленных параметров на примере процесса, проводимого при температуре 343 К, результаты вычислений занесем в табл. 1.
Таблица 1.
Параметры процесса, вычисленные по графику временной зависимости конверсии стирола
| t | U | ${{\vartheta }_{{{\text{pm}}}}}$ × 104 | $\left[ M \right]$ | $\left[ {{{{\text{R}}}^{\centerdot }}} \right]{\;} \times {\text{1}}{{{\text{0}}}^{{\text{7}}}}$ | ${{k}_{{\text{t}}}}{\;} \times {\text{1}}{{{\text{0}}}^{{\text{7}}}}$ | g |
|---|---|---|---|---|---|---|
| 0 | 0 | 0 | 5.2 | 0 | 15 | 1 |
| 1800 | 0.08 | 2.31 | 4.78 | 0.937 | 7.6 | 0.514 |
| 5400 | 0.208 | 2 | 4.12 | 0.943 | 7.5 | 0.507 |
| 7200 | 0.256 | 1.85 | 3.87 | 0.927 | 7.7 | 0.525 |
| 16 200 | 0.488 | 1.57 | 2.66 | 1.14 | 5.1 | 0.346 |
| 18 000 | 0.512 | 1.48 | 2.54 | 1.13 | 5.2 | 0.353 |
| 19 800 | 0.576 | 1.51 | 2.2 | 1.33 | 3.8 | 0.255 |
| 21 600 | 0.608 | 1.46 | 2.04 | 1.39 | 3.4 | 0.233 |
| 23 400 | 0.656 | 1.46 | 1.79 | 1.58 | 2.7 | 0.181 |
| 27 000 | 0.784 | 1.51 | 1.12 | 2.61 | 1 | 0.066 |
| 28 800 | 0.9 | 1.63 | 0.52 | 6.06 | 0.18 | 0.012 |
| 30 600 | 0.923 | 1.57 | 0.4 | 7.6 | 0.11 | 0.008 |
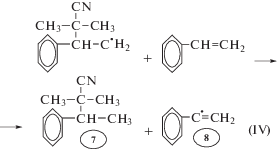
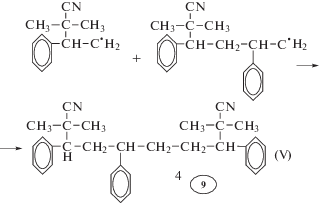
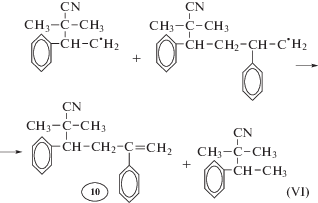
Составление матриц процесса радикальной полимеризации. Рассмотрим процесс радикальной термической полимеризации стирола, инициируемой азобисизобутиронитрилом, по стадиям [9, с. 85]:
1. Распад инициатора (kd)
2. Инициирование (kin)*
3. Рост активных цепей (kp)
4. Передача активных цепей на молекулы мономера (ktrm)
5. Обрыв цепи рекомбинацией (krec = kt)
6. Обрыв цепи диспропорционированием (принимаем упрощение, что kdis = 0)
* – процесс инициирования рассмотрим отдельно от диссоциации инициатора на радикалы,
примем приближение, что константа скорости инициирования ${{k}_{{{\text{in}}}}}$ равна 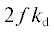 [8, с. 34].
[8, с. 34].
Пронумеруем вещества, входящие в схему выше, в порядке их написания в стадиях без учета повторений и составим атомную матрицу ${\text{D}}$ аналогично [10, с. 50], где строки – это вещества с первого по десятое, первый столбец – атомы углерода, второй столбец – атомы водорода, третий столбец – атомы азота:
Также составим стехиометрическую матрицу G аналогично [10, с. 15], в которой строки – это рассматриваемые стадии реакции (с первой по шестую), а столбцы – вещества с первого по десятое, атомный состав которых отображен в матрице D:
Отрицательные значения в матрице ${\text{G}}$ обусловлены стехиометрическими коэффициентами, которые стоят перед реагентами, положительные значения – это коэффициенты перед продуктами реакции, присутствующими в данной стадии (строке матрицы).
Согласно [10, с. 44–45] необходимо выполнение условия: произведение матриц ${\text{G}}$ и ${\text{D}}$ должно равняться нулю. Действительно, при умножении представленных выше матриц ${\text{G}}$ (6 × 10) и ${\text{D}}$ (10 × 3) получаем нулевую матрицу (6 × 3).
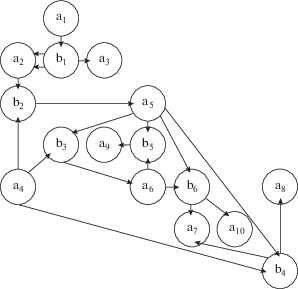
Составление кинетической модели процесса радикальной полимеризации. На рис. 1 представлен граф радикального процесса, соответствующий постадийной схеме:
Конечный ориентированный двудольный граф включает в себя множества ${\text{A}} = \left\{ {{{{\text{а }}}_{{\text{1}}}}{,\; \ldots ,\;}{{{\text{а }}}_{{\text{n}}}}} \right\}$ – вершины графа, соответствующие веществам, участвующим в реакциях, и ${\text{B}} = \left\{ {{{{\text{b}}}_{{\text{1}}}}{,\; \ldots ,\;}{{{\text{b}}}_{{\text{m}}}}} \right\}$ – вершины графа, соответствующие самим реакциям, т.е. стадиям процесса [2, с. 351].
Составим кинетическую модель процесса радикальной полимеризации в виде системы дифференциальных уравнений скоростей изменения концентраций веществ ${{c}_{n}}$ за единицу времени $t,$ где коэффициенты соответствуют столбцам матрицы ${\text{G:}}$
(6)
$\begin{gathered} \frac{{{\text{d}}{{c}_{{\text{1}}}}}}{{{\text{d}}t}} = - {{{\omega }}_{{\text{1}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{\text{2}}}}}}{{{\text{d}}t}} = {\text{2}}\quad{{{\omega }}_{{\text{1}}}} - {{{\omega }}_{{\text{2}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{\text{3}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{1}}}}{\text{,}} \\ \frac{{{\text{d}}{{c}_{{\text{4}}}}}}{{{\text{d}}t}} = - {{{\omega }}_{{\text{2}}}} - {{{\omega }}_{{\text{3}}}} - {{{\omega }}_{{\text{4}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{\text{5}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{2}}}} - {{{\omega }}_{{\text{3}}}} - {{{\omega }}_{{\text{4}}}} - \\ - \,\,{{{\omega }}_{{\text{5}}}} - {{{\omega }}_{{\text{6}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{\text{6}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{3}}}} - {{{\omega }}_{{\text{5}}}} - {{{\omega }}_{{\text{6}}}}{\text{,}} \\ \frac{{{\text{d}}{{c}_{{\text{7}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{4}}}} + {{{\omega }}_{{\text{6}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{\text{8}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{4}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{\text{9}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{5}}}}{\text{,}}\,\,\,\,\frac{{{\text{d}}{{c}_{{{\text{10}}}}}}}{{{\text{d}}t}} = {{{\omega }}_{{\text{6}}}}{\text{,}} \\ \end{gathered} $Введем в систему ${\text{(6)}}$ поправку ${{h}_{{\text{1}}}}$ при расчете константы инициирования ${{k}_{{{\text{in}}}}}$ = 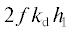 в формуле ${{{\omega }}_{{\text{2}}}}{\text{:}}$
в формуле ${{{\omega }}_{{\text{2}}}}{\text{:}}$
(8)
${{{\omega }}_{{\text{2}}}} = {{k}_{{\text{2}}}}\quad{{c}_{{\text{2}}}}\quad{{c}_{{\text{4}}}} = {{k}_{{{\text{in}}}}}\quad{{h}_{{\text{1}}}}\quad{{c}_{{\text{2}}}}\quad{{c}_{{\text{4}}}}{\text{,}}$поправку ${{h}_{{\text{2}}}}$ в производную $\frac{{{\text{d}}{{c}_{{\text{2}}}}}}{{{\text{d}}t}}{\text{:}}$
(9)
$\frac{{{\text{d}}{{c}_{{\text{2}}}}}}{{{\text{d}}t}} = {\text{2}}\quad{{{\omega }}_{{\text{1}}}} - {{{\omega }}_{{\text{2}}}} + {{h}_{{\text{2}}}}$и поправку ${{h}_{{\text{3}}}}$ в производную $\frac{{{\text{d}}{{c}_{{\text{4}}}}}}{{{\text{d}}t}}{\text{:}}$
(10)
$\frac{{{\text{d}}{{c}_{{\text{4}}}}}}{{{\text{d}}t}} = - {{{\omega }}_{{\text{2}}}} - {{{\omega }}_{{\text{3}}}} - {{{\omega }}_{{\text{4}}}} - {{h}_{{\text{3}}}}{\text{,}}$которые позволят регулировать равенство данной производной с концентрацией мономера, вычисленной по формуле (2) в соответствующий момент времени. Данные поправки позволяют решить обратную кинетическую задачу с помощью системы (6) и найти среднечисловую степень полимеризации.
Были аппроксимированы введенные поправки в виде формул с целью рассмотрения возможности применения их для других радикальных процессов:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В программе MathCAD получена математическая модель, позволяющая вычислить концентрации участвующих в процессе радикальной полимеризации веществ. При решении обратной кинетической задачи и поиске поправок использовалась формула для вычисления среднечисловой степени полимеризации ${{P}_{n}}$ в момент времени $t{\text{:}}$
(14)
${{P}_{n}}\left( t \right) = \frac{{{{{\rho }}_{{\text{9}}}}}}{{m\quad{{c}_{{\text{9}}}}\left( t \right)}}{\text{,}}$После аппроксимирования поправок ${{h}_{{\text{1}}}},$ ${{h}_{{\text{2}}}},$ ${{h}_{{\text{3}}}}$ в формулу $\left( {{\text{14}}} \right)$ был введен коэффициент корреляции ${{K}_{{\text{с }}}}$ в виде функции
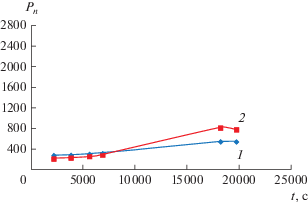
Результаты вычислений в сравнении с экспериментальными данными приведены на рис. 2–4 для процесса, проводимого при температурах 343, 348 и 353 К соответственно.
Рис. 2.
Зависимость среднечисловой степени полимеризации от времени при температуре 343 К: 1 – кривая, построенная по экспериментальным данным; 2 – кривая, построенная по вычисленным данным.
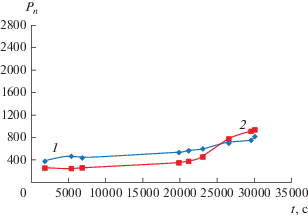
Рис. 3.
Зависимость среднечисловой степени полимеризации от времени при температуре 348 К: 1 – кривая, построенная по экспериментальным данным; 2 – кривая, построенная по вычисленным данным.
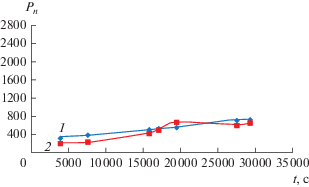
Рис. 4.
Зависимость среднечисловой степени полимеризации от времени при температуре 353 К: 1 – кривая, построенная по экспериментальным данным; 2 – кривая, построенная по вычисленным данным.
Максимальная погрешность вычисленного и экспериментального значения среднечисловой степени полимеризации составляет 40% при 343 К, 33.3% при 348 К и 37.5% при 353 К.
ЗАКЛЮЧЕНИЕ
Представлена математическая модель радикального процесса полимеризации на примере термической радикальной полимеризации стирола. Полученная кинетическая модель соответствует виду системы дифференциальных уравнений на графе:
(16)
$\frac{{{\text{d}}{{c}_{n}}}}{{{\text{d}}t}} = \sum\limits_{i = 1}^m {{{{\gamma }}_{{{\text{in}}}}}\quad{{{\omega }}_{i}}\left( {t{\text{,}}c} \right) + {{e}_{n}}\left( t \right)} {\text{,}}$В статье представлен подробный алгоритм нахождения недостающих для расчета данных из графиков конверсии и составления кинетической модели радикального процесса полимеризации с использованием минимального набора исходных данных. Разница вычисленного и экспериментального значения среднечисловой степени полимеризации составляет порядка 40%, что обусловлено идеей задать поправочные коэффициенты в виде формул, в которых учитываются только такие параметры процесса, как температура, конверсия и время, прошедшее с начала полимеризации. Применимость аналогичных поправок и коэффициента корреляции необходимо проверить на других радикальных процессах.
ОБОЗНАЧЕНИЯ
| $\left[ I \right]$ | концентрация инициатора, моль/л |
| $\left[ M \right]$ | концентрация мономера, моль/л |
| $[{{{\text{R}}}^{\centerdot }}]$ | концентрация радикалов, моль/л |
| c | молярная концентрация вещества, моль/л |
| e | безразмерная поправка в общем виде системы дифференциальных уравнений на графе |
| f | безразмерная эффективность инициатора |
| g | коэффициент константы скорости реакции обрыва, учитывающий гель-эффект |
| h | безразмерная поправка в системе дифференциальных уравнений |
| K | безразмерный коэффициент корреляции |
| k | константа скорости реакции, $\frac{{\text{л }}}{{{м о л ь \;с }}}$ |
| m | молекулярная масса мономера, г/моль |
| P | безразмерная среднечисловая степень полимеризации |
| T | температура, К |
| t | время, с |
| U | безразмерная конверсия мономера |
| γ | безразмерная сумма элементов стехиометрической матрицы |
| ρ | плотность, г/л |
| ϑ | скорость реакции, $\frac{{{\text{м о л ь }}}}{{{л \;с }}}$ |
| ω | скорость реакции в системе дифференциальных уравнений, $\frac{{\text{1}}}{{\text{с }}}$ или $\frac{{{\text{м о л ь }}}}{{{л \;с }}}$ |
ИНДЕКСЫ
Список литературы
Бенсон С. Основы химической кинетики. М.: Мир, 1964.
Вольперт А.И., Худяев С.И. Анализ в классах разрывных функций и уравнения математической физики. М.: Наука, 1975.
Галеев Э.Р., Лежнева Н.В., Елизаров В.В., Елизаров В.И. Математическое моделирование процесса полимеризации бутилкаучука // Вестник технологического университета. 2016. Т. 19. № 23. С. 92.
Улитин Н.В., Терещенко К.А., Дебердеев Т.Р., Насыров И.И., Самарин Е.В., Калинина Д.Ш. Псевдоживая радикальная полимеризация бутилакрилата в присутствии тритиокарбонатов: моделирование кинетики и регулирование молекулярно-массовых характеристик полимера // Теорет. основы хим. технологии. 2015. Т. 49. № 1. С. 79.
Аминова Г.А., Антонова И.О., Бронская В.В., Мануйко Г.В., Игнашина Т.В., Исмагилова А.И. Математическое моделирование процесса синтеза бутилкаучука // Вестник технологического университета. 2012. Т. 15. № 4. С. 103.
Tefera N., Weickert G., Bloodworth R., Schweer J. Free radical suspension polymerization kinetics of styrene up to high conversion // Macromol. Chem. Phys. 1994. V. 195. P. 3067.
Ханукаева И.А., Колесников Г.С. Изучение кинетики полимеризации стирола в вязких средах // Высокомол. соединения. Сер. А. 1968. Т. 10. № 5. С. 1127.
Багдасарьян Х.С. Теория радикальной полимеризации. М.: Наука, 1966.
Савада Х. Термодинамика полимеризации. М.: Химия, 1979.
Исмагилова А.С., Спивак С.И. Математическое моделирование химических процессов. Уфа: РИЦ БашГУ, 2014.
Краснов К.С., Воробьев Н.К., Годнев И.Н., Васильева В.Н., Васильев В.П., Киселева В.Л., Белоногое К.Н., Гостикин В.П. Физическая химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ. М.: Высшая школа, 1995.
Вольперт А.И. Дифференциальные уравнения на графах // Мат. сб. 1972. Т. 88(130). № 4(8). С. 578.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии