Теоретические основы химической технологии, 2019, T. 53, № 5, стр. 510-516
Экстракция хлоридных комплексов железа(III) в системе полипропиленгликоль 425–NaCl–H2O
Ю. А. Заходяева 1, *, И. В. Зиновьева 1, А. А. Вошкин 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 МИРЭА – Российский технологический университет
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 20.05.2019
После доработки 27.05.2019
Принята к публикации 27.05.2019
Аннотация
Приведены результаты экспериментальных исследований межфазного распределения железа(III) в экологически безопасной двухфазной водной системе на основе полипропиленгликоля с молекулярной массой 425 и хлорида натрия. Установлен механизм экстракции, определены количественные характеристики процесса экстракции железа(III) в исследуемой системе.
ВВЕДЕНИЕ
Традиционно железо извлекают из руд с его высоким содержанием с помощью флотации и пирометаллургии, а его извлечение из руд, хвостов и отходов с низким содержанием – с использованием гидрометаллургических процессов [1–3]. Однако присутствие железа в кислом растворе выщелачивания является распространенной проблемой в большинстве гидрометаллургических процессов, в том числе процессов переработки отходов производства и потребления, и его удаление проводят методом осаждения или экстракции. Осадительные методы очистки растворов от железа в ряде случаев малоэффективны вследствие больших расходов на нейтрализацию растворов, а также ввиду соосаждения с гидроксидом железа(III) ценных металлов и примесей.
Большинство гидрометаллургических технологических схем извлечения, разделения и очистки цветных и редких металлов основано на использовании сульфатных, хлоридных и нитратных растворов или их смесей. Существенно влиять на состав водных растворов для улучшения показателей экстракционного извлечения железа в большинстве случаев экономически нецелесообразно, в отличие от решения аналитических задач, при которых в раствор могут быть добавлены комплексообразователи, окислители и т.д.
При разработке экстракционных процессов извлечения железа из растворов различного состава следует учитывать состояние компонентов в водной фазе. В первую очередь необходимо учитывать комплексообразование катиона Fe3+ с анионами минеральных кислот, которое может способствовать или, наоборот, препятствовать извлечению железа в зависимости от механизма экстракции.
Результаты исследований [4] показывают, что значения закомплексованности при различных составах растворов сильно отличаются и увеличиваются в ряду ${\text{NO}}_{{\text{3}}}^{ - }{\text{ < \;C}}{{{\text{l}}}^{ - }}{\text{\; < \;SO}}_{{\text{4}}}^{{{\text{2}} - }}.$ С другой стороны, важно учитывать гидратацию образующихся комплексов и особенно анионов минеральных кислот, если они входят в состав экстрагируемых соединений, как при экстракции солей железа нейтральными экстрагентами, или извлекаются в органическую фазу взаимосвязано с распределением катионов Fe3+, как при бинарной экстракции солей железа.
Для эффективного извлечения железа и при необходимости очистки от других примесей в зависимости от состава водного раствора используют различные экстрагенты: фосфорорганические кислоты (D2EHPA, Cyanex 272, PC88A, Cyanex 301, Cyanex 302), карбоновые кислоты (Versatic 10), третичные амины (Alamine 336), соли четвертичных аммониевых оснований (Aliquat 336), нейтральные экстрагенты (трибутилфосфат, метилизобутилкетон, Cyanex 921, Cyanex 923, амиды), хелатные экстрагенты (Lix 860 и Lix 984) и др. [5–14].
Экстракция фосфорорганическими и высокомолекулярными алифатическими кислотами происходит по катионообменному механизму, поэтому ионы многих металлов экстрагируются вместе с железом. Карбоновые кислоты имеют достаточно высокую растворимость в водной фазе, что приводит к потере экстрагента. Кроме того, в случае использования катионообменных экстрагентов при извлечении железа из солянокислых растворов требуется их предварительная нейтрализация [7, 8].
При исследовании экстракции железа(III) из кислых хлоридных растворов нейтральными кислородсодержащими экстрагентами различных классов было показано, что трибутилфосфат является наиболее эффективным и проявляет лучшие технологические характеристики. Экстракция железа при концентрации HCl 6–10 моль/л и выше протекает с высокими коэффициентами распределения, а при концентрации HCl < 2 моль/л железо практически не извлекается в органическую фазу [6].
Анионообменные экстрагенты, например Aliquat 336, эффективно извлекают анионные хлорокомплексы железа(III) [14]. Однако в подобных системах вследствие большой термодинамической устойчивости экстрагируемого комплекса R3NCH3 · FeCl4 реэкстракция железа водой из органической фазы затруднена, поэтому для реэкстракции используют растворы солей или кислот с анионами, образующими сильно гидратированные комплексы с катионом Fe3+ или комплексообразователи.
Для очистки кислых хлоридных растворов от железа(III) может быть использована экстракция HFeCl4 бинарными экстрагентами [4, 15–17]. При экстракции железа(III) бинарными экстрагентами различного состава (5-кратный избыток по отношению к Fe) было установлено, что соли триалкиламмония на основе монокарбоновых кислот нормального строения и α-разветвленных кислот, а также алкилфенолов различного строения извлекают железо(III) из хлоридных алюминиевых растворов с коэффициентами распределения в интервале 60–300. Реэкстракция железа существенно улучшается по сравнению с исходной системой с хлоридом триалкиламмония, а также при использовании алкилфенолятов по сравнению с карбоксилатами триалкиламмония. Увеличение концентрации HCl способствует экстракции железа каприлатом триалкиламмония, и при концентрации соляной кислоты более 5 моль/л коэффициенты распределения железа(III) равны 102 и выше. Важно отметить, что при использовании растворов бинарных экстрагентов в монокарбоновых кислотах модификаторы не требуются. Высокая температура вспышки монокарбоновых кислот обеспечивает пожаро- и взрывобезопасные условия проведения экстракции в промышленном масштабе.
Традиционные экстракционные системы включают использование органических растворителей, которые в основном токсичные, легковоспламеняющиеся, летучие и считаются вредными для окружающей среды и здоровья человека. В последние годы наметилась тенденция применения систем, исключающих из своего состава органический растворитель [18–23]. Двухфазные водные системы предлагают отличную альтернативу для селективной экстракции металлов в гидрометаллургических процессах [18, 19, 23]. В настоящее время в мире большой интерес вызывают исследования по выделению металлов из различных типов отходов, в том числе элементов питания, с использованием экстракционных систем на основе водорастворимых полимеров [18–20].
Настоящая работа посвящена исследованию межфазного распределения железа(III) в двухфазной водной системе полипропиленгликоль 425–NaCl–H2O.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный раствор хлорида железа(III) получали растворением в дистиллированной воде точной навески FeCl3 · 6H2O квалификации “ч”, взвешенной на аналитических весах (AND HR-100AZ), слабо подкисленной хлороводородной кислотой для предотвращения образования гидроксидных форм железа(III).
Для приготовления двухфазной водной системы использовали полипропиленгликоль с молекулярной массой 425 (Acros Organics) и хлорид натрия квалификации “хч”. В большинстве экспериментов использовали экстракционную систему состава полипропиленгликоль 425 (30 мас. %)–NaCl (8 мас. %)–H2O за исключением экспериментов, в которых исследовали влияние состава экстракционной системы на извлечение железа(III).
Исследование экстракционных равновесий проводили при температуре 25°С в градуированных пробирках с пришлифованными пробками в термостатированном шейкере Enviro-Genie (Scientific Industries, Inc.) при скорости вращения 30 об./мин. Время установления равновесия определено предварительно и составляет 15 мин. Содержание ионов железа(III) в исходном растворе ([Fe]исх), в солевой ([Fe]сол.ф) и полимерной ([Fe]пол.ф) фазах после экстракции определяли методом спектрофотометрии в видимой области (λ = 420 нм) с использованием в качестве индикатора сульфосалициловой кислоты относительно холостых растворов, измерение оптической плотности проводили на приборе ПЭ-5400УФ (ООО “Экросхим”). Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
Спектры поглощения в области длин волн от 190 до 1000 нм записывали на приборе Cary-60 (Agilent Tech.) в кварцевой кювете толщиной 1 мм относительно воды.
Кислотность среды контролировали рН-метром Starter 5000 (OHAUS) с комбинированным электродом, калиброванным по буферам, имеющим значения рН 1.68, 4.01, 7.00, 10.01 (при 25°С).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
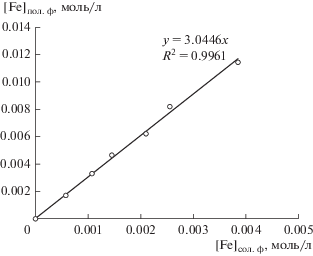
Изучено влияние исходной концентрации железа(III) в диапазоне концентраций 0.001–0.01 моль/л на его извлечение из хлоридных растворов в системе с полипропиленгликолем 425. На рис. 1 приведена изотерма экстракции ионов железа(III) в системе полипропиленгликоль 425 (30 мас. %)–NaCl (8 мас. %)–H2O (рНсол.ф 1.70). Изотерма экстракции имеет прямолинейный характер, что указывает на то, что коэффициент распределения ионов железа(III) не зависит от исходной концентрации металла в растворе и имеет значение 3.04 ± 0.13.
Рис. 1.
Изотерма экстракции Fe(III) в системе полипропиленгликоль 425 (30 мас. %)–NaCl (8 мас. %)–H2O.
Кислотность солевой фазы является важным параметром, который может влиять как на форму нахождения ионов металлов в растворе, так и на степень гидратации полимерной фазы экстракционной системы. Изучено влияние равновесных значений рН солевой фазы на эффективность извлечения железа(III) в диапазоне рН 0–4. Экстракционные данные показывают, что ионы Fe3+ из хлоридных растворов экстрагируются в достаточно широкой области кислотности (рис. 2). Зависимость коэффициента распределения от равновесных значений рН солевой фазы имеет два линейных участка в диапазонах рН 0–2 и 2–4. Из рис. 2. видно, что в интервале значений рН 2–4 извлечение ионов железа не зависит от кислотности солевой фазы, при значениях рН < 2 наблюдается существенное возрастание коэффициента распределения железа(III).
Рис. 2.
Зависимость степени извлечения железа(III) от равновесных значений рН солевой фазы в присутствии HCl (1) и H2SO4 (2) ([Fe]исх = 1 × 10–2 моль/л).
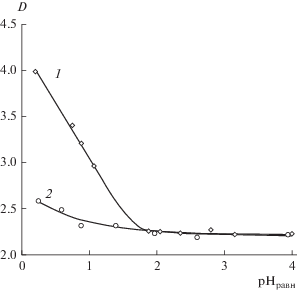
Уменьшение значений рН солевой фазы приводит к уменьшению содержания воды в полимерной фазе [21], что повышает гидрофобность фазы, способствует связыванию железа(III) с хлорид-ионами и переходу образующегося комплекса в полимерную фазу. Таким образом, достигается повышение эффективности экстракции ионов железа.
Для оценки влияния природы минеральной кислоты, используемой для создания требуемого значения рН солевого раствора, на эффективность извлечения железа(III) в исследуемой экстракционной системе были рассмотрены две минеральные кислоты H2SO4 и HCl. Результаты экспериментов (рис. 2) показывают, что в диапазоне значений рН 2–4 различий в эффективности извлечения железа(III) в зависимости от природы минеральной кислоты нет, при значениях рН < 2 эффективность извлечения железа(III) гораздо выше в случае использования хлороводородной кислоты. При увеличении кислотности солевой фазы увеличивается концентрация хлорид-ионов в растворе, которые влияют на извлечение железа(III) и способствуют его извлечению в полимерную фазу.
Для интерпретации экспериментальных зависимостей межфазного распределения ионов железа от состава системы, определения состава экстрагируемых комплексов и количественного описания распределения необходимо знать состояние компонентов и возможное его изменение в солевой и полимерной фазах. Для водных растворов соединений железа неидеальность описывается реакциями комплексообразования катиона Fe3+ с анионами минеральных кислот, а при относительно высоких значениях рН и с гидроксид-ионами. В полимерной фазе необходимо изучить состояние (составы) экстрагируемых соединений в зависимости от условий.
Ранее [6] было установлено, что железо из солянокислых растворов экстрагируется нейтральными экстрагентами в форме HFeCl4, для которой характерно наличие в электронных спектрах поглощения двух полос с максимумами при 318 и 365 нм [15].
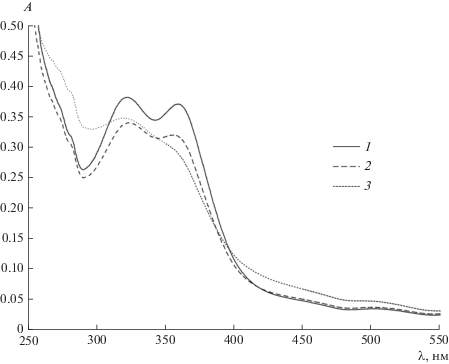
Для определения механизма экстракции нами были проведены исследования по определению состава экстрагируемых форм железа(III) в исследуемой экстракционной системе. На рис. 3 представлены электронные спектры поглощения полимерных фаз после экстракции железа в системе полипропиленгликоль 425–NaCl–H2O при значениях рН 0.8, 1.9 и 2.9. Спектры получены для полимерных фаз с равновесной концентрацией железа 2.5 × 10–3 моль/л. Из представленных результатов видно, что при уменьшении значений рН наблюдается существенное увеличение доли анионных комплексов ${\text{FeCl}}_{4}^{ - }$, отвечающих максимуму поглощения при 318 и 360 нм и уменьшение доли катионных форм существования железа(III), отвечающих полосам поглощения при 284 и 500 нм, что обусловливает резкое увеличение коэффициента распределения железа(III) при повышении кислотности (рис. 2).
Рис. 3.
Электронные спектры поглощения полимерной фазы после экстракции Fe(III) в системе, содержащей 30 мас. % полипропиленгликоля 425 и 8 мас. % NaCl при различных значениях рН ([Fe]пол.ф = 2.5 × 10–3 моль/л): 1 – 0.8; 2 – 1.9; 3 – 2.9.
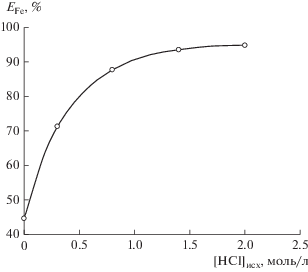
Изучено влияние исходной концентрации хлороводородной кислоты на извлечение железа(III) в диапазоне от 0 до 2 моль/л в системе полипропиленгликоль 425–NaCl–H2O. Использование хлороводородной кислоты с концентрацией более 2 моль/л приводит к образованию гомогенного раствора.
Из рис. 4 видно, что с увеличением концентрации HCl увеличивается степень извлечения железа(III). Максимальная степень извлечения 95% достигается при концентрации HCl 2 моль/л.
Рис. 4.
Зависимость степени извлечения Fe(III) от исходной концентрации хлороводородной кислоты в системе полипропиленгликоль 425–NaCl–H2O ([Fe]исх = 1 × 10–2 моль/л).
Изучено межфазное распределение железа(III) в экстракционной системе с полипропиленгликолем 425 в зависимости от концентрации хлорида натрия в системе. На рис. 5 представлена зависимость степени извлечения железа(III) от исходной концентрации хлорида натрия в растворе в диапазоне 1.6–4.7 моль/л.
Рис. 5.
Зависимость степени извлечения Fe(III) от исходной концентрации хлорида натрия в системе полипропиленгликоль 425–NaCl–H2O ([Fe]исх = 1 × × 10–2 моль/л).
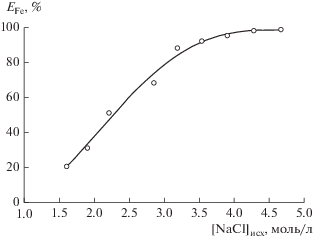
Из рис. 5 видно, что при увеличении концентрации хлорида натрия в системе степень извлечения железа(III) увеличивается и достигает количественного извлечения при концентрации NaCl > 4 моль/л.
Нами получены электронные спектры поглощения полимерной и солевой фаз после экстракции Fe(III) в системе, содержащей 30 мас. % полипропиленгликоля 425 и NaCl от 6 до 15 мас. % (рис. 6).
Рис. 6.
Электронные спектры поглощения полимерной (1–3) и солевой (4–6) фаз после экстракции Fe(III) в системе, содержащей 30 мас. % полипропиленгликоля 425 и NaCl, мас. %: 1, 6 – 15; 2, 5 – 10; 3, 4 – 6. [Fe]исх = 3 × 10–4 моль/л.
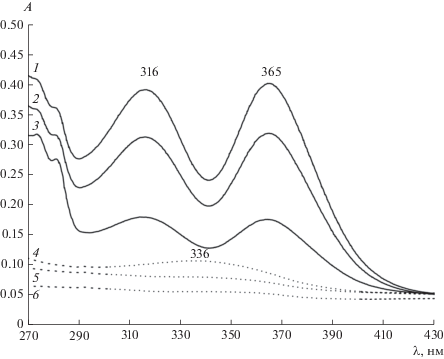
В спектре поглощения солевых фаз (рис. 6, спектры 4–6) присутствует полоса поглощения при 336 нм, которая указывает на присутствие железа в растворе преимущественно в катионной форме ${\text{FeCl}}_{{\text{2}}}^{ + }$ [14]. Анализ электронных спектров поглощения полимерных фаз (рис. 6, спектры 1–3) показал, что в спектрах поглощения экстрактов присутствуют две полосы с λmах, равными 316 и 365 им.
Анализ полученных данных позволяет сделать вывод, что железо из хлоридных растворов извлекается преимущественно в виде комплексного аниона ${\text{FeCl}}_{{\text{4}}}^{ - }.$ При увеличении содержания хлорида натрия в системе происходит смещение спектров поглощения в область более высоких значений оптической плотности, что указывает на увеличение доли анионных комплексов железа(III) и содержания железа(III) в полимерной фазе.
ЗАКЛЮЧЕНИЕ
В настоящей работе изучено межфазное распределение Fe(III) в двухфазной водной системе полипропиленгликоль 425 (30 мас. %)–NaCl (8 мас. %)–H2O. Установлен механизм экстракции железа(III) в исследуемой системе. Железо(III) извлекается из хлоридных растворов в системе с полипропиленгликолем 425 в виде анионного комплекса ${\text{FeCl}}_{{\text{4}}}^{ - }.$ Получены количественные характеристики экстракции. Изучено влияние исходной концентрации железа(III), кислотности солевой фазы, концентрации хлорида натрия на извлечение железа(III).
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований и Правительства Москвы в рамках научного проекта № 19-33-70011.
ОБОЗНАЧЕНИЯ
| A | оптическая плотность |
| D | коэффициент распределения |
| E | степень извлечения, % |
| R2 | коэффициент регрессии |
| λ | длина волны, нм |
ИНДЕКСЫ
Список литературы
Liu B., Zhang Y., Lu M., Su Z., Li G., Jiang T. Extraction and separation of manganese and iron from ferruginous manganese ores: A review // Miner. Eng. V. 131. 2019. P. 286.
Остапенко П.Е. Обогащение железных руд. М.: Недра, 1977.
Ma M. Froth flotation of iron ores // Int. J. Min. Eng. Miner. Process. 2012. V. 1. № 2. P. 56.
Золотов Ю.А., Холькин А.И., Пашков Г.Л., Флейтлих И.Ю., Белова В.В., Сергеев В.В., Вошкин А.А. Экстракция железа из производственных растворов // Хим. технол. 2002. № 7. С. 14.
Wojciechowska I., Wieszczycka K., Wojciechowska A., Aksamitowski P. Ether derivatives – Efficient Fe(III) extractants from HCl solution // Sep. Purif. Technol. 2019. V. 209. P. 756.
Mishra R.K., Rout P.C., Sarangi K., Nathsarma K.C. A comparative study on extraction of Fe(III) from chloride leach liquor using TBP, Cyanex 921 and Cyanex 923 // Hydrometallurgy. 2011. V. 104. P. 298.
Kul M., Oskay K.O. Separation and recovery of valuable metals from real mix electroplating wastewater by solvent extraction // Hydrometallurgy. 2015. V. 155. P. 153.
Azizitorghabeh A., Rashchi F., Babakhani A. Stoichiometry and structural studies of Fe(III) and Zn(II) solvent extraction using D2EHPA/TBP // Sep. Purif. Technol. 2016. V. 171. P. 197.
Sayar N., Filiz M., Sayar A. Extraction of Zn(II) from aqueous hydrochloric acid solutions into Alamine 336-m-xylene systems. Modelling considerations to predict optimum operational conditions // Hydrometallurgy. 2007. V. 86. № 1–2. P. 27.
Saji J., Reddy M.L.P. Liquid–liquid extraction and separation of iron(III) from titania wastes using TBP-MIBK mixed solvent system // Hydrometallurgy. 2001. V. 61. P. 81.
Reddy B.R., Sarma P.V.R.B. Extraction of iron(III) at macro-level concentrations using TBP MIBK and their mixtures // Hydrometallurgy. 1996. V. 43. P. 299.
Zhang G., Chen D., Wei G., Zhao H., Wang L., Qi T., Meng F., Meng L. Extraction of iron(III) from chloride leaching liquor with high acidity using tri-n-butyl phosphate and synergistic extraction combined with methyl isobutyl ketone // Sep. Purif. Technol. 2015. V. 150. P. 132.
Saji J., Rao T.P., Iyer C.S.P., Reddy M.L.P. Extraction of iron(III) from acidic chloride solutions by Cyanex 923 // Hydrometallurgy. 1998. V. 49. P. 289.
Mishra R.K., Rout P.C., Sarangi K., Nathsarma K.C. Solvent extraction of Fe(III) from the chloride leach liquor of low grade iron ore tailings using Aliquat 336 // Hydrometallurgy. 2011. V. 108. P. 93.
Voshkin A.A., Belova V.V., Khol’kin A.I. Extraction of iron(III) by binary extractants based on quaternary ammonium bases and organic acids // Russ. J. Inorg. Chem. 2003. V. 48. № 4. P. 608.
Voshkin A.A., Belova V.V., Zakhodyaeva Yu.A. Iron Extraction with Di(2-Ethylhexyl)dithiophosphoric Acid and a Binary Extractant Based on It // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 387.
Belova V.V., Voshkin A.A., Khol’kin A.I. Liquid-liquid distribution of metals in systems with trioctylmethylammonium dinonyl naphthalenesulfonate // Theor. Found. Chem. Eng. 2011. V. 45. P. 764.
Leite D.S., Carvalho P.L.G., de Lemos L.R., Mageste A.B., Rodrigues G.D. Hydrometallurgical recovery of Zn(II) and Mn(II) from alkaline batteries waste employing aqueous two-phase system // Sep. Purif. Technol. 2019. V. 210. P. 327.
Leite D.S., Carvalho P.L.G., de Lemos L.R., Mageste A.B., Rodrigues G.D. Hydrometallurgical separation of copper and cobalt from lithium-ion batteries using aqueous two-phase systems // Hydrometallurgy. 2017. V. 169. P. 245.
Zakhodyaeva Yu.A., Izyumova K.V., Solov’eva M.S., Voshkin A.A. Extraction separation of the components of leach liquors of batteries // Theor. Found. Chem. Eng. 2017. V. 51. № 5. P. 883.
Bulgariu L., Bulgariu D. Extraction of gold(III) from chloride media in aqueous polyethylene glycol-based two-phase system // Sep. Purif. Technol. 2011. V. 80. P. 620.
Shkinev V.M., Zakhodyaeva Yu.A., Dzhenloda R.Kh., Voshkin A.A. Synthesis of Magnetic Nanoparticles of Iron Oxide at the Interface in the Polyethylene Glycol–Ammonium Sulfate–Water Extraction System // Mendeleev Commun. 2017. V. 27. № 5. P. 485.
Karmakar R., Sen K. Aqueous biphasic extraction of metal ions: An alternative technology for metal regeneration // J. Mol. Liq. 2019. V. 273. P. 231.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


