Теоретические основы химической технологии, 2019, T. 53, № 6, стр. 689-702
Термодинамика процессов, протекающих при жидкометаллическом пиролизе отработавших автомобильных шин
А. А. Осипов a, В. В. Ульянов a, *, В. А. Гулевский a, В. П. Мельников a, С. Е. Харчук a, **
a Акционерное общество “Государственный научный центр Российской Федерации – Физико-энергетический институт им. А.И. Лейпунского”
Калужская область, Обнинск, Россия
* E-mail: vulyanov@ippe.ru
** E-mail: skharchuk@ippe.ru
Поступила в редакцию 22.05.2018
После доработки 23.07.2018
Принята к публикации 06.08.2019
Аннотация
Проведены термодинамические расчеты в обоснование новой жидкометаллической технологии пиролиза отработавших автомобильных шин. Исследована возможность использования жидкого свинца в качестве теплоносителя при пиролизе шин. Рассчитано, что равновесное давление кислорода в системе Pb–PbO существенно выше давления кислорода в продуктах пиролиза, поэтому при взаимодействии последних и свинца твердая фаза оксида свинца не будет образовываться. В зависимости от содержания серы в шинах и температуры, возможно образование конденсированных фаз PbS и PbCl2. При этом очистку расплава свинца от серы и хлора можно проводить периодически или в отдельной зоне. Показано, что в условиях пиролиза трудно ожидать окисления свинца водяным паром с образованием твердой фазы. Примеси железа, цинка, меди, кадмия и мышьяка в области температур от 400 до 800°С не образуют соединений со свинцом. Не выявлено ограничений для использования свинца в качестве жидкометаллического теплоносителя при пиролизе отработавших автомобильных шин.
ВВЕДЕНИЕ
Значительной частью техногенных отходов, сопровождающихся выбросом в окружающую среду вредных элементов и соединений, являются отработавшие автомобильные шины. Их общемировые запасы по разным данным оцениваются в 60–80 млн т при ежегодном приросте до 10 млн т.
На сегодняшний день проблема их утилизации стоит чрезвычайно остро. Химический состав шин крайне разнообразен. В табл. 1 и 2 приведены составы автомобильных покрышек по данным различных источников.
Таблица 1.
Состав автомобильных шин автомобилей в Европейском союзе [1]
| Материал | Содержание материала в покрышках, % | |
|---|---|---|
| для легковых автомобилей | для грузовых автомобилей | |
| Резина/эластомеры | 47 | 45 |
| Технический углерод | 21.5 | 22 |
| Металлы | 16.5 | 25 |
| Текстиль | 5.5 | – |
| Оксид цинка | 1 | 2 |
| Сера | 1 | 1 |
| Присадки | 7.5 | 5 |
Таблица 2.
Состав отработавших шин в соответствии с приказом № 75-Э от 16.06.2004 г. Главного управления природных ресурсов и охраны окружающей среды Минприроды России по Ханты-Мансийскому автономному округу
| Наименование компонента | Содержание, % |
|---|---|
| Синтетический каучук | 85.7 |
| Железо | 3.2 |
| Капрон | 1 |
| Марганец | 0.6 |
| Углерод | 10 |
| Диоксид кремния | 0.5 |
В составе шин присутствуют перечисленные в Приложении 1 к Базельской конвенции [2] (табл. 3) химические элементы и соединения, представляющие опасность.
Таблица 3.
Опасные составляющие отходов согласно Базельской конвенции
| Химическое наименование | Содержание, мас. % |
|---|---|
| Соединения меди, входящие в состав металлокорда | ~0.02 |
| Соединения цинка, зафиксированные в резиновой матрице | Следы |
| Кадмий в виде примеси в оксиде цинка | ~0.001 |
| Свинец и его соединения в виде примеси в оксиде цинка | ~0.005 |
| Стеариновая кислота в твердой форме | ~0.3 |
| Галогенный бутилкаучук | ~0.10 |
Разнообразный химический состав накладывает ряд ограничений на процессы утилизации шин после их использования, поэтому на практике применяются в основном только три способа: механическое измельчение, сжигание и пиролиз. Из них наиболее широкое распространение получил пиролиз [3]. Процесс пиролиза шин представляет собой их химическое разложение при нагреве в газовой бескислородной среде. При этом образуются твердые, жидкие и газообразные продукты с целым спектром полезных веществ. Очень важно, чтобы длительность пиролиза была относительно невелика (менее 1 ч), так как ее увеличение приводит к уменьшению доли товарных продуктов в общей массе получившихся, а также ухудшает экономические показатели из-за необходимости подводить тепло. В основном по этой причине ведется активный поиск новых теплоносителей с повышенными коэффициентами теплоотдачи. В настоящее время в качестве таковых для применения в различных областях науки и техники предлагаются жидкий свинец и его сплавы [4–7].
Авторы работы обосновывают проведение пиролиза отработавших шин непосредственно в объеме расплавленного свинца. Для оценки перспективности такого способа переработки шин необходимо проанализировать возможные результаты физико-химических взаимодействий свинца и компонент шин, особенности которых выявляются при термодинамическом анализе протекающих химических реакций. Поэтому целью настоящей работы является проведение термодинамических расчетов реакций взаимодействия основных компонентов отработавших автомобильных шин (каучук, сера, металлы, кремний, азот, хлор, кислород и др.), жидкого свинца и пиролизной воды.
ИСХОДНЫЕ ДАННЫЕ ДЛЯ ТЕРМОДИНАМИЧЕСКИХ РАСЧЕТОВ
При пиролизе резина не переходит в жидкое состояние, а постепенно теряет часть своего материала в виде газообразных продуктов и одновременно теряет эластичность. Жидкая фаза получается в результате конденсации газообразных продуктов, а результатом процесса являются различные газообразные и конденсированные продукты, соотношение между которыми зависит от условий проведения процесса (табл. 4). Пиролизный газ, как правило, используется в виде топлива. Пиролизные смолы могут использоваться в качестве добавки к котельным топливам или же могут быть подвергнуты переработке совместно с сырой нефтью или ее фракциями. Твердый углеродный остаток пиролиза шин пригоден в качестве заменителя технического углерода, а также в качестве наполнителя к целому ряду товарных продуктов. Содержание серы в покрышках (около 1%) сопоставимо с ее содержанием в угле с малым содержанием серы или нефти с очень низким содержанием серы, и, следовательно, уровень диоксида серы также низок, как и в других видах топлива.
Таблица 4.
Продукты “классического” пиролиза изношенных шин при температурах от 400 до 550°С
| Показатели | Пиролиз изношенных шин | |
|---|---|---|
| Температурный диапазон | 450–550°C | 400–550°C |
| Выход продуктов, % | ||
| Смола | 45–55 | 58–59 |
| Вода | 3–4 | 2–2.5 |
| Газ | 10–12 | 7.6–8 |
| Твердый остаток | 32–35 | 31–32.6 |
| Характеристика смолы | ||
| Плотность при 200°С, кг/м3 | 900–910 | – |
| Вязкость при 200°С, мм2/с | 3–4 | – |
| Молекулярная масса | 160–170 | – |
| Теплота сгорания, МДж/кг | 40.2 | 31 |
| Элементный состав смолы, % | ||
| Углерод | от 87 | Алифатические соединения 5 |
| Водород | 9.5 | Ароматические соединения 95 |
| Сера | 0.6–0.8 | 1.1 |
| Азот + кислород | 2.2–2.6 | – |
| Состав газа, об. % | ||
| Алкены С2–С5 | 35–38 | – |
| Метан | 22–27 | – |
| Алканы С2–С5 | 22–25 | – |
| Водород | 15–18 | – |
| Оксид углерода | 1–2 | – |
| Диоксид углерода | 3–5 | – |
| Характеристика твердого остатка | ||
| Зольность, % | 10–12 | 7.7 |
| Элементный состав твердого остатка, % | ||
| Углерод | 95–97 | – |
| Водород | 1.5–2 | – |
| Сера | 2–3 | 2.1 |
| Азот + кислород | 0.2–0.5 | – |
| Теплота сгорания, МДж/кг | – | 23.5 |
Смола пиролиза представляет собой темно-коричневую жидкость с содержанием 2–4% воды, которая не отслаивается при длительном отстаивании.
Термодинамические расчеты проводились при условии, что процесс проходит при атмосферном давлении и основным регулирующим параметром является температура. Элементный состав был задан в соответствии с данными табл. 1–4, а именно: С, H, S, N, O, Cl, Si, Zn, Cr, As, Cd, Fe, Cu, Pb, Mn.
Расчеты проводились в несколько этапов. На первом этапе проводились термодинамические расчеты термической деструкции основного компонента шин – синтетического каучука. На втором этапе учитывались примеси. На третьем этапе рассматривались реакции взаимодействия жидкого свинца и продуктов термической деструкции синтетического каучука и примесей. Непосредственно расчеты производились при помощи программного продукта FACT – Facility for the Analysis of Chemical Thermodynamics, располагающегося в открытом доступе (http://www.crct.polymtl.ca/fact/).
РЕЗУЛЬТАТЫ ТЕРМОДИНАМИЧЕСКИХ РАСЧЕТОВ
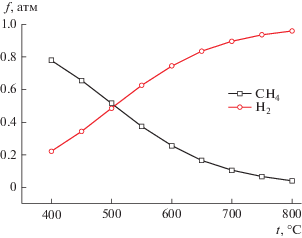
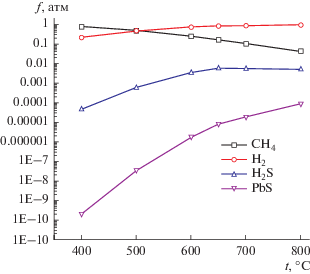
Результаты термодинамических расчетов термической деструкции синтетического каучука в температурном диапазоне 400–800°С без доступа кислорода. Результаты термодинамических расчетов термической деструкции синтетического каучука [С5H8]n в температурном диапазоне 400–800°С без доступа кислорода приведены в табл. 5, из которой следует, что состав газовой фазы представлен в основном метаном и водородом. В температурном диапазоне 400–500°С основным компонентом газовой фазы является метан, а в температурном диапазоне 550–800°С преобладает водород (рис. 1).
Таблица 5.
Состав газовой фазы (фугитивность веществ) при термической деструкции синтетического каучука в температурном диапазоне от 400 до 800°С
| Фугитивность, атм | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вещество | 400°С | 450°С | 500°С | 550°С | 600°С | 650°С | 700°С | 750°С | 800°С |
| CH4 | 7.8 × 10–01 | 6.6 × 10–01 | 5.2 × 10–01 | 3.8 × 10–01 | 2.6 × 10–01 | 1.7 × 10–01 | 8.9 × 10–01 | 9.3 × 10–01 | 9.5 × 10–01 |
| H2 | 2.2 × 10–01 | 3.4 × 10–01 | 4.8 × 10–01 | 6.2 × 10–01 | 7.4 × 10–01 | 8.3 × 10–01 | 1.0 × 10–01 | 6.6 × 10–02 | 4.2 × 10–02 |
| C2H6 | 8.4 × 10–06 | 9.2 × 10–06 | 8.6 × 10–06 | 7.0 × 10–06 | 5.0 × 10–06 | 3.2 × 10–06 | 1.9 × 10–06 | 1.1 × 10–06 | 7.5 × 10–07 |
| C2H4 | 2.8 × 10–09 | 1.1 × 10–08 | 3.5 × 10–08 | 8.6 × 10–08 | 1.7 × 10–07 | 2.9 × 10–07 | 4.2 × 10–07 | 5.8 × 10–07 | 7.0 × 10–07 |
| CH3 | 1.4 × 10–13 | 1.5 × 10–12 | 1.1 × 10–11 | 6.2 × 10–11 | 2.6 × 10–10 | 8.6 × 10–10 | 2.4 × 10–09 | 5.9 × 10–09 | 1.3 × 10–08 |
| H | 2.6 × 10–15 | 4.9 × 10–14 | 6.3 × 10–13 | 5.7 × 10–12 | 4.0 × 10–11 | 2.2 × 10–10 | 1.0 × 10–09 | 3.9 × 10–09 | 1.3 × 10–08 |
| C2H2 | 8.6 × 10–16 | 1.5 × 10–14 | 2.5 × 10–13 | 2.6 × 10–12 | 2.0 × 10–11 | 1.2 × 10–10 | 5.9 × 10–10 | 2.3 × 10–09 | 8.2 × 10–09 |
| C2H5 | 6.1 × 10–16 | 8.5 × 10–15 | 5.4 × 10–14 | 2.3 × 10–13 | 7.8 × 10–13 | 2.0 × 10–12 | 4.3 × 10–12 | 8.2 × 10–12 | 1.4 × 10–11 |
| Oстальное | 1.8 × 10–20 | 1.2 × 10–19 | 4.9 × 10–19 | 1.4 × 10–18 | 3.0 × 10–18 | 4.9 × 10–18 | 2.7 × 10–15 | 1.5 × 10–14 | 7.4 × 10–14 |
Результаты термодинамических расчетов термической деструкции синтетического каучука в температурном диапазоне 400–800°С в присутствии серы. Сера является важным компонентом, который может взаимодействовать как с продуктами термической деструкции шин, так и с металлами, например свинцом. Содержание серы в автомобильных покрышках может варьироваться в пределах нескольких процентов.
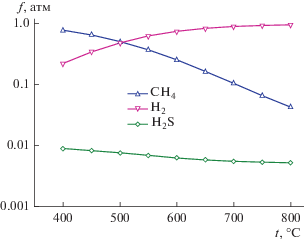
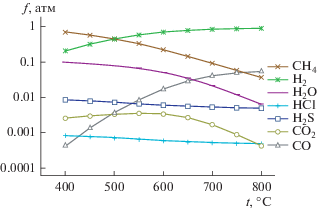
Результаты термодинамических расчетов термической деструкции синтетического каучука (рис. 2) в присутствии 1 мас. % серы приведены в табл. 6. Состав газовой фазы представлен в основном метаном, водородом и сероводородом. В температурном диапазоне 400–500°С основным компонентом газовой фазы является метан, а в температурном диапазоне 550–800°С преобладает водород (рис. 3). Концентрация сероводорода монотонно уменьшается с ростом температуры от 400 до 800°С и увеличивается с увеличением концентрации серы.
Таблица 6.
Состав газовой фазы термической деструкции вулканизированного серой каучука при температурах 400–800°С
| Фугитивность, атм | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вещество | 400°С | 450°С | 500°С | 550°С | 600°С | 650°С | 700°С | 750°С | 800°С |
| CH4 | 7.1 × 10–01 | 6.1 × 10–01 | 4.8 × 10–01 | 3.5 × 10–01 | 2.4 × 10–01 | 1.5 × 10–01 | 9.8 × 10–02 | 6.2 × 10–02 | 4.0 × 10–02 |
| H2 | 2.1 × 10–01 | 3.3 × 10–01 | 4.6 × 10–01 | 6.0 × 10–01 | 7.2 × 10–01 | 8.1 × 10–01 | 8.6 × 10–01 | 9.0 × 10–01 | 9.2 × 10–01 |
| H2O | 4.2 × 10–02 | 3.9 × 10–02 | 3.4 × 10–02 | 2.9 × 10–02 | 2.2 × 10–02 | 1.5 × 10–02 | 9.3 × 10–03 | 5.2 × 10–03 | 5.1 × 10–03 |
| HCl | 8.6 × 10–03 | 8.0 × 10–03 | 7.3 × 10–03 | 6.7 × 10–03 | 6.1 × 10–03 | 5.7 × 10–03 | 5.4 × 10–03 | 5.2 × 10–03 | 5.1 × 10–03 |
| H2S | 8.6 × 10–03 | 8.0 × 10–03 | 7.3 × 10–03 | 6.7 × 10–03 | 6.1 × 10–03 | 5.7 × 10–03 | 5.4 × 10–03 | 5.1 × 10–03 | 2.7 × 10–03 |
| CO2 | 4.4 × 10–04 | 5.6 × 10–04 | 1.5 × 10–03 | 6.2 × 10–04 | 6.0 × 10–04 | 4.8 × 10–04 | 3.0 × 10–04 | 1.5 × 10–04 | 7.3 × 10–05 |
| CO | 1.8 × 10–04 | 5.1 × 10–04 | 5.7 × 10–04 | 3.6 × 10–03 | 7.1 × 10–03 | 1.2 × 10–02 | 3.4 × 10–06 | 3.7 × 10–06 | 3.9 × 10–06 |
| C2H6 | 7.6 × 10–06 | 8.3 × 10–06 | 7.7 × 10–06 | 6.3 × 10–06 | 4.4 × 10–06 | 2.9 × 10–06 | 1.8 × 10–06 | 1.1 × 10–06 | 7.1 × 10–07 |
| COS | 2.6 × 10–07 | 4.7 × 10–07 | 7.9 × 10–07 | 1.2 × 10–06 | 1.9 × 10–06 | 2.7 × 10–06 | 4.0 × 10–07 | 5.5 × 10–07 | 6.4 × 10–07 |
| CH3SH | 3.3 × 10–08 | 3.9 × 10–08 | 4.3 × 10–08 | 8.0 × 10–08 | 1.5 × 10–07 | 2.7 × 10–07 | 3.0 × 10–08 | 5.1 × 10–08 | 1.2 × 10–07 |
| CH3Cl | 4.6 × 10–09 | 1.1 × 10–08 | 3.2 × 10–08 | 4.2 × 10–08 | 3.9 × 10–08 | 3.5 × 10–08 | 2.1 × 10–08 | 2.6 × 10–08 | 5.3 × 10–08 |
| H2S2 | 3.6 × 10–09 | 6.8 × 10–09 | 8.8 × 10–09 | 1.0 × 10–08 | 1.1 × 10–08 | 1.6 × 10–08 | 2.0 × 10–08 | 2.5 × 10–08 | 2.6 × 10–08 |
| C2H4 | 2.6 × 10–09 | 4.3 × 10–09 | 5.0 × 10–09 | 5.8 × 10–09 | 9.0 × 10–09 | 1.2 × 10–08 | 1.2 × 10–08 | 2.3 × 10–08 | 2.2 × 10–08 |
| H2CO | 1.1 × 10–10 | 4.6 × 10–10 | 1.5 × 10–09 | 4.1 × 10–09 | 6.9 × 10–09 | 8.6 × 10–09 | 1.1 × 10–08 | 1.4 × 10–08 | 1.9 × 10–08 |
| CH3OH | 1.1 × 10–10 | 2.3 × 10–10 | 4.0 × 10–10 | 7.4 × 10–10 | 2.4 × 10–09 | 7.3 × 10–09 | 9.6 × 10–09 | 1.2 × 10–08 | 1.3 × 10–08 |
| HCOOH | 3.9 × 10–11 | 1.1 × 10–10 | 2.7 × 10–10 | 6.7 × 10–10 | 1.6 × 10–09 | 3.9 × 10–09 | 2.3 × 10–09 | 5.6 × 10–09 | 1.2 × 10–08 |
| CS2 | 3.7 × 10–11 | 7.9 × 10–11 | 1.9 × 10–10 | 5.9 × 10–10 | 7.0 × 10–10 | 8.2 × 10–10 | 1.1 × 10–09 | 3.9 × 10–09 | 1.2 × 10–08 |
| HS | 7.7 × 10–12 | 4.4 × 10–11 | 1.4 × 10–10 | 2.1 × 10–10 | 2.6 × 10–10 | 6.9 × 10–10 | 1.0 × 10–09 | 2.8 × 10–09 | 8.0 × 10–09 |
| (CH3)2S | 2.9 × 10–12 | 9.5 × 10–12 | 2.6 × 10–11 | 6.8 × 10–11 | 2.8 × 10–10 | 5.3 × 10–10 | 6.5 × 10–10 | 2.3 × 10–09 | 6.8 × 10–09 |
| S2 | 2.5 × 10–12 | 7.2 × 10–12 | 1.8 × 10–11 | 5.9 × 10–11 | 1.6 × 10–10 | 2.5 × 10–10 | 5.5 × 10–10 | 4.4 × 10–10 | 6.3 × 10–10 |
| C2H4O | 2.1 × 10–12 | 3.5 × 10–12 | 1.0 × 10–11 | 3.8 × 10–11 | 6.2 × 10–11 | 2.1 × 10–10 | 2.6 × 10–10 | 3.8 × 10–10 | 2.5 × 10–10 |
| C2H5Cl | 1.1 × 10–12 | 1.8 × 10–12 | 3.7 × 10–12 | 1.3 × 10–11 | 4.8 × 10–11 | 1.2 × 10–10 | 1.8 × 10–10 | 1.0 × 10–10 | 1.4 × 10–10 |
| CH3 | 1.3 × 10–13 | 4.8 × 10–13 | 2.3 × 10–12 | 3.4 × 10–12 | 1.9 × 10–11 | 7.9 × 10–11 | 5.9 × 10–12 | 2.8 × 10–11 | 5.5 × 10–11 |
| CH3CH2OH | 7.6 × 10–14 | 2.6 × 10–13 | 6.2 × 10–13 | 2.6 × 10–12 | 2.8 × 10–12 | 2.3 × 10–12 | 4.9 × 10–12 | 2.1 × 10–11 | 5.2 × 10–11 |
| CH3COOH | 7.3 × 10–14 | 1.6 × 10–13 | 3.0 × 10–13 | 2.5 × 10–12 | 2.5 × 10–12 | 2.1 × 10–12 | 4.0 × 10–12 | 7.6 × 10–12 | 1.3 × 10–11 |
| CH2CO | 5.5 × 10–14 | 8.4 × 10–14 | 2.6 × 10–13 | 3.5 × 10–13 | 7.2 × 10–13 | 1.8 × 10–12 | 2.1 × 10–12 | 1.8 × 10–12 | 4.6 × 10–12 |
| Oстальное | 8.2 × 10–15 | 7.7 × 10–14 | 3.9 × 10–13 | 6.9 × 10–13 | 9.9 × 10–13 | 2.9 × 10–12 | 3.0 × 10–12 | 4.3 × 10–12 | 6.8 × 10–12 |
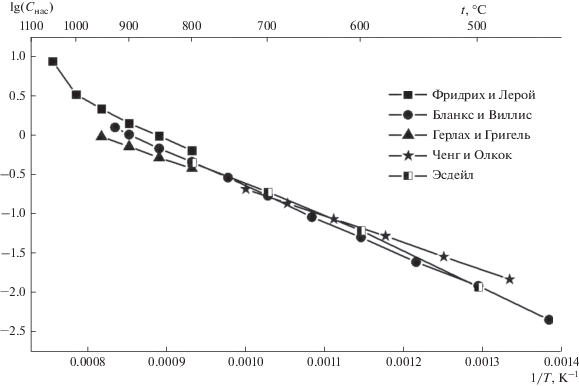
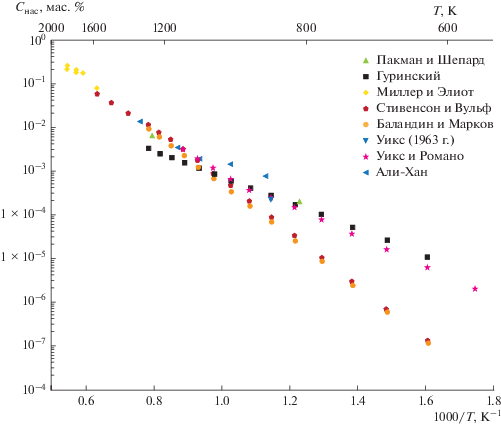
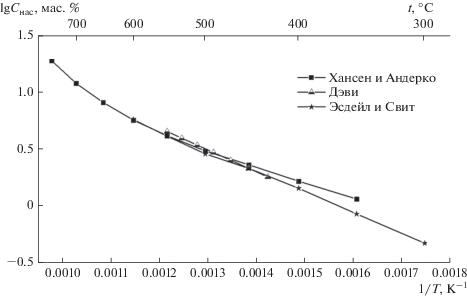
Диаграмма состояния системы Pb–S известна из работы Лина и др. [10], в которой использованы результаты, представленные в справочнике Хансена и Андерко [11] при построении участка диаграммы от 0 до 50 ат. % S. В системе обнаружено образование соединения PbS, плавящегося конгруэнтно при 1118°С. При температуре 800°С в интервале концентраций 70.7–98.9 ат. % осуществляется монотектическое превращение, однако металлографически расслоение не наблюдается из-за возможного “отжига” структуры с участием столь легкоплавкого компонента, как свинец. Эвтектическая точка при температуре реакции 327°С содержит 0.0017 ат. % S. Согласно упомянутой диаграмме Pb и PbS (13.4 мас. % S) обладают полной взаимной растворимостью в жидком состоянии.
В равновесии с жидким свинцом находится соединение PbS с температурой плавления 1119 ± ± 16°С. Растворимость PbS в жидком свинце (кривая ликвидуса) характеризуется величинами, указанными в табл. 7.
Таблица 7.
Растворимость серы в жидком свинце [15]
| t, °С | 800 | 850 | 900 | 950 | 1000 | 1050 |
| Cнас, мас. % | 0.64 | 0.98 | 1.42 | 2.16 | 3.29 | 8.66 |
В справочнике Эллиота [12] упоминается работа Голоема и Крёгера (1956 г.), которые построили диаграмму р–Т–х, особенно подробно вблизи PbS – единственного соединения в этой системе. Обнаружено, что PbS плавится при 1127°С и содержит избыток свинца 3 × 10–4 ат. %. Это соединение имеет узкую область гомогенности (±3 × 10–4 ат. %). Аномалии в форме ликвидуса объяснены ближним упорядочением в жидкости.
Там же приведены данные Бланкса и Виллиса [13] по растворимости серы в жидком свинце, определенной методом химического анализа (табл. 8).
Таблица 8.
Растворимость серы в жидком свинце [12]
| t, °С | 450 | 500 | 550 | 600 | 650 | 700 |
| Cнас, мас. % | 0.0046 | 0.0124 | 0.0248 | 0.051 | 0.092 | 0.172 |
| t, °С | 750 | 800 | 850 | 900 | 925 | – |
| Cнас, мас. % | 0.291 | 0.46 | 0.68 | 1.02 | 1.26 | – |
Данные приведены по графику из работы Бланкса и Виллиса, в которой растворимость определяли через неодинаковые температурные интервалы. По их расчетам эвтектическая концентрация соответствует 0.0017 ат. % (0.00026 мас. %) S.
В справочнике Шанка [14] приведены данные Герлаха и Григеля [15] по растворимости серы в жидком свинце. Повторное определение серы в жидком свинце дало значения, приведенные в табл. 9.
Таблица 9.
Растворимость серы в жидком свинце [14]
| t, °С | 800 | 850 | 900 | 950 |
| Cнас, мас. % | 0.38 | 0.52 | 0.72 | 0.96 |
Как сообщает Шанк [14], значения точки плавления PbS, по данным различных исследователей, находятся в интервале от 1109 ± 2 до 1111 ± 4°С и 1114°С.
В середине температурного интервала (500–680°С), изученного Ченгом и Олкоком [10], растворимость серы в жидком свинце составляет 0.42 ат. %, а согласно данным Бланкса и Виллиса [13] – 0.34 ат. %.
Исследуя диаграмму состояния двойной системы свинец–сульфид свинца, Эсдейл [16] дал анализ ранее опубликованных результатов по термодинамическим свойствам и фазовым равновесиям в псевдодвойной системе Pb–PbS. Расчетом установлено, что область несмешиваемости в жидкой фазе существует в очень узком интервале температур (1041–1058°С).
Лин с соавторами [17, 18] дал диаграмму состояния системы свинец–сера, которую рассчитывали в предположении, что фаза PbS имеет постоянный состав. Для описания термодинамических свойств жидкой фазы использовали модель ассоциированных растворов. Предполагали, что жидкая фаза состоит из Pb, S и PbS, находящихся в равновесии Pb(ж) + S(ж) = PbS(ж). Значения различных параметров получали обработкой данных по термодинамическим свойствам и фазовым равновесиям в системе свинец–сера. Диаграмму состояния Р–Т–Х фазы PbS рассчитывали с использованием модели, согласно которой преобладающими дефектами в фазе PbS являются двойные ионизированные вакансии в подрешетке свинца и аналогичные вакансии в подрешетке серы.
Рассчитанная кривая растворимости (ликвидус) серы в жидком свинце характеризуется величинами, указанными в табл. 10.
Таблица 10.
Растворимость серы в жидком свинце [12]
| t, °С | 500 | 600 | 700 | 800 |
| Cнас, мас. % | 0.012 | 0.062 | 0.192 | 0.450 |
Рассчитанная концентрация серы в эвтектике Pb + PbS составляет 0.006 ат. % (0.0009 мас. %) при температуре 327°С. Выше 1000°С наблюдается тенденция к расслоению. При температуре 1118°С соединение PbS содержит 49.996 ат. % (13.40 мас. %) S.
В обзоре Арнольдова [19] для растворимости серы в расплаве свинца для интервала температур 350–1050°С дано уравнение
(1)
$\lg {{С}_{{{\text{нас}}}}}({\text{мac}}.{\text{ }}\% \,{\text{S}}) = 3.872--{{4462} \mathord{\left/ {\vphantom {{4462} T}} \right. \kern-0em} T}.$Имеющиеся данные по растворимости серы (PbS) в жидком свинце представлены на рис. 4.
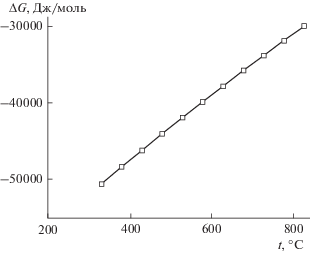
Реакция взаимодействия свинца и сероводорода с образованием сульфида свинца и водорода
характеризуется существенно отрицательной величиной стандартной энергии Гиббса в температурном диапазоне 400–800°С (рис. 5). Это означает, что выход реакции (2) будет практически стехиометрическим, однако данная реакция протекает на фоне других реакций, например реакций термической деструкции каучука
(3)
${{[{{{\text{С}}}_{{\text{5}}}}{{{\text{H}}}_{8}}]}_{n}} = n{{{\text{С}}}_{{\text{5}}}}{{{\text{H}}}_{8}},\,\,{{{\text{С}}}_{{\text{5}}}}{{{\text{H}}}_{8}} = 4{\text{C}} + {\text{C}}{{{\text{H}}}_{4}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}.$Рис. 5.
Температурная зависимость стандартной энергии Гиббса реакции образования PbS (Pb + H2S = = PbS + H2).
Реакция (3) также характеризуются отрицательными значениями стандартной энергии Гиббса в температурном диапазоне 400–800°С (рис. 6). Следовательно, выход реакции (2) уже не будет стехиометрическим, а будет определяться совместным решением уравнений (2) и (3) для заданных начальных условий. Результаты таких расчетов приведены в табл. 11 и на рис. 7 и 8.
Рис. 6.
Температурная зависимость стандартной энергии Гиббса реакции разложения С5H8 (C5H8 = = 4C + CH4 + 2H2).
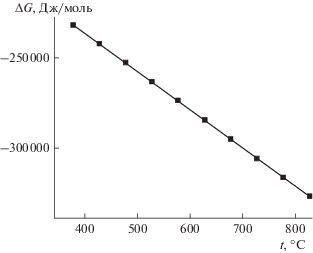
Таблица 11.
Состав газовой фазы термической деструкции каучука в присутствии серы (${{C}_{{{{{[{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{8}}}}]}}_{n}}}}}$ = 99%, CS = 1%) в температурном диапазоне 400–500°С
| Фугитивность, атм | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вещество | 400°С | 450°С | 500°С | 550°С | 600°С | 650°С | 700°С | 750°С | 800°С |
| CH4 | 7.7 × 10–01 | 6.5 × 10–01 | 5.1 × 10–01 | 3.7 × 10–01 | 2.5 × 10–01 | 1.6 × 10–01 | 1.0 × 10–01 | 6.6 × 10–02 | 4.2 × 10–02 |
| H2 | 2.2 × 10–01 | 3.4 × 10–01 | 4.8 × 10–01 | 6.2 × 10–01 | 7.4 × 10–01 | 8.3 × 10–01 | 8.9 × 10–01 | 9.3 × 10–01 | 9.5 × 10–01 |
| H2S | 8.9 × 10–03 | 8.2 × 10–03 | 7.6 × 10–03 | 6.9 × 10–03 | 6.3 × 10–03 | 5.8 × 10–03 | 5.5 × 10–03 | 5.3 × 10–03 | 5.2 × 10–03 |
| C2H6 | 8.3 × 10–06 | 9.0 × 10–06 | 8.5 × 10–06 | 6.9 × 10–06 | 4.9 × 10–06 | 3.2 × 10–06 | 1.9 × 10–06 | 1.2 × 10–06 | 7.0 × 10–07 |
| CH3SH | 3.4 × 10–08 | 4.2 × 10–08 | 4.6 × 10–08 | 4.5 × 10–08 | 4.1 × 10–08 | 3.7 × 10–08 | 3.2 × 10–08 | 2.7 × 10–08 | 2.3 × 10–08 |
| H2S2 | 3.7 × 10–09 | 1.1 × 10–08 | 3.5 × 10–08 | 5.9 × 10–09 | 7.0 × 10–09 | 8.7 × 10–09 | 1.1 × 10–08 | 1.5 × 10–08 | 1.9 × 10–08 |
| C2H4 | 2.8 × 10–09 | 4.4 × 10–09 | 5.1 × 10–09 | 8.5 × 10–08 | 1.7 × 10–07 | 2.8 × 10–07 | 4.2 × 10–07 | 5.8 × 10–07 | 7.5 × 10–07 |
| Oстальное | 5.2 × 10–11 | 1.6 × 10–10 | 5.1 × 10–10 | 1.4 × 10–9 | 4.5 × 10–09 | 1.1 × 10–08 | 3.4 × 10–09 | 9.2 × 10–08 | 1.8 × 10–07 |
Рис. 8.
Активность конденсированной фазы PbS в зависимости от температуры для различного содержания серы в системе [С5H8]n–S–Pb.
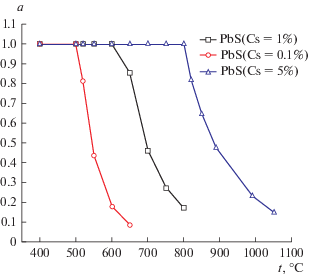
Таким образом, в зависимости от содержания серы в шинах и температуры, возможно образование конденсированной фазы PbS. Возможное взаимодействие свинца с сероводородом можно рассматривать с положительной стороны: расплав сорбирует серу, тем самым уменьшая ее содержание в продуктах. При этом очистку расплава от серы можно проводить периодически или в отдельной зоне.
Результаты термодинамических расчетов влияния воды на пиролиз отработавших автомобильных шин в расплаве свинца. Экспериментальные данные по пиролизу отработанных покрышек указывают на значительное содержание воды (до 4 мас. %), содержащейся в продуктах термической деструкции. Вода слабо взаимодействует со свинцом, однако значительные объемы воды могут привести к окислению свинца, с другой стороны, и метан, и водород являются восстановителями оксида свинца. Поэтому для количественных оценок выхода реакций взаимодействия свинца и продуктов пиролиза необходимо учитывать окислительное воздействие воды на свинец.
Рассмотрим реакцию взаимодействия свинца и воды:
(4)
$\begin{gathered} \{ {\text{Pb}}\} + m({{{\text{H}}}_{{\text{2}}}}{\text{O}}) = x[{\text{O}}] + (1 - x)\{ {\text{Pb}}\} + \\ + \,\,(m - x)({{{\text{H}}}_{{\text{2}}}}{\text{O}}) + x({{{\text{H}}}_{2}}), \\ \end{gathered} $В качестве стандартных состояний выберем чистые вещества (жидкий свинец, твердый оксид свинца (для растворенного кислорода), газообразный водород при давлении 1 атм, водяной пар при давлении 1 атм), тогда
(5)
$\Delta {{G}^{ \circ }} = - RT\ln \frac{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}\frac{{{{a}_{{\text{O}}}}}}{{{{a}_{{{\text{Pb}}}}}}} \approx - RT\ln \frac{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}{{a}_{{\text{O}}}},$(6)
$\frac{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}} = \frac{x}{{m - x}};$${{a}_{{\text{O}}}}$ – равновесная активность кислорода в жидком свинце
(7)
${{a}_{{\text{O}}}} = \frac{{{{c}_{{\text{O}}}}}}{{c_{{\text{O}}}^{s}}} = \frac{1}{{c_{{\text{O}}}^{s}}}x;$$c_{{\text{O}}}^{s}$ – концентрация насыщения кислорода в свинце в мольных долях [5, 6]
Так как известно, что для растворенного кислорода в системе {Pb}–[O] выполняется закон Генри ${{a}_{{\text{O}}}}\sim {{c}_{{\text{O}}}},$ то для растворителя выполняется закон Рауля ${{a}_{{{\text{Pb}}}}}\sim {{c}_{{{\text{Pb}}}}},$ а так как $c_{{\text{O}}}^{s} \ll 1,$ то
После подстановки соотношений (6), (7) и (9) в (5) получим
(10)
$\Delta {{G}^{ \circ }} = - RT\ln \frac{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}{{a}_{{\text{O}}}} = - RT\ln \frac{{{{x}^{2}}}}{{(m - x)}}\frac{1}{{c_{{\text{O}}}^{s}}}.$Полученное соотношение позволяет произвести расчет равновесной концентрации растворенного кислорода в жидком свинце в зависимости от исходного количества молей воды. Расчет показывает, что выход реакции взаимодействия свинца и воды по кислороду мал и достигает предельной концентрации кислорода при соотношении количества молей воды к количеству молей свинца, равному ~4 × 104. Как было отмечено ранее, и водород, и метан являются восстановителями оксида свинца, поэтому в условиях пиролиза трудно ожидать окисления свинца водяным паром с образованием твердой фазы.
Результаты термодинамических расчетов влияния примесей азота, кислорода и хлора на пиролиз отработавших автомобильных шин в расплаве свинца. Примеси азота, кислорода и хлора находятся в составе автомобильных шинах в виде различных соединений, количественное содержание которых, как правило, составляет несколько процентов. Примеси кислорода и хлора обладают высокой реакционной способностью, поэтому необходимы количественные расчеты реакций взаимодействия данных примесей с продуктами термической деструкции шин и свинцом.
Основным источником кислорода может являться оксид цинка ZnO (0.5–1 мас. %), диоксид кремния SiO2, или кремниевая кислота m(SiO2) ⋅ n(H2O). Массовая доля кислорода в оксиде цинка составляет ~0.2, тогда на кислород в шине приходится 0.1–0.2 мас. %.
Предположим, что вместо ZnO в шинах используется SiO2 в количестве 0.5–1 мас. %, тогда на кислород в шине придется 0.27–0.53 мас. %. С другой стороны, согласно данным, приведенным в табл. 4, в продуктах пиролиза содержится 2–4 мас. % воды в конденсированной фазе, 1–2 CO и 3–5 об. % CO2. Тогда на кислород в жидкой фазе приходится 1.8–3.6 и 3.2–4.8 мас. % кислорода в газе, что соответствует 1.3–2.2 мас. % кислорода в воде и газе. Кроме того, кислород содержится в смоле и твердой фазе. Согласно данным табл. 4 на азот + кислород приходится 2.2–2.6 в жидкой фазе (смоле) и 0.2–0.5 мас. % в твердой фазе, что соответствует 1.3–1.5 мас. % в смоле и твердой фазе.
Для расчетов закладывалось значение 2 кислорода, 1 азота и 1 мас. % хлора в шине. По-видимому, содержание хлора является завышенным, однако он является потенциально опасным элементом, поэтому для термодинамических расчетов завышенная оценка выглядит вполне разумной. Результаты термодинамических расчетов показали, что в системе, состоящей из С, H, S, Cl, N и O, азот проявляет себя как малоактивный компонент и его влиянием можно пренебречь. Также выявлено, что присутствие примесей хлора и кислорода приводит к образованию соединений HCl, Н2O, CO, CO2 и других веществ в существенно меньших концентрациях. Так как в расчетах были заданы одинаковые концентрации хлора и серы (1 мас. %), а их молекулярные массы очень близки (MS = 32, MCl = 34.5), то концентрации H2S и HCl в продуктах пиролиза практически одинаковы и совпадают на рис. 9. Кроме того, концентрация CO выше концентрации CO2, что не соответствует экспериментальным данным. Одним из возможных объяснений различия теории и эксперимента может являться неточность задания начальных условий. В табл. 12 приведены термодинамические расчеты для других значений начальных условий, а именно: ${{C}_{{{{{\left[ {{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{8}}}}} \right]}}_{n}}}}}$ = 85, CC = 9, CS = = 0.9, CCl = 0.1, CО = 5% (концентрация С в массовых процентах).
Таблица 12.
Состав газовой фазы термической деструкции резины в присутствии примесей S, Cl и O при температуре 400–500°С (${{C}_{{{{{[{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{8}}}}]}}_{n}}}}}$ = 85%, CC = 9%, CS = 0.9%, CCl = 0.1%, CО = 5%)
| Фугитивность, атм | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вещество | 400°С | 450°С | 500°С | 550°С | 600°С | 650°С | 700°С | 750°С | 800°С |
| CH4 | 6.8 × 10–01 | 5.7 × 10–01 | 4.5 × 10–01 | 3.3 × 10–01 | 2.2 × 10–01 | 1.5 × 10–01 | 9.2 × 10–02 | 5.8 × 10–02 | 3.7 × 10–02 |
| H2 | 2.1 × 10–01 | 3.2 × 10–01 | 4.5 × 10–01 | 5.8 × 10–01 | 7.0 × 10–01 | 7.8 × 10–01 | 8.4 × 10–01 | 8.7 × 10–01 | 9.0 × 10–01 |
| H2O | 9.9 × 10–02 | 9.1 × 10–02 | 8.0 × 10–02 | 6.7 × 10–02 | 5.1 × 10–02 | 3.5 × 10–02 | 2.2 × 10–02 | 1.2 × 10–02 | 6.4 × 10–03 |
| H2S | 8.4 × 10–03 | 7.8 × 10–03 | 7.2 × 10–03 | 6.6 × 10–03 | 6.0 × 10–03 | 5.6 × 10–03 | 5.2 × 10–03 | 5.0 × 10–03 | 4.9 × 10–03 |
| CO2 | 2.6 × 10–03 | 3.0 × 10–03 | 3.6 × 10–03 | 3.6 × 10–03 | 3.4 × 10–03 | 2.7 × 10–03 | 1.7 × 10–03 | 8.9 × 10–04 | 4.3 × 10–04 |
| HCl | 8.4 × 10–04 | 1.4 × 10–03 | 3.3 × 10–03 | 6.6 × 10–04 | 6.0 × 10–04 | 5.6 × 10–04 | 5.2 × 10–04 | 5.0 × 10–04 | 4.9 × 10–04 |
| CO | 4.4 × 10–04 | 7.8 × 10–04 | 7.2 × 10–04 | 8.5 × 10–03 | 1.7 × 10–02 | 2.9 × 10–02 | 4.1 × 10–02 | 4.9 × 10–02 | 5.4 × 10–02 |
| C2H6 | 6.9 × 10–06 | 7.5 × 10–06 | 7.1 × 10–06 | 5.7 × 10–06 | 4.1 × 10–06 | 2.6 × 10–06 | 1.6 × 10–06 | 9.6 × 10–07 | 6.7 × 10–07 |
| COS | 6.3 × 10–07 | 1.1 × 10–06 | 1.9 × 10–06 | 3.1 × 10–06 | 4.7 × 10–06 | 6.5 × 10–06 | 8.1 × 10–06 | 9.0 × 10–06 | 9.4 × 10–06 |
| CH3SH | 3.1 × 10–08 | 3.8 × 10–08 | 4.1 × 10–08 | 7.5 × 10–08 | 1.5 × 10–07 | 2.5 × 10–07 | 1.6 × 10–06 | 9.6 × 10–07 | 6.7 × 10–07 |
| H2S2 | 3.5 × 10–09 | 9.9 × 10–09 | 3.1 × 10–08 | 4.1 × 10–08 | 3.7 × 10–08 | 3.6 × 10–08 | 3.8 × 10–07 | 5.1 × 10–07 | 5.8 × 10–07 |
| C2H4 | 2.4 × 10–09 | 4.3 × 10–09 | 5.0 × 10–09 | 9.6 × 10–09 | 2.1 × 10–08 | 3.3 × 10–08 | 5.0 × 10–08 | 5.8 × 10–08 | 1.2 × 10–07 |
| CH3Cl | 4.3 × 10–10 | 1.1 × 10–09 | 3.6 × 10–09 | 5.8 × 10–09 | 6.9 × 10–09 | 8.4 × 10–09 | 2.8 × 10–08 | 5.0 × 10–08 | 6.1 × 10–08 |
| H2CO | 2.6 × 10–10 | 6.4 × 10–10 | 9.1 × 10–10 | 1.3 × 10–09 | 2.4 × 10–09 | 7.3 × 10–09 | 2.0 × 10–08 | 2.4 × 10–08 | 5.2 × 10–08 |
| CH3OH | 2.4 × 10–10 | 5.2 × 10–10 | 8.4 × 10–10 | 1.2 × 10–09 | 1.7 × 10–09 | 4.0 × 10–09 | 1.1 × 10–08 | 2.3 × 10–08 | 2.0 × 10–08 |
| HCOOH | 2.3 × 10–10 | 4.6 × 10–10 | 7.9 × 10–10 | 9.9 × 10–10 | 1.6 × 10–09 | 1.5 × 10–09 | 9.6 × 10–09 | 1.4 × 10–08 | 1.8 × 10–08 |
| Oстальное | 5.3 × 10–11 | 1.7 × 10–10 | 5.6 × 10–10 | 9.8 × 10–10 | 2.3 × 10–09 | 4.6 × 10–09 | 7.5 × 10–09 | 1.6 × 10–08 | 4.3 × 10–08 |
Таким образом, увеличение концентрации кислорода приводит к повышению выхода CO и CO2, при этом CO2 доминирует в области температур до 500°С. Следует отметить важность примеси кислорода с точки зрения взаимодействия со свинцом, так как свинец обладает высоким сродством к кислороду. Расчет показывает, что равновесное давление кислорода в системе Pb–PbO существенно выше давления кислорода в продуктах пиролиза, что обусловлено влиянием водорода и метана, являющихся восстановителями оксида свинца. Поэтому при взаимодействии кислорода и свинца твердая фаза оксида свинца не будет образовываться.
Результаты термодинамических расчетов влияния металлических примесей на пиролиз отработавших автомобильных шин в расплаве свинца. Расплав свинца может растворять металлические компоненты, входящие в состав шин, что может привести к его загрязнению различными примесями в процессе пиролиза. Это, в свою очередь, должно отразиться на методах поддержания качества теплоносителя и его очистки.
Возможность химического взаимодействия свинца с металлическими компонентами определяется также и существованием соответствующих интерметаллических соединений между жидким металлом и элементами, входящими в состав шин.
Как было отмечено ранее, одним из основных продуктов пиролиза шин является водород. Водород является хорошим восстановителем для большинства соединений металлов с кислородом, однако примесь кислорода ограничивает восстановительные возможности водорода. Поэтому в преддверии рассмотрения вопроса о растворимости важно знать, какие металлические примеси могут находиться в свободном состоянии, а какие в связанном.
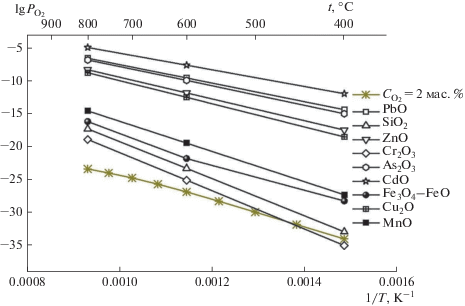
На рис. 10 приведены результаты расчетов, из которых следует, что равновесное парциальное давление кислорода при термической диссоциации окислов выше парциального давления кислорода в продуктах пиролиза шин. Это означает, что все окислы будут восстанавливаться до чистых металлов водородом (за исключением оксида хрома Cr2O3 при температурах ниже 450°С).
Рис. 10.
Равновесное парциальное давление кислорода при диссоциации окислов в зависимости от температуры.
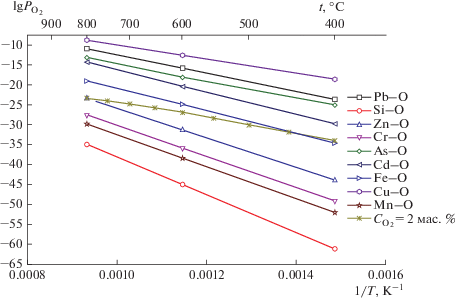
Однако из расчетов равновесного парциального давления кислорода в системах Me–O для случая избытка металлического компонента (рис. 11), а именно когда металл присутствует в конденсированной фазе (активность равна единице), следует, что не все окислы будут восстанавливаться полностью.
Окислы цинка, хрома, марганца, кремния в области температур 400–800°С и железа при температурах ниже 500°С будут восстанавливаться до тех пор, пока активность чистых металлов не достигнет определенной величины. Например, восстановление магнетита Fe3O4 при температуре 450°С прекратится, когда активность железа Fe достигнет единицы (концентрация железа в свинце достигнет концентрации насыщения). Аналогично восстановление окисла цинка ZnO при температуре 800°С прекратится, когда активность цинка Zn достигнет единицы. Окислы SiO2, MnO, Cr2O3 будут восстанавливаться до значений активностей чистых металлов $ \ll 1$ (т.е. их концентрации в свинце будут много меньше концентрации насыщения). Таким образом, с практической стороны интерес вызывают только железо, цинк, мышьяк, кадмий и медь.
Однако и эти металлы в области температур 400–800°С не образуют соединений со свинцом. Растворимость железа (рис. 12) в свинце мала и на данном этапе ее влиянием можно пренебречь, однако примеси цинка, кадмия, мышьяка и меди обладают существенной растворимостью в свинце.
Несмотря на то, что примеси цинка, кадмия, цинка и мышьяка обладают большим сродством к кислороду (рис. 13) в сравнении со свинцом, в условиях пиролиза шин они не будут образовывать соединений с кислородом и, следовательно, могут практически неограниченно накапливаться в свинце.
С одной стороны, это можно рассматривать как положительный результат, так как уменьшается выброс этих элементов в газовую фазу. Но, с другой стороны, накопление примесей в свинце будет сопровождаться изменением его физико-химических свойств, что необходимо учитывать при разработке конкретных технологических схем.
ЗАКЛЮЧЕНИЕ
Расчет показывает, что равновесное давление кислорода в системе Pb–PbO существенно выше давления кислорода в продуктах пиролиза. Поэтому при взаимодействии кислорода и свинца твердая фаза оксида свинца не будет образовываться. В зависимости от содержания серы в шинах и температуры, возможно образование конденсированных фаз PbS и PbCl2. При этом очистку расплава от серы и хлора можно проводить периодически или в отдельной зоне. Расчет показывает, что в условиях пиролиза трудно ожидать окисления свинца водяным паром с образованием твердой фазы. Проведенный анализ показывает, что примеси, железа, цинка, меди, кадмия и мышьяка в области температур 400–800°С не образуют соединений со свинцом.
Основным результатом проведенной работы является выявление отсутствия ограничений для использования свинца в качестве жидкометаллического теплоносителя при пиролизе отработавших автомобильных шин с точки зрения термодинамики.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (уникальный идентификатор ПНИЭР RFMEFI57916X0136).
ОБОЗНАЧЕНИЯ
| a | активность кислорода |
| aO | равновесная активность кислорода в жидком свинце |
| Снас | концентрация насыщения |
| $c_{{\text{O}}}^{s}$ | концентрация насыщения кислорода в свинце |
| f | фугитивность, атм |
| ΔG | свободная энергия Гиббса, Дж/моль |
| ${{P}_{{{{{\text{H}}}_{2}}}}}$ | равновесное парциальное давление водорода над жидким свинцом |
| ${{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | равновесное парциальное давление водяного пара над жидким свинцом |
| R | универсальная газовая постоянная, Дж/(моль К) |
| T | температура, °С |
Список литературы
Хелпикс. Орг (2016) Перечень отходов, образующихся при эксплуатации автотранспорта. http:// helpiks.org/5-33099.html (дата обращения: 29.03.2016).
Федеральный закон от 25.11.1994 г. № 49-ФЗ “О ратификации Базельской конвенции о контроле за трансграничной перевозкой опасных отходов и их удалением”. 1994.
Suris A.L. The study of various models of the process of thermal treatment of solid waste // Theor. Found. Chem. Eng. 2018. V. 52. № 2. P. 234. [Сурис А.Л. Исследование различных моделей процесса термической переработки твердых отходов // Теор. осн. хим. технол. 2018. Т. 52. № 2. С. 212.] https://doi.org/10.1134/S0040579518020185
Skomorokhova S.N., Nikolaev A.N., Askhadullin R.S.h., Trifanova E.M., Sitnikov I.V. The immobilization of the ash residue produced as a result of processing radioactive ion-exchange resins in a lead melt // Asian J. Microbiol., Biotechnol. Environ. Sci. 2016. V. 18. № 4. P. 1063.
Легких А.Ю., Асхадуллин Р.Ш., Садовничий Р.П. Обеспечение коррозионной стойкости сталей в тяжелых жидкометаллических теплоносителях // Изв. высш. учебн. завед. Яд. энерг. 2016. № 1. С. 138.
Лаврова О.В., Легких А.Ю., Стороженко А.Н. Термодинамические аспекты процесса окисления металлических примесей и поверхностей сталей в расплавах тяжелых жидких металлов // Изв. высш. учебн. завед. Яд. энерг. 2016. № 4. С. 102.
Ульянов В.В., Гулевский В.А., Мартынов П.Н., Фомин А.С., Шелеметьев В.М., Садовничий Р.П., Ниязов С.-А.С. Применение теплоносителей Pb и Pb–Bi в новых технологиях переработки твердых, жидких и газообразных сред // Изв. высш. учебн. завед. Яд. энерг. 2012. № 4. С. 102.
ООО “Д-Мобайл” (2018) Пиролиз изношенных шин и отходов полимеров. https://additive.spb.ru/piroliz.html (дата обращения: 22.04.2018).
Устинов В.А., Козлита А.Н., Люлькин М.С. Выбор температурного режима в аппарате пиролиза на основании химии процесса // Нефтегазов. дело. 2011. № 3. С. 208.
Cheng L.L., Alcock C.B. A thermodynamic study of dilute solutions of sulphur in liquid tin and lead // Trans. AIME. 1961. V. 221. P. 215.
Хансен М., Андерко К. Структуры двойных сплавов. Пер. с англ. М.: Металлургиздат, 1962. Т. 1, 2.
Эллиот Р.П. Структуры двойных сплавов. Первое дополнение. Пер. с англ. М.: Металлургия, 1970. Т. 1, 2.
Blanks R.F., Willis G.M. Equilibria between lead, lead sulphide, and cuprous sulphide, and the decopperizing of lead with sulphur // Physical Chemistry of Process Metallurgy / Ed. Pierre G.R.St. New York: Interscience, 1961. P. 991.
Шанк Ф.А. Структуры двойных сплавов. Второе дополнение. Пер. с англ. М.: Металлургия, 1973.
Gerlach J., Grigel J. Loslichkeit von Schwefel in fltissigem Blei // Metall (Clausthal-Zellerfeld, Ger.). 1963. Bd. 17. S. 802.
Esdaile J.D. Thermodynamics and phase diagram of the lead-lead sulphide binary system // Proc. – Australas. Inst. Min. Metall. 1972. № 241. P. 63.
Lin J.-C., Sharma R.C., Chang Y.A. The Pb–S (lead-sulfur) system // Bull. Alloy Phase Diagrams. 1986. V. 7. № 4. P. 374.
Savitskii E.M., Gribulya V.B. Application of Computer Techniques in the Prediction of Inorganic Compounds. New Delhi: Oxonian, 1985.
Арнольдов M.H. Растворимость и коррозия конструкционных материалов в жидкометаллических теплоносителях (свинец, висмут и их сплавы): обзор ФЭИ-0288. М.: ЦНИИАтоминформ, 1999.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии