Теоретические основы химической технологии, 2020, T. 54, № 1, стр. 45-51
Эффект разделяющего агента в экстрактивной дистилляции
В. А. Лотхов a, *, С. Я. Квашнин a, Н. Н. Кулов a, **
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: vlotk2011@mail.ru
** E-mail: kulovnn@mail.ru
Поступила в редакцию 16.09.2019
После доработки 30.09.2019
Принята к публикации 04.10.2019
Аннотация
На примере системы бензол–гептан–N-метилпирролидон показана возможность образования практически нелетучих молекулярных комплексов между компонентами смеси и разделяющим агентом различного состава. При моделировании фазового равновесия пар–жидкость, как правило, не учитывают реальную структуру раствора, принимая мономолекулярную структуру веществ, содержащихся в растворе. Это существенным образом влияет на реальные значения коэффициентов относительной летучести, приводящие к появлению концентрационной инверсии. Экспериментально определены значения долей веществ, находящихся в мономолекулярном виде.
ВВЕДЕНИЕ
Процессы разделения жидких смесей находят широкое применение в различных отраслях промышленности, в заводских и исследовательских лабораториях. Универсальным физическим методом является простая дистилляция, применение которой для разделения близкокипящих и азеотропных смесей представляется или невозможным, или слишком дорогим. Во многих случаях вследствие близких значений равновесных концентраций различных веществ и требования большого числа ступеней разделения используют экстрактивную дистилляцию – процесс многократного испарения и конденсации компонентов смеси в присутствии добавляемого к раствору растворимого в жидкой фазе, но, практически нелетучего разделяющего агента, оказывающего селективное воздействие на ключевые компоненты смеси, подлежащей разделению.
В настоящее время экстрактивная дистилляция широко применяется для разделения сложных смесей. Например, она успешно используется для выделения бензола из нефтяных фракций, а также для снижения содержания ароматических соединений в высококачественных автомобильных бензинах [1–3].
Для того чтобы увеличить относительную летучесть и облегчить разделение, влияние разделяющего агента на коэффициенты активности разделяемых компонентов должно быть различным. В отличие от обычной дистилляции, в процессе которой низкокипящий компонент всегда будет концентрироваться в дистилляте, в экстрактивной дистилляции в присутствии некоторых разделяющих агентов он может накапливаться в кубе. В то же время, когда высококипящий компонент в обычной дистилляции собирается в кубе, в экстрактивной дистилляции в присутствии другого разделяющего агента он может накапливаться в дистилляте. Экспериментально показано [4], что при разделении бинарной смеси ацетон (tk = = 56.5°C)–метанол (tk = 64.7°C) в присутствии таких разделяющих агентов, как глицерин или этиленгликоль, снижающих летучесть метанола, он становится кубовым продуктом, в то время как такие разделяющие агенты, как метилэтилкетон или ацетофенон, уменьшающие летучесть ацетона, делают его кубовым продуктом.
На рис. 1 приведены данные по фазовому равновесию жидкость–пар для системы бензол (tk = = 80.1°C) (1)–гептан (tk = 98.4°C) (2)–N-метилпирролидон (tk = 202°C) (3), экспериментально определенные при различных соотношениях S, характеризующих количество разделяющего агента (N-метилпирролидонa) отнесенного к суммарному содержанию бензола и гептана в исходной смеси. Поскольку N-метилпирролидон в паровой фазе практически отсутствует, на рис. 1 приведены значения относительных концентраций бензола в жидкой фазе.
Рис. 1.
Равновесие пар–жидкость в системе бензол (1)–гептан (2)–N-метилпирролидон (3) при x1 = y1 [9]: 1 – S = 0; 2 – у1 = x1; 3 – S = 1; 4 – S = 2; 5 – S = 3.
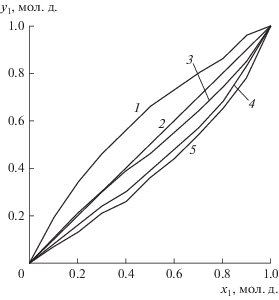
Из приведенных на рис. 1 данных следует, что наличие в разделяемой системе N-метилпирролидона оказывает существенное влияние на содержание компонентов в паровой фазе, вызывая инверсию относительной летучести компонента 1. Концентрация низкокипящего компонента 1 в жидкой фазе становится выше, чем в паровой. Следовательно, дистиллят обогащается высококипящим компонентом 2, кубовая жидкость – бензолом и N-метилпирролидоном. На рис. 2 показано, как изменяется при этом относительная летучесть бензола в зависимости от отношения S.
Рис. 2.
Коэффициенты относительной летучести в системе бензол–гептан–N-метилпирролидон в зависимости от S для различных концентраций бензола: x1 = 0.1 (1), 0.5 (2) и 0.9 (3) мол. д.
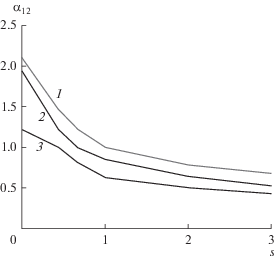
В качестве объяснения этого явления было высказано предположение [5, 6], что в системах, содержащих предельные, ароматические углеводороды и полярные разделяющие компоненты, к которым принадлежит N-метилпирролидон, возможно образование молекулярных комплексов с аренами, приводящих к снижению их летучестей. Молекулярные комплексы, характеризующиеся донорно-акцепторными взаимодействиями, в органической химии представляют интерес ввиду их возможной роли в качестве промежуточных продуктов реакции, приводящих к стабильным соединениям , как отмечали в своей книге Эндрюс и Кифер [7]. В процессе экстрактивной дистилляции эти комплексы могут играть главную роль при интенсивном взаимодействии компонентов исходной смеси с разделяющим агентом.
Вместе с тем исследования фазового равновесия жидкость–пар в бинарной системе бензол–N-метилпирролидон, которым посвящено большое число работ (в книге [8] содержится 17 ссылок на отечественные и зарубежные экспериментальные исследования), показали, что эта система характеризуется незначительными отклонениями (соразмерными по масштабу с погрешностями эксперимента) от закона Рауля.
Цель настоящей работы – изучение механизма действия разделяющего агента в экстрактивной дистилляции на примере разделения бинарной смеси бензол–гептан в присутствии N-метилпирролидона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для изучения влияния растворителя на процесс экстрактивной дистилляции проведены опыты по изучению фазового равновесия жидкость–пар в динамических и статических условиях смесей, составленных из бензола, гептана и N-метилпирролидона. Для экспериментального исследования фазового равновесия в изобарических условиях использовали эбулиометр Свентославского. Подробное описание методики эксперимента содержится в работе [9]. На основе опытных данных определены параметры бинарного взаимодействия в уравнениях NRTL для коэффициентов активности компонентов. Эта математическая модель адекватно описывает опытные данные и находится в удовлетворительном согласии с результатами других исследователей.
Опыты по фазовому равновесию жидкость–пар, а также измерения давления паров однокомпонентных, бинарных и трехкомпонентных систем при полном испарении жидких образцов в изотермических условиях проводили в статической ячейке, снабженной устройством для ввода жидких образцов и манометром. Термостатирование ячейки осуществляли в воздушном термостате. Экспериментально найденные значения давлений сопоставляли с вычисленными по уравнениям Клапейрона–Менделеева и Дальтона, рассматривая смесь как идеальную, поскольку в опытах общее давление паров в ячейке не превышало 760 мм рт. ст. Подробное описание экспериментальной методики приведено в работе [10].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 содержатся результаты тестовых испытаний по полному испарению небольших количеств бензола, гептана, а также их смесей при 20°С. Как видно из данных табл. 1, среднее отклонение измеренного давления от вычисленного по уравнениям Клапейрона–Менделеева и Дальтона составляет 5.72%, а максимальное не превышает 9.98%.
Таблица 1.
Экспериментальные и вычисленные значения давления паров
| Компоненты | g, г | P(экс), мм рт. ст. | P(выч), мм рт. ст. | d, % |
|---|---|---|---|---|
| Бензол | 0.253 | 20.7 | 21.0 | 1.44 |
| Бензол | 0.440 | 34.0 | 36.5 | 7.35 |
| Н-гептан | 0.337 | 22.5 | 21.8 | –3.11 |
| Н-гептан | 0.205 | 12.1 | 13.3 | 9.98 |
| Бензол Н-гептан | 0.250 0.149 | 28.4 | 30.3 | 6.70 |
В табл. 2 приведены результаты измерения давлений паров бензола p1, гептана p2 и их смесей в присутствии N-метилпирролидона при 20°С. Для идеальных газовых смесей общее давление должно быть равным сумме парциальных давлений. Однако давления паров компонентов смесей существенно ниже вычисленных (Pвыч):
Таблица 2.
Сравнение экспериментальных значений давлений паров с вычисленными по уравнениям Дальтона, Клапейрона–Менделеева, а также по уравнениям, учитывающим образование молекулярных комплексов бензола и гептана с N-метилпирролидоном (z1 = 0.394, z2 = 0.743)
| Система | g, г | S | P(экс), мм рт. ст. |
P(выч)0, мм рт. ст. |
d0, % | P(выч)1, мм рт. ст. |
d1, % |
|---|---|---|---|---|---|---|---|
| Бензол N-мп |
0.489 0.405 |
0.745 | 17.7 | 45.3 | –156 | – | – |
| Н-гептан N-мп |
0.368 0.212 |
0.583 | 18.7 | 24.6 | –31.6 | – | – |
| Бензол Н-гептан N-мп |
0.307 0.245 0.425 |
0.672 | 23.6 | 41.5 | –75.8 | 21.9 | –7.34 |
| Бензол Н-гептан N-мп |
0.0953 0.068 0.691 |
3.66 | 6.05 | 12.4 | –106 | 6.51 | 7.64 |
| Бензол Н-гептан N-мп |
0.0913 0.088 0.327 |
1.61 | 6.91 | 13.4 | –94.4 | 7.34 | –6.08 |
| Бензол Н-гептан N-мп |
0.017 0.189 0.107 |
0.513 | 16.7 | 13.8 | 17.4 | 18.5 | 10.8 |
Расхождения (do) достигают 156%.
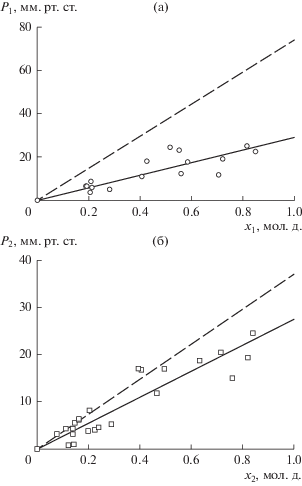
На рис. 3 показаны результаты измерения равновесных давлений смеси паров бензола (1) и N-метилпирролидона (3) (рис. 3a) и гептана (2) и N-метилпирролидона (3) (рис. 3б) в зависимости от концентрации компонентов. Штриховые линии на рис. 3а рассчитаны по уравнению P1 = = $P_{1}^{0}{{x}_{1}}$ + p3, а на рис. 3б по уравнению P2 = $P_{2}^{0}{{x}_{2}}$ + p3. Давление насыщенного пара метилпирролидона во всех опытах оставалось постоянным и равным p3 = 0.161 мм рт. ст. Парциальные давления паров бензола и гептана изменялись в зависимости от их количеств в смеси (при 20°С давление паров бензола составило $P_{1}^{0}$ = 73.1, гептана – $P_{2}^{0}$ = 37.0 мм рт. ст.). Отношения измеренных давлений к вычисленным равны z1 = 0.394 и z2 = 0.743. Снижение давления паров бензола и гептана, по-видимому, связано с образованием низко летучих молекулярных комплексов бензола с N-метилпирролидоном и гептана с N-метилпирролидоном в жидкой фазе. В результате низкой летучести молекулярных комплексов доля мономерных молекул бензола z1 и гептана z2 в паровой фазе уменьшается. Анализируя данные табл. 2, можно отметить, что вычисленные значения давлений с учетом коэффициентов z1 и z2 находятся в удовлетворительном соответствии с измеренными в опыте. Среднее отклонение составляет 7.97%, максимальное – 10.8%.
Рис. 3.
Изменение давлений паров бензола (a) и гептана (б) в смеси с N-метилпирролидоном в зависимости от концентрации. Изотермические условия, t = = 20°C. Сплошные линии – линейная аппроксимация экспериментальных данных (точки). Штриховые линии – расчет по уравнению Рауля.
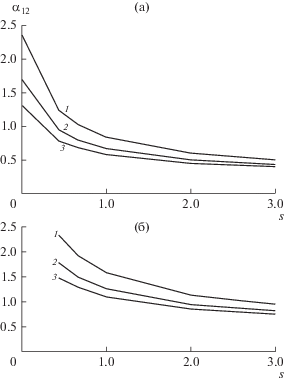
На рис. 4 приведены результаты вычислительного эксперимента по моделированию фазового равновесия жидкость–пар в изотермических условиях. Как видно из рис. 4а, в интервале изменения S = 0.3–0.8 в зависимости от содержания бензола в смеси x1 коэффициенты относительной летучести становятся меньше единицы и при S = 3 достигают значения α12 = 0.4.
Рис. 4.
Зависимость коэффициента относительной летучести от S (t = 20°C) без учета образования молекулярных комплексов (a) и с учетом их образования (б) для различных концентраций бензола: x1 = 0.1 (1), 0.2 (2), 0.5 (3) и 0.7 (4) мол. д.
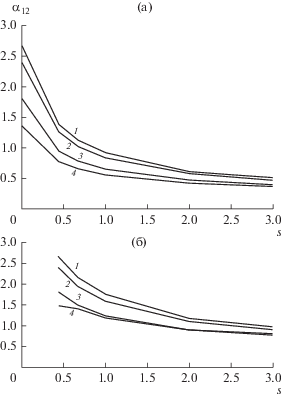
Причина появления таких значений относительной летучести (легким компонентом становится гептан) состоит в том, что при моделировании фазового равновесия жидкость–пар, как правило, принимают мономолекулярную структуру веществ, содержащихся в растворе. Однако это не всегда соответствует действительности. Как было показано выше, значительная доля веществ участвует в реакции образования практически нелетучих молекулярных комплексов.
Зависимость коэффициентов относительной летучести, рассчитанных с учетом образовавшихся в растворе практически нелетучих молекулярных комплексов бензола с N-метилпирролидоном (z1 = 0.394) и гептана с N-метилпирролидоном (z2 = 0.743), приведена на рис. 4б. Как следует из этого рисунка, почти во всем диапазоне изменения S и x1 коэффициенты относительной летучести больше единицы и лишь при больших значениях S и x1 находятся вблизи 1.
Аналогичные результаты можно наблюдать на рис. 5, на котором построены зависимости коэффициентов относительной летучести рассматриваемой системы от S и x1, рассчитанные для изотермических условий (t = 50°С) и найденных в опытах значениях z1 = 0.16 и z2 = 0.30.
Рис. 5.
Зависимость коэффициента относительной летучести от S (t = 50°C) без учета образования молекулярных комплексов (a) и с учетом их образования (б) для различных концентраций бензола: x1 = 0.2 (1), 0.5 (2) и 0.7 (3) мол. д.
В книге [11] отмечается, что в ассоциированных растворах отклонения от идеальности весьма велики и кажется разумным приписать, по крайней мере, большую часть этих отклонений взаимодействиям, приводящим к образованию молекулярных комплексов. При этом система мономер–молекулярный комплекс должна не сильно отличаться от идеальной, поскольку между образующими ее частицами действуют лишь обычные межмолекулярные силы. Подтверждением этой гипотезы, на наш взгляд, являются результаты настоящей работы. В табл. 3 приведены значения коэффициентов относительной летучести бинарной системы бензол (1)–гептан (2), определенные для изотермических условий (t = 20 и 50°С). Сопоставляя по степени неидеальности значения коэффициентов относительной летучести, приведенных на рис. 4б и 5б, с содержащимися в табл. 3, можно прийти к заключению, что они находятся в удовлетворительном качественном соответствии.
Таблица 3.
Коэффициенты относительной летучести в системе бензол (1)–гептан (2) в изотермических условиях
| x1, мол. д. | α12 | |
|---|---|---|
| температура, °С | ||
| 20 | 50 | |
| 0.1 | 2.69 | 2.55 |
| 0.2 | 2.51 | 2.36 |
| 0.4 | 2.06 | 1.93 |
| 0.5 | 2.02 | 1.71 |
| 0.7 | 1.37 | 1.31 |
| 0.8 | 1.16 | 1.14 |
| 0.9 | 1.02 | 1.01 |
Учитывая изложенное выше, можно предложить следующую принципиальную схему процесса экстрактивной дистилляции (рис. 6).
Рис. 6.
Принципиальная схема процесса экстрактивной дистилляции: A, B – низко- и высококипящий компоненты, L – разделяющий агент, AL, BL – молекулярные комплексы.
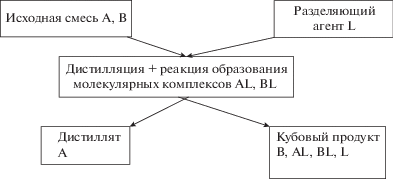
В этом процессе разделяющий агент, значительно менее летучий по сравнению с компонентами исходной смеси, вводят в верхней части колонны. В колонне между восходящим потоком пара и нисходящим потоком жидкости происходят многократные акты испарения и конденсации, в процессе которых осуществляется межфазный массообмен с реакцией образования практически нелетучих молекулярных комплексов в жидкой фазе AL, BL. При этом в результате реакции поток пара по колонне уменьшается, а поток жидкости возрастает. Возникает дополнительная к создаваемой потоком разделяющего агента неэквимолярность потоков за счет реакции, влияющая на эффективность массопереноса. Под воздействием такого массообмена низкокипящий компонент исходной смеси A концентрируется в дистилляте, а высококипящий компонент B и образующиеся молекулярные комплексы AL, BL вместе с разделяющим агентом L накапливаются в кубе колоны.
Очевидно, что в рассматриваемом случае действие разделяющего агента оказывает существенное влияние как на равновесие жидкость–пар, так и на кинетику процесса. Изменение относительной летучести компонентов, обусловленное разной интенсивностью взаимодействия компонентов с растворителем, происходит в основном за счет реакции образования молекулярных комплексов. Появляющаяся при этом скоростная неравномерность потоков пара и жидкости вызывает изменение эффективности массопереноса.
ЗАКЛЮЧЕНИЕ
На основе натурного и вычислительного эксперимента показано, что в условиях экстрактивной ректификации влияние разделяющего агента на относительную летучесть компонентов смеси определяется свойствами раствора, в которых главную роль играют реакции образования практически нелетучих молекулярных комплексов разделяющего реагента с компонентами исходной смеси различной интенсивности. Наличие молекулярных комплексов существенно влияет на фазовое равновесие жидкость–пар в разделяемой системе, а также на эффективность массообмена.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 18-13-00475).
ОБОЗНАЧЕНИЯ
| do | отклонение, % |
| g | масса вещества, г |
| α = ($y_{i}^{*}$/xi)[(1 – ‒ xi)/(1 – $y_{i}^{*}$)] | коэффициент относительной летучести |
| M | молекулярная масса, г/моль |
| P, p | давления, мм рт. ст. |
| P0 | давление насыщенного пара, мм рт. ст. |
| R | универсальная газовая постоянная, равная 8.31 × 107 эрг/(моль град) |
| S = x3/(x1 + x2) | концентрация разделяющего агента, отнесенная к суммарной концентрации бензола и гептана |
| T | температура, К |
| V | объем, см3 |
| x | концентрация вещества в жидкой фазе, мол. д. |
| y | концентрация вещества в паровой фазе, мол. д. |
| y* | концентрация вещества в паровой фазе, равновесная концентрации вещества в жидкой фазе, мол. д. |
| z | доля вещества в мономером виде |
ИНДЕКСЫ
Список литературы
Гайле А.А., Сомов В.Е., Варшавский О.М. Ароматические углеводороды: выделение, применение, рынок. СПб.: Химиздат, 2000.
Handbook of Petroleum Engineering Processes / Ed. Meyers R.A. New York: McGraw-Hill, 2004.
Гайле А.А., Соловых И.А. Снижение содержания бензола в автомобильных бензинах методом экстрактивной ректификации // Изв. С.-Петерб. гос. технол. инст. (тех. унив.). 2013. № 18 (44). С. 32.
Yeh A., Berg J. Reversing of relative volatilities by extractive distillation // Recent Advances in Separation Techniques III. AIChE Symposium Series. V. 82. № 250 / Ed. Li N.N. New York: American Institute of Chemical Engineers, 1986. P. 169.
Зарецкий М., Коган В.Б., Кононов Н.Ф., Подоляк В.Г. Влияние строения полярных растворителей на их селективность в системе тиофен–бензол // Журн. прикл. хим. 1970. Т. 4. № 7. С. 1563.
Blanco B., Sanz M.T., Beltran S., Cabezas J.L. Vapor–Liquid Equilibrium of the Ternary System Benzene + + Heptane + N-Methylpyrrolidone (NMP) at 181.33 kPa // J. Chem. Eng. Data. 2002. V. 47. P. 1167.
Эндрюс Л., Кифер Р. Молекулярные комплексы в органической химии. М.: Мир, 1967.
Гайле А.А., Залищевский Г.Д. N-метилпирролидон. Получение свойства и применение в качестве селективного растворителя. СПб.: Химиздат, 2005.
Иванов И.В., Лотхов В.А., Глебова Ю.А., Челюскина Т.В., Кулов Н.Н. Исследование фазового равновесия в системе бензол–гептан–N-метилпирролидон // Теор. осн. хим. технол. 2014. Т. 48. № 4. С. 363.
Каширская О.А., Лотхов В.А., Дильман В.В. Определение коэффициента молекулярной диффузии барометрическим методом // Ж. физ. хим. 2008. Т. 82. № 7. С. 1378.
Пригожин И., Дефей Р. Химическая термодинамика. Новосибирск: Наука, 1966.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


