Теоретические основы химической технологии, 2020, T. 54, № 4, стр. 475-479
Межфазное распределение V(IV) в системе полиэтиленгликоль 1500–нитрат натрия–вода
М. И. Федорова a, А. В. Левина a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 23.03.2020
После доработки 25.03.2020
Принята к публикации 27.03.2020
Аннотация
Проведено исследование межфазного распределения ионов V(IV) в нитратной системе с полиэтиленгликолем 1500. Получены зависимости коэффициента распределения V(IV) от параметров процесса экстракции. Установлено, что предложенная двухфазная водная система позволяет эффективно извлекать V(IV) из кислых нитратных растворов со степенью извлечения более 70% за одну ступень экстракции.
ВВЕДЕНИЕ
Ванадий и его соединения нашли широкое применение в следующих отраслях: металлургия, в качестве добавки к сплавам [1–3], химическая промышленность, в качестве катализатора при производстве оксидов серы и оксидов азота [4, 5], а также биодизельного топлива [6], нефтехимическая промышленность [7], кроме того, при производстве высокотехнологичных изделий [8] и др. При этом добыча ванадия из руд затруднительна вследствие того, что он не образует собственных минералов и его добыча ведется попутно [9], а спрос на него с каждым годом растет [10]. Альтернативным источником ванадия могут являться тяжелые нефти [11] – в них он находится в виде металлоорганических соединений. Его содержание в таком сырье может достигать 1400 г/т. Первым этапом выделения ванадия и сопутствующих металлов из нефти является деметаллизация минеральными кислотами, в результате которой образуются кислые водные растворы.
Достаточно эффективным и хорошо изученным способом выделения ванадия из кислых водных растворов является жидкостная экстракция [12–17]. Ванадий(IV) в растворах при значениях рН < 3 находится в виде VO2+ [12], что позволяет извлекать его в органическую фазу катионообменными экстрагентами, такими как моно-2-этилгексиловый эфир 2-этилгексилфосфорной кислоты [12–15], ди(2-этилгексил)фосфорная кислота [15–17], а также ди(2,4,4-триметилпентил)фосфиновая кислота [18] с образованием соединений следующих составов: ${\text{VO}}{{{\text{A}}}_{2}} \cdot {{\left( {{\text{HA}}} \right)}_{2}}$, ${\text{VO}}{{{\text{A}}}_{2}}$, ${\text{VO}}{{\left( {{\text{HA}}} \right)}_{2}}$, где ${{{\text{A}}}^{ - }}$ – остаток органической кислоты. Данные экстрагенты характеризуются высокими значениями коэффициента распределения. Так, в случае ди(2-этилгексил)фосфорной кислоты он равен 9 при исходной концентрации ванадил-иона 0.01 моль/л и экстрагента 0.5 моль/л и соотношении водной и органической фаз, равном 1 : 1 [15].
На сегодняшний день для извлечения и разделения солей металлов особый интерес представляют экстракционные системы на основе водорастворимых полимеров (полиэтиленгликолей, полипропиленгликолей и др.) [19–35], которые являются экологически безопасной заменой органическим растворителям. Данные системы позволяют эффективно извлекать такие металлы, как Fe(III), Ni(II), Co(II), La(III), Ce(III) и др. [21–31], а также соединения V(V) [32, 33]. Наиболее хорошо изучено извлечение металлов из сульфатных и хлоридных сред [23–30]. Так, экстракция металлов из сульфатных сред возможна только при введении в экстракционную систему комплексообразователей неорганического (тиоцианата калия) [25] или органического (1-нитрозо-2-нафтола, ализаринового красного и др.) происхождения [28–30].
Экстракция соединений ванадия(IV) в двухфазных водных системах к настоящему времени изучена мало. Имеются данные по экстракционному извлечению тиоцианатных комплексов ванадия(IV) в системе полиэтиленгликоль 1500–сульфат аммония–вода [34]. При 16-кратном избытке тиоцианат-ионов наблюдается количественное извлечение V(IV) в полимерную фазу.
Одними из перспективных двухфазных водных систем для выделения ионов металлов являются системы на основе нитратов щелочных металлов [19, 20], которые показывают высокую эффективность извлечения (>60%) ряда ионов металлов (Fe, Co, Ni) без введения дополнительных комплексообразующих агентов [35].
Таким образом, цель настоящей работы – изучение межфазного распределения V(IV) в экологически безопасной экстракционной системе полиэтиленгликоль 1500–нитрат натрия–вода без введения комплексообразующих агентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный раствор сульфата ванадила получали растворением точной навески VOSO4 · 3H2O квалификации “х. ч.”, взвешенной на аналитических весах, в 0.05 М растворе серной кислоты.
Экстракционная система была приготовлена с использованием полиэтиленгликоля с молекулярной массой 1500 (Acros Organics) и нитрата натрия квалификации “х. ч.”. Во всех экспериментах использовали систему состава полиэтиленгликоль 1500 (16.3 мас. %)–NaNO3 (36 мас. %)–H2O. Для предотвращения перехода VO2+ в другую форму (V2O4, ${\text{H}}{{{\text{V}}}_{{\text{2}}}}{\text{O}}_{5}^{ - }$) в процессе экстракции в систему вводили азотную кислоту до рН 1.1. Измерение кислотности среды проводили при помощи pH-метра Starter 5000 (OHAUS) с комбинированным электродом, калиброванным по буферным растворам (pH 1.68, 4.01, 7.00, 10.01) при температуре 25°С.
Экстракцию V(IV) проводили при температуре 25°С в градуированных пластиковых пробирках в термостатированном шейкере Enviro-Genie (Scientific Industries, Inc.) при скорости вращения 30 об/мин до установления термодинамического равновесия (30 мин). Исходная концентрация ионов V(IV) в солевой фазе составляла 0.01 моль/л.
Концентрацию V(IV) в исходном растворе и в фазах после экстракции определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина, образующего комплекс с V(IV), который поглощает в видимой области спектра при 536 нм [36]. Определение значений оптической плотности проводили с использованием прибора Cary-60 (Agilent Tech.) в кюветах толщиной 10 мм.
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
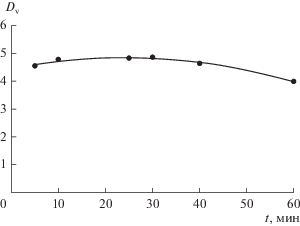
Нами было проведено исследование по определению времени установления равновесия при экстракции ионов V(IV) в системе полиэтиленгликоль 1500 (16.3 мас. %)–NaNO3 (36 мас. %)–H2O. Из рис. 1 видно, что ионы V(IV) довольно быстро переходят в полимерную фазу, выход на постоянное значение коэффициента распределения наблюдается уже при 5 мин. При этом после 40 мин наблюдается незначительное снижение коэффициента распределения V(IV), которое может быть вызвано эффектом эмульгирования [35].
Рис. 1.
Зависимость коэффициента распределения V(IV) от времени контакта фаз в системе полиэтиленгликоль 1500 (16.3 мас. %)–нитрат натрия (36 мас. %)–вода при СV(исх) = 0.01 моль/л, pHсол.ф = 1.1.
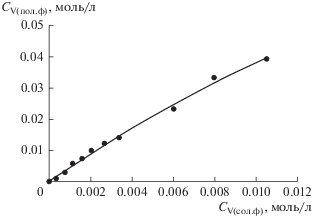
Для установления влияния исходной концентрации V(IV) на коэффициент распределения была проведена серия экспериментов с изменением начальной концентрации сульфата ванадила в солевой фазе в диапазоне от 0.001 до 0.04 моль/л. На рис. 2 представлена изотерма экстракции V(IV) в системе полиэтиленгликоль 1500 (16.3 мас. %)–нитрат натрия (36 мас. %)–вода. Как видно, изотерма экстракции V(IV) имеет близкий к прямолинейному характер зависимости.
Рис. 2.
Изотерма экстракции V(IV) в системе полиэтиленгликоль 1500 (16.3 мас. %)–нитрат натрия (36 мас. %)–вода при pHсол.ф = 1.1.
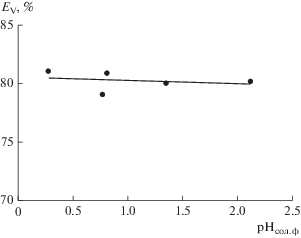
Изучено влияние кислотности среды на экстракцию V(IV) в исследуемой экстракционной системе. На рис. 3 представлена зависимость эффективности извлечения V(IV) от равновесных значений рН солевой фазы. Как видно, V(IV) экстрагируется в достаточно узком диапазоне значений рН (0 < рН < 2.5), причем извлечение V(IV) не зависит от кислотности солевой фазы. Экстракция ванадия(IV) в области более высоких значений рН протекает с образованием в солевой фазе нерастворимых соединений.
Рис. 3.
Зависимость степени извлечения V(IV) от кислотности солевой фазы в системе полиэтиленгликоль 1500 (16.3 мас. %)–нитрат натрия (36 мас. %)–вода при СV(исх) = 0.01 моль/л.
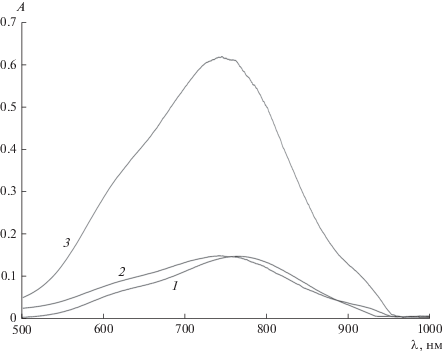
Ранее в работе [35] был предложен механизм экстракции катионов металлов в системе полиэтиленгликоль 1500–нитрат натрия–вода:
Ванадий(IV), так же как и ряд других переходных металлов, в растворах находится в виде аквакатиона состава ${{\left[ {{\text{VO}}{{{\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)}}_{5}}} \right]}^{{2 + }}}$ и имеет максимум поглощения в области 760 нм [37]. Для определения механизма экстракции нами были проведены исследования по определению состава экстрагируемых форм V(IV) в исследуемой экстракционной системе. Были получены электронные спектры поглощения исходного раствора сульфата ванадила и равновесных солевой и полимерной фаз, представленные на рис. 4. Как видно, исходный раствор, солевая и полимерная фазы после экстракции имеют схожие электронные спектры, указывающие на то, что V(IV) находится в одинаковой форме. Гидрофильный катионный аквакомплекс ${{\left[ {{\text{VO}}{{{\left( {{{{\text{H}}}_{2}}{\text{O}}} \right)}}_{5}}} \right]}^{{2 + }}}$ преимущественно распределяется в полимерную фазу с низким значением $\Delta {{{\text{G}}}_{{{\text{hyd}}}}}{\text{(NO}}_{{\text{3}}}^{ - }{\text{)\; = \;--275\;}}{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}$, образуя водородные связи с молекулами полиэтиленгликоля.
Рис. 4.
Электронный спектр поглощения исходного раствора (1), солевой (2) и полимерной (3) фаз после экстракции в системе полиэтиленгликоль 1500 (16.3 мас. %)–нитрат натрия (36 мас. %)–вода при СV(исх) = 0.01 моль/л, pHсол.ф = 1.1.
Таким образом, полученные нами данные показали эффективность использования экстракционной системы полиэтиленгликоль 1500 (16.3 мас. %)–NaNO3 (36 мас. %)–H2O для выделения V(IV) из кислых растворов. Предложенная система позволяет без введения дополнительных экстрагентов и использования пожароопасных и токсичных органических растворителей извлекать ванадий(IV) в полимерную фазу более чем на 70% за одну ступень.
ЗАКЛЮЧЕНИЕ
В настоящей работе предложена экологически безопасная экстракционная система полиэтиленгликоль 1500 (16.3 мас. %)–NaNO3 (36 мас. %)–H2O для извлечения ванадия(IV) из кислых растворов. Изучено влияние времени контакта фаз, исходной концентрации металла, а также кислотности среды на эффективность извлечения V(IV). Преимуществом предлагаемой системы по сравнению с другими системами на основе полимеров является возможность экстракции без дополнительных комплексообразующих агентов. Установлено, что в исследуемой системе V(IV) извлекается более чем на 70% за одну стадию экстракции. Предложен механизм извлечения ионов V(IV). Показано, что в полимерную фазу переходят аквакомплексы V(IV), которые связаны с полимером водородными связями. Предложенная экстракционная система перспективна при разработке химико-технологических процессов выделения V(IV) из кислых растворов.
Исследование частично выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 20-33-80015, а также в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований.
ОБОЗНАЧЕНИЯ
| A | оптическая плотность |
| C | концентрация, моль/л |
| D | коэффициент распределения |
| Е | степень извлечения, % |
| t | время, мин |
| λ | длина волны, нм |
ИНДЕКСЫ
Список литературы
Yin B., Maresca F., Curtin W.A. Vanadium is an optimal element for strengthening in both fcc and bcc high-entropy alloys // Acta Mater. 2020. V. 188. P. 486.
Rogachev S.O., Khatkevich V.M., Nikulin S.A., Ignateva M.V., Gromov A.A. High thermally stable multi-layer steel/vanadium alloy hybrid material obtained by high-pressure torsion // Mater. Lett. 2019. V. 255. Article 126527.
Solano-Alvarez W., Fernandez Gonzalez L., Bhades-hia H.K.D.H. The effect of vanadium alloying on the wear resistance of pearlitic rails // Wear. 2019. V. 436–437. Article 2030042.
Dadvar M.A., Fazael R. Application of sodium titanate nanotubes doped with vanadium (VNaTNT) as a heterogeneous catalyst for oxidation of sulfides at room temperature // Chin. J. Catal. 2016. V. 37. P. 494.
Shen M., Xu L., Wang J., Li C., Wang W., Zhai Y. Effect of synthesis methods on activity of V2O5/CeO2/WO3–TiO2 catalyst for selective catalytic reduction of NOx with NH3 // J. Rare Earths. 2016. V. 34. P. 259.
El-Metwaly N., Farghaly T.A., Althagafi I., Elghalban M.G. Synthesis for novel VO(II)-triazole complexes; spectral, analytical characterization and catalytic usage for biodiesel synthesis from waste oil // J. Mol. Struct. 2019. V. 1190. P. 86.
Mishanin I.I., Bogdan V.I. Advantages of ethane oxidative dehydrogenation on the MoVNbTeOx catalyst under elevated pressure // Mendeleev Commun. 2019. V. 29. P. 455.
Li J., Li J., Zhang Y., Li J., Yang Y., Zhao H., Zheng C., Li J., Huang J., Li F., Tang T., Yao J. All-optical switchable terahertz spin-photonic devices based on vanadium dioxide integrated metasurfaces // Opt. Commun. 2020. V. 460. Article 124986.
Chen X., Wang H., Yan B. Sulfuric acid leaching and recovery of vanadium from a spinel concentrate beneficiated from stone coal ore // Hydrometallurgy. 2020. V. 191. Article 105239.
Gilligan R., Nikoloski A.N. The extraction of vanadium from titanomagnetites and other sources // Miner. Eng. 2020. V. 146. Article 106106.
Zuliani J.E., Miyata T., Mizoguchi T., Feng J., Kirk D.W., Jia C.Q. Characterization of vanadium in oil sands fluid petroleum coke using electron microscopy // Fuel. 2016. V. 178. P. 124.
Cai Z., Feng Y., Li H., Zhou Y. Selective separation and extraction of vanadium(IV) and manganese(II) from co-leaching solution of roasted stone coal and pyrolusite via solvent extraction // Ind. Eng. Chem. Res. 2013. V. 52. P. 13768.
Li X., Wei C., Wu J., Li M., Deng Z., Li C., Xu H. Co-extraction and selective stripping of vanadium(IV) and molybdenum(VI) from sulphuric acid solution using 2-ethylhexyl phosphonic acid mono-2-ethylhexyl ester // Sep. Purif. Technol. 2012. V. 86. P. 64.
Li D., Chen D., Zhang G., Zhao H., Qi T., Wang W., Wang L., Liu Y. Preparation of highly pure vanadyl sulfate from sulfate solutions containing impurities of iron and aluminum by solvent extraction using EHEHPA // Metals. 2017. V. 7. P. 106.
Zhang Y., Zhang T.-A., Lv G., Zhang G., Liu Y., Zhang W. Synergistic extraction of vanadium(IV) in sulfuric acid media using a mixture of D2EHPA and EHEHPA // Hydrometallurgy. 2016. V. 166. P. 87.
Nishihama S., Hirai T., Komasawa I. Mechanism of photoreductive extraction of vanadium in a liquid-liquid extraction system using bis(2-ethylhexyl)phosphoric acid // Ind. Eng. Chem. Res. 2000. V. 39. P. 3018.
Курбатова Л.Д., Слепухин П.А., Курбатов Д.И., Заболоцкая Е.В. Cпектроскопическое изучение экстракции ванадия(IV) ди-2-этилгексилфосфорной кислотой // Журн. общ. хим. 2012. Т. 82. С. 1035.
Li X.-B., Wei C., Wu J., Li M.-T., Deng Z.-G., Xu H.-S. Thermodynamics and mechanism of vanadium(IV) extraction from sulphate medium with D2EHPA, EHEHPA and CYANEX 272 in kerosene // Trans. Nonferrous Met. Soc. China. 2012. V. 22. P. 461.
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid-liquid equilibrium of aqueous two-phase system composed of poly(ethyleneoxide) 1500 and sodium nitrate // J. Chem. Eng. Data. 2019. V. 64. № 3. P. 1250.
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid–liquid equilibrium in an extraction system based on polyvinylpyrrolidone-3500 and sodium nitrate // Theor. Found. Chem. Eng. 2019. V. 53. № 2. P. 159. [Заходяева Ю.А., Рудаков Д.Г., Соловьев В.О., Вошкин А.А., Тимошенко А.В. Равновесие жидкость–жидкость в экстракционной системе на основе поливинилпирролидона-3500 и нитрата натрия // Теор. осн. хим. технол. 2019. Т. 53. № 2. С. 131.]
Shkinev V.M., Zakhodyaeva Yu.A., Dzhenloda R.Kh., Mokhodoeva O.B., Voshkin A.A. Synthesis of magnetic iron oxide nanoparticles at the interface of the polyethylene glycol–ammonium sulfate–water extraction system // Mendeleev Commun. 2017. V. 27. № 5. P. 485.
Voshkin A.A., Shkinev V.M., Zakhodyaeva Y.A. A new extraction method for the preparation of zinc oxide nanoparticles in aqueous two-phase systems // Russ. J. Phys. Chem. 2017. V. 91. P. 226.
Федорова М.И., Заходяева Ю.А., Вошкин А.А. Межфазное распределение Fe(III) и Zn(II) в хлоридных системах с Aliquat 336 в полипропиленгликоле 425 // Теор. осн. хим. технол. 2020. Т. 54. № 3. С. 304.
Gradov O.M., Zakhodyaeva Yu.A., Zinov’eva I.V., Voshkin A.A. Some features of the ultrasonic liquid extraction of metal ions // Molecules. 2019. V. 24. P. 3549.
Zakhodyaeva Yu.A., Izyumova K.V., Solov’eva M.S., Voshkin A.A. Extraction separation of the components of leach liquors of batteries // Theor. Found. Chem. Eng. 2017. V. 51. № 5. P. 883.
Zakhodyaeva Yu.A., Zinov’eva I.V., Voshkin A.A. Extraction of iron(III) chloride complexes using the polypropylene glycol 425–NaCl–H2O system // Theor. Found. Chem. Eng. 2019. V. 53. № 5. P. 735. [Заходяева Ю. А., Зиновьева И. В., Вошкин А. А. Экстракция хлоридных комплексов железа (III) в системе полипропиленгликоль 425–NaCl–H2O // Теор. осн. хим. технол. 2019. Т. 53. № 5. С. 510.]
Fedorova M.I., Zinov’eva I.V., Zakhodyaeva Yu.A., Voshkin A.A. Extraction of Fe(III), Zn(II), and Mn(II) using a system with a green solvent for trioctylmethylammonium thiocyanate // Theor. Found. Chem. Eng. 2020. V. 54. № 2. P. 313. [Федорова М.И., Зиновьева И.В., Заходяева Ю.А., Вошкин А.А. Экстракция Fe(III), Zn(II) и Mn(II) в системе с новым “зеленым” растворителем для тиоцианата триоктилметиламмония // Теор. осн. хим. технол. 2020. Т. 54. № 2. С. 202.]
de Oliveira W.C.M., Rodrigues G.D., Mageste A.B., de Lemos L.R. Green selective recovery of lanthanum from Ni-MH battery leachate using aqueous two-phase systems // Chem. Eng. J. 2017. V. 322. P. 346.
da Silveira Leite D., Carvalho P.L.G, Almeida M.R., de Lemos L.R., Mageste A.B., Rodrigues G.D. Extraction of yttrium from fluorescent lamps employing multivariate optimization in aqueous two-phase systems // Sep. Purif. Technol. 2020. V. 242. Article 116791.
Valadares A., Valadares C.F., de Lemos L.R., Mageste A.B., Rodrigues G.D. Separation of cobalt and nickel in leach solutions of spent nickel-metal hydride batteries using aqueous two-phase systems (ATPS) // Hydrometallurgy. 2018. V. 181. P. 180.
Sun P., Huang K., Song W., Gao Z., Liu H. Separation of rare earths from the transition metals using a novel ionic liquid-based aqueous two phase system: Towards green and efficient recycling of rare earths from the NdFeB magnets // Ind. Eng. Chem. Res. 2018. V. 57. № 49. P. 16934.
Pan Y., Sun X., Zhang Y. Separation of vanadium and molybdenum from aqueous solution using PEG2000 + sodium sulfate + water aqueous two-phase system // SN Appl. Sci. 2019. V. 1. Article 1461.
Sun T., Pan Y., Sun X., Zhang Y. Recovery of vanadium using an aqueous two-phase system consisting of poly (ethylene glycol) 2000 and sodium sulfate // Hydrometallurgy. 2019. V. 189. Article 105135.
Симонова Т.Н., Дубровина В.А. Разделение ванадия(IV) и ванадия(V) в присутствии тиоцианат-ионов с применением двухфазных водных систем и его определение // Журн. анал. хим. 2014. Т. 69. № 9. С. 927.
Zakhodyaeva Yu.A., Zinov’eva I.V., Tokar E.S., Voshkin A.A. Complex extraction of metals in an aqueous two-phase system based on poly(ethylene oxide) 1500 and sodium nitrate // Molecules. 2019. V. 24. P. 4078.
Музгин В.Н., Хамзина Л.Б., Золотавин В.Л., Безруков И.Я. Аналитическая химия ванадия. М.: Наука, 1981.
Щеглова Н.В., Попова Т.В., Квятковская Ю.А., Бажина Е.С., Смотрина Т.В., Кузнецова О.Н. Комплексообразование оксованадия(IV) с малоновой кислотой в поликомпонентных водных растворах // Вестн. технол. унив. 2017. Т. 20. № 12. С. 16.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


