Теоретические основы химической технологии, 2020, T. 54, № 4, стр. 421-430
Фазовые равновесия и экстракционные свойства глубоких эвтектических растворителей в системах спирт–эфир
А. А. Самаров a, *, Л. М. Шишаева a, А. М. Тойкка a
a Санкт-Петербургский государственный университет, Институт химии
Санкт-Петербург, Россия
* E-mail: artemy.samarov@spbu.ru
Поступила в редакцию 20.12.2019
После доработки 31.01.2020
Принята к публикации 31.01.2020
Аннотация
В последнее время значительное внимание уделяется способности глубоких эвтектических растворителей (deep eutectic solvents, DES) заменять ионные жидкости в процессах экстракции. Цель настоящей работы – определение физико-химических параметров гетерогенных систем и фазового равновесия в промышленно значимых смесях, включающих DES. Изучены системы этанол–этилацетат–DES, н-пропанол–н-пропилацетат–DES и н-бутанол–н-бутилацетат–DES при температуре 293.15 К и атмосферном давлении. Исследовались DES на основе хлорида холина – смеси с глицерином и с мочевиной. На основе полученных данных о равновесных составах сосуществующих жидких фаз проведен анализ способности DES к разделению указанных смесей спиртов и эфиров. Для корреляции экспериментальных данных о равновесии жидкость–жидкость применялась модель локального состава NRTL.
ВВЕДЕНИЕ
Разделение азеотропных смесей или смесей близкокипящих компонентов является серьезной проблемой даже на сегодняшний день. Традиционная ректификация не позволяет в полной мере решить эту задачу. Оптимальным процессом с точки зрения энергоэффективности и технологической реализации в данном случае может выступать экстракция и экстрактивная ректификация [1–5]. Ключевым фактором в эффективности экстрактивной ректификации является правильный выбор экстрагента. Классические органические растворители, которые применяются в настоящее время, имеют ряд ограничений (высокая летучесть, токсичность, а также высокие энергетические затраты на регенерацию) [6]. Именно поэтому в последние годы все больше внимания уделяется вопросам зеленой химии. Одними из новых потенциально безопасных для окружающей среды растворителей являются глубокие эвтектические растворители (deep eutectic solvents, DES). Глубокий эвтектический растворитель представляет собой смесь, состоящую из донора водородной связи (HBD) и акцептора (HBA), при смешивании которых образуется жидкость с более низкой температурой плавления, чем у отдельных компонентов [7, 8]. Глубокие эвтектические растворители имеют несколько преимуществ по сравнению с традиционными ионными жидкостями: простота синтеза, а также доступность и относительно невысокая стоимость составляющих компонентов [7, 9, 10]. Глубокие эвтектические растворители на основе хлорида холина уже успешно используются при очистке биодизеля от глицерина и разделении других органических соединений [11–15].
Объектами исследования данной работы являются смеси спиртов и сложных эфиров. Они представляют собой типичный пример азеотропных смесей [16, 17] и, что гораздо важнее, являются составляющими многокомпонентных жидкофазных реакционных систем, интерес к изучению которых связан с их промышленной значимостью. Такими системами, например, являются смеси с химической реакцией этерификации–гидролиза [18–21]. Сложные эфиры используются в качестве растворителей и имеют широкую область применения в различных областях химической промышленности [22, 23].
Данная статья является продолжением серии работ, посвященных изучению фазового равновесия жидкость–жидкость и экстракционных свойств глубоких эвтектических растворителей на основе хлорида холина в азеотропных системах [24–28]. В настоящей работе рассматривается возможность использования DES на основе хлорида холина (смеси с глицерином и с мочевиной) для разделения смесей спиртов с эфирами уксусной кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Этиловый спирт осушали с помощью молекулярных сит с размером пор 3 Å в несколько стадий. Н-пропанол, н-бутанол, этилацетат, н-пропилацетат, н-бутилацетат, глицерин и мочевина были использованы без дополнительной очистки. Чистоту указанных выше реактивов оценивали методом газовой хроматографии (ГХ). Содержание влаги и чистоту хлорида холина определяли с использованием прибора синхронного термического анализа Netzsch STA 449 F1 Jupiter (Германия) с квадрупольным масс-спектрометром Netzsch QMS 403C Aëolos (Германия). Методы очистки и степень чистоты реактивов представлены в табл. 1.
Таблица 1.
Методы очистки и чистота используемых реактивов (ГХ – газовая хроматография, TГA – термогравиметрический анализ)
| Номер по CAS |
Вещество | Источник | Чистота, мас. д.а | Метод очистки | Метод анализа |
|---|---|---|---|---|---|
| 64-17-5 | Этанол | Вектон | 0.990 | Осушка | ГХ |
| 71-23-8 | Н-пропанол | Вектон | 0.990 | Нет | ГХ |
| 71-36-3 | Н-бутанол | Вектон | 0.990 | Нет | ГХ |
| 141-78-6 | Этилацетат | Вектон | 0.998 | Нет | ГХ |
| 109-60-4 | Н-пропилацетат | Вектон | 0.990 | Нет | ГХ |
| 123-86-4 | Н-бутилацетат | Вектон | 0.990 | Нет | ГХ |
| 56-81-5 | Глицерин | Вектон | 0.990 | Нет | ГХ |
| 57-13-61 | Мочевина | Вектон | 0.980 | Нет | TГA |
| 67-48-1 | Хлорид холина | AppliChem | 0.980 | Осушка | TГA |
Подготовка DES. Перед исследованием фазового равновесия хлорид холина проходил процедуру осушки для удаления воды. Сушку проводили в вакууме (10 Па) с нагревом до 70°С в течение 5 ч. Далее хлорид холина и глицерин/мочевину помещали в виалы объемом 10 мл в молярном соотношении 1:2 [29]. Компоненты взвешивали на аналитических весах Shinko VIBRA HT-120CE (Япония) с точностью до 0.001 г. Затем для ускорения образования DES виалы помещали в ультразвуковую ванну при температуре 40°С на 3 ч. В результате были получены бесцветные прозрачные жидкости DES (ChCl:Gl) и DES (ChCl:Ur). Содержание воды измеряли после приготовления DES методом титрования по Карлу Фишеру. Установлено, что все образцы DES содержат менее 0.1 мас. д. воды.
Исследование фазового равновесия. В виалы с подготовленными DES добавляли определенное количество спирта и соответствующего эфира гравиметрическим методом. Затем виалы помещали в жидкостный термостат при заданной температуре (погрешность ±0.05 К) и перемешивали магнитной мешалкой в течение 3 ч. По окончании перемешивания образцы выдерживались 12 ч для достижения полного распределения фаз. Каждую фазу отбирали отдельно и анализировали методом ГХ. Исследование фазового равновесия жидкость–жидкость было выполнено с использованием газового хроматографа “Хроматек Кристалл 5000.2" (Россия) с детектором по теплопроводности (ДТП) на насадочной колонке Porapak R (длина 1 м, внутренний диаметр 3 мм). В качестве газа-носителя использовали гелий со скоростью потока 40 мл/мин. Рабочие температуры колонки, испарителя и ДТП составляли 483, 503 и 513 К соответственно. Для расчета состава равновесных фаз использовали метод внешнего стандарта. Неопределенность анализа ГХ в среднем составляла ±0.005 мас. д.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментальные данные о фазовом равновесии жидкость–жидкость в системах этанол–этилацетат–DES, н-пропанол–н-пропилацетат–DES и н-бутанол–н-бутилацетат–DES при температуре 293.15 К и атмосферном давлении представлены в табл. 2 и 3.
Таблица 2.
Экспериментальные данные о фазовом равновесии жидкость–жидкость в системе спирт (1)–эфир (2)–DES (ChCl:Gl) (3) при 293.15 Ка и атмосферном давленииб (wi – массовые долив, βi – коэффициент распределения, S – селективность)
| Органическая фаза | DES-фаза | βспирт | βэфир | S | ||
|---|---|---|---|---|---|---|
| w1 | w2 | w1 | w2 | |||
| Этанол (1)–этилацетат (2)–DES (ChCl:Gl) (3) | ||||||
| 0.000 | 0.998 | 0.000 | 0.010 | 0.000 | 0.010 | – |
| 0.030 | 0.959 | 0.026 | 0.012 | 0.856 | 0.013 | 68.4 |
| 0.061 | 0.922 | 0.043 | 0.015 | 0.699 | 0.016 | 43.0 |
| 0.101 | 0.880 | 0.065 | 0.018 | 0.644 | 0.020 | 31.5 |
| 0.134 | 0.840 | 0.083 | 0.022 | 0.619 | 0.026 | 23.6 |
| 0.174 | 0.781 | 0.105 | 0.024 | 0.603 | 0.031 | 19.6 |
| 0.211 | 0.732 | 0.130 | 0.033 | 0.616 | 0.045 | 13.7 |
| 0.251 | 0.671 | 0.151 | 0.040 | 0.602 | 0.060 | 10.1 |
| 0.293 | 0.606 | 0.180 | 0.056 | 0.614 | 0.092 | 6.6 |
| 0.325 | 0.548 | 0.196 | 0.070 | 0.604 | 0.128 | 4.7 |
| 0.349 | 0.452 | 0.239 | 0.113 | 0.686 | 0.251 | 2.7 |
| Н-пропанол (1)–н-пропилацетат (2)–DES (ChCl:Gl) (3) | ||||||
| 0.000 | 0.997 | 0.000 | 0.009 | 0.000 | 0.009 | – |
| 0.040 | 0.955 | 0.015 | 0.008 | 0.375 | 0.008 | 44.8 |
| 0.100 | 0.893 | 0.028 | 0.010 | 0.280 | 0.011 | 25.0 |
| 0.170 | 0.821 | 0.048 | 0.012 | 0.282 | 0.015 | 19.3 |
| 0.252 | 0.729 | 0.065 | 0.014 | 0.258 | 0.019 | 13.4 |
| 0.327 | 0.643 | 0.078 | 0.017 | 0.239 | 0.026 | 9.0 |
| 0.377 | 0.583 | 0.085 | 0.014 | 0.212 | 0.030 | 5.6 |
| 0.419 | 0.529 | 0.094 | 0.016 | 0.225 | 0.022 | 7.1 |
| 0.492 | 0.421 | 0.123 | 0.019 | 0.250 | 0.045 | 5.2 |
| 0.511 | 0.383 | 0.148 | 0.023 | 0.290 | 0.065 | 4.4 |
| 0.536 | 0.331 | 0.151 | 0.025 | 0.282 | 0.069 | 4.1 |
| 0.550 | 0.286 | 0.168 | 0.027 | 0.305 | 0.091 | 3.4 |
| 0.557 | 0.253 | 0.192 | 0.032 | 0.345 | 0.126 | 2.7 |
| Н-бутанол (1)–н-бутилацетат (2)–DES (ChCl:Gl) (3) | ||||||
| 0.000 | 1.000 | 0.000 | 0.006 | 0.000 | 0.006 | – |
| 0.048 | 0.951 | 0.006 | 0.007 | 0.126 | 0.007 | 17.1 |
| 0.095 | 0.903 | 0.012 | 0.007 | 0.125 | 0.008 | 15.0 |
| 0.194 | 0.806 | 0.017 | 0.008 | 0.089 | 0.009 | 9.4 |
| 0.256 | 0.742 | 0.023 | 0.009 | 0.090 | 0.012 | 7.4 |
| 0.318 | 0.673 | 0.027 | 0.009 | 0.085 | 0.013 | 6.4 |
| 0.378 | 0.602 | 0.031 | 0.009 | 0.081 | 0.015 | 5.4 |
| 0.422 | 0.542 | 0.032 | 0.009 | 0.077 | 0.017 | 4.6 |
| 0.475 | 0.473 | 0.036 | 0.010 | 0.076 | 0.021 | 3.6 |
| 0.504 | 0.428 | 0.038 | 0.011 | 0.076 | 0.026 | 2.9 |
| 0.540 | 0.377 | 0.040 | 0.011 | 0.075 | 0.029 | 2.6 |
| 0.575 | 0.327 | 0.044 | 0.009 | 0.109 | 0.000 | 0.0 |
| 0.621 | 0.256 | 0.048 | 0.006 | 0.096 | 0.018 | 5.5 |
| 0.669 | 0.176 | 0.052 | 0.003 | 0.077 | 0.017 | 4.6 |
| 0.703 | 0.094 | 0.068 | 0.002 | 0.077 | 0.023 | 3.3 |
| 0.739 | 0.000 | 0.080 | 0.000 | 0.077 | 0.028 | 2.8 |
Таблица 3.
Экспериментальные данные о фазовом равновесии жидкость–жидкость в системе спирт (1)–эфир (2)–DES (ChCl:Ur) (3) при 293.15 Ка и атмосферном давленииб (wi – массовые долив, βi – коэффициент распре-деления, S – селективность)
| Органическая фаза | DES-фаза | βспирт | βэфир | S | ||
|---|---|---|---|---|---|---|
| w1 | w2 | w1 | w2 | |||
| Этанол (1)–этилацетат (2)–DES (ChCl:Ur) (3) | ||||||
| 0.000 | 0.998 | 0.000 | 0.016 | 0.000 | 0.016 | – |
| 0.033 | 0.964 | 0.022 | 0.018 | 0.663 | 0.018 | 36.0 |
| 0.090 | 0.898 | 0.048 | 0.017 | 0.533 | 0.019 | 28.6 |
| 0.156 | 0.824 | 0.072 | 0.020 | 0.459 | 0.024 | 18.8 |
| 0.230 | 0.732 | 0.095 | 0.023 | 0.410 | 0.031 | 13.2 |
| 0.301 | 0.651 | 0.113 | 0.025 | 0.375 | 0.039 | 9.6 |
| 0.362 | 0.575 | 0.125 | 0.025 | 0.346 | 0.044 | 7.9 |
| 0.408 | 0.499 | 0.139 | 0.026 | 0.342 | 0.052 | 6.6 |
| 0.437 | 0.420 | 0.153 | 0.031 | 0.350 | 0.074 | 4.8 |
| Н-пропанол (1)–н-пропилацетат (2)–DES (ChCl:Ur) (3) | ||||||
| 0.000 | 1.000 | 0.000 | 0.007 | 0.000 | 0.007 | – |
| 0.051 | 0.948 | 0.012 | 0.010 | 0.239 | 0.011 | 21.6 |
| 0.106 | 0.891 | 0.022 | 0.011 | 0.212 | 0.013 | 16.6 |
| 0.171 | 0.823 | 0.029 | 0.011 | 0.172 | 0.013 | 12.9 |
| 0.238 | 0.757 | 0.039 | 0.011 | 0.162 | 0.015 | 11.1 |
| 0.298 | 0.694 | 0.044 | 0.010 | 0.148 | 0.014 | 10.3 |
| 0.361 | 0.627 | 0.047 | 0.010 | 0.130 | 0.016 | 8.3 |
| 0.410 | 0.569 | 0.055 | 0.011 | 0.133 | 0.019 | 6.9 |
| 0.463 | 0.506 | 0.056 | 0.010 | 0.121 | 0.020 | 6.1 |
| 0.527 | 0.433 | 0.064 | 0.010 | 0.122 | 0.023 | 5.3 |
| 0.559 | 0.393 | 0.067 | 0.012 | 0.120 | 0.031 | 3.9 |
| 0.595 | 0.346 | 0.070 | 0.012 | 0.118 | 0.035 | 3.4 |
| 0.623 | 0.307 | 0.080 | 0.013 | 0.129 | 0.042 | 3.0 |
| 0.644 | 0.276 | 0.073 | 0.013 | 0.114 | 0.047 | 2.4 |
| 0.666 | 0.249 | 0.104 | 0.016 | 0.156 | 0.064 | 2.4 |
| 0.681 | 0.222 | 0.084 | 0.017 | 0.123 | 0.077 | 1.6 |
| 0.699 | 0.182 | 0.084 | 0.016 | 0.1195 | 0.088 | 1.4 |
| Н-бутанол (1)–н-бутилацетат (2)–DES (ChCl:Ur) (3) | ||||||
| 0.000 | 1.000 | 0.000 | 0.005 | 0.000 | 0.005 | – |
| 0.042 | 0.957 | 0.004 | 0.007 | 0.089 | 0.007 | 12.2 |
| 0.111 | 0.884 | 0.007 | 0.008 | 0.064 | 0.009 | 7.1 |
| 0.180 | 0.814 | 0.010 | 0.009 | 0.057 | 0.011 | 5.1 |
| 0.264 | 0.731 | 0.016 | 0.013 | 0.059 | 0.018 | 3.3 |
| 0.335 | 0.660 | 0.017 | 0.014 | 0.052 | 0.021 | 2.4 |
| 0.404 | 0.591 | 0.019 | 0.013 | 0.046 | 0.022 | 2.1 |
| 0.461 | 0.529 | 0.022 | 0.015 | 0.049 | 0.028 | 1.7 |
| 0.511 | 0.472 | 0.027 | 0.015 | 0.052 | 0.032 | 1.6 |
| 0.559 | 0.413 | 0.028 | 0.014 | 0.051 | 0.034 | 1.5 |
| 0.598 | 0.363 | 0.029 | 0.012 | 0.049 | 0.033 | 1.5 |
| 0.628 | 0.327 | 0.027 | 0.009 | 0.043 | 0.023 | 1.6 |
| 0.660 | 0.285 | 0.033 | 0.007 | 0.050 | 0.025 | 2.0 |
| 0.689 | 0.245 | 0.024 | 0.003 | 0.034 | 0.013 | 2.7 |
| 0.723 | 0.203 | 0.033 | 0.003 | 0.045 | 0.012 | 3.7 |
| 0.761 | 0.152 | 0.025 | 0.001 | 0.033 | 0.007 | 4.9 |
| 0.817 | 0.076 | 0.033 | 0.001 | 0.041 | 0.007 | 6.1 |
| 0.866 | 0.000 | 0.042 | 0.000 | 0.048 | 0.000 | 0.0 |
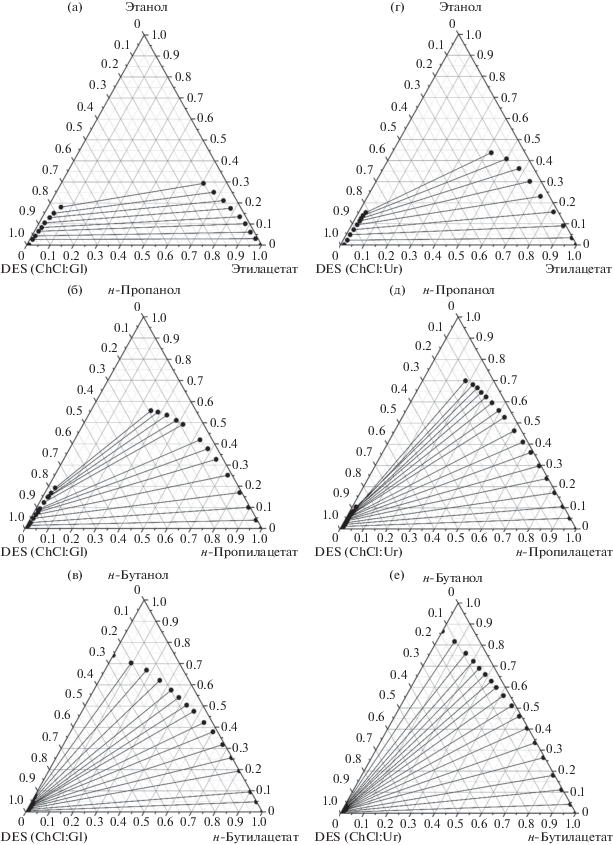
В настоящей работе DES рассматривается как псевдокомпонент, поэтому экспериментальные данные равновесных составов представлены в концентрационных треугольниках. В этом случае одна из вершин треугольника отвечает смеси двух компонентов, образующих DES. На основании экспериментальных данных, приведенных в табл. 2 и 3, были построены фазовые диаграммы для исследуемых систем (рис. 1).
Рис. 1.
Фазовые диаграммы систем спирт–эфир уксусной кислоты–DES на основе хлорида холина при температуре 293.15 К и атмосферном давлении: (а) – этанол–этилацетат–DES (ChCl:Gl), (б) – н-пропанол–пропилацетат–DES (ChCl:Gl), (в) – н-бутанол–бутилацетат–DES (ChCl:Gl), (г) – этанол–этилацетат–DES (ChCl:Ur), (д) – н-пропанол–н-пропилацетат–DES (ChCl:Gl), (е) – н-бутанол–н-бутилацетат–DES (ChCl:Ur).
Для характеристики эффективности экстракции используют два важных параметра, это коэффициент распределения компонента βi и селективность S, которые определяются следующим образом:
(2)
$S = \left( {\frac{{w_{i}^{{\text{I}}}}}{{w_{i}^{{{\text{II}}}}}}} \right)\left( {\frac{{w_{j}^{{{\text{II}}}}}}{{w_{j}^{{\text{I}}}}}} \right),$Эти параметры представлены в табл. 2 и 3 и на рис. 2.
Рис. 2.
Зависимость селективности S от концентрации спирта в органической фазе w: (a) – 1 – этанол–этилацетат–DES (ChCl:Gl); 2 – этанол–этилацетат–DES (ChCl:Ur); (б) – 1 – н-пропанол–н-пропилацетат–DES (ChCl:Gl), 2 – н-пропанол–н-пропилацетат–DES (ChCl:Ur); (в) – 1 – н-бутанол–н-бутилацетат–DES (ChCl:Gl), 2 – н-бутанол–н-бутилацетат–DES (ChCl:Ur).
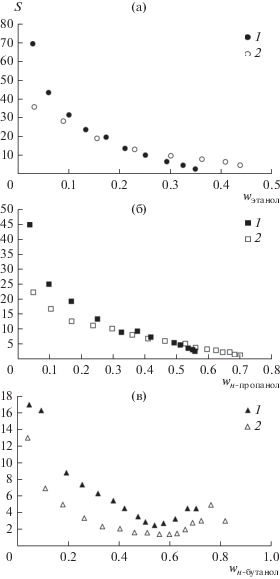
Значение селективности увеличивается с уменьшением концентрации спирта в органической фазе. В случае систем н-бутанол–н-бутилацетат–DES зависимость селективности проходит через минимум, данный факт связан с наличием двух областей ограниченной растворимости (н-бутанол–DES и н-бутилацетат–DES). Наибольшее значение селективности в случае обоих DES достигается в системе этанол–этилацетат–DES. Полученные данные показывают, что при увеличении числа атомов углерода в цепи спирта и эфира коэффициент распределения эфира остается практически неизменным во всех системах, а коэффициент распределения спирта значительно меняется. Поэтому падение величины селективности (как отношения коэффициентов распределения) при увеличении числа атомов углерода в молекулах спирта и эфира связано с указанным изменением коэффициента распределения спирта. Следует отметить, что наиболее эффективным экстрагентом выступает DES, образованный хлоридом холина и глицерином, значения селективности в данном случае оказываются выше во всех изученных системах.
Экспериментальные данные о фазовом равновесии проходили проверку на внутреннюю согласованность с помощью уравнения Ханда [30]:
(3)
$w_{1}^{{\text{I}}} = a + b\left( {\frac{{w_{1}^{{\text{I}}}}}{{w_{3}^{{{\text{II}}}}}}} \right),$Таблица 4.
Параметры уравнения Ханда и коэффициент корреляции R2
| Система | Параметры | R2 | |
|---|---|---|---|
| a | b | ||
| Этанол– этилацетат–DES (ChCl:Gl) | 0.6749 | 0.023 | 0.9771 |
| Н-пропанол–н-пропилацетат–DES (ChCl:Gl) | 0.7797 | 0.0301 | 0.9911 |
| Н-бутанол–н-бутилацетат–DES (ChCl:Gl) | 0.9331 | 0.0078 | 0.9997 |
| Этанол–этилацетат–DES (ChCl:Ur) | 0.8094 | 0.0131 | 0.9984 |
| Н-пропанол–н-пропилацетат–DES (ChCl:Ur) | 0.8870 | 0.0148 | 0.9987 |
| Н-бутанол–н-бутилацетат–DES (ChCl:Ur) | 0.9635 | 0.0011 | 0.9998 |
Коэффициент корреляции R2 > 0.97 и линейная зависимость указывают на высокую внутреннюю согласованность полученных экспериментальных данных.
МОДЕЛИРОВАНИЕ ФАЗОВОГО РАВНОВЕСИЯ
Экспериментальные результаты были обработаны моделью локальных составов NRTL [31]. Уравнение NRTL для коэффициентов активности компонентов системы имеет следующий вид:
(4)
$\begin{gathered} {\text{ln}}\left( {{{\gamma }_{i}}} \right) = \frac{{\sum\limits_{j = 1}^m {{{x}_{j}}{{\tau }_{{ji}}}{{G}_{{ji}}}} }}{{\sum\limits_{l = 1}^m {{{x}_{l}}{{G}_{{li}}}} }} + \\ + \,\,\sum\limits_{j = 1}^m {\frac{{{{x}_{j}}{{G}_{{ij}}}}}{{\sum\limits_{l = 1}^m {{{x}_{l}}{{G}_{{lj}}}} }}} \left( {{{\tau }_{{ij}}} - \frac{{\sum\limits_{r = 1}^m {{{x}_{r}}{{\tau }_{{rj}}}{{G}_{{rj}}}} }}{{\sum\limits_{l = 1}^m {{{x}_{l}}{{G}_{{lj}}}} }}} \right), \\ \end{gathered} $(5)
${{\tau }_{{ji}}} = \frac{{{{g}_{{ji}}} - {{g}_{{ii}}}}}{{RT}} = \frac{{\Delta {{g}_{{ji}}}}}{{RT}},$(8)
$OF = \sum\limits_{k = 1}^n {\sum\limits_{i = 1}^n {\left[ {\mathop {\left( {x_{{ik}}^{{\exp }} - x_{{ik}}^{{cal}}} \right)}\nolimits_{\text{I}}^2 + \mathop {\left( {x_{{ik}}^{{\exp }} - x_{{ik}}^{{cal}}} \right)}\nolimits_{{\text{II}}}^2 } \right]} } .$Параметры, полученные в ходе оптимизации, представлены в табл. 5.
Таблица 5.
Энергетические параметры gji, полученные корреляцией экспериментальных данных о фазовом равновесии жидкость–жидкость на основе модели NRTL, и величины средних стандартных отклонений
| ij | ∆gji, Дж моль–1 | ∆gij, Дж моль–1 | αji |
|---|---|---|---|
| Этанол (1)–этилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –25777.6 | –15554.9 | 0.3 |
| 1–3 | 1781.5 | –9033.6 | 0.3 |
| 2–3 | 9019.0 | 10687.4 | 0.3 |
| σ = 0.45 | |||
| Н-пропанол (1)–н-пропилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –23036.1 | –9665.6 | 0.3 |
| 1–3 | 4762.7 | –5410.8 | 0.3 |
| 2–3 | 10702.9 | 9475.1 | 0.3 |
| σ = 0.40 | |||
| Н-бутанол (1)–н-бутилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –2715.2 | 1347.2 | 0.3 |
| 1–3 | 3729.6 | 4480.5 | 0.3 |
| 2–3 | 16898.1 | 10495.5 | 0.3 |
| σ = 1.09 | |||
| Этанол (1)–этилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –42231.7 | –44944.4 | 0.3 |
| 1–3 | 5715.6 | 14962.3 | 0.3 |
| 2–3 | 12191.5 | 7884.0 | 0.3 |
| σ = 0.14 | |||
| Н-пропанол (1)–н-пропилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –23133.6 | –14551.1 | 0.3 |
| 1–3 | 5194.6 | –8565.0 | 0.3 |
| 2–3 | 14741.1 | 9808.9 | 0.3 |
| σ = 0.50 | |||
| Н-бутанол (1)–н-бутилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –12923.5 | –4212.8 | 0.3 |
| 1–3 | 4508.2 | 5808.4 | 0.3 |
| 2–3 | 13959.1 | 10614.3 | 0.3 |
| σ = 1.21 | |||
Стандартное отклонение σ определялось следующим выражением:
(9)
$\begin{gathered} \sigma {\text{(\% )}} = \\ = 100 \times \sqrt {\frac{{\sum\limits_{i = 1}^n {\sum\limits_{i = 1}^4 {\mathop {\left( {x_{{ik}}^{{\exp }} - x_{{ik}}^{{cal}}} \right)}\nolimits_{\text{I}}^2 + \mathop {\left( {x_{{ik}}^{{\exp }} - x_{{ik}}^{{cal}}} \right)}\nolimits_{{\text{II}}}^2 } } }}{{2mn}}} , \\ \end{gathered} $Результаты моделирования с использованием уравнения NRTL хорошо согласуются с экспериментальными данными. Величины σ также представлены в табл. 5. Относительно большое значение величины стандартного отклонения наблюдается лишь для системы н-бутанол–н-бутилацетат–DES (1.21%).
ЗАКЛЮЧЕНИЕ
Получены данные о фазовом равновесии жидкость–жидкость в системах спирт–эфир–DES, необходимые для оценки экстракционных свойств DES. Изучены DES на основе хлорида холина – смеси с глицерином и с мочевиной с мольным соотношением 1 : 2. Рассчитаны коэффициенты распределения компонентов и значения селективности, проведен анализ эффективности экстракции спиртов из смеси с эфирами. Установлено, что наибольшие значения селективность принимает для систем, содержащих DES на основе смеси хлорида холина и глицерина. Отмечено, что с увеличением длины алкильной цепи в гомологическом ряду значения селективности существенно снижаются. Коэффициент распределения также зависит от длины алкильной цепи, причем в случае спирта это изменение выражено наиболее сильно в сравнении с эфиром. Расчеты по модели NRTL подтверждают хорошую согласованность полученных экспериментальных данных: стандартное отклонение для исследованных систем не превысило 1.21%.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-73-00092).
ОБОЗНАЧЕНИЯ
| a, b | настраиваемые параметры |
| gji | энергетический параметр, Дж моль–1 |
| m | количество компонентов |
| n | количество нод |
| R2 | коэффициент корреляции |
| S | селективность |
| T | температура, К |
| w | массовая доля |
| x | мольная доля |
| α | коэффициент в распределении больцмановского типа |
| β | коэффициент распределения |
| σ | стандартное отклонение, % |
ИНДЕКСЫ
Список литературы
Luyben W.L., Chien I.-L. Design and Control of Distillation Systems for Separating Azeotropes. Hoboken: Wiley, 2010.
Rodríguez N.R., González A.S.B., Tijssen P.M.A., Kroon M.C. Low transition temperature mixtures (LTTMs) as novel entrainers in extractive distillation // Fluid Phase Equilib. 2015. V. 385. P. 72.
Serafimov L.A., Bushina D.I., Chelyuskina T.V. Heterogeneous systems of extractive rectification with one high-boiling component // Theor. Found. Chem. Eng. 2007. V. 41. № 6. P. 839. [Серафимов Л.А., Бушина Д.И., Челюскина Т.В. Гетерогенные системы экстрактивной ректификации с одним тяжелокипящим агентом // Теор. осн. хим. технол. 2007. Т. 41. № 6. С. 643.]
Serafimov L.A., Frolkova A.K., Bushina D.I. Extractive distillation of binary azeotropic mixtures // Theor. Found. Chem. Eng. 2008. V. 42. № 5. P. 507. [Серафимов Л.А., Фролкова А.К., Бушина Д.И. Ректификация азеотропных бинарных смесей с экстрактивным агентом // Теор. осн. хим. технол. 2008. Т. 42. № 5. С. 521.]
Sazonova A.Y., Raeva V.M., Frolkova, A.K. Design of extractive distillation process with mixed entrainer // Chem. Pap. 2016. V. 70. № 5. P. 594.
Li Q., Zhang J., Lei Z., Zhu J., Zhu J., Huang X. Selection of ionic liquids as entrainers for the separation of ethyl acetate and ethanol // Ind. Eng. Chem. Res. 2009. V. 48. P. 9006.
Paiva A., Craveiro R., Aroso I., Martins M., Reis R.L., Duarte A.R.C. Natural deep eutectic solvents – Solvents for the 21st century // ACS Sustainable Chem. Eng. 2014. V. 2. P. 1063.
Smith E.L., Abbott A.P., Ryder K.S. Deep Eutectic Solvents (DESs) and Their Applications // Chem. Rev. 2014. V. 114. P. 11060.
Zhang Q., De Oliveira Vigier K., Royer S., Jérôme F. Deep eutectic solvents: syntheses, properties and applications // Chem. Soc. Rev. 2012. V. 41. P. 7108.
Ruß C., König B. Low melting mixtures in organic synthesis – an alternative to ionic liquids? // Green Chem. 2012. V. 14. P. 2969.
Bewley B.R., Berkaliev A., Henriksen H., Ball D.B., Ott L.S. Waste glycerol from biodiesel synthesis as a component in deep eutectic solvents // Fuel Process. Technol. 2015. V. 138. P. 419.
Shahbaz K., Mjalli F.S., Hashim M.A., Al Nashef I.M. Using Deep Eutectic Solvents Based on Methyl Triphenyl Phosphunium Bromide for the Removal of Glycerol from Palm-Oil-Based Biodiesel // Energy Fuels. 2011. V. 25. P. 2671.
Maugeri Z., Leitner W., Domínguez De María P. Practical separation of alcohol-ester mixtures using Deep-Eutectic-Solvents // Tetrahedron Lett. 2012. V. 53. P. 6968.
Liu X., Xu D., Diao B., Gao J., Zhang L., Ma Y., Wang Y. Separation of Dimethyl Carbonate and Methanol by Deep Eutectic Solvents: Liquid-Liquid Equilibrium Measurements and Thermodynamic Modeling // J. Chem. Eng. Data. 2018. V. 63. P. 1234.
Liu X., Xu D., Diao B., Zhang L., Gao J., Liu D., Wang Y. Choline chloride based deep eutectic solvents selection and liquid-liquid equilibrium for separation of dimethyl carbonate and ethanol // J. Mol. Liq. 2019. V. 275. P. 347.
Handbook of Chemistry and Physics / Ed. Lide D.R. Boca Raton, Fla.: CRC, 2004.
Matsuda H., Takahara H., Fujino S., Constantinescu D., Kurihara K., Tochigi K., Ochi K., Gmehling J. Selection of entrainers for the separation of the binary azeotropic system methanol+dimethyl carbonate by extractive distillation // Fluid Phase Equilib. 2010. V. 310. P. 166.
Toikka A.M., Toikka M.A., Pisarenko Y.A., Serafimov L.A. Vapor–liquid equilibria in systems with esterification reaction // Theor. Found. Chem. Eng. 2009. V. 43. № 2. P. 129. [Тойкка А.М., Тойкка М.А., Писаренко Ю.А., Серафимов Л.А. Фазовые равновесия жидкость–пар в системах с реакцией этерификации // Теор. осн. хим. технол. 2009. Т. 43. № 2. С. 141.]
Toikka A.M., Samarov A.A., Toikka M.A. Phase and chemical equilibria in multicomponent fluid systems with a chemical reaction // Russ. Chem. Rev. 2015. V. 84. P. 378.
Toikka M.A., Tsvetov N.S., Toikka A.M. Experimental study of chemical equilibrium and vapor-liquid equilibrium calculation for chemical-equilibrium states of the n-propanol-acetic acid-n-propyl acetate-water system // Theor. Found. Chem. Eng. 2013. V. 47. P. 554.
Samarov A.A., Toikka M.A., Naumkin P.V., Toikka A.M. Chemical equilibrium and liquid-phase splitting in acetic acid + n-propanol + n-propyl acetate + water system at 293.15 and 353.15 K // Theor. Found. Chem. Eng. 2016. V. 50. № 5. P. 739. [Самаров А.А., Тойкка М.А., Наумкин П.В., Тойкка А.М. Химическое равновесие и расслаивание жидких фаз в системе уксусная кислота + н-пропанол + н-пропилацетат + вода при 293.15 и 353.15 K // Теор. осн. хим. технол. 2016. Т. 50. № 5. С. 561.]
Altuntepe E., Greinert T., Hartmann F., Reinhardt A., Sadowski G., Held C. Thermodynamics of enzyme-catalyzed esterifications: I. Succinic acid esterification with ethanol // Appl. Microbiol. Biotechnol. 2017. V. 101. P. 5973.
Altuntepe E., Emel’yanenko V.N., Forster-Rotgers M., Sadowski G., Verevkin S.P., Held C. Thermodynamics of enzyme-catalyzed esterifications: II. Levulinic acid esterification with short-chain alcohols // Appl. Microbiol. Biotechnol. 2017. V. 101. P. 7509.
Samarov A.A., Smirnov M.A., Toikka A.M., Prikhodko I.V. Study of Deep Eutectic Solvent on the Base Choline Chloride as Entrainer for the Separation Alcohol-Ester Systems // J. Chem. Eng. Data. 2018. V. 63. P. 1877.
Samarov A.A., Smirnov M.A., Sokolova M.P., Toikka A.M. Liquid-Liquid Equilibrium Data for the System N-Octane + Toluene + DES at 293.15 and 313.15 K and Atmospheric Pressure // Theor. Found. Chem. Eng. 2018. V. 52. P. 258.
Samarov A.A., Smirnov M.A., Sokolova M.P., Popova E.N., Toikka A.M. Choline chloride based deep eutectic solvents as extraction media for separation of n-hexane-ethanol mixture // Fluid Phase Equilib. 2017. V. 448. P. 123.
Samarov A., Shner N., Mozheeva E., Toikka A. Liquid-liquid equilibrium of alcohol–ester systems with deep eutectic solvent on the base of choline chloride // J. Chem. Thermodyn. 2019. V. 131. P. 369.
Тойкка М.А., Самаров А.А., Садаева А.А., Сенина А.А., Лобачева О.Л. Химическое равновесие в системе пропионовая кислота–этиловый спирт–этилпропионат–вода и экстракционные процессы с участием глубоких эвтектических растворителей // Тонкие хим. технол. 2019. Т. 14. № 1. С. 47.
Abbott A.P., Harris R.C., Ryder K.S., D’Agostino C., Gladden L.F., Mantle M.D. Glycerol eutectics as sustainable solvent systems // Green Chem. 2011. V. 13. P. 82.
Hand D.B. Dineric distribution // J. Phys. Chem. 1930. V. 34. № 9. P. 1961.
Renon H., Prausnitz J.M. Local compositions in thermodynamic excess functions for liquid mixtures // AIChE J. 1968. V. 14. P. 135.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


