Теоретические основы химической технологии, 2021, T. 55, № 2, стр. 224-234
Фазовые равновесия в системах спирт–эфир с глубокими эвтектическими растворителями на основе хлорида холина при 293.15 и 313.15 K
А. А. Самаров a, *, М. А. Тойкка a, А. М. Тойкка a
a Санкт-Петербургский государственный университет, Институт химии
Санкт-Петербург, Россия
* E-mail: artemy.samarov@spbu.ru
Поступила в редакцию 16.11.2020
После доработки 07.12.2020
Принята к публикации 07.12.2020
Аннотация
Проведено исследование фазового равновесия жидкость–жидкость в системах этанол–н-пропилацетат и н-пропанол–этилацетат с глубокими эвтектическими растворителями (DES) при температурах 293.15 и 313.15 К и атмосферном давлении. Были изучены DES хлорид холина–глицерин и хлорид холина–мочевина в мольном соотношении 1 : 2. Проведена проверка экспериментальных данных на внутреннюю согласованность с помощью уравнения Отмера–Тобиаса. На основании полученных данных были рассчитаны коэффициенты распределения и значения селективности. Установлено влияние спирта и эфира на положение области фазового равновесия. Для корреляции экспериментальных данных о равновесия жидкость–жидкость была применена модель локального состава NRTL.
ВВЕДЕНИЕ
Защита окружающей среды от промышленных загрязнений является актуальной проблемой для многих отраслей промышленности. Поэтому в настоящее время внимание ученых направлено на разработку и модификацию экологически чистых соединений, способных растворять многие вещества, в том числе, отходы промышленных предприятий [1, 2]. Несмотря на то, что вода является одним из самых безопасных “зеленых” растворителей, она не подходит для экстракции различных устойчивых соединений. Именно глубокие эвтектические растворители (DES) привлекли внимание исследователей, так как они являются экологически безопасной альтернативной традиционным летучим органическим растворителям [3]. Традиционно DES представляют собой смесь, находящуюся в жидком состоянии при комнатной температуре и состоящей из донора и акцептора водородной связи [4]. Большинство DES являются биоразлагаемыми, биосовместимыми и нетоксичными [5, 6]. Они обладают низким давлением пара, в широком температурном диапазоне сохраняют жидкое состояние, а также имеют низкую воспламеняемость и высокую сольватационную способность [7, 8]. По своим физическим свойствам DES схожи с ионными жидкостями, но их стоимость гораздо ниже и их проще синтезировать [5, 9, 10].
Сегодня DES находят самое разнообразное применение в различных областях промышленности. DES могут быть подходящими растворителями для разнообразных биокаталитических реакций [11]. В работе [12] приводится краткий обзор использования DES в различных химических процессах. Они выступают в качестве пластификаторов полимерных мембран [13–15]. Но основной областью исследований по-прежнему остаются экстракция и фазовое равновесие [16, 17].
Сложные эфиры являются важными продуктами и промежуточными соединениями в современной химической промышленности. Их обычно получают путем реакции этерификации, которая ограничена условиями термодинамического равновесия, в результате получается смесь исходных реагентов и продуктов, включающих сложный эфир. Ректификационный метод не позволяет эффективно разделить эти смеси, так как в большинстве из них присутствует азеотроп, поэтому необходимы специальные способы (экстрактивная ректификация, экстракция) выделения целевых продуктов. Это в свою очередь невозможно без полной термодинамической картины поведения фазового равновесия. В одной из недавних работ проведен обзор и анализ закономерностей формирования структур фазовых диаграмм со сложным физико-химическим поведением [18].
Настоящая работа является продолжением серии исследований, посвященных изучению фазового равновесия жидкость–жидкость и экстракционных свойств глубоких эвтектических растворителей на основе хлорида холина [19–23] в системах спирт–сложный эфир. Целью данной работы является анализ фазовых диаграмм и оценка влияния спирта и эфира на область нерастворимости, а также определение эффективности экстракции спиртов изучаемыми DES.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Н-пропанол, этилацетат, пропилацетат, глицерин и мочевина (Вектон, Россия) использовались без дополнительной очистки. Этиловый спирт (0.96 мас. д., Вектон, Россия) осушали с помощью молекулярных сит. Была использована дважды дистиллированная вода. Чистота указанных выше реактивов оценена методом газовой хроматографии (ГХ). Хлорид холина (>0.98 мас. д., AppliChem, Германия) осушали под вакуумом, оценка чистоты проводилась с использованием прибора синхронного термического анализа Netzsch STA 449 F1 Jupiter (Германия) с квадрупольным масс-спектрометром Netzsch QMS 403C Aëolos (Германия). Методы очистки и степень чистоты реактивов представлены в табл. 1.
Таблица 1.
Чистота реактивов
| CAS номер | Вещество | Чистота, мас. д.a | Метод очистки | Метод анализа |
|---|---|---|---|---|
| 64-17-5 | Этанол | 0.990 | Осушка | ГХб |
| 71-23-8 | Пропанол-1 | 0.990 | Нет | ГХб |
| 141-78-6 | Этилацетат | 0.980 | Нет | ГХб |
| 109-60-4 | Пропилацетат | 0.980 | Нет | ГХб |
| 56-81-5 | Глицерин | 0.990 | Нет | ГХб |
| 57-13-6 | Мочевина | 0.980 | Нет | ГХб |
| 67-48-1 | Хлорид холина | 0.980 | Осушка | TГAв |
Подготовка DES. Хлорид холина подвергался сушке в вакууме (1 Па) при нагревании до 363.15 К в течение 5 ч. Затем хлорид холина и глицерин/мочевину помещали в виалы объемом 10 мл в молярном соотношении 1 : 2 [10]. Исходные составы были приготовлены гравиметрическим методом с помощью аналитических весов Shinko VIBRA HT-120CE (с точностью до 0.001 г, Япония). Далее виалы помещали в ультразвуковую ванну при температуре 313.15 К на 3 ч. В результате были получены бесцветные прозрачные жидкости DES (ChCl:Gl) и DES (ChCl:Ur). Содержание воды после приготовления DES измеряли титриметрическим методом по Карлу Фишеру. Было установлено, что все образцы DES содержат менее 0.1 мас. д. воды.
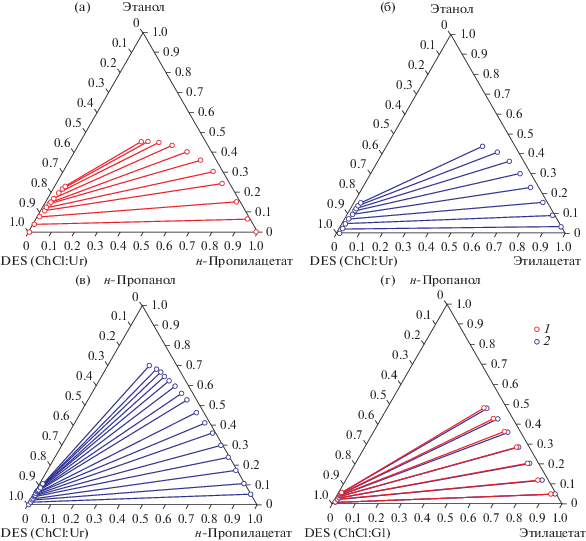
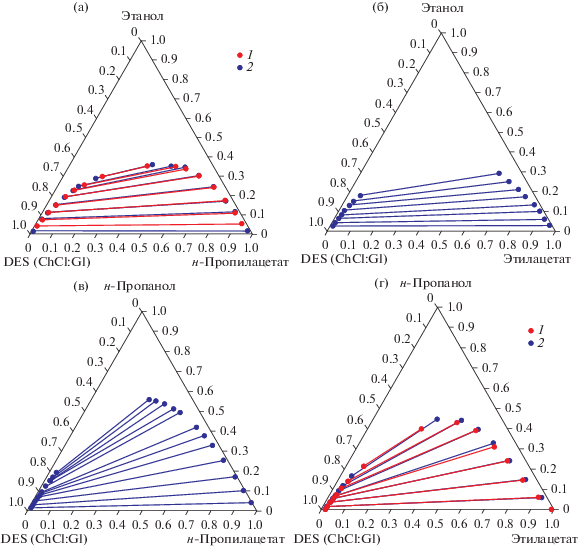
Рис. 1.
Ноды равновесия жидкость–жидкость в псевдотройных системах с участием DES (ChCl:Gl): (а) – этанол–н-пропилацетат–DES (1 – 293.15 K, 2 – 313.15 K), (б) – этанол–этилацетат–DES (293.15 K) [16], (в) – н-пропанол–н-пропилацетат–DES (293.15 K) [16], (г) – н-пропанол–этилацетат–DES (1 – 293.15, 2 – 313.15 K).
Исследование фазового равновесия. В виалы с подготовленными DES помещали определенное количество спирта и эфира. Смеси термостатировали в жидкостном термостате (LOIP LT-117 с точностью 0.1 К, Россия) при заданной температуре и перемешивали с помощью магнитной мешалки в течение 3–4 ч. Затем эти смеси выдерживали в течение 12 ч, чтобы обеспечить полное разделение фаз. После установления фазового равновесия образцы каждой из фаз отбирали отдельно и анализировали методом ГХ. Использовали газовый хроматограф “Кристалл 5000.2” (Россия) с детектором по теплопроводности (ДТП) и насадочной колонкой Porapak R (диаметр 3 мм, длина 1 м). В качестве газа-носителя использовали гелий марки “А” со скоростью 30 мл/мин. Рабочая температура колонки, испарителя и ДТП составила 483.15, 503.15 и 513.15 К соответственно. Количественный анализ проводили с использованием метода внутреннего стандарта. Стандартная неопределенность хроматографического анализа составила 0.005 мас. д. Анализ каждой из фаз проводили не менее 4 раз.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее нами было установлено, что DES, образованные хлоридом холина и глицерином/мочевиной, сохраняют начальное соотношение исходных компонентов во всей области составов в обогащенной DES фазе [24]. Поэтому в данной работе DES рассматривается как псевдокомпонент, и для удобства равновесные составы смесей представлены в концентрационных равносторонних треугольниках. В этом случае две из вершин треугольника отвечают чистым спирту и эфиру, а одна из вершин – смеси двух компонентов, образующих DES. Экспериментальные данные о фазовом равновесии жидкость–жидкость в системе этанол–н-пропилацетат–DES при температурах 293.15 и 313.15 К представлены в табл. 2 и на рис. 2. Экспериментальные данные о фазовом равновесии жидкость–жидкость в системе н-пропанол–этилацетат–DES при температурах 293.15 и 313.15 К приведены в табл. 3 и на рис. 3.
Таблица 2.
Экспериментальные данные о фазовом равновесии жидкость–жидкость в системе этанол (1)–н-пропилацетат (2)–DES (3) при 293.15 и 313 Ка и атмосферном давленииб (wi – массовые долив)
| Органическая фаза | Фаза DES | β1 | β2 | S | ||
|---|---|---|---|---|---|---|
| w1 | w2 | w1 | w2 | |||
| DES (ChCl:Gl), 293.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.006 | 1.391 | 0.008 | |
| 0.019 | 0.967 | 0.016 | 0.009 | 0.847 | 0.010 | 86.3 |
| 0.120 | 0.870 | 0.079 | 0.016 | 0.657 | 0.019 | 35.5 |
| 0.173 | 0.791 | 0.112 | 0.024 | 0.646 | 0.031 | 21.0 |
| 0.246 | 0.700 | 0.151 | 0.041 | 0.615 | 0.058 | 10.5 |
| 0.306 | 0.606 | 0.192 | 0.058 | 0.627 | 0.096 | 6.5 |
| 0.347 | 0.523 | 0.226 | 0.080 | 0.652 | 0.154 | 4.2 |
| 0.354 | 0.458 | 0.249 | 0.095 | 0.704 | 0.208 | 3.4 |
| 0.360 | 0.371 | 0.289 | 0.153 | 0.802 | 0.412 | 1.9 |
| DES (ChCl:Gl), 313.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.007 | |||
| 0.06 | 0.92 | 0.04 | 0.01 | 0.764 | 0.014 | 53.7 |
| 0.111 | 0.867 | 0.076 | 0.019 | 0.684 | 0.022 | 31.5 |
| 0.176 | 0.790 | 0.110 | 0.029 | 0.626 | 0.037 | 17.0 |
| 0.243 | 0.707 | 0.152 | 0.043 | 0.627 | 0.060 | 10.4 |
| 0.301 | 0.610 | 0.196 | 0.064 | 0.652 | 0.105 | 6.2 |
| 0.340 | 0.531 | 0.228 | 0.087 | 0.672 | 0.164 | 4.1 |
| 0.351 | 0.480 | 0.256 | 0.117 | 0.729 | 0.244 | 3.0 |
| 0.353 | 0.352 | 0.298 | 0.177 | 0.844 | 0.503 | 1.7 |
| DES (ChCl:Ur), 313.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.006 | 0.659 | 0.006 | |
| 0.066 | 0.923 | 0.039 | 0.008 | 0.595 | 0.009 | 64.9 |
| 0.15 | 0.83 | 0.08 | 0.01 | 0.509 | 0.013 | 37.8 |
| 0.244 | 0.723 | 0.108 | 0.018 | 0.442 | 0.025 | 17.9 |
| 0.304 | 0.655 | 0.124 | 0.019 | 0.407 | 0.029 | 14.1 |
| 0.362 | 0.572 | 0.142 | 0.023 | 0.393 | 0.040 | 9.9 |
| 0.404 | 0.491 | 0.151 | 0.025 | 0.373 | 0.050 | 7.4 |
| 0.436 | 0.409 | 0.169 | 0.028 | 0.387 | 0.069 | 5.6 |
| 0.451 | 0.344 | 0.196 | 0.036 | 0.434 | 0.104 | 4.2 |
| 0.455 | 0.294 | 0.216 | 0.042 | 0.476 | 0.142 | 3.3 |
| 0.455 | 0.267 | 0.228 | 0.048 | 0.502 | 0.180 | 2.8 |
Таблица 3.
Экспериментальные данные о фазовом равновесии жидкость–жидкость в системе н-пропанол (1)–этилацетат (2)–DES (3) при 293.15 и 313 Ка и атмосферном давленииб (wi – массовые долив)
| Органическая фаза | Фаза DES | β1 | β2 | S | ||
|---|---|---|---|---|---|---|
| w1 | w2 | w1 | w2 | |||
| DES (ChCl:Gl), 293.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.017 | 0.729 | 0.017 | |
| 0.060 | 0.917 | 0.016 | 0.018 | 0.261 | 0.020 | 13.1 |
| 0.15 | 0.80 | 0.04 | 0.02 | 0.243 | 0.026 | 9.3 |
| 0.242 | 0.689 | 0.055 | 0.024 | 0.226 | 0.035 | 6.5 |
| 0.328 | 0.576 | 0.069 | 0.028 | 0.209 | 0.049 | 4.3 |
| 0.396 | 0.476 | 0.091 | 0.030 | 0.229 | 0.064 | 3.6 |
| 0.442 | 0.382 | 0.118 | 0.037 | 0.267 | 0.097 | 2.8 |
| 0.446 | 0.275 | 0.164 | 0.049 | 0.368 | 0.179 | 2.1 |
| DES (ChCl:Gl), 313.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.019 | 0.506 | 0.019 | |
| 0.061 | 0.902 | 0.015 | 0.020 | 0.243 | 0.022 | 10.9 |
| 0.146 | 0.790 | 0.04 | 0.02 | 0.246 | 0.029 | 8.6 |
| 0.241 | 0.680 | 0.056 | 0.026 | 0.232 | 0.039 | 6.0 |
| 0.311 | 0.588 | 0.074 | 0.030 | 0.239 | 0.051 | 4.7 |
| 0.390 | 0.470 | 0.105 | 0.035 | 0.269 | 0.074 | 3.6 |
| 0.430 | 0.369 | 0.140 | 0.046 | 0.324 | 0.124 | 2.6 |
| 0.399 | 0.232 | 0.214 | 0.077 | 0.538 | 0.331 | 1.6 |
| DES (ChCl: Ur), 293.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.007 | |||
| 0.06 | 0.92 | 0.04 | 0.01 | 0.764 | 0.014 | 53.7 |
| 0.111 | 0.867 | 0.076 | 0.019 | 0.684 | 0.022 | 31.5 |
| 0.176 | 0.790 | 0.110 | 0.029 | 0.626 | 0.037 | 17.0 |
| 0.243 | 0.707 | 0.152 | 0.043 | 0.627 | 0.060 | 10.4 |
| 0.301 | 0.610 | 0.196 | 0.064 | 0.652 | 0.105 | 6.2 |
| 0.340 | 0.531 | 0.228 | 0.087 | 0.672 | 0.164 | 4.1 |
| 0.351 | 0.480 | 0.256 | 0.117 | 0.729 | 0.244 | 3.0 |
| 0.353 | 0.352 | 0.298 | 0.177 | 0.844 | 0.503 | 1.7 |
| DES (ChCl:Ur), 313.15 K | ||||||
| 0.000 | 1.000 | 0.000 | 0.006 | 0.659 | 0.006 | |
| 0.066 | 0.923 | 0.039 | 0.008 | 0.595 | 0.009 | 64.9 |
| 0.15 | 0.83 | 0.08 | 0.01 | 0.509 | 0.013 | 37.8 |
| 0.244 | 0.723 | 0.108 | 0.018 | 0.442 | 0.025 | 17.9 |
| 0.304 | 0.655 | 0.124 | 0.019 | 0.407 | 0.029 | 14.1 |
| 0.362 | 0.572 | 0.142 | 0.023 | 0.393 | 0.040 | 9.9 |
| 0.404 | 0.491 | 0.151 | 0.025 | 0.373 | 0.050 | 7.4 |
| 0.436 | 0.409 | 0.169 | 0.028 | 0.387 | 0.069 | 5.6 |
| 0.451 | 0.344 | 0.196 | 0.036 | 0.434 | 0.104 | 4.2 |
| 0.455 | 0.294 | 0.216 | 0.042 | 0.476 | 0.142 | 3.3 |
| 0.455 | 0.267 | 0.228 | 0.048 | 0.502 | 0.180 | 2.8 |
Рис. 3.
Зависимости модели Отмера–Тобиаса для систем: (а) – этанол–н-пропилацетат–DES (1 – DES (ChCl:Gl) при 293.15 К, 2 – DES (ChCl:Gl) при 313.15 К, 3 – DES (ChCl:Ur) при 313.15 К), (б) – н-пропанол–этилацетат–DES (1 – DES (ChCl:Gl) при 293.15 К, 2 – DES (ChCl:Gl) при 313.15 К, 3 – DES (ChCl:Ur) при 293.15 К, 4 – DES (ChCl:Ur) при 313.15 К.
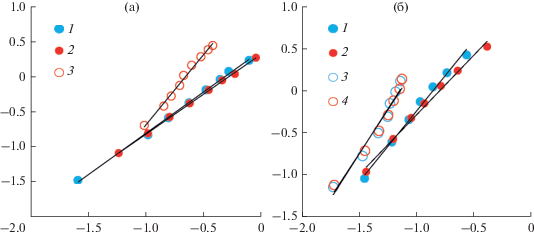
Была проведена проверка экспериментальных данных о фазовом равновесии на внутреннюю согласованность с использованием модели Отмера–Тобиаса [15].
(1)
${\text{log}}\left( {\frac{{1 - w_{2}^{{\text{I}}}}}{{w_{2}^{{\text{I}}}}}} \right) = a + b{\text{log}}\left( {\frac{{1 - w_{3}^{{{\text{II}}}}}}{{w_{3}^{{{\text{II}}}}}}} \right),$Таблица 4.
Параметры уравнения Отмера–Тобиаса и коэффициент корреляции R2
| Система | Параметры | R2 | |
|---|---|---|---|
| a | b | ||
| 293.15 К | |||
| Этанол–н-пропилацетат–DES (ChCl:Gl) | 1.1724 | 0.3661 | 0.9982 |
| Н-пропанол–этилацетат–DES (ChCl:Gl) | 1.6760 | 1.4367 | 0.9922 |
| Н-пропанол–этилацетат–DES (ChCl:Ur) | 2.1316 | 2.4498 | 0.9588 |
| 313.15 К | |||
| Этанол–н-пропилацетат–DES (ChCl:Gl) | 1.1326 | 0.3140 | 0.9993 |
| Этанол–н-пропилацетат–DES (ChCl:Ur) | 1.9931 | 1.3032 | 0.9913 |
| Н-пропанол–этилацетат–DES (ChCl:Gl) | 1.4146 | 1.1290 | 0.9925 |
| Н-пропанол–этилацетат–DES (ChCl:Ur) | 2.0795 | 2.3760 | 0.9678 |
Коэффициент корреляции выше 0.9 указывает на высокую согласованность полученных экспериментальных данных (табл. 4).
Помимо информации о фазовом равновесии, полученной в данной работе, на рис. 2, 3 приведены ноды для систем этанол–этилацетат–DES и н-пропанол–н-пропилацетат–DES, изученные в работе [16]. Подобный сравнительный анализ топологии диаграмм дает возможность оценить влияние спирта и эфира на положение фазового равновесия. На рис. 2а представлена система этанол–н-пропилацетат–DES (ChCl:Gl), а на рис. 2б система этанол–этилацетат–DES (ChCl:Gl), область нерастворимости и угол наклона нод практически идентичные, влияние эфира на положение фазового равновесия в данном случае минимально. Противоположная ситуация иллюстрируется рис. 2а (этанол–н-пропилацетат–DES (ChCl:Gl)) и 2в (н-пропанол–н-пропилацетат–DES (ChCl:Gl)). В данном случае имеется значительное увеличение области нерастворимости и выраженное изменение угла наклона нод. Аналогичное поведение происходит и в системах с этилацетатом. Изменение DES в данном случае не оказывает существенного влияния, а определяющим фактором по-прежнему является только спирт.
Для оценки эффективности процесса экстракции были рассчитаны коэффициенты распределения (βi) и селективность (S):
(3)
$S = \left( {\frac{{w_{i}^{{\text{I}}}}}{{w_{i}^{{{\text{II}}}}}}} \right)\left( {\frac{{w_{j}^{{{\text{II}}}}}}{{w_{j}^{{\text{I}}}}}} \right),$Таблица 5.
Энергетические параметры gji, полученные корреляцией экспериментальных данных о фазовом равновесии жидкость–жидкость моделью NRTL
| ij | ∆gji, Дж моль–1 | ∆gij, Дж моль–1 | αji |
|---|---|---|---|
| Этанол (1)–н-пропилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –16915.2 | –28828.4 | 0.3 |
| 1–3 | 7493.4 | 10046.7 | 0.3 |
| 2–3 | 33643.0 | –16554.2 | 0.3 |
| σ = 0.49 | |||
| Этанол (1)–н-пропилацетат (2)–DES (ChCl:Ur) (3) | |||
| 1–2 | –29389.8 | –33562.0 | 0.3 |
| 1–3 | 10719.9 | 11374.0 | 0.3 |
| 2–3 | 8264.7 | 4421.2 | 0.3 |
| σ = 0.26 | |||
| н-пропанол (1)–этилацетат (2)–DES (ChCl:Gl) (3) | |||
| 1–2 | –17903.9 | 22011.6 | 0.3 |
| 1–3 | 8378.5 | 7895.2 | 0.3 |
| 2–3 | –1509.7 | –7277.1 | 0.3 |
| σ = 0.96 | |||
| н-пропанол (1)–этилацетат (2)–DES (ChCl:Ur) (3) | |||
| 1–2 | –15603.8 | –24355.9 | 0.3 |
| 1–3 | 5348.4 | 5576.3 | 0.3 |
| 2–3 | 18516.1 | –12856.0 | 0.3 |
| σ = 0.46 | |||
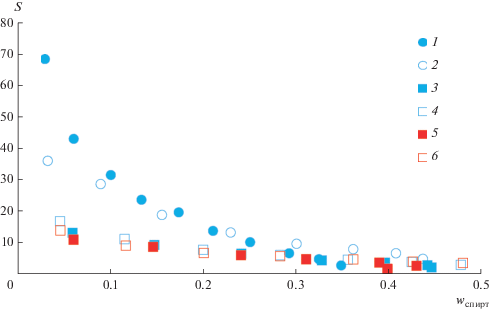
На рис. 4 приведены зависимости значения селективности от содержания спирта в системах спирт–этилацетат–DES при температурах 293.15 и 313.15 К. DES (ChCl:Gl) и (ChCl:Ur) показывают большие значения селективности в системах этанол–этилацетат, чем в системах н-пропанол–этилацетат. Такой результат объясняется значительным различием в коэффициентах распределения для этанола (βэтанол ≈ 0.6 [16]) и пропанола (βн-пропанол ≈ 0.2, табл. 3), в то время как для эфира он имеет постоянное значение.
Рис. 4.
Зависимость селективности от концентрации спирта в органической фазе в системах с этилацетатом: 1 – этанол–этилацетат–DES (ChCl:Gl) при 293.15 К [16]; 2 – этанол–этилацетат–DES (ChCl:Ur), 293.15 К [16]; 3 – н-пропанол–этилацетат–DES (ChCl:Gl), 293.15 К; 4 – н-пропанол–этилацетат–DES (ChCl:Ur), 293.15 К; 5 – н-пропанол–этилацетат–DES (ChCl:Gl), 313.15 К; 6 – н-пропанол–этилацетат–DES (ChCl:Ur), 313.15 К.
Значения селективности для систем спирт–н-пропилацетат–DES представлены на рис. 5. В данных системах характер зависимостей значений селективности от состава аналогичен. Для систем этанол–этилацетат наблюдаются большие значения селективности, чем для систем н-пропанол–этилацетат.
Рис. 5.
Зависимость селективности от концентрации спирта в органической фазе в системах: 1 – этанол–н-пропилацетат–DES (ChCl:Gl) при 293.15 К; 2 – этанол–н-пропилацетат–DES (ChCl:Gl) при 313.15 К; 3 – этанол–н-пропилацетат–DES (ChCl:Ur) при 313.15 К; 4 – н-пропанол–н-пропилацетат–DES (ChCl:Gl) при 293.15 К [16]; 5 – н-пропанол–н-пропилацетат–DES (ChCl:Ur) при 293.15 К [16].
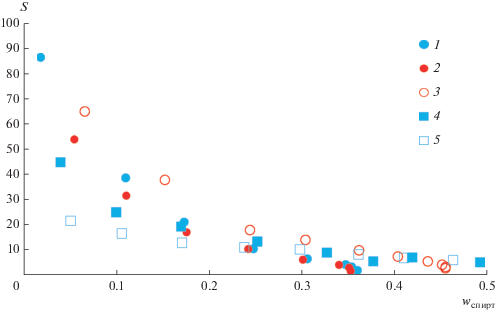
Важно отметить, что значения селективности для DES (ChCl:Ur) находятся выше, чем для DES (ChCl:Gl) в системе этанол–н-пропилацетат при 313.15 К. Однако в системе пропанол–этилацетат отсутствует выраженная температурная зависимость селективности от различных DES.
МОДЕЛИРОВАНИЕ ФАЗОВОГО РАВНОВЕСИЯ
Моделирование фазового равновесия осуществлялось с использованием модели локальных составов NRTL [25]. Уравнение NRTL для коэффициентов активности компонентов системы имеет следующий вид:
(4)
$\begin{gathered} {\text{ln}}\left( {{{\gamma }_{i}}} \right) = \frac{{\sum\limits_{j = 1}^m {{{x}_{j}}{{\tau }_{{ji}}}{{G}_{{ji}}}} }}{{\sum\limits_{l = 1}^m {{{x}_{l}}{{G}_{{li}}}} }} + \sum\limits_{j = 1}^m {\frac{{{{x}_{j}}{{G}_{{ij}}}}}{{\sum\limits_{l = 1}^m {{{x}_{l}}{{G}_{{lj}}}} }}} \times \\ \times \,\,\left( {{{\tau }_{{ij}}} - \frac{{\sum\limits_{r = 1}^m {{{x}_{r}}{{\tau }_{{rj}}}{{G}_{{rj}}}} }}{{\sum\limits_{l = 1}^m {{{x}_{l}}{{G}_{{lj}}}} }}} \right), \\ \end{gathered} $(5)
${{\tau }_{{ji}}} = \frac{{{{g}_{{ji}}} - {{g}_{{ii}}}}}{{RT}} = \frac{{\Delta {{g}_{{ji}}}}}{{RT}},$(8)
$OF = \sum\limits_{k = 1}^n {\sum\limits_{i = 1}^m {\left[ {\left( {x_{{ik}}^{{{\text{exp}}}} - x_{{ik}}^{{cal}}} \right)_{{\text{I}}}^{2} + \left( {x_{{ik}}^{{{\text{exp}}}} - x_{{ik}}^{{cal}}} \right)_{{{\text{II}}}}^{2}} \right]} } .$Оптимизацию проводили при средней температуре для каждой из изученных систем, которая составила 303.15 К, только для системы этанол–н-пропилацетат–DES (ChCl:Ur) была выбрана температура исследования 313.15 К.
Стандартное отклонение σ было рассчитано по следующей формуле:
(9)
$\sigma \left( \% \right) = 100\sqrt {\frac{{\sum\limits_{k = 1}^n {\sum\limits_{i = 1}^m {\left[ {\left( {x_{{ik}}^{{{\text{exp}}}} - x_{{ik}}^{{cal}}} \right)_{{\text{I}}}^{2} + \left( {x_{{ik}}^{{{\text{exp}}}} - x_{{ik}}^{{cal}}} \right)_{{{\text{II}}}}^{2}} \right]} } }}{{2mn}}} ,$Параметры, полученные в ходе оптимизации, представлены в табл. 5.
Результаты моделирования с использованием уравнения NRTL хорошо согласуются с экспериментальными данными, величина стандартного отклонения не превышает 0.96%.
ЗАКЛЮЧЕНИЕ
Получены данные об экстракционных свойствах DES хлорид холина–глицерин и хлорид холина–мочевина в мольном соотношении 1 : 2. Экспериментальные результаты газохроматографического исследования фазового равновесия в системах этанол–н-пропилацетат и н-пропанол–этилацетат с указанными DES во всем диапазоне концентраций при температурах 293.15 и 313.15 К позволили установить определяющее влияние спиртов на параметры фазового равновесия в изученных системах. Линейный вид зависимости Отмера–Тобиаса подтвердил высокий уровень внутренней согласованности экспериментальных данных. Определены величины селективности и коэффициенты распределения спирта и эфира: для DES, образованного хлоридом холина и мочевиной, значения селективности имеют наибольшие значения. Результаты обработки данных по уравнениям модели NRTL отражают высокий уровень корреляции – величина стандартного отклонения не превышает 0.96%.
Авторы выражают благодарность за финансовую поддержку Российскому научному фонду (проекты № 19-73-00092 и 20-73-10007) и Совету по грантам Президента РФ (Грант Президента РФ МК-1288.2020.3).
ОБОЗНАЧЕНИЯ
| a, b | настраиваемые параметры |
| gji | энергетический параметр, Дж моль–1 |
| m | количество компонентов |
| n | количество нод |
| R2 | коэффициент корреляции |
| S | селективность |
| T | температура, К |
| w | массовая доля |
| x | мольная доля |
| α | коэффициент в распределении больцмановского типа |
| β | коэффициент распределения |
| σ | стандартное отклонение, % |
ИНДЕКСЫ
Список литературы
Haghbakhsh R., Raeissi S. Modeling the phase behavior of carbon dioxide solubility in deep eutectic solvents with the cubic plus association equation of state // J. Chem. Eng. Data. 2018. V. 63. P. 897.
Haghbakhsh R., Raeissi S. Densities and volumetric properties of (choline chloride + urea) deep eutectic solvent and methanol mixtures in the temperature range of 293.15–323.15 K // J. Chem. Thermodyn. 2018. V. 124. P. 10.
Abbott A.P., Capper G., Davies D.L., Rasheed R.K., Tambyrajah V. Novel solvent properties of choline chloride/urea mixtures // Chem. Commun. 2003. P. 70.
Florindo C., Lima F., Ribeiro B.D., Marrucho I.M. Deep eutectic solvents: overcoming 21st century challenges // Curr. Opin. Green Sustainable Chem. 2019. V. 18. P. 31.
Zhang Q., De Oliveira Vigier K., Royer S., Jérôme F. Deep eutectic solvents: syntheses, properties and applications // Chem. Soc. Rev. 2012. V. 41. P. 7108.
Xu X., Liu W., Li M., Ri Y., Wang Y. Ternary liquid-liquid equilibrium of azeotropes (ester + alcohol) with different ionic liquids at T = 298.15 K // J. Chem. Eng. Data. 2017. V. 62. P. 532.
Warrag S.E.E., Peters C.J., Kroon M.C. Deep eutectic solvents for highly efficient separations in oil and gas industries // Curr. Opin. Green Sustainable Chem. 2017. V. 5. P. 55.
Azizi N., Khajeh M., Alipour M. Rapid and selective oxidation of alcohols in deep eutectic solvent // Ind. Eng. Chem. Res. 2014. V. 53. P. 15561.
Dai Y., van Spronsen J., Witkamp G.J., Verpoorte R., Choi Y.H. Natural deep eutectic solvents as new potential media for green technology // Anal. Chim. Acta. 2013. V. 766. P. 61.
Garcia G., Aparicio S., Ullah R., Atilhan M. Deep Eutectic Solvents: Physicochemical Properties and Gas Separation Applications // Energy Fuels. 2015. V. 29. P. 2616.
Pätzold M., Siebenhaller S., Kara S., Liese A., Syldatk C., Holtmann D. Deep Eutectic Solvents as Efficient Solvents in Biocatalysis // Trends Biotechnol. 2019. V. 37. P. 943.
Wazeer I., Hadj-kali M.K. Deep eutectic solvents: designer fluids for // J. Chem. Technol. Biotechnol. 2018. V. 93. P. 945.
Sokolova M.P., Smirnov M.A., Samarov A.A., Bobrova N.V., Vorobiov V.K., Popova E.N., Filippova E., Geydt P., Lahderanta E., Toikka A.M. Plasticizing of chitosan films with deep eutectic mixture of malonic acid and choline chloride // Carbohydr. Polym. 2018. V. 197. P. 548.
Smirnov M.A., Nikolaeva A.L., Vorobiov V.K., Bobrova N.V., Abalov I.V., Smirnov A.V., Sokolova M.P. Ionic conductivity and structure of chitosan films modified with lactic acid-choline chloride NADES // Polymers (Basel). 2020. V. 12. P. 350.
Smirnov M.A., Sokolova M.P., Tolmachev D.A., Vorobiov V.K., Kasatkin I.A., Smirnov N.N., Klaving A.V., Bobrova N.V., Lukasheva N.V., Yakimansky A.V. Green method for preparation of cellulose nanocrystals using deep eutectic solvent // Cellulose. 2020. V. 27. P. 4305.
Samarov A.A., Shishaeva L.M., Toikka A.M. Phase Equilibria and Extraction Properties of Deep Eutectic Solvents in Alcohol–Ester Systems // Theor. Found. Chem. Eng. 2020. V. 54. P. 551.
Li X., Row K.H. Development of deep eutectic solvents applied in extraction and separation // J. Sep. Sci. 2016. V. 39. P. 3505.
Frolkova A.V., Ososkova T.E., Frolkova A.K. Thermodynamic and Topological Analysis of Phase Diagrams of Quaternary Systems with Internal Singular Points // Theor. Found. Chem. Eng. 2020. V. 54. P. 407.
Samarov A.A., Smirnov M.A., Toikka A.M., Prikhodko I.V. Study of Deep Eutectic Solvent on the Base Choline Chloride as Entrainer for the Separation Alcohol-Ester Systems // J. Chem. Eng. Data. 2018. V. 63. P. 1877.
Samarov A.A., Smirnov M.A., Sokolova M.P., Toikka A.M. Liquid–Liquid Equilibrium Data for the System n-Octane + Toluene + DES at 293.15 and 313.15 K and Atmospheric Pressure // Theor. Found. Chem. Eng. 2018. V. 52. P. 258.
Samarov A.A., Smirnov M.A., Sokolova M.P., Popova E.N., Toikka A.M. Choline chloride based deep eutectic solvents as extraction media for separation of n-hexane-ethanol mixture // Fluid Phase Equilib. 2017. V. 448. P. 123.
Samarov A., Shner N., Mozheeva E., Toikka A. Liquid-liquid equilibrium of alcohol–ester systems with deep eutectic solvent on the base of choline chloride // J. Chem. Thermodyn. 2019. V. 131. P. 369.
Toikka M.A., Samarov A.A., Sadaev A.A., Senina A.A., Lobacheva O.L. Chemical equilibrium in the propionic acid – ethanol – ethyl propionate – water system and extraction processes with participation of deep eutectic solvents // Fine Chem. Technol. 2019. V. 14. P. 47.
Samarov A., Prikhodko I., Liubichev D., Toikka A. Liquid–Liquid Equilibrium of Alcohol (Ethanol or n-Propanol)–Ester (Ethyl or n-Propyl Propionate) Systems with a Deep Eutectic Solvent Based on Choline Chloride at 293.15 K // J. Chem. Eng. Data. 2020. V. 65. P. 5545.
Renon H., Prausnitz J.M. Local compositions in thermodynamic excess functions for liquid mixtures // AIChE J. 1968. V. 14. P. 135.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии