Теоретические основы химической технологии, 2021, T. 55, № 2, стр. 204-209
Химия экстракции La(NO3)3 и Ce(NO3)3 из нитратных растворов смесями нитрата метилтри-н-октиламмония и три-н-бутилфосфата в толуоле
С. И. Степанов a, *, Нгуен Тхи Иен Хоа a, А. М. Чекмарев a, А. Ю. Цивадзе b
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: chao_step@mail.ru
Поступила в редакцию 20.11.2020
После доработки 01.12.2020
Принята к публикации 03.12.2020
Аннотация
Методом изомолярных серий установлены границы областей синергетной экстракции нитрата лантана и нитрата церия(III) из низкокислотных нитратных растворов с высаливателем NH4NO3 1.0 М изомолярными смесями нитрата три-н-октилметиламмония с три-н-бутилфосфатом в толуоле. Впервые химия экстракции в установленных областях проявления синергетного эффекта определена как непрерывная последовательность экстрагируемых смешанных комплексов состава (R4N)n[Ln(NO3)3 + n ⋅ mТБФ], где n = 1–3, m = 3–1 для лантана и n = 1–3, m = 4–1 для церия(III) в зависимости от мольного соотношения экстрагентов. Антибатная последовательность в изменении значений n и m в смешанных комплексах с ростом концентрации четвертичной соли в смеси объяснена замещением фосфорильных лигандов три-н-бутилфосфата нитратными лигандами нитрата три-н-октилметиламмония вплоть до полного их вытеснения из координационной сферы лантаноида.
ВВЕДЕНИЕ
Экстракция редкоземельных элементов (РЗЭ) смесями экстрагентов различных классов нашла широкое применение в технологии их разделения в 1980-х годах. В большинстве случаев экстракционные смеси, состоящие, как правило, из двух экстрагентов, проявляли синергетный эффект, заключающийся в сверхаддитивном распределении целевого компонента (применительно к тематике данной статьи – редкоземельного элемента (Ln)) из водной фазы в смесь двух экстрагентов [1]. Промышленное применение для разделения РЗЭ средней группы нашли синергетные смеси солей четвертичных аммониевых оснований (ЧАО, ЧАС) и нейтральных фосфорорганических соединений (НФОС), в частности нитрат метилтриалкиламмония (ТАМАН) и три-н-бутилфосфат (ТБФ) [2]. В научно-технической литературе конца XX–начала XXI вв. разгорелась широкая полемика о химии экстракции РЗЭ смесями ЧАС и НФОС, в том числе о составе экстрагируемых синергетных соединений. Достаточно подробный обзор работ по этой тематике до 2004 г. представлен в монографии С.И. Степанова и А.М. Чекмарева [3, с. 149–156]. Основные споры велись вокруг двух ключевых экстрагируемых комплексов – однозарядного смешанного комплекса состава R4N[Ln(NO3)4 ⋅ n(НФОС)] и двухзарядного комплекса (R4N)2[Ln(NO3)5 ⋅ n(НФОС)], где R4N – однозарядный катион четвертичного аммония, n = 1–3, НФОС: ТБФ, фосфиноксид разнорадикальный (ФОР), ди-изо-октилметилфосфонат (ДИОМФ), три-н-октилфосфиноксид (ТОФО).
В работах А.К. Пяртмана [4, 5] была постулирована экстракция однозарядного комплекса РЗЭ цериевой группы, т.е. элементов от La до Nd, и двухзарядного – для РЗЭ средней и тяжелой групп от Sm до Lu.
В работах С.И. Степанова и А.М. Чекмарева [3, с. 172–184] рассматривали более широкий спектр образующихся соединений, выходящий за рамки только одно- или двухзарядного комплексов.
Развитие редкометалльной промышленности, наступившее после 2011 г., в том числе редкоземельного производства, поставило новые задачи по разделению РЗЭ всех трех групп – легкой, средней и тяжелой. Основными средами, принятыми для разделения РЗЭ в нашей стране, являются азотнокислые среды. Однако высокая стоимость азотной кислоты, потребление которой в экстракционной технологии велико, потребовали перехода к низкокислотным нитратным растворам как средам для разделения РЗЭ и поискам эффективных экстракционных систем для разделительных процессов. Такими эффективными системами являются смеси ЧАС и НФОС, и, в частности, смеси нитрата метилтри-н-октиламмония (ТОМАН) и ТБФ. Если для разделения РЗЭ средней группы накоплен достаточно большой опыт использования смесей ТАМАН–ТБФ из нитратных растворов, то разделение легкой группы РЗЭ (ЛРЗЭ) этими смесями практически не изучено. И в первую очередь для решения практических задач экстракционной технологии необходимо точное знание составов экстрагируемых соединений ЛРЗЭ из низкокислотных нитратных растворов смесями ЧАС–ТБФ в широкой области соотношений компонентов.
Целью настоящей работы является определение методом изомолярных серий областей синергетной экстракции и состава экстрагируемых соединений нитрата лантана и нитрата церия(III) из низкокислотных нитратных растворов с высаливателем смесями ТОМАН–ТБФ во всей области изменения их молярных отношений в смесях с использованием статистической обработки экспериментальных данных для выявления всех статистически значимых смешанных экстрагируемых соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали La2O3, Ce(NO3)3 ⋅ 6H2O, NH4NO3, ТБФ квалификации “ч”; NH4OH, HNO3, толуол квалификации “х. ч.”. ТОМАН был получен по оригинальной методике с содержанием основного вещества CH3(C8H17)3NNO3 99.9% в пересчете на сухой безводный продукт.
Исходные 1.0 М водные растворы La(NO3)3 и Ce(NO3)3 готовили растворением точных навесок La2O3 и Ce(NO3)3 ⋅ 6H2O в расчетном количестве концентрированной HNO3 и дистиллированной воде соответственно, после чего в полученные растворы вносили расчетную навеску твердого NH4NO3 и после полного ее растворения доводили рН приготовленного раствора до 2, что соответствовало концентрации HNO3 ~0.01 М, 1.0 М водными растворами аммиака или HNO3.
1.0 М изомолярные растворы ТОМАН–ТБФ в толуоле готовили в мерных колбах на 100 мл. В колбу вносили расчетное количество 3.65 М ТБФ и расчетное количество 1.96 М ТОМАН, после чего смесь доводили толуолом до метки. Концентрацию ТОМАН в исходном экстрагенте устанавливали по содержанию R4N+ групп потенциометрическим титрованием йодидной формы четвертичной соли 0.1 М водным раствором AgNO3 в смеси 50 об. % пропанола и 50 об. % воды в присутствии йодид-селективного электрода фирмы “Раделкис” (Венгрия).
Экстракцию лантана и церия проводили в стеклянных пробирках с притертыми крышками объемом 10–25 мл при комнатной температуре 20 ± 2°С, интенсивном перемешивании, соотношении объемов органической и водной фаз О : В = 1 : 1 (по 5–10 мл), времени контакта фаз 15 мин, времени расслаивания фаз 10–20 мин, после чего проводили отбор аликвоты водной фазы, которую анализировали на содержание лантаноида комплексонометрическим титрованием в присутствии индикатора ксиленолового оранжевого [6].
Для верификации результатов, полученных при анализе водной фазы на содержание La и Ce в отдельных пробах, проводили их определение в равновесных органических фазах после “мокрого” сжигания аликвоты экстракта в смеси кислот HNO3 + HClO4 в колбах Кьельдаля при нагревании на газовой горелке. Пробу раствора после “мокрого” сжигания количественно переносили в коническую колбу из термостойкого стекла на 250 мл и анализировали трилонометрическим методом.
Коэффициенты распределения DLn рассчитывали по традиционной формуле: DLn = Сорг/Сводн = = (Сисх– Сводн)/Сводн, где Сисх, Сводн и Сорг – исходная концентрация La или Ce(III) в водной и равновесные концентрации в водной и органической фазах, соответственно. Синергетный эффект SLn рассчитывали по уравнению SLn = Dсм/(D1+ D2), где Dсм – экспериментально определенный коэффициент распределения La или Ce(III) для раствора смеси экстрагентов; D1 и D2 – коэффициенты распределения La или Ce(III) для индивидуального раствора каждого экстрагента при их концентрациях, равных в смешанном растворе. При SLn > 1 наблюдается синергетный эффект, а при SLn < 1 – антисинергетный или антагонистический эффект [3, с. 135–137].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены зависимости коэффициентов распределения лантана DLa от исходных концентраций ТБФ, ТОМАН и состава их 1.0 М изомолярных смесей при экстракции из низкокислотного нитратного раствора с высаливателем. Для зависимости DLa от концентрации ТБФ средняя статистическая ошибка определения концентрации лантана в исходном (титрование 5 аликвот) и равновесных водных растворах по 9 точкам (3 серии экспериментов с трехкратным титрованием каждой точки) при доверительной вероятности 95% составила 0.028 и 3.93% соответственно. Средняя статистическая ошибка в определении величины DLa для трех идентичных серий экспериментов этой зависимости составила 7.89%. Для зависимости DLa от концентрации ТОМАН средняя ошибка определения равновесной концентрации при тех же условиях составила 3.23%, а для DLa – 6.49%. Для усредненных экспериментальных точек обеих зависимостей была проведена процедура сглаживания по 5 точкам [7].
Рис. 1.
Зависимость DLa от концентрации ТБФ (1), ТОМАН (2), состава смесей ТОМАН–ТБФ (3) и синергетная кривая (4) при экстракции лантана из раствора, содержащего 0.88 М La(NO3)3, 4.0 M NH4NO3, 0.01 M HNO3.
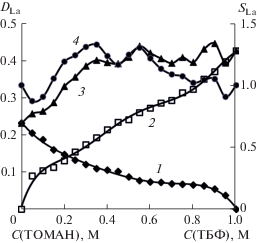
Результирующие зависимости после соответствующей обработки (рис. 1) представляют собой плавные кривые с промежуточными перегибами, целочисленные мольные отношения La : ТБФ(ТОМАН) для которых соответствуют образованию в органической фазе сольватов La(NO3)3 ⋅ mТБФ и комплексам состава (R4N)n[La(NO3)3 + n], где n = 1–2 [3].
Зависимость DLa от состава изомолярных смесей ТОМАН–ТБФ представляет собой кривую с 4 выраженными максимумами для составов ТОМАН–ТБФ: 0.35–0.65; 0.55–0.45; 0.75–0.25 и 0.9–0.1. Средняя статистическая ошибка экспериментального определения DLa для этой зависимости составила 4.51%, что верифицирует значимость максимумов на экспериментальной кривой.
На рис. 1 представлена также синергетная кривая или зависимость синергетного эффекта SLa от состава изомолярных смесей, рассчитанная по описанным выше зависимостям DLa. Точки, лежащие выше значений SLa = 1, определяют область синергетной экстракции, которая простирается от состава 0.15 М ТОМАН–0.85 М ТБФ до состава 0.9 М ТОМАН–0.1 М ТБФ. Прилежащие к этой области составы ТОМАН–ТБФ характеризуются антагонистическим эффектом. На синергетной кривой выделяются два ярко выраженных максимума с величиной SLa = 1.33 и 1.30 для составов 0.35 М ТОМАН–0.65 М ТБФ и 0.55 М ТОМАН–0.45 М ТБФ соответственно. Для синергетных смесей с шагом в 0.05 М были проведены расчеты мольных отношений La : ТОМАН : ТБФ по экспериментально определенным содержаниям лантана в органической фазе, представленные в табл. 1.
Таблица 1.
Мольные отношения La : ТБФ : ТОМАН в области синергетной экстракции из растворов, содержащих 0.88 М La(NO3)3, 4.0 M NH4NO3 и 0.01 M HNO3
| ТБФ, М | 0.85 | 0.80 | 0.75 | 0.70 | 0.65 | 0.60 | 0.55 | 0.50 |
| ТОМАН, М | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.45 | 0.50 |
| ТБФ : ТОМАН | 5.7 : 1 | 4 : 1 | 3 : 1 | 2.3 : 1 | 1.9 : 1 | 3 : 2 | 1.2 : 1 | 1 : 1 |
| La(NO3)3, орг., М | 0.196 | 0.219 | 0.231 | 0.245 | 0.252 | 0.249 | 0.248 | 0.255 |
| ТБФ : La(NO3)3 | 4.33 | 3.66 | 3.25 | 2.86 | 2.58 | 2.41 | 2.22 | 1.96 |
| ТОМАН : La(NO3)3 | 0.76 | 0.92 | 1.08 | 1.23 | 1.39 | 1.61 | 1.82 | 1.96 |
| ТБФ, М | 0.45 | 0.40 | 0.35 | 0.30 | 0.25 | 0.20 | 0.15 | 0.10 |
| ТОМАН, М | 0.55 | 0.60 | 0.65 | 0.70 | 0.75 | 0.80 | 0.85 | 0.90 |
| ТБФ : ТОМАН | 1 : 1.2 | 2 : 3 | 1 : 1.9 | 1 : 2.3 | 1 : 3 | 1 : 4 | 1 : 5.7 | 1 : 9 |
| La(NO3)3, орг., М | 0.268 | 0.260 | 0.254 | 0.248 | 0.255 | 0.249 | 0.265 | 0.271 |
| ТБФ : La(NO3)3 | 1.68 | 1.54 | 1.38 | 1.21 | 0.98 | 0.80 | 0.57 | 0.37 |
| ТОМАН : La(NO3)3 | 2.05 | 2.31 | 2.56 | 2.82 | 2.94 | 3.21 | 3.21 | 3.32 |
С учетом высокой концентрации La(NO3)3 = = 0.88 М в исходном нитратном растворе и наличия в водной фазе высаливателя содержание лантана в органических экстрактах близко к насыщению. Поэтому мольные отношения, представленные в табл. 1, можно рассматривать как отношения компонентов в экстрагируемом комплексе, на основании которых может быть предложен состав экстрагируемых соединений.
В соответствии с литературными данными, рассмотренными в [3, с. 149–156], экстракция РЗЭ смесями нитратов ЧАО с ТБФ сопровождается образованием смешанных комплексов состава (R4N)n[Ln(NO3)3 +n ⋅ mТБФ], где n = 1–2, m = 1–3. Согласно данным табл. 1, в области изменения концентрации ТОМАН от 0.15 до 0.3 М химию экстракции определяет образование комплексов состава R4N[La(NO3)4 ⋅ 3ТБФ] и R4N[La(NO3)4 ⋅ 2ТБФ]. Дальнейший рост концентрации ТОМАН в смеси вплоть до 0.6 М сопровождается образованием двухзарядных комплексов состава (R4N)2[La(NO3)5 ⋅ 3ТБФ] и (R4N)2[La(NO3)5 ⋅ 2ТБФ], которые экстрагируются наряду с однозарядными смешанными комплексами ТОМАН с ТБФ. В области 0.6–0.9 М ТОМАН протекает образование трехзарядных смешанных комплексов состава (R4N)3[La(NO3)6 ⋅ · (1–2)ТБФ], содержащих 1 или 2 молекулы ТБФ в своем составе. При концентрации 0.9 М ТОМАН и выше экстракция сопровождается образованием анионных нитратных комплексов лантана с ТОМАН состава (R4N)n[La(NO3)3 + n], где n = 3–4. ТБФ в этом случае полностью вытесняется из координационной сферы лантана нитратным лигандом и не оказывает влияния на его экстракцию четвертичной солью.
Два максимума на синергетной кривой соответствуют экстракции наиболее устойчивых смешанных комплексов состава R4N[La(NO3)4 ⋅ 3ТБФ] и (R4N)2[La(NO3)5 ⋅ 2ТБФ]. Основным мотивом в изменении состава экстрагируемых смешанных соединений лантана является замещение во внутренней координационной сфере фосфорильного лиганда нитратным при увеличении содержания ТОМАН в смеси. При значительном преобладании ТОМАН наблюдается образование трехзарядного анионного комплекса, содержащего 1 молекулу ТБФ (один фосфорильный лиганд) и последующее образование анионного комплекса с ТОМАН, содержащего 6 и даже 7 нитратных лигандов в своем составе.
Область с низким содержанием ТОМАН, от 0.05 до 0.15 М, характеризуется антагонистическим эффектом при экстракции лантана из нитратных растворов с низкой кислотностью и высоким содержанием высаливателя. Этот эффект обусловлен, по-видимому, сольватацией ТОМАН избытком ТБФ в органической фазе, приводящей к понижению термодинамической активности ТОМАН [3, с. 42], неспособного в этих условиях эффективно экстрагировать однозарядный анионный комплекс состава NH4[La(NO3)4], который образуется в водном нитратном растворе при избытке NH4NO3.
На рис. 2 представлены зависимости DCe(III) от концентрации ТОМАН, ТБФ и состава их 1.0 М изомолярных смесей, а также синергетная кривая.
Рис. 2.
Зависимость DCe(III) от концентрации ТБФ (1), ТОМАН (2), состава смесей ТОМАН–ТБФ (3) и синергетная кривая (4) при экстракции церия(III) из раствора, содержащего 1.0 М Ce(NO3)3, 4.0 M NH4NO3, 0.01 M HNO3.
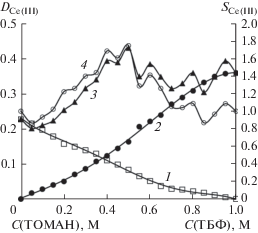
Как и при экстракции лантана смесями ТОМАН–ТБФ, на синергетной кривой SCe(III) – состав 1.0 М изомолярных смесей ТОМАН–ТБФ выделяется область синергетной экстракции, простирающаяся от состава 0.2 М ТОМАН–0.8 М ТБФ до состава 0.7 М ТОМАН–0.3 М ТБФ с максимумом SCe(III) = 1.75 для состава 0.5 М ТОМАН–0.5 М ТБФ. Области 1.0–0.85 М ТБФ и от 0.25–0.95 М ТБФ характеризуются антагонистическим эффектом – SCe(III) < 1.
Таким образом, область синергетной экстракции Ce(III) 1.0 М смесями ТОМАН–ТБФ в толуоле сужается по сравнению с таковой для La. Однако, максимальное значение синергетного эффекта для Ce(III) в 1.3 раза выше, чем для La, а положение максимума смещено в область 0.5 М ТОМАН–0.5 М ТБФ. В табл. 2 представлены мольные отношения Ce(III) : ТБФ : ТОМАН для области синергетной экстракции с шагом 0.05 М.
Таблица 2.
Мольные отношения Ce(III) : ТБФ : ТОМАН в области синергетной экстракции из растворов, содержащих 1.0 М Ce(NO3)3, 4.0 M NH4NO3 и 0.01 M HNO3
| ТБФ, М | 0.80 | 0.75 | 0.70 | 0.65 | 0.60 | 0.55 |
| ТОМАН, М | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.45 |
| ТБФ : ТОМАН | 4 : 1 | 3 : 1 | 2.3 : 1 | 1.9 : 1 | 3 : 2 | 1.2 : 1 |
| Ce(NO3)3, орг., М | 0.202 | 0.216 | 0.240 | 0.254 | 0.282 | 0.280 |
| ТБФ : Ce(NO3)3 | 3.96 | 3.47 | 2.92 | 2.56 | 2.13 | 1.96 |
| ТОМАН : Ce(NO3)3 | 0.99 | 1.16 | 1.25 | 1.38 | 1.42 | 1.61 |
| ТБФ, М | 0.50 | 0.45 | 0.40 | 0.35 | 0.30 | 0.25 |
| ТОМАН, М | 0.50 | 0.55 | 0.60 | 0.65 | 0.70 | 0.75 |
| ТБФ : ТОМАН | 1 : 1 | 1 : 1.2 | 2 : 3 | 1 : 1.9 | 1 : 2.3 | 1 : 3 |
| La(NO3)3, орг., М | 0.301 | 0.259 | 0.277 | 0.258 | 0.240 | 0.248 |
| ТБФ : Ce(NO3)3 | 1.66 | 1.74 | 1.44 | 1.36 | 1.21 | 1.01 |
| ТОМАН : Ce(NO3)3 | 1.66 | 2.13 | 2.16 | 2.52 | 2.92 | 3.03 |
Данные табл. 2 позволяют сделать заключение о составе экстрагируемых соединений Ce(III) смесями ТОМАН–ТБФ различного состава. При мольном отношении ТОМАН : ТБФ = 1 : 4 экстракция Ce(III) сопровождается образованием смешанного комплекса R4N[Ce(NO3)4 ⋅ 4ТБФ], содержащего 4 фосфорильных лиганда во внутренней координационной сфере. С ростом концентрации ТОМАН в смесях от 0.2 до 0.5 М наряду с однозарядным анионным смешанным комплексом наблюдается экстракция двухзарядного, состава (R4N)2[Ce(NO3)5 ⋅ (2–3)ТБФ], в котором с уменьшением концентрации ТБФ закономерно уменьшается число фосфорильных лигандов от 3 до 2. В точке максимума синергетного эффекта – 0.5 М ТОМАН–0.5 М ТБФ в соответствии с наблюдаемыми мольными отношениями Ce(III) : ТБФ : ТОМАН наиболее вероятна совместная экстракция двух смешанных комплексов состава R4N[Ce(NO3)4 ⋅ 4ТБФ] и (R4N)2[Ce(NO3)5 ⋅ 2ТБФ] в равных долях. Дальнейшее повышение содержания ТОМАН в смесях сопровождается образованием трехзарядного нитратного анионного комплекса Ce(III) с ТОМАН, включающего 1 молекулу ТБФ (R4N)3[Ce(NO3)6 ⋅ ТБФ], вплоть до состава 0.75 М ТОМАН–0.25 М ТБФ. Для составов, содержащих более 0.75 М ТОМАН, экстракция протекает с образованием трехзарядного комплекса состава (R4N)3[Ce(NO3)6], не содержащего молекул ТБФ в своем составе. Мольное отношение Ce(III) : ТОМАН в этой области увеличивается от 3.0 до 3.8 для 1.0 М раствора ТОМАН в толуоле, однако концентрация Ce(III) в органической фазе изменяется от 0.233 до 0.264 М. При экстракции индивидуальными 0.75–1.0 М растворами ТОМАН концентрация Ce(III) в органической фазе также изменяется от 0.235 до 0.264 М, что подтверждает образование только анионных нитратных комплексов Ce(III) с ТОМАН. Возможно, что экстракция комплекса (R4N)3[Ce(NO3)6] сопровождается дополнительной сольватацией 1–2 свободными молекулами R4NNO3.
ЗАКЛЮЧЕНИЕ
Методом изомолярных серий определены границы синергетной экстракции нитрата лантана и нитрата церия(III) из растворов, содержащих 0.88 М La(NO3)3 или 1.0 М Ce(NO3)3, 0.01 М HNO3, 4.0 М NH4NO3, соответственно, 1.0 М изомолярными смесями ТОМАН–ТБФ в толуоле, простирающиеся от состава 0.15 М ТОМАН–0.85 М ТБФ до состава 0.9 М ТОМАН–0.1 М ТБФ для лантана и от 0.2 М ТОМАН–0.8 М ТБФ до 0.7 М ТОМАН–0.3 М ТБФ для церия(III). В отличие от известных литературных данных об экстракции лантана и церия(III) преимущественно в форме одного или двух смешанных комплексов с нитратом ЧАО + ТБФ, впервые химия экстракции в установленной области проявления синергетного эффекта определена как непрерывная последовательность экстрагируемых смешанных комплексов состава (R4N)n[Ln(NO3)3 +n ⋅ mТБФ], где n = = 1–3, m = 3–1 для лантана и n = 1–3, m = 4–1 для церия(III) в зависимости от соотношения ТОМАН–ТБФ. С ростом концентрации ТОМАН в смеси фосфорильные лиганды ТБФ замещаются нитратными лигандами ТОМАН вплоть до полного вытеснения ТБФ из координационной сферы лантана или церия(III). Этот процесс сопровождается повышением зарядности образующихся анионных нитратных комплексов от одно- до трехзарядного и понижением сольватного числа ТБФ от 3–4 до 1. При значительном избытке ТБФ в смесях с ТОМАН наблюдается антагонистический эффект экстракции лантана и церия(III), обусловленный сольватацией ТОМАН молекулами ТБФ и понижением его термодинамической активности в экстракционном процессе.
Работа выполнена при финансовой поддержке Минобрнауки России (соглашение о предоставлении гранта № 075-15-2020-782).
ОБОЗНАЧЕНИЯ
ИНДЕКСЫ
Список литературы
Косынкин В.Д., Сарычев Г.А., Селивановский А.К., Трубаков Ю.М., Федулова Г.Т. Технология получения индивидуальных редкоземельных элементов (РЗЭ) из суммарного концентрата, выделенного из монацита, основанная на отечественных экстрагентах // V Международная конференция-школа по химической технологии ХТ'16: сб. тез. докл. сателл. конф. ХХ Мендел. съезда по общ. и прикл. химии. 16–20 мая 2016 г.: в 3 т. Волгоград: ВолгГТУ, 2016. Т. 1. С. 124.
Вальков А.В., Сергиевский В.В. Смеси фосфорорганических экстрагентов с нитратом метилтриалкиламмония в технологии самария, гадолиния, тербия и эрбия // Перспективы добычи, производства и применения РЗМ: тез. докл. 1-й Всеросс. науч.-практ. конф. 26–27 сентября 2011 г. М.: ВНИИХТ, 2011. С. 1.
Степанов С.И., Чекмарев А.М. Экстракция редких металлов солями четвертичных аммониевых оснований. М.: ИздАТ, 2004.
Пяртман А.К., Копырин А.А., Ковалев С.В., Кескинов В.А. Влияние разбавителей на процессы экстракции нитратов лантанидов(III) и иттрия(III) нитратами четвертичных аммониевых оснований и три-н-бутилфосфатом // Проблемы комплексного использования руд. Тез. докл. 2-го Межд. симп. СПб., 1996. С. 244.
Копырин А.А., Пяртман А.К. Закономерности распределения лантанидов(III) в многокомпонентных системах при использовании экстрагентов различных классов и их смесей // 11-я Российская конференция по экстракции. Тез. докл. М., 1998. С. 133.
Бусев А.И., Типцова В.Г., Иванов В.М. Руководство по аналитической химии редких элементов. М.: Химия, 1978.
Румшиский Л.З. Математическая обработка результатов эксперимента. Справочное руководство. М.: Наука, 1971.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


