Теоретические основы химической технологии, 2021, T. 55, № 2, стр. 210-215
Линейные концентрационные и температурные законы сохранения в открытом безградиентном химическом реакторе
Н. И. Кольцов *
Чувашский государственный университет им. И.Н. Ульянова
Чебоксары, Россия
* E-mail: koltsovni@mail.ru
Поступила в редакцию 25.05.2020
После доработки 25.11.2020
Принята к публикации 27.11.2020
Аннотация
Найдены новые линейные концентрационные и температурные законы сохранения для химических реакций, протекающих по нелинейным механизмам в открытом неизотермическом реакторе идеального смешения. Такие законы связывают нестационарные значения концентраций и температуры с начальными условиями и тепловыми эффектами реакций и могут использоваться для идентификации механизмов химических реакций.
ВВЕДЕНИЕ
Линейные законы сохранения (ЛЗС) представляют собой комбинации нестационарных значений концентраций реагентов, температуры и других параметров реакции, сохраняющие постоянные значения в течение всей реакции (автономные инварианты). К настоящему времени известно [1–6], что в закрытом неизотермическом реакторе идеального смешения (НРИС) всегда выполняются концентрационные стехиометрические ЛЗС (ЛСЗС), число которых равно числу различных (независимых) атомов реагентов. Кроме ЛСЗС, в закрытом реакторе могут выполняться и более сложные концентрационные кинетические ЛЗС (ЛКЗС), зависящие от особенностей кинетики химической реакции. В закрытых системах могут выполняться и температурные ЛЗС (ЛТЗС). В открытых идеальных системах, из-за переменного потока реагентов, эти закономерности нарушаются и ЛЗС могут вообще отсутствовать. Поэтому, обнаружить ЛЗС, в особенности – температурные, в открытых системах сложнее и в настоящее время механизмы их формирования и методы установления не известны. В связи с этим целью данной работы является разработка метода установления концентрационных и температурных ЛЗС в сложных химических реакциях, протекающих по линейным и нелинейным механизмам в открытом НРИС. Идея метода состоит в использовании двух или более дифференциальных соотношений, которые являются обобщением аналогичных ЛЗС в закрытых системах. Эти соотношения представляют собой обыкновенные линейные дифференциальные уравнения, которые интегрируются аналитически и позволяют получать новые концентрационные и температурные законы сохранения.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Пусть химическая реакция протекает через нелинейные стадии вида
(1)
${{\Sigma }_{j}}{{a}_{{ij}}}{{{\text{А}}}_{j}} \Leftrightarrow {{\Sigma }_{j}}{{a}_{{ - ij}}}{{{\text{А}}}_{j}},\,\,\,i = 1, \ldots ,\,s,$(2)
$\begin{gathered} A_{j}^{'} = {{\Sigma }_{i}}({{a}_{{ - ij}}} - {{a}_{{ij}}})({{r}_{i}} - {{r}_{{ - i}}}) + {{q}_{0}}{{A}_{{0j}}}--q{{A}_{j}},\,\,j = 1,\, \ldots ,\,n, \\ T{\kern 1pt} ' = \beta {{\Sigma }_{i}}({{r}_{{i~}}} - {{r}_{{ - i}}})Q_{i}^{*} + \alpha \left( {{{T}_{x}}--T} \right) + {{q}_{0}}{{T}_{0}}--qT, \\ \end{gathered} $(3)
$\begin{gathered} A_{j}^{'} = {{\Sigma }_{i}}({{a}_{{ - ij}}} - {{a}_{{ij}}})({{r}_{i}} - {{r}_{{ - i}}}) + {{q}_{0}}{{A}_{{0j}}}--q{{A}_{j}},\,\,j = 1,\, \ldots ,\,n, \\ \theta {\kern 1pt} ' = {{\Sigma }_{i}}({{r}_{i}}--{{r}_{{ - i}}}){{Q}_{i}} + \alpha ({{\theta }_{x}}--\theta ) + {{q}_{0}}{{\theta }_{0}}--q\theta , \\ \end{gathered} $(4)
${{\Sigma }_{j}}{{\alpha }_{{mj}}}{{A}_{j}}_{{}} = {{C}_{m}},\,\,\,m = 1,{\text{ }}2,\,\, \ldots ,\,\,N,$(5)
${{\Sigma }_{j}}{{\beta }_{{kj}}}{{A}_{j}}_{{}} + \theta = {{C}_{k}},\,\,\,k = 1,{\text{ }}2,\,\, \ldots ,$При q ≠ q0уравнения (1)–(3) перестают описывать закрытый НРИС, и алгебраические ЛЗС вида (4)–(5) не выполняются и замещаются более общими дифференциальными соотношениями
(6)
${{\Sigma }_{j}}{{\alpha }_{{mj}}}A_{j}^{'} = {{q}_{0}}{{\Sigma }_{j}}{{\alpha }_{{mj}}}{{A}_{{0j}}} - q{{\Sigma }_{j}}{{\alpha }_{{mj}}}{{A}_{j}},\,\,\,{{m}_{j}} = 1,\,\,2,\,\, \ldots ,$(7)
$\begin{gathered} {{\Sigma }_{j}}{{\beta }_{{kj}}}A_{j}^{'} + \theta {\kern 1pt} ' = {{q}_{0}}({{\Sigma }_{j}}{{\beta }_{{kj}}}{{A}_{{0j}}} + {{\theta }_{0}}) - \hfill \\ - \,\,q({{\Sigma }_{j}}{{\beta }_{{kj}}}{{A}_{j}} + \theta ),\,\,\,{{k}_{j}} = 1,2, \ldots \,\,. \hfill \\ \end{gathered} $Эти соотношения являются линейными ОДУ относительно комбинаций реагентов и температуры, и, поэтому, интегрируются аналитически
(8)
$\begin{gathered} q{{\Sigma }_{j}}{{\alpha }_{{mj}}}{{A}_{j}} = {{\Sigma }_{j}}{{\alpha }_{{mj}}}{{A}_{{0j}}} \times \\ \times \,\,[{{q}_{0}} + (q--{{q}_{0}})\exp (--qt)],\,\,\,{{m}_{j}} = 1,2,\,\, \ldots , \\ \end{gathered} $(9)
$\begin{gathered} q({{\Sigma }_{j}}{{\beta }_{{kj}}}{{A}_{j}} + \theta ) = ({{\Sigma }_{j}}{{\beta }_{{kj}}}{{A}_{{0j}}} + {{\theta }_{0}}) \times \\ \times \,\,[{{q}_{0}} + (q--{{q}_{0}})\exp (--qt)],\,\,\,{{k}_{j}} = 1,\,\,2,\,\, \ldots \,\,. \\ \end{gathered} $Эти равенства, рассмотренные попарно (обозначим номера этих пар индексами mj1, mj2), позволяют исключить из них время и получить не зависящие от времени новые концентрационные и температурные ЛЗС для открытого реактора
(10)
$\begin{gathered} {{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{j1}}}{{\Sigma }_{{j2}}}{{\alpha }_{{mj2}}}{{A}_{{0j2}}} = \\ = \,\,{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{0j1}}}{{\Sigma }_{{j2}}}{{a}_{{mj2}}}{{A}_{{j2}}},{{m}_{{j1}}},\,\,\,{{m}_{{j2}}} = 1,\,\,2,\,\, \ldots , \\ \end{gathered} $(11)
$\begin{gathered} {{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{j1}}}({{\Sigma }_{{j2}}}{{\beta }_{{kj2}}}{{A}_{{0j2}}} + {{\theta }_{0}}) = \\ = \,\,{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{0j1}}}({{\Sigma }_{{j2}}}{{\beta }_{{kj2}}}{{A}_{{j2}}} + \theta ),\,\,\,{{m}_{{j1}}},\,\,\,{{m}_{{j2}}} = 1,2,\,\, \ldots \,\,. \\ \end{gathered} $Эти ЛЗС зависят только от стехиометрии и тепловых эффектов стадий, концентраций реагентов и температуры, но не зависят от констант скоростей стадий. Это позволяет использовать их для решения обратных задач по идентификации механизмов химических реакций [13–19].
На практике ЛЗС (10)–(11) удобнее использовать в следующем эквивалентном виде (с постоянными правыми частями)
(12)
$\begin{gathered} {{K}_{m}}(t) \equiv {{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{{{{{A}_{{j1}}}} \mathord{\left/ {\vphantom {{{{A}_{{j1}}}} \Sigma }} \right. \kern-0em} \Sigma }}_{{j2}}}{{\alpha }_{{mj2}}}{{A}_{{j2}}} = \\ = \,\,{{{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{0j1}}}} \mathord{\left/ {\vphantom {{{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{0j1}}}} {{{\Sigma }_{{j2}}}}}} \right. \kern-0em} {{{\Sigma }_{{j2}}}}}{{\alpha }_{{mj2}}}{{A}_{{0j2}}},\,\,\,m = 1,\,\,2,\,\, \ldots , \\ \end{gathered} $(13)
$\begin{gathered} {{L}_{k}}(t) \equiv {{{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{j1}}}} \mathord{\left/ {\vphantom {{{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{j1}}}} {({{\Sigma }_{j}}_{2}{{\beta }_{{kj}}}_{2}{{A}_{j}}_{2} + \theta )}}} \right. \kern-0em} {({{\Sigma }_{j}}_{2}{{\beta }_{{kj}}}_{2}{{A}_{j}}_{2} + \theta )}} = \\ = \,\,{{{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{0j1}}}} \mathord{\left/ {\vphantom {{{{\Sigma }_{{j1}}}{{\alpha }_{{mj1}}}{{A}_{{0j1}}}} {({{\Sigma }_{{j2}}}{{\beta }_{{kj2}}}{{A}_{{0j2}}} + {{\theta }_{0}})}}} \right. \kern-0em} {({{\Sigma }_{{j2}}}{{\beta }_{{kj2}}}{{A}_{{0j2}}} + {{\theta }_{0}})}},\,\,\,k = 1,\,\,2,\,\, \ldots \,\,. \\ \end{gathered} $Для экспериментальной проверки этих ЛЗС достаточно измерить значения нестационарных концентраций реагентов и температуры в различные моменты времени и подставить их в выражения (12)–(13). Если при этом будут получены тождества (с учетом ошибок измерений), то предполагаемый механизм реакции может быть принят как возможный.
ВЫЧИСЛИТЕЛЬНЫЙ ЭКСПЕРИМЕНТ
Применим приведенные выше результаты к конкретным реакциям.
Пример 1. Пусть реакция А ⇔ С + D протекает по схеме
(1.1)
$1)\,\,\,{\text{A}} \Leftrightarrow {\text{B}},\,\,\,2)\,\,\,{\text{B}} \Leftrightarrow {\text{C}} + {\text{D}}.$Найдем ЛЗС вида (12)–(13) для этой реакции в открытом НРИС. Запишем для нее модель (3):
(1.2)
$\begin{gathered} A' = --{{r}_{1}} + {{r}_{{ - 1}}} + {{q}_{0}}{{A}_{0}}--qA, \\ B' = {{r}_{1}}--{{r}_{{ - 1}}}--{{r}_{2}} + {\text{ }}{{r}_{{ - 2}}} + {{q}_{0}}{{B}_{0}}--qB, \\ \end{gathered} $(1.3)
$\begin{gathered} C' = {{r}_{2}}--{{r}_{{ - 2}}} + {{q}_{0}}{{C}_{0}}--qC, \\ D' = {{r}_{2}}--{{r}_{{ - 2}}} + {{q}_{0}}{{D}_{0}}--qD, \\ \end{gathered} $(1.4)
$\begin{gathered} \theta ' = {{Q}_{1}}({{r}_{1}}--{{r}_{ - }}_{1}) + {{Q}_{2}}({{r}_{2}}--{{r}_{ - }}_{2}) + \\ + \,\,\alpha ({{\theta }_{x}}--\theta ) + {{q}_{0}}{{\theta }_{0}}--q\theta , \\ \end{gathered} $Если при этом α = 0 (идеальный закрытый НРИС), то выполняется еще один независимый температурный ЛЗС вида (5):
В открытом НРИС (q ≠ q0) ЛЗС (1.5)–(1.6) нарушаются, но выполняются более общие дифференциальные соотношения вида (6)–(7):
(1.7)
$\begin{gathered} A' + B'\,\, + С' = \\ = \,\,{{q}_{0}}({{A}_{0}} + {{B}_{0}} + {{С}_{0}})--q(A + B + С), \\ \end{gathered} $(1.9)
$\begin{gathered} {{Q}_{1}}A'\,\,--{{Q}_{2}}C'\,\, + q' = \\ = \,\,{{q}_{0}}({{Q}_{1}}{{A}_{0}}--{{Q}_{2}}{{C}_{0}} + {{q}_{0}})--q({{Q}_{1}}A--{{Q}_{2}}C + \theta ). \\ \end{gathered} $Проинтегрируем эти уравнения и получим соответственно
(1.10)
$\begin{gathered} q(A + B + С) = {{q}_{0}}({{A}_{0}} + {{B}_{0}} + {{С}_{0}}) + \hfill \\ + \,\,\left( {q--{{q}_{0}}} \right)({{A}_{0}} + {{B}_{0}} + {{С}_{0}})\exp \left( {--qt} \right), \hfill \\ \end{gathered} $(1.11)
$\begin{gathered} q(С--D) = {{q}_{0}}\left( {{{C}_{0}}--{{D}_{0}}} \right) + \\ + \,\,\left( {q--{{q}_{0}}} \right)\left( {{{C}_{0}}--{{D}_{0}}} \right)\exp \left( {--qt} \right), \\ \end{gathered} $(1.12)
$\begin{gathered} q({{Q}_{1}}A--{{Q}_{2}}C + \theta ) = {{q}_{0}}({{Q}_{1}}{{A}_{0}}--{{Q}_{2}}{{C}_{0}} + {{\theta }_{0}}) + \\ + \,\,\left( {q--{{q}_{0}}} \right)({{Q}_{1}}{{A}_{0}}--{{Q}_{2}}{{C}_{0}} + {{\theta }_{0}})\exp \left( {--qt} \right). \\ \end{gathered} $Исключим из (1.10)–(1.12) время t и получим один независимый концентрационный ЛЗС в форме (10):
(1.13)
$\begin{gathered} (A + B + С)({{C}_{0}}--{{D}_{0}}) = \\ = \,\,(С--D)({{A}_{0}} + {{B}_{0}} + {{С}_{0}}), \\ \end{gathered} $и один независимый температурный ЛЗС в форме (11):
(1.14)
$\begin{gathered} (A + B + С)({{Q}_{1}}{{A}_{0}}--{{Q}_{2}}{{C}_{0}} + {{\theta }_{0}}) = \\ = \,\,({{Q}_{1}}A--{{Q}_{2}}C + \theta )({{A}_{0}} + {{B}_{0}} + {{С}_{0}}). \\ \end{gathered} $Эти же ЛЗС удобно переписать в форме (12)–(13):
(1.15)
$\begin{gathered} K\left( t \right) \equiv {{(С--D)} \mathord{\left/ {\vphantom {{(С--D)} {(A + B + С)}}} \right. \kern-0em} {(A + B + С)}} = \\ = \,\,{{\left( {{{C}_{0}}--{{D}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{C}_{0}}--{{D}_{0}}} \right)} {({{A}_{0}} + {{B}_{0}} + {{С}_{0}})}}} \right. \kern-0em} {({{A}_{0}} + {{B}_{0}} + {{С}_{0}})}}, \\ \end{gathered} $(1.16)
$\begin{gathered} L\left( t \right) \equiv {{({{Q}_{1}}A--{{Q}_{2}}C + \theta )} \mathord{\left/ {\vphantom {{({{Q}_{1}}A--{{Q}_{2}}C + \theta )} {(A + B + С)}}} \right. \kern-0em} {(A + B + С)}} = \\ = \,\,{{({{Q}_{1}}{{A}_{0}}--{{Q}_{2}}{{C}_{0}} + {{\theta }_{0}})} \mathord{\left/ {\vphantom {{({{Q}_{1}}{{A}_{0}}--{{Q}_{2}}{{C}_{0}} + {{\theta }_{0}})} {({{A}_{0}} + {{B}_{0}} + {{С}_{0}})}}} \right. \kern-0em} {({{A}_{0}} + {{B}_{0}} + {{С}_{0}})}}. \\ \end{gathered} $Графическая иллюстрация этих ЛЗС при q0 = 1, q = 0.9, A0 = 1, B0 = 0, C0 = 0, D0 = 0, T0 = 300, Tx = T0, R = 8.314, $Q_{1}^{*}$ = 10000, $Q_{2}^{*}$ = 20000, E1 = 10000, E−1 = = 20 000, E2 = 10 000, E−2 = 30 000, α = 0, β = 0.03 приведена на рис. 1.
Рис. 1.
Концентрационный и температурный ЛЗС, зависимости концентраций реагентов и температуры от времени для реакции (1.1): 1 – K(t), 2 – L(t), 3 – A(t), 4 – C(t), 5 – T(t)/T0.
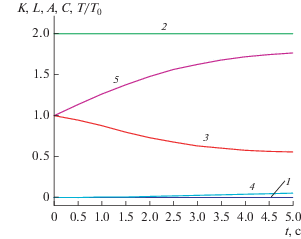
Покажем, как можно использовать эти ЛЗС для решения обратных задач. Предположим, что для реакции, протекающей по схеме (1.1) , в моменты времени, например, t = 0.5, 1 и 1.5 по рис. 1 с погрешностью ε = 0.05 (5%) определены нестационарные концентрации реагентов A = (0.95, 0.90, 0.80), B = (0.10, 0.20, 0.30), C = (0.00, 0.00, 0.01), D = (0.03, 0.08, 0.01) и соответствующие температуры θ = (1.15, 1.30, 1.40). Подставим эти данные в (1.15)–(1.16) и найдем расчетные значения концентрационного Kрасч = (–0.03, –0.07, 0.00) и температурного Lрасч = (2.00, 2.00, 1.96) ЛЗС. Поэлементно сравним их с соответствующими теоретическими (точными) значениями K = (0.00, 0.00, 0.00) и L = (2.00, 2.00, 2.00). Поскольку |K – Kрасч| ≤ 0.07, |L – Lрасч| ≤ 0.04, то механизм (1.1) согласуется с концентрационным и температурным ЛЗС с ошибками 7% и 4% соответственно.
Рассмотрим для реакции А ⇔ С + D альтернативный механизм
Запишем для него модель (3):
Пример 2. Реакция H2 + 1/2O2 ⇔ H2O протекающая по схеме
(2.1)
$\begin{gathered} 1)\,\,\,{{{\text{H}}}_{2}} \Leftrightarrow 2{\text{H}}*,\,\,\,\,2)\,\,\,{{{\text{O}}}_{2}} \Leftrightarrow 2{\text{O}}*, \\ 3)\,\,\,2{\text{H}}* + \,\,{\text{O}}* \Leftrightarrow {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $в открытом НРИС описывается системой ОДУ (3):
(2.2)
$\begin{gathered} A' = --{{r}_{1}} + {{r}_{ - }}_{1} + {{q}_{0}}{{A}_{0}}--qA, \\ B' = --{{r}_{2}} + {{r}_{{ - 2}}} + {{q}_{0}}{{B}_{0}}--qB, \\ \end{gathered} $(2.3)
$\begin{gathered} C' = {{r}_{3}}--{{r}_{{ - 3}}} + {{q}_{0}}{{C}_{0}}--qC, \\ D' = 2{{r}_{1}}--2{{r}_{ - }}_{1}--2{{r}_{3}} + 2{{r}_{{ - 3}}} + {{q}_{0}}{{D}_{0}}--qD, \\ \end{gathered} $(2.5)
$\begin{gathered} \theta ' = {{Q}_{1}}({{r}_{1}}--{{r}_{ - }}_{1}) + {{Q}_{2}}({{r}_{2}}--{{r}_{ - }}_{2}) + \\ + \,\,{{Q}_{3}}({{r}_{3}}--{{r}_{ - }}_{3}) + a({{\theta }_{x}}--\theta ) + {{q}_{0}}{{\theta }_{0}}--q\theta , \\ \end{gathered} $В идеальном закрытом НРИС выполняется и температурный ЛЗС вида (5):
В открытом НРИС выполняются соотношения вида (6)–(7):
(2.8)
$\begin{gathered} 2B'\,\, + C' + E' = \\ = \,\,{{q}_{0}}\left( {2{{B}_{0}} + {{C}_{0}} + {{E}_{0}}} \right)--q\left( {2B + C + E} \right), \\ \end{gathered} $(2.9)
$\begin{gathered} 2A'\,\, + 2C' + D' = \\ = \,\,{{q}_{0}}\left( {2{{A}_{0}} + 2{{C}_{0}} + {{D}_{0}}} \right)--q\left( {2A + 2C + D} \right), \\ \end{gathered} $(2.10)
$\begin{gathered} {{Q}_{1}}A'\,\, + {{Q}_{2}}B'\,\,--{{Q}_{3}}C'\,\, + \theta ' = \\ = \,\,{{q}_{0}}({{Q}_{1}}{{A}_{0}} + {{Q}_{2}}{{B}_{0}}--{{Q}_{3}}{{C}_{0}} + {{\theta }_{0}})-- \\ - \,\,q({{Q}_{1}}A + {{Q}_{2}}B--{{Q}_{3}}C + \theta ). \\ \end{gathered} $Проинтегрируем эти уравнения и получим соответственно
(2.11)
$\begin{gathered} q(2A + 2С + D) = \\ = \,\,(2{{A}_{0}} + 2{{С}_{0}} + {{D}_{0}})\left[ {{{q}_{0}} + \left( {q--{{q}_{0}}} \right)\exp \left( {--qt} \right)} \right], \\ \end{gathered} $(2.12)
$\begin{gathered} q\left( {2B + C + E} \right) = \left( {2{{B}_{0}} + {{C}_{0}} + {{E}_{0}}} \right) \times \\ \times \,\,\left[ {{{q}_{0}} + \left( {q--{{q}_{0}}} \right)\exp \left( {--qt} \right)} \right], \\ \end{gathered} $(2.13)
$\begin{gathered} q({{Q}_{1}}A + {{Q}_{2}}B--{{Q}_{3}}C + \theta ) = \\ = \,\,({{Q}_{1}}{{A}_{0}} + {{Q}_{2}}{{B}_{0}}--{{Q}_{3}}{{C}_{0}} + {{\theta }_{0}}) \times \\ \times \,\,\left[ {{{q}_{0}} + \left( {q--{{q}_{0}}} \right)\exp \left( {--qt} \right)} \right]. \\ \end{gathered} $Исключим время t из уравнений (2.11)–(2.13) и найдем концентрационный и температурный ЛЗС
(2.14)
$\begin{gathered} \left( {2A + 2C + D} \right)\left( {2{{B}_{0}} + {{C}_{0}} + {{E}_{0}}} \right) = \\ = \,\,\left( {2B + C + E} \right)\left( {2{{A}_{0}} + 2{{C}_{0}} + {{D}_{0}}} \right), \\ \end{gathered} $(2.15)
$\begin{gathered} \left( {2A + 2C + D} \right)({{Q}_{1}}{{A}_{0}} + {{Q}_{2}}{{B}_{0}}--{{Q}_{3}}{{C}_{0}} + {{\theta }_{0}}) = \\ = \,\,({{Q}_{1}}A + {{Q}_{2}}B--{{Q}_{3}}C + \theta )(2{{A}_{0}} + 2{{С}_{0}} + {{D}_{0}}). \\ \end{gathered} $Запишем эти ЛЗС в форме (12)–(13):
(2.16)
$\begin{gathered} K\left( t \right) \equiv {{\left( {2A + 2C + D} \right)} \mathord{\left/ {\vphantom {{\left( {2A + 2C + D} \right)} {}}} \right. \kern-0em} {}}\left( {2B + C + E} \right) = \\ = \,\,{{\left( {2{{A}_{0}} + 2{{C}_{0}} + {{D}_{0}}} \right)} \mathord{\left/ {\vphantom {{\left( {2{{A}_{0}} + 2{{C}_{0}} + {{D}_{0}}} \right)} {\left( {2{{B}_{0}} + {{C}_{0}} + {{E}_{0}}} \right)}}} \right. \kern-0em} {\left( {2{{B}_{0}} + {{C}_{0}} + {{E}_{0}}} \right)}}, \\ \end{gathered} $(2.17)
$\begin{gathered} L\left( t \right) \equiv {{(2A{\text{ }} + 2C + D)} \mathord{\left/ {\vphantom {{(2A{\text{ }} + 2C + D)} {({{Q}_{1}}A + {{Q}_{2}}B - {{Q}_{3}}C + \theta )}}} \right. \kern-0em} {({{Q}_{1}}A + {{Q}_{2}}B - {{Q}_{3}}C + \theta )}} = \\ = \,\,{{(2{{A}_{0}} + 2{{С}_{0}} + {{D}_{0}})} \mathord{\left/ {\vphantom {{(2{{A}_{0}} + 2{{С}_{0}} + {{D}_{0}})} {({{Q}_{1}}{{A}_{0}} + {{Q}_{2}}{{B}_{0}} - {{Q}_{3}}{{C}_{0}} + {{\theta }_{0}})}}} \right. \kern-0em} {({{Q}_{1}}{{A}_{0}} + {{Q}_{2}}{{B}_{0}} - {{Q}_{3}}{{C}_{0}} + {{\theta }_{0}})}}. \\ \end{gathered} $Эти ЛЗС при q0 = 1, q = 0.9, A0 = 0.5, B0 = 0.5, C0 = 0, D0 = 0, E0 = 0, T0 = 300, Tx = T0, R = 8.314, $Q_{{\text{1}}}^{*}$ = 10 000, $Q_{{\text{2}}}^{*}$ = 10 000, $Q_{{\text{3}}}^{*}$ = 10 000, E1 = 10 000, E−1 = 20 000, E2 = 10 000, E−2 = 20 000, E3 = 10 000, E−3 = 20 000, α = 0, β = 0.03 приведены на рис. 2.
Рис. 2.
Концентрационный и температурный ЛЗС, зависимости концентраций реагентов и температуры от времени для реакции (2.1): 1 – K(t), 2 – L(t), 3 – A(t), 4 – B(t), 5 – C(t), 6 – T(t)/T0.
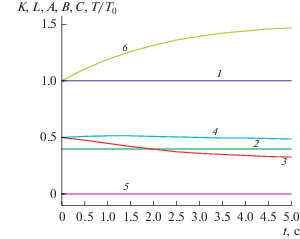
Применим ЛЗС (2.16)–(2.17) и данные рис. 2 для решения обратной задачи. Определим в моменты времени, например, t = 0.5, 1.0 и 1.5 с погрешностью ε = 0.1 (10%) значения концентраций реагентов A = (0.50, 0.45 и 0.40), B = (0.50, 0.50 и 0.50), C = (0.00, 0.00 и 0.01), D = (0.10, 0.20 и 0.25), E = (0.00, 0.05 и 0.10) и температуру θ = (1.10, 1.20 и 1.30). Подставим эти значения в (2.16)–(2.17) и найдем расчетные значения концентрационного Kрасч = (1.10, 1.0476, 0.9640) и температурного Lрасч = (0.4151, 0.4000, 0.3863) ЛЗС. Поэлементно сравним их с теоретическими значениями K = = (1.00, 1.00, 1.00) и L = (0.40, 0.40, 0.40) и получим |K – Kрасч| ≤ 0.10, |L – Lрасч| ≤ 0.02. Следовательно, механизм (2.1) согласуется с концентрационным и температурным ЛЗС (2.16)–(2.17) с ошибками 10 и 2% соответственно.
Рассмотрим для той же реакции H2 + 1/2O2 ⇔ ⇔ H2O альтернативный необратимый механизм
Динамика этой реакции описывается уравнениями (2.2)–(2.5) при r−1 = r−2 = r−3 = 0. Проинтегрируем эти уравнения численно и примем их решения за экспериментальные данные. “Измерим” в моменты времени t = 0.5, 1 и 1.5 с погрешностью ε = 0.01 (10%) концентрации A = (0.50, 0.45, 0.40), B = (0.50, 0.50, 0.50), C = (0.00, 0.00, 0.00), D = = (0.10, 0.20, 0.25)), E = (0.00, 0.05, 0.10) и температуру θ = (1.10, 1.20, 1.30). Подставим эти данные в (2.16)–(2.17) и найдем Kрасч = (1.09, 1.04, 0.95) и Lрасч = (0.41, 0.41, 0.39). Поэлементно сравним их с теоретическими значениями K = (1.00, 1.00, 1.00) и L = (0.40, 0.40, 0.40) и получим |K – Kрасч| ≤ ≤ 0.09 (9%), |L – Lрасч| ≤ 0.01 (1%). Следовательно, механизм (2.1*) лучше согласуется с концентрационным и температурным ЛСЗ (2.16)–(2.17), чем механизм (2.1).
ЗАКЛЮЧЕНИЕ
Приведен метод определения новых типов линейных концентрационных и температурных законов сохранения химических реакций, которые можно наблюдать в открытом реакторе идеального смешения. Методы установления и исследования таких законов для открытых систем в литературе не описаны. Новизна предлагаемого в данной статье метода состоит в возможности получения точных аналитических выражений для линейных концентрационных и температурных законов сохранения химических реакций. Нахождение таких законов позволяет априори получать новую информацию о нестационарных характеристиках изучаемого процесса, которая может быть проверена экспериментально. Найденные с помощью предложенного в работе метода законы сохранения зависят только от стехиометрических и тепловых, но не зависят от кинетических параметров реакции. Полученные результаты расширяют набор инвариантных и релаксационных характеристик реакций и могут быть использованы при решении обратных задач химической кинетики, связанных с идентификацией механизмов химических реакций.
Автор выражает благодарность В.Х. Федотову за обсуждение работы.
ОБОЗНАЧЕНИЯ
| Aj | концентрации реагентов, мол. д. |
| $A_{j}^{0}$ | концентрации реагентов на входе реактора, мол. д. |
| aij | безразмерные стехиометрические коэффициенты прямых стадий |
| a−ij | безразмерные стехиометрические коэффициенты обратных стадий |
| Cm, Ck | безразмерные константы нормирования |
| Ср | удельная теплоемкость реакционной смеси, Дж/(моль К) |
| Ei | энергии активации прямых стадий, Дж/моль |
| E−i | энергии активации обратных стадий, Дж/моль |
| Km | безразмерные концентрационные ЛЗС |
| ki | константы скоростей прямых стадий, 1/с |
| k−i | константы скоростей обратных стадий, 1/с |
| ki0 | предэкспоненты констант скоростей прямых стадий, 1/с |
| k−i0 | предэкспоненты констант скоростей обратных стадий, 1/с |
| Lk | безразмерные температурные ЛЗС |
| M | молекулярная масса, кг/моль |
| N | число независимых реагентов |
| n | число реагентов |
| P | ранг матрицы стехиометрических коэффициентов |
| Qi | тепловые эффекты стадий, Дж/моль |
| q | скорость потока реакционной смеси, 1/c |
| R | газовая постоянная, Дж/(моль К) |
| ri | скорости прямых стадий, 1/с |
| r−i | скорости обратных стадий, 1/с |
| S | площадь поверхности теплообмена, м2 |
| T | температура реакционной смеси, К |
| Tx | температура стенки реактора, К |
| t | время, с |
| V | объем реактора, м3 |
| α ≡ ≡ βγSM/(ρV) | комбинированный параметр, 1/с |
| αmj | безразмерные константы, зависящие от стехиометрии стадий |
| β | величина, равная 1/Cp, (моль К)/Дж |
| βkj | безразмерные константы, зависящие от температурных параметров стадий реакции |
| γ | коэффициент теплопередачи через стенку реактора, Дж/(с м2 К) |
| ε | погрешность измерений |
| θ | безразмерная температура реакционной смеси |
| θx | безразмерная температура стенки реактора |
| ρ | плотность реакционной смеси, кг/м3 |
ИНДЕКСЫ
Список литературы
Гиббс Дж. Термодинамические работы. М.: ГИТЛ, 1950.
Корзухин М.Д. Линейные законы сохранения в химической кинетике // Журн. физ. хим. 1972. Т. 46. № 7. С. 1845.
Вольперт А.И., Худяев С.И. Анализ в классах разрывных функций и уравнения математической физики. М.: Наука, 1975.
Яблонский Г.С., Быков В.И., Горбань А.Н. Кинетические модели реакций. Новосибирск: Наука, 1983.
Алексеев Б.В., Кольцов Н.И., Федотов В.Х. Линейные инварианты в формальной кинетике химических реакций // Журн. физ. хим. 1992. Т. 66. № 12. С. 3219.
Кольцов Н.И. Математическое моделирование каталитических реакций. Чебоксары: Чувашский университет, 2007.
Арис Р. Анализ процессов в химических реакторах. Л.: Химия, 1967.
Вольтер Б.В., Сальников И.Е. Устойчивость режимов работы химических реакторов. М.: Химия, 1981.
Франк-Каменецкий Д.А. Основы макрокинетики. Диффузия и теплопередача в химической кинетике. М.: Интеллект, 2008.
Быков В.И., Цыбенова С.Б. Нелинейные модели химической кинетики. М.: URSS, 2011.
Островский Г.М., Зиятдинов Н.Н., Лаптева Т.В. Оптимизация технических систем. М.: КНОРУС, 2012.
Ziyatdinov N.N. Modeling and Optimization of Chemical-Technological Processes and Systems // Theor. Found. Chem. Eng. 2017. V. 51. № 5. P. 889. [Зиятдинов Н.Н. Моделирование и оптимизация химико-технологических процессов и систем // Теор. осн. хим. технол. 2017. Т. 51. № 5. С. 546.]
Исмагилова А.С., Спивак С.И. Обратные задачи химической кинетики, Saarbrücken: Lambert Academic, 2013.
Aster R.C., Borchers B., Thurber C.H. Parameter estimation and inverse problems. N.Y.: Elsevier, 2013.
Pisarenko E.V., Pisarenko V.N. Analysis and simulation of the nonlinear kinetics of reacting chemical systems // Theor. Found. Chem. Eng. 2013. V. 47. № 2. P. 128. [Писаренко Е.В., Писаренко В.Н. Анализ и моделирование нелинейной кинетики химических реагирующих систем // Теор. осн. хим. технол. 2013. Т. 47. № 2. С. 173.]
Shatalov M.Yu., Fedotov S.I., Shatalov Yu.M. New methods of determination of kinetic parameters of theoretical models from experimental data // Theor. Found. Chem. Eng. 2013. V. 47. № 3. P. 207. [Шаталов М.Ю., Федотов С.И., Шаталов Ю.М. Новый метод определения кинетических параметров теоретических моделей на основе экспериментальных данных // Теор. осн. хим. технол. 2013. Т. 47. № 3. С. 260.]
Katsman E.A., Sokolova I.V., Temkin O.N. Solution of the reverse kinetic problem for oscillatory reactions // Theor. Found. Chem. Eng. 2014. V. 48. № 2. P. 175. [Кацман Е.А., Соколова И.В., Темкин О.Н. Решение обратной кинетической задачи для колебательных реакций // Теор. осн. хим. технол. 2014. Т. 48. № 2. С. 190.]
Shatalov M.Yu., Demidov A.S., Fedotov I.A. Estimating the parameters of chemical kinetics equations from the partial information about their solution // Theor. Found. Chem. Eng. 2016. V. 50. № 2. P. 148. [Шаталов М.Ю., Демидов А.С., Федотов И.А. Оценка параметров уравнений химической кинетики по частичной информации об их решении // Теор. осн. хим. технол. 2016. Т. 50. № 2. С. 153.]
Sahibgareeva M.V. Interval algorithm for the global search of uncertainty domains in simulating the kinetics of complex chemical reactions // Theor. Found. Chem. Eng. 2019. V. 53. № 3. P. 389. [Сахибгареева М.В. Интервальный алгоритм глобального поиска областей неопределенности при моделировании кинетики сложных химических реакций // Теор. осн. хим. технол. 2019. Т. 53. № 3. С. 302.]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


