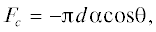Теоретические основы химической технологии, 2021, T. 55, № 3, стр. 367-374
Агрегативная устойчивость наноразмерных частиц оксидов алюминия и магния в воздухе, воде и физиологическом растворе
Н. В. Зайцева a, М. А. Землянова a, b, А. М. Игнатова a, b, *, М. С. Степанков a
a Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения
Пермь, Россия
b Пермский национальный исследовательский политехнический университет
Пермь, Россия
* E-mail: iampstu@gmail.com
Поступила в редакцию 24.09.2020
После доработки 05.10.2020
Принята к публикации 20.11.2020
Аннотация
Рассматривается агрегативная устойчивость наноразмерных частиц оксидов алюминия и магния, так как они являются распространенными компонентами окружающей среды. Воздух и вода выбраны в качестве наиболее вероятных контактных сред, а физиологический раствор как среда, имитирующая внутреннюю среду человека. Установлено, что во всех средах частицы оксида алюминия обладают меньшей агрегативной устойчивостью и с большей вероятностью образуют агломераты, чем частицы оксида магния. Наноразмерные частицы оксида магния и алюминия во внутренних средах организма человека склонны образовывать наноразмерные кластеры, соединенные через жидкостные мостики, они не устойчивы, т.е. наноразмерные частицы могут перемещаться в форме кластера, а в среде органа-мишени распадаться на частицы и оказывать действие как наноразмерный материал. Агрегативная устойчивость наноразмерных частиц определяется материалом частиц, их размером и расстоянием между ними, при этом она динамически меняется при переходе из внешней среды во внутренние среды организма и на разных этапах метаболизма, что доказывает необходимость учета физического взаимодействия частиц в различных средах для оценки их токсичности.
ВВЕДЕНИЕ
Исследования последних 10 лет выявили, что неотъемлемым фактором окружающей среды, оказывающим негативное влияние на организм человека, являются нанодисперсные частицы различного химического состава [1–5]. Существуют различные подходы оценки токсичности наноразмерных частиц [6, 7]. Однако единым мнением большинства исследователей является то, что наноразмерные частицы оказывают негативный эффект на организм человека, превосходящий по интенсивности эффект, оказываемый микродисперсными аналогами. Существует ряд исследований [8, 9], устанавливающих общий механизм биохимического взаимодействия наноразмерных частиц с клетками человека и их компонентами. Существуют также исследования, посвященные эффектам, оказываемым конкретными химическими соединениями в нанодисперсной форме [10–12]. При этом физическими процессами, происходящими между наноразмерными частицами, пренебрегают.
В работах [13, 14], посвященных техническим аспектам использования наноразмерных материалов, отмечается, что нанометрическая размерность – это не постоянная характеристика дисперсной системы, она зависит от множества факторов, определяющих агрегативную устойчивость дисперсной системы. Так, наноразмерные частицы, находящиеся в газовой фазе, с большей вероятностью образуют агрегаты при длительном нахождении в ней.
Механизмы поверхностного взаимодействия наноразмерных частиц в жидкой фазе характеризуются электростатическими, стерическими и мостиковыми силами, а также гидрофильностью и гидрофобностью частиц.
Иными словами, наноразмерные частицы, находящиеся в той или иной среде, в зависимости от ряда физических факторов могут агломерировать между собой за счет взаимного притяжения, а могут отталкиваться друг от друга или адсорбировать на своей поверхности компоненты окружающей среды. Следовательно, наноразмерные частицы могут в одной среде образовать кластер, превышающий своими размерами 100 нм, а в другой среде этот кластер может распадаться на отдельные составляющие.
Рассматривая поведение наноразмерных частиц при попадании из внешней среды во внутреннюю среду организма человека, можно сформулировать три основных сценария.
Первый сценарий подразумевает, что при переходе из внешней среды во внутреннюю состояние дисперсности системы не изменяется, если частицы находились в форме отдельных наноразмерных объектов и они сохраняют свое состояние. Если во внешней среде частицы образовали агломерат, адсорбировали на поверхности другие вещества или сами осели на поверхности более крупных частиц, то и во внутренней среде они находятся в этом состоянии.
Второй сценарий заключается в том, что во внешней среде частицы дисперсной системы не сохраняют своей нанометрической размерности, а при попадании в организм во внутренней среде характер физического взаимодействия изменяется, и они вновь “распадаются” на наноразмерные объекты. Ситуация опасна тем, что потенциальный риск от частиц внешней среды может быть значительно недооценен.
Третий сценарий описывает ситуацию, при которой во внешней среде частицы дисперсной системы находятся в нанодисперсном состоянии, а при попадании в организм во внутренней среде характер физического взаимодействия изменяется таким образом, что они образуют микроразмерные кластеры. Данная ситуация чревата возможностью развития отсроченного эффекта действия на организм, что осложнит установление взаимосвязи между воздействием и эффектом.
Учитывая, что различия между внутренней и внешней средами по уровню температуры, составу, электромагнитным и прочим параметрам значительные, развитие событий наиболее вероятно по второму и третьему сценариям. Актуальным является выявление параметров агрегативной устойчивости наноразмерных частиц в окружающей и внутренней средах организма для повышения достоверности оценки риска здоровью населения при экспозиции наноразмерными частицами и разработке мероприятий по их устранению и минимизации.
Цель исследования – оценить агрегативную устойчивость наноразмерных частиц оксидов алюминия и магния в воздухе, воде и физиологическом растворе.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Для оценки агрегативной устойчивости использовали теорию ДЛФО (теория Дерягина, Ландау, Фервея, Овербека) [20]. Согласно этой теории, взаимодействие частиц достаточно полно описывается с позиции силы Ван-дер-Ваальса, возникающей в результате флуктуации заряда атомов или молекул на поверхности контакта, и сил капиллярного взаимодействия (мостиковая сила), возникающих в зоне жидкостного мостика между частицами согласно эффекту Марангони–Гиббса [21].
Сила Ван-дер-Ваальса (Fv), описывающая взаимодействие между двумя частицами, имеющими сферическую или близкую к ней форму, диаметром D1 и D2 определяли по формуле
где A – постоянная Гамакера, Дж [3]; z – расстояние между частицами, мкм; d – приведенный диаметр частиц, нм ×10–3.Отрицательный знак в формуле (1) указывает, что это сила притяжения. Константа Гамакера зависит от материала частиц и определяется по справочным данным [22].
Приведенный диаметр частиц определяли по формуле
Для предварительной оценки могут использоваться общие диапазоны значений константы Гамакера, для углеводородов ее величина находится в диапазоне (4–10) × 10–20 Дж, для оксидов металлов (10–16) × 10–20 Дж и для металлов (16–50) × × 10–20 Дж.
Константу Гамакера для определения величины силы взаимодействия между двумя разнородными частицами в воздухе рассчитывали по формуле
где А1 – константа Гамакера для частицы из одного материала, а А2 – константа Гамакера для частицы из другого материала.Константу Гамакера для определения величины силы взаимодействия между частицами одинакового состава в жидкой среде рассчитывали по формуле
(4)
${{A}_{{\left( {131} \right)}}} = {{\left( {\sqrt {{{A}_{1}}} - \sqrt {{{А}_{3}}} } \right)}^{2}},$Константу Гамакера для определения величины силы взаимодействия между частицами разнородного состава в жидкой среде рассчитывали по формуле
(5)
${{A}_{{\left( {132} \right)}}} = \left( {\sqrt {{{A}_{1}}} - \sqrt {{{А}_{3}}} } \right)\left( {\sqrt {{{A}_{2}}} - \sqrt {{{А}_{3}}} } \right).$В случае, когда частицы имели шероховатость, силу взаимодействия рассчитывали по формуле
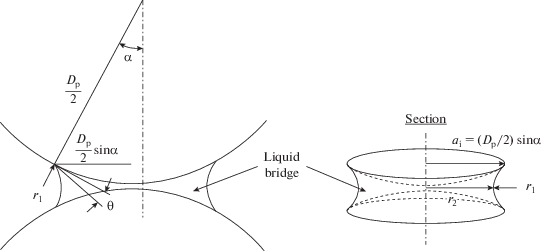
где b – среднее значение высоты элемента шероховатости поверхности частиц b1 и b2 (рис. 1):Рис. 1.
Схема расположения наноразмерных частиц, имеющих шероховатость, относительно друг друга при взаимном притяжении.
В том случае, когда взаимодействие частиц происходит в жидкой среде (вода или физраствор), между ними образуется жидкостный мостик (рис. 2), удерживающий частицы между собой за счет капиллярной силы, вычисляемой по формуле
где α – центральный угол (рис. 2), θ – угол смачивания материала частицы жидкостью среды.Для того чтобы установить величину угла α (угол прямоугольного треугольника, в котором один катет – это радиус частицы, а другой – радиус области контакта), необходимо вычислить величину радиуса области контакта жидкостного мостика a между частицами по формуле
где k – приведенная постоянная упругости для двух контактирующих тел из разных материалов с модулем Юнга (E1, E2) и коэффициентами Пуассона (v1, v2), определяемая по формулеВ данном исследовании агрегативная устойчивость оценивалась без учета загрязнений сред, электромагнитных условий и условий кислотности жидких сред.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования рассматриваются наноразмерные частицы оксида алюминия (37.8 нм) и оксида магния (34.4 нм). Выбор этих оксидов обоснован тем, что они относятся к наиболее распространенным соединениям в окружающей среде [15], а эффекты их воздействия на организм широко изучены [16–19].
В исследовании рассматриваются силы взаимодействия в воздухе, воде и физиологическом растворе, имитирующем внутреннюю среду человека. Постоянные Гамакера составляют, ×10–20 Дж: для воды – 4.4; физиологического раствора – 0.4; оксида алюминия – 15.5; оксида магния – 10.6.
Поскольку в исследовании изучали поведение наноразмерных частиц в аспекте воздействия на человека, в качестве расстояния принимается величина диаметра альвеолярных пространств, которая согласно справочным данным [23] составляет в среднем, мкм: для ребенка – 150; взрослого человека – 280; человека в пожилом возрасте – 350.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Аналитические графические зависимости, характеризующие величину силы Ван-дер-Ваальса между наноразмерными частицами оксида алюминия и магния совместно и по отдельности, в воздухе, воде и физиологическом растворе на расстоянии L, соответствующем физиологическому диапазону строения альвеолярного пространства человека, полученные авторами, представлены на рис. 3.
Рис. 3.
Зависимость величины силы притяжения между частицами оксида магния и алюминия в различных средах: (а) – воздух, (б) – вода, (в) – физиологический раствор. 1 – Al2O3, 2 – MgO, 3 – Al2O3 + MgO.
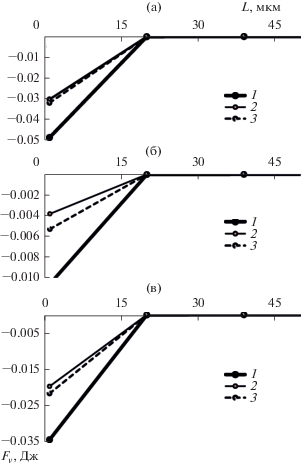
Согласно представленным зависимостям минимальные силы взаимного притяжения между наноразмерными частицами, рассмотренными в исследовании, размер которых составляет от 34–35 нм, возникают в том случае, когда они находятся друг от друга на расстоянии 20 мкм и более. В случае их расположения относительно друг друга на расстоянии менее 20 мкм их агрегативная устойчивость резко снижается вне зависимости от характера среды, поэтому данное расстояние и используется в последующих расчетах.
Выявлено, что наименьшей агрегативной устойчивостью (т.е. с наибольшей вероятностью образующие агрегаты) обладают наноразмерные частицы оксида алюминия. В данном исследовании это частицы с наибольшей величиной константы Гамакера. Величина силы Fv, возникающая между частицами оксида алюминия в воздухе, составляет 4 × 10–2–1 × 10–4 Дж, что больше, чем между частицами оксида магния в 1.5 раза, в воде 1 × 10–2–2.6 × 10–5 Дж, что больше, чем между частицами оксида магния в 3 раза, в физиологическом растворе 3 × 10–2–8.5 × 10–5 Дж, что больше, чем между частицами оксида магния в 1.6 раза. Однако, в случае совместного нахождения в среде частиц оксидов магния и алюминия, агрегативная устойчивость увеличивается за счет частиц оксида магния, константа Гамакера которых ниже, чем у оксида алюминия. Следовательно, при наличии в смеси частиц с высокой агрегативной устойчивостью они повышают общую агрегативную устойчивость смеси в среднем на 40%.
Вне зависимости от состава наименьшей агрегативной устойчивостью наноразмерные частицы обладают в воздушной среде. Величина силы притяжения между частицами снижается при переходе в жидкую среду, наименьший показатель силы притяжения соответствует водной среде. Агрегативная устойчивость в воде выше на 80%, чем в воздухе, и на 35% выше, чем в физиологическом растворе. Данное наблюдение является важным с точки зрения прогнозирования поведения частиц в окружающей среде в зависимости от влажности. Предположительно, с увеличением влажности агрегативная устойчивость повышается, и частицы с меньшей вероятностью образуют кластеры.
На основе оценки сил притяжения установлено, что вероятность реализации сценария, при котором наноразмерные частицы изменяют свою агрегативную устойчивость при переходе из внешней окружающей среды во внутренние среды человека, высокая. При попадании во внутренние среды человека увеличивается вероятность распада кластеров частиц, образованных в воздухе, на более мелкие и восстановления наноразмерности дисперсной системы.
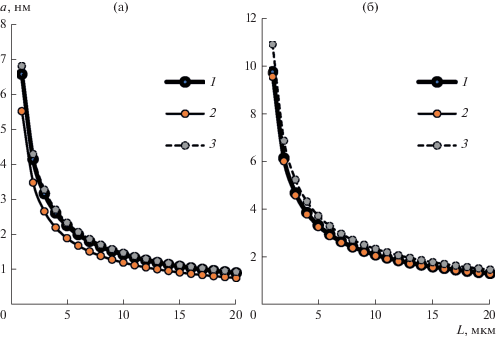
В реальных условиях наноразмерные частицы агрегируют между собой за счет образования мостиков жидкости между ними. В зависимости от рода частицы и среды геометрические параметры жидкостного мостика будут различны. Характерным параметром для описания строения жидкостного мостика является величина радиуса области контакта. На рис. 4 представлена зависимость величины радиуса области контакта жидкостного мостика между наноразмерными частицами оксида алюминия и магния совместно и по отдельности, в воде и физиологическом растворе от расстояния друг от друга в диапазоне от 1 до 20 мкм, полученная авторами в результате аналитических расчетов. Зависимости демонстрируют тенденцию, при которой радиус области контакта между частицами в физиологическом растворе выше, чем в воде в среднем в 1.6 раза.
Рис. 4.
Зависимость величины радиуса контакта жидкостного мостика между частицами: (а) – в воде, (б) – в физиологическом растворе. 1 – Al2O3, 2 – MgO, 3 – Al2O3 + MgO.
Аналитические графические зависимости, характеризующие величину капиллярной силы жидкостного мостика, необходимой для удержания в кластере наноразмерных частиц оксида алюминия и магния совместно и по отдельности, в воде и физиологическом растворе на расстоянии от 1 до 20 мкм друг от друга, полученные авторами, представлены на рис. 5. Общая тенденция соответствует тому, что с увеличением расстояния между частицами величина капиллярной силы жидкостного мостика, необходимой для их удержания, возрастает.
Рис. 5.
Капиллярная сила, необходимая для удержания кластера частиц жидкостным мостиком, в зависимости от расстояния между ними: (а) – в воде, (б) – в физиологическом растворе. 1 – Al2O3, 2 – MgO, 3 – Al2O3 + MgO.
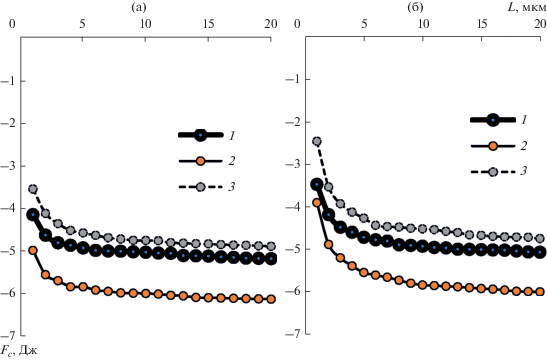
Согласно представленным зависимостям для удержания частиц между собой в жидкой среде из физиологического раствора требуются меньшие силы капиллярного взаимодействия. Это означает, что кластеры, образованные между наноразмерными частицами в физиологическом растворе, более устойчивы, чем в воде в 1.2 раза. При совместном присутствии в физиологическом растворе разнородных частиц (в случае исследования совместного нахождения частиц оксида алюминия и оксида магния) стойкость кластеров возрастает относительно аналогичной ситуации в воде в 1.5 раза. Установлено, что кластеры, образованные частицами из материала с большей константой Гамакера (в рамках данного исследования – оксида алюминия), в целом устойчивее кластеров из частиц, материалу которых соответствует меньший показатель константы Гамакера (в рамках данного исследования – оксида магния), в среднем на 20%.
ЗАКЛЮЧЕНИЕ
В настоящей работе проведена оценка агрегативной устойчивости наноразмерных частиц оксидов алюминия и магния в воздухе, воде и физиологическом растворе. Установлено, что во всех средах частицы оксида алюминия обладают меньшей агрегативной устойчивостью и с большей вероятностью образуют агломераты, чем частицы оксида магния. Сила взаимодействия между частицами оксида алюминия выше, чем между частицами оксида магния в 1.5–3 раза. На агрегативную устойчивость влияет наличие примесей. Так, наличие примеси частиц с высокой агрегативной устойчивостью (оксид магния) способно повысить общую агрегативную устойчивость смеси в среднем на 40%. Влияет также и расстояние между частицами; установлено, что силами взаимодействия Ван-дер-Ваальса можно пренебречь, если оно составляет более 20 мкм.
При переходе наноразмерных частиц из воздушной среды в жидкую величина силы притяжения между частицами снижается, их агрегативная устойчивость повышается до 80% и они с меньшей вероятностью образуют новые и укрупняют ранее образованные кластеры и с большей вероятностью кластеры, образованные в воздушной среде, распадаются.
Наноразмерные частицы оксида магния и алюминия во внутренних средах организма человека склонны образовывать кластеры, соединенные через жидкостные мостики, которые являются неустойчивыми, т.е. наноразмерные частицы могут перемещаться в форме кластера, а в среде органа-мишени распадаться на частицы и оказывать действие как наноразмерный материал. Например, оксид алюминия, как материал с большей постоянной Гамакера, образует более стойкие кластеры, чем оксид магния, как материал с меньшим показателем постоянной Гамакера.
Агрегативная устойчивость наноразмерных частиц определяется материалом частиц, их размером и расстоянием между ними, при этом она динамически меняется при переходе из внешней среды во внутренние среды организма и на разных этапах метаболизма, что доказывает необходимость учета физического взаимодействия частиц в различных средах для оценки их токсичности.
ОБОЗНАЧЕНИЯ
| A | постоянная Гамакера, Дж |
| b | среднее значение высоты элемента шероховатости поверхности частиц, мкм |
| D | реальный диаметр частицы, мкм |
| d | приведенный диаметр частиц, мкм |
| E | модуль Юнга, МПа |
| F | сила взаимодействия, Дж |
| k | приведенная постоянная упругости для двух контактирующих тел из разных материалов |
| L | расстояние между частицами, мкм |
| v | коэффициент Пуассона |
| z | расстояние между частицами, мкм |
| α | центральный угол, град |
| θ | угол смачивания материала частицы жидкостью среды, град |
ИНДЕКСЫ
Список литературы
Голохваст С.К., Памирский И.Э. Экологические и нанотоксикологические аспекты взаимодействия минералов и белков // Вестн. нов. мед. технол. 2010. № 2. С. 53.
Богатиков О.А. Неорганические наночастицы в природе // Вестн. Росс. акад. наук. 2003. Т. 73. № 5. С. 426.
Саркисов П.Д., Стоянова О.В., Дли М.И. Принципы управления проектами в сфере наноиндустрии // Теор. осн. хим. технол. 2013. Т. 47. № 1. С. 36.
Землянова М.А., Игнатова А.М. Исследование морфологических изменений тканей внутренних органов лабораторных животных при воздействии нанодисперсных оксидов переходных и легких металлов и неметаллов // Вестн. Перм. унив. С.: Биол. 2019. № 3. С. 320.
Кузнецов Г.В., Стрижак П.А., Шлегель Н.Е. Взаимодействие капель воды и суспензий при их столкновениях в газовой среде // Теор. осн. хим. технол. 2019. Т. 53. № 5. С. 546.
Богатырев В.А. Лабораторная диагностическая система токсичности наноматериалов // Изв. высш. учебн. завед. Прикл. нелинейная дин. 2014. № 6. С. 4.
Maynard R.L. Nano-technology and nano-toxicology // Emerging Health Threats J. 2012. V. 5. № 1. Article number 17508. https://doi.org/10.3402/ehtj.v5i0.17508
Valavanidis A., Fiotakis K., Vlachogianni T. Airborne particulate matter and human health: Toxicological assessment and importance of size and composition of particles for oxidative damage and carcinogenic mechanisms // J. Environ. Sci. Health, Part C: Environ. Carcinog. Ecotoxicol. Rev. 2008. V. 26. P. 339.
Yanamala N., Kagan V.E., Shvedova A.A. Molecular modeling in structural nanotoxicology: interactions of nanoparticles with nanomachinery of cells // Adv. Drug Delivery Rev. 2013. V. 65. № 15. P. 70.
Zaitseva N.V., Zemlyanova M.A., Ignatova A.M., Stepankov M.S. Morphological changes in lung tissues of mice caused by exposure to nano-sized particles of nickel oxide // Nanotechnol. Russ. 2018. V. 13. № 7–8. P. 393.
Zaitseva N.V., Zemlyanova M.A., Stepankov M.S., Ignatova A.M. Studying and assessing the toxicity of calcium oxide nanoparticles under one-time inhalation exposure // Nanotechnol. Russ. 2019. V. 14. № 9–10. P. 497.
Землянова М.А., Тиунова А.И., Степанков М.С., Иванова А.С. Потенциальная опасность для здоровья человека наноразмерного оксида кобальта // Экол. чел. 2018. № 1. С. 36.
Iveson S.M., Litster J.D., Hapgood K.P., Ennis B.J. Nucleation, growth and breakage phenomena in agitated wet granulation processes: A review // Powder Technol. 2001. V. 39. P. 117.
Pitois O., Moucheront P., Chateau X. Rupture energy of a pendular liquid bridge // Eur. Phys. J. B. 2001. V. 23. P. 79.
Лященко А.К., Дильман В.В., Таран В.В. Слабые воздействия и процессы релаксации в воде и других жидкостях // Теор. осн. хим. технол. 2019. Т. 53. № 6. С. 603.
Землянова М.А., Зайцева Н.В., Игнатова А.М., Степанков М.С. Оценка реакции дыхательных путей на однократное интратрахеальное введение нано- и микроразмерных частиц оксида алюминия // Гиг. санит. 2019. Т. 98. № 2. С. 196.
Zaitseva N.V., Zemlyanova M.A., Stepankov M.S., Ignatova A.M. Comparative assessment of aluminum bioaccumulation and morphological changes in the lungs and brain after a single inhalation exposure to nanodispersed aluminum oxide // Nanotechnol. Russ. 2019. V. 14. № 1–2. P. 62.
Зайцева Н.В., Землянова М.А., Степанков М.С., Игнатова А.М. Научное прогнозирование токсичности и оценка потенциальной опасности наночастиц оксида магния для здоровья человека // Экол. чел. 2019. № 2. С. 39.
Зайцева Н.В., Землянова М.А., Степанков М.С., Игнатова А.М. Оценка токсичности и потенциальной опасности наночастиц оксида алюминия для здоровья человека // Экол. чел. 2018. № 5. С. 9.
Дерягин Б.В., Чураев Н.В., Муллер В.М. Поверхностные силы. М.: Наука, 1985.
Сажин Б.С., Чунаев М.В., Сажин В.Б. Термокапиллярный механизм неустойчивости слоя жидкости (эффект Марангони) // Усп. хим. хим. технол. 2009. № 3(96). С. 103.
Корн Г., Корн Т. Справочник по математике для научных работников и инженеров. М.: Наука, 1977.
Иванов К.П. Новые проблемы в дыхательной функции легких // Ульяновск. мед.-биол. журн. 2016. № 1. С. 37.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии