Теоретические основы химической технологии, 2021, T. 55, № 5, стр. 567-577
Протонированный комплекс бис-Глицин никеля – эффективный прекурсор для химического осаждения сплава никель–фосфор
Е. Г. Винокуров a, b, *, **, С. Н. Гридчин c, Г. М. Мухаметова a, В. Д. Скопинцев d, Т. Ф. Бурухина a
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Всероссийский институт научной и технической информации РАН
Москва, Россия
c Ивановский государственный химико-технологический университет
Иваново, Россия
d Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Москва, Россия
* E-mail: vin-62@mail.ru
** E-mail: vin@muctr.ru
Поступила в редакцию 18.01.2021
После доработки 22.03.2021
Принята к публикации 23.03.2021
Аннотация
С использованием алгоритма Бринкли проведены расчеты ионных равновесий в системе NiSO4–H2Suс–HGly для оценки истинного состава глицинатно-сукцинатного раствора химического никелирования. Показано, что в слабокислых растворах преобладает протонированный бис-глицинатный комплексный катион, который служит прекурсором при химического осаждении никель-фосфорных покрытий. Стабилизацию рН раствора в слабокислой среде обеспечивают сукцинат-ионы и протонированные глицинатные комплексы никеля. В щелочных растворах преобладают бис- и трис-глицинатные комплексы никеля. Выдвинутые предположения о роли компонентов раствора химического никелирования подтверждены экспериментальными данными по влиянию концентраций кислот и рН на скорость осаждения покрытия и поддержание оптимальной кислотности реакционной зоны. Определен оптимальный состав раствора химического никелирования (моль/л): сульфат никеля – 0.12, гипофосфит натрия – 0.36, аминоуксусная кислота – 0.2–0.3; янтарная кислота – 0.2–0.4, ацетат свинца – 10–5. При рН 4.8–6.8 и температуре 70–95°С и удельной площади загрузки 1 дм2/л получены качественные никель-фосфорные покрытия стабильного состава, которые можно использовать в качестве защитно-упрочняющих, осаждающихся со скоростью до 38–40 мкм/ч.
ВВЕДЕНИЕ
Среди декоративных, антикоррозионных и функциональных покрытий большое распространение приобрели сплавы никель–фосфор, получаемые методом автокаталитического осаждения [1–7]. Важным достоинством химического способа нанесения металлических покрытий является равномерность толщины и состава покрытий по поверхности сложнопрофилированных изделий.
Растворы для химического нанесения металлических покрытий содержат соли металлов, восстановитель (гипофосфит), лиганд, стабилизатор и буферную добавку. Применение лигандов вызвано необходимостью предупреждения реакции в объеме раствора, приводящей к его разложению. В качестве лигандов для ионов никеля применяют цитраты, лактаты, пирофосфаты, сукцинаты, пропионаты, глицинаты и многие др. [8–13].
Большинство используемых в настоящее время растворов для химического осаждения сплава Ni–P в качестве лиганда и буферирующей системы содержат цитрат-ионы [7] или глицин [14]; последний может также использоваться в растворе на основе цитратов никеля для поддержания рН раствора [15]. Известны растворы на основе глицинатных комплексов никеля, в которых для стабилизации рН используют дикарбоновые кислоты – малоновую [16–18], адипиновую [19]. Для осаждения сплава Ni–P одновременное применение глицина и янтарной кислоты в литературе не обнаружено, несмотря на то, что янтарная кислота совместно с другими лигандами используется в этом процессе как буферная добавка [20]. На примере аналогичных комплексов кобальта показано положительное влияние янтарной кислоты на процесс осаждения покрытий [21]. Таким образом, комбинация глицина (NH2CH2COOH, HGly) и янтарной кислоты ((CH2)2(COOH)2, H2Succ) представляется перспективной для создания высокоэффективных растворов химического никелирования.
Несмотря на то, что в литературе подробно описано влияние различных лигандов на скорость осаждения, качество или состав покрытий [11, 13, 22], подбор лигандов в большинстве случаев проводится опытным путем. Обоснование выбора лигандов, особенно при наличии нескольких, затруднено в связи с тем, что в различных условиях, прежде всего при различной кислотности среды, в растворе существуют различные комплексные соединения металлов.
На ряде примеров выявлена значительная роль комплексных соединений [23–25], в том числе гидроксокомплексов [26], в процессе формирования покрытий и предложены модели выбора лигандов при разработке новых составов растворов для нанесения покрытий сплавами и многовалентными металлами [27–30], в том числе для химического никелирования [31, 32].
Для развития новых технологий, необходимо проведение фундаментальных исследований, связанных с получением, исследованием строения, свойств и реакционной способности химических соединений – молекулярных и ионных предшественников (прекурсоров) получаемого материала. Важной задачей представляется теоретическое обоснование состава раствора на основе моделирования его равновесного состава, что позволяет выбрать лиганд и буферную систему для осаждения покрытий Ni–P. Для решения этой задачи полезно использовать алгоритм Бринкли [33]. Рассмотрение равновесного состава раствора актуально в связи с тем, что предпринятые ранее попытки расчета ионных равновесий в глицинатных растворах [31, 34, 35] не вполне корректны, поскольку не учитывали все виды частиц, которые могут существовать в системе Ni2+–H+–Gly–, особенно в присутствии дополнительного лиганда.
Цель настоящей работы – моделирование равновесного состава раствора химического никелирования, содержащего глицин и янтарную кислоту, и теоретическое обоснование роли компонентов в процессе формирования покрытий.
МЕТОДИКИ РАСЧЕТА И ЭКСПЕРИМЕНТА
Расчеты ионных равновесий на основе уравнений материального баланса в системе NiSO4–H2Sucс–HGly выполнены по алгоритму Бринкли [33], развитому в последующих исследованиях [36, 37], с использованием программы RRSU [38]. Константы диссоциации янтарной кислоты и константы устойчивости сукцинатов никеля(II) при 25°С и I = 0.1 взяты из работ [39, 40]. Значения lgβ для NiGly+, NiGly2, NiGly3– и pK для H2Gly+, HGly рекомендованы IUPAC [41], lgβ для NiHGly2+, ${\text{NiHGly}}_{2}^{ + },$ ${\text{Ni}}{{{\text{H}}}_{{\text{2}}}}{\text{Gly}}_{2}^{{2 + }}$ приняты по результатам работы [42], значение lg β для Ni(OH)Gly определено авторами [43]. Величины pK гидролиза ионов Ni2+ выбраны с учетом рекомендаций [44–46]. Константы устойчивости сульфатных комплексов никеля(II) для I = 0.1 рассчитаны по уравнению Васильева [47] на основании данных [48]. Константа диссоциации ${\text{HSO}}_{4}^{ - }$ взята из работы [49]. Значение константы реакции образования смешанного комплекса NiSuccGly– приведено в работе [50]. Используемые для расчета равновесий в системе NiSO4–H2Sucс–HGly численные значения констант координационных и протолитических равновесий приведены в табл. 1.
Таблица 1.
Матрица стехиометрических коэффициентов и значения констант равновесий в системе NiSO4–H2Succ–HGly при 25°С и I = 0.1
| № | Равновесие | Стехиометрические коэффициенты базисных частицы |
lg β | ||||
|---|---|---|---|---|---|---|---|
| H+ | Ni2+ | Succ2– | Gly– | ${\text{SO}}_{4}^{{2 - }}$ | |||
| 1 | H2O ⇄ H+ + OH– | –1 | 0 | 0 | 0 | 0 | –13.78 |
| 2 | Ni2+ + H2O ⇄ H+ + Ni(OH)+ | –1 | 1 | 0 | 0 | 0 | –9.40 |
| 3 | Ni2+ + 2H2O ⇄ 2H+ + Ni(OH)2 | –2 | 1 | 0 | 0 | 0 | –18.09 |
| 4 | Ni2+ + 3H2O ⇄ 3H+ + ${\text{Ni(OH)}}_{3}^{ - }$ | –3 | 1 | 0 | 0 | 0 | –30.0 |
| 5 | Ni2+ + 4H2O ⇄ 4H+ + ${\text{Ni(OH)}}_{4}^{{2 - }}$ | –4 | 1 | 0 | 0 | 0 | –44.0 |
| 6 | 4Ni2+ + 4H2O ⇄ 4H+ + ${\text{N}}{{{\text{i}}}_{4}}{\text{(OH)}}_{4}^{{4 + }}$ | –4 | 4 | 0 | 0 | 0 | –28.2 |
| 7 | 2Ni2+ + H2O ⇄ H+ + Ni2(OH)3+ | –1 | 2 | 0 | 0 | 0 | –10.7 |
| 8 | H+ + ${\text{SO}}_{4}^{{2 - }}$ ⇄ ${\text{HSO}}_{4}^{ - }$ | 1 | 0 | 0 | 0 | 1 | 1.49 |
| 9 | Ni2+ + ${\text{SO}}_{4}^{{2 - }}$ ⇄ NiSO4 | 0 | 1 | 0 | 0 | 0 | 1.48 |
| 10 | Ni2+ + ${\text{2SO}}_{4}^{{2 - }}$ ⇄ ${\text{Ni(S}}{{{\text{O}}}_{4}}{\text{)}}_{4}^{{2 - }}$ | 0 | 2 | 0 | 0 | 0 | 1.84 |
| 11 | H+ + Succ2– ⇄ HSucc– | 1 | 0 | 1 | 0 | 0 | 5.29 |
| 12 | 2H+ + Succ2– ⇄ H2Succ | 2 | 0 | 1 | 0 | 0 | 9.29 |
| 13 | Ni2+ + Succ2– ⇄ NiSucc | 0 | 1 | 1 | 0 | 0 | 1.62 |
| 14 | Ni2+ + H+ + Succ2– ⇄ NiHSucc+ | 1 | 1 | 1 | 0 | 0 | 6.34 |
| 15 | H+ + Gly– ⇄ HGly | 1 | 0 | 0 | 1 | 0 | 9.60 |
| 16 | 2H+ + Gly– ⇄ H2Gly+ | 2 | 0 | 0 | 1 | 0 | 11.97 |
| 17 | Ni2+ + Gly– ⇄ NiGly+ | 0 | 1 | 0 | 1 | 0 | 5.80 |
| 18 | Ni2+ + 2Gly– ⇄ NiGly2 | 0 | 1 | 0 | 2 | 0 | 10.62 |
| 19 | Ni2+ + 3Gly– ⇄ ${\text{NiGly}}_{3}^{ - }$ | 0 | 1 | 0 | 3 | 0 | 13.97 |
| 20 | Ni2+ + OH– + Gly– ⇄ Ni(OH)Gly | –1 | 1 | 0 | 1 | 0 | –3.70 |
| 21 | Ni2+ + H+ + Gly– ⇄ NiHGly2+ | 1 | 1 | 0 | 1 | 0 | 11.35 |
| 22 | Ni2+ + H+ + 2Gly– ⇄ ${\text{NiHGly}}_{2}^{ + }$ | 1 | 1 | 0 | 2 | 0 | 17.33 |
| 23 | Ni2+ + 2H+ + 2Gly– ⇄ ${\text{Ni(HGly)}}_{2}^{{2 + }}$ | 2 | 1 | 0 | 2 | 0 | 24.04 |
| 24 | Ni2+ + Succ2– + Gly– ⇄ NiSuccGly– | 0 | 1 | 1 | 1 | 0 | 7.17 |
Отсутствие данных для констант равновесия и других термодинамических характеристик большинства реакций при различных температурах не позволило провести расчеты диаграмм распределения комплексов при повышенных температурах. Также надо отметить, что одновременный учет изменения констант равновесия всех реакций с увеличением температуры не должен принципиально влиять на относительный характер распределения комплексов.
Для подтверждения оценки модели проводили химическое осаждение покрытий сплавом Ni–P при температуре 70°С из растворов следующего состава [17, 18]: сульфат никеля 0.12 М, гипофосфит натрия 0.36 М, ацетат свинца 10–5 М, в который добавлялось Х моль/л лигандов, где Х – концентрация лиганда, аминоуксусная кислота (HGly) – 0.05–0.4 М; янтарная кислота (H2Succ) – 0–0.4 М. Для растворов устанавливали значения рН 4.8–6.8 с помощью корректировки раствором NaOH или H2SO4. Удельная площадь загрузки составляла 1 дм2/л.
Стальные пластины протирали тканью, смоченной керосином, для удаления следов смазки, затем обезжиривали венской известью, промывали проточной водой, а затем дистиллированной водой и сушили на воздухе. Перед началом эксперимента стальную пластину погружали в раствор H2SO4 (10 мас. %) для активирования на 10 с, затем промывали дистиллированной водой.
Скорость осаждения r (мг см–2 ч–1), учитывая время осаждения t (ч) и площадь покрытия S (см2), рассчитывали по следующей формуле:
где m – масса покрытия (мг), A – площадь поверхности образца (см2), t – время осаждения покрытия (ч).Удельное изменение рН раствора рассчитывали по формуле
где рНн, рНк – начальное и конечное (после осаждения покрытий) значение рН раствора соответственно; m – масса покрытия, г.РАСЧЕТЫ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 в качестве примера приведена диаграмма распределения никеля в системе в системе NiSO4–H2Succ–HGly при 25°С.
Рис. 1.
Диаграмма распределения никеля в системе NiSO4–H2Succ–HGly при соотношении NiSO4 : H2Succ : HGly = = 1 : 3 : 3, C(NiSO4) = 0.01 M, I = 0.1: 1 – NiSO4; 2 – Ni2+; 3 – NiHGly2+; 4 – ${\text{Ni}}({\text{HGly}})_{2}^{{2 + }};$ 5 – ${\text{NiHGly}}_{2}^{ + };$ 6 – NiGly+; 7 – NiSuccGly–; 8 – NiGly2; 9 – ${\text{NiGly}}_{3}^{ - };$ 10 – Ni(OH)Gly; 11 – ${\text{Ni}}({\text{OH}})_{3}^{ - };$ 12 – Ni(OH)2; 13 – Ni(OH)+; 14 – ${\text{N}}{{{\text{i}}}_{{\text{4}}}}({\text{OH}})_{4}^{{4 + }};$ 15 – NiSucc; 16 – NiHSucc+ (пунктирными линиями показано распределение никеля в отсутствие глицина).
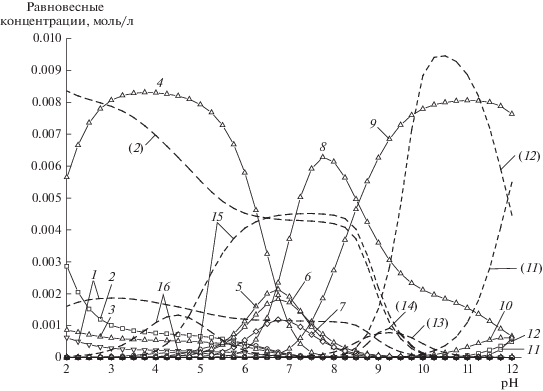
Результаты расчёта ионных равновесий показывают, что поведение указанных систем определяется, главным образом, процессами образования комплексов HGly с ионами Ni2+ и процессами протонирования Succ2–. При этом растворимые бис- и трис-комплексы глицина (рис. 1, кривые 4, 8, 9) оказываются доминирующими частицами в широкой области рН. Образование устойчивых глицинатных комплексов никеля препятствует образованию гидроксидов, характеризующихся низкой растворимостью. Это имеет важное значение, поскольку при высоких значениях рН исходного раствора может происходить образование ряда гидроксокомплексов (рис. 1, кривые 11–14) и выделение фазы гидроксида никеля, что приведет к самопроизвольному разложению раствора при повышенной температуре за счет протекания реакций окисления–восстановления на поверхности фазы [51].
Другой особенностью системы NiSO4–H2Succ–HGly является сравнительно небольшая доля образования как однородных по лиганду сукцинатных комплексов NiSucс и NiHSucc+ (рис. 1, кривые 15, 16), так и смешанного сукцинатно-глицинатного комплекса NiSuccGly– (рис. 1, кривая 7). Присутствие в системе значительного количества свободных сукцинат-ионов и продуктов их протонирования (рис. 2) позволяет в полной мере использовать буферные свойства янтарной кислоты для стабилизации кислотности рабочего раствора в процессе химического осаждения никеля из глицинатно-сукцинатного электролита.
Рис. 2.
Диаграмма координационных и протолитических равновесий в системе NiSO4–H2Succ–HGly при соотношении NiSO4 : H2Succ : HGly = 1 : 3 : 3, C(NiSO4) = 0.01 M, I = 0.1: 1 – NiSO4; 2 – Ni2+; 3 – NiHGly2+; 4 – ${\text{Ni}}({\text{HGly}})_{2}^{{2 + }};$ 5 – ${\text{NiHGly}}_{2}^{ + };$ 6 – NiGly+; 7 – NiSuccGly–; 8 – NiGly2; 9 – ${\text{NiGly}}_{3}^{ - };$ 10 – Ni(OH)Gly; 11 – Gly–; 12 – HGly; 13 – H2Gly+; 14 – ${\text{HSO}}_{4}^{ - };$ 15 – ${\text{SO}}_{4}^{{2 - }};$ 16 – H2Succ; 17 – HSucc–; 18 – Succ2– (пунктирными линиями показано распределение сукцината в 0.03 М растворе янтарной кислоты в отсутствие сульфата никеля(II) и глицина).
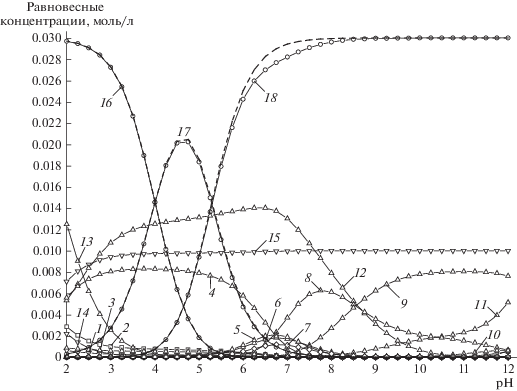
Таким образом, при значениях рН < 6.8 преобладающим в рассматриваемой системе является положительно заряженный комплексный ион ${\text{Ni}}({\text{HGly}})_{2}^{{2 + }}$ (рис. 1, кривая 4), что согласно ранее предложенной модели [32] должно обеспечить высокую скорость осаждения покрытий. Расчет скорости осаждения покрытий по математической модели [32], учитывающей для рассматриваемой системы дентатность лиганда (D) и заряд комплекса (Z):
приводит к значениям скорости 0.6 мг/(см2 ч) при 25°С, что приблизительно в два раза больше, чем для случая отрицательно заряженных триc-комплексов ${\text{NiGly}}_{3}^{ - }$ никеля (0.3 мг/(см2 ч) при рН 8.5 [32]).
Расчеты показывают, что увеличение концентрации глицина в растворе приводит к росту относительной доли протонированного бис-глицинатного комплекса. Так, при соотношении [Ni2+] : [H2Succ] = 1 : 2 при концентрации [HGly] = = [Ni2+] в этот комплекс связано 30% ионов никеля, тогда как при двукратном увеличении концентрации глицина – уже 60%, а при трехкратном – 80%. Таким образом, протонированный бис-глицинатный комплекс является основным источником никеля для реакции осаждения покрытий при рН < 7. В щелочных растворах разряду подвергаются бис- и трис-глицинатные комплексы никеля.
Важной особенностью процесса химического никелирования является подкисление реакционного слоя за счет реакции окисления гипофосфита [51], что может привести к разрушению существующих комплексов. В этой связи, важное внимание необходимо уделить сохранению рН за счет буферирования раствора. Рассматриваемая система в значительной степени содержит не связанный в комплекс с ионами никеля сукцинат-ион, который связывает H+ с образованием частиц HSucc– и H2Succ при рН < 7.5 (рис. 2, кривые 16, 17), и, таким образом, обеспечивает поддержание рН в реакционном слое, препятствуя разрушению комплексов никеля и сохраняя высокую скорость осаждения.
Полученные результаты свидетельствуют о перспективности данной системы для разработки состава раствора химического никелирования.
Исследование процесса химического осаждения покрытий при температуре 70°С из глицинатно-сукцинатных растворов показало, что возможно получение качественных осадков сплава Ni–P в интервале рН от 4.2 до 6.8 с довольно высокой скоростью. Покрытия, осаждаемые из указанных растворов, получаются равномерные, имеющие хорошее сцепление с основой.
Решающая роль сукцинат-иона в стабилизации рН раствора подтверждается экспериментальными данными (рис. 3), согласно которым увеличение концентрации янтарной кислоты до 0.2–0.4 моль/л сопровождается эффективным связыванием выделяющихся при окислении гипофосфита ионов водорода: удельное изменение рН в этих растворах почти в 3 раза ниже, чем в растворах без янтарной кислоты.
Рис. 3.
Влияние концентрации янтарной кислоты на скорость осаждения (1) и удельное изменение рН раствора после осаждения покрытий (2). Состав (моль/л) раствора: NiSO4 – 0.12, NaH2PO2 – 0.36, HGly –0.30, H2Succ – 0–0.40, Pb2+ – 10–5; pH – 5.8.
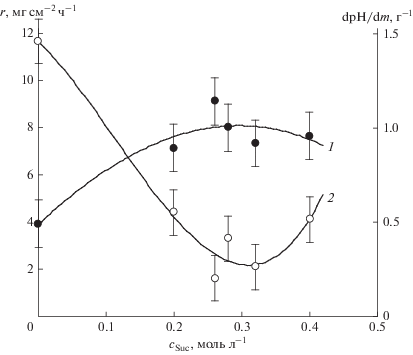
Предотвращение подкисления раствора положительно сказывается и на скорости осаждения; она увеличивается вдвое по сравнению со скоростью, полученной в растворе только глицинатных комплексов никеля (рис. 3).
Влияние рН на скорость осаждения согласуется с известными данными по растворам химического никелирования других лигандных составов [51], согласно которым подкисление раствора химического никелирования приводит к интенсификации побочной реакции выделения водорода в ущерб основной реакции восстановления металла. Полученные экспериментальные данные в глицинатно-сукцинатном растворе подтверждают эту закономерность (рис. 4).
Рис. 4.
Влияние рН на скорость осаждения (1) и удельное изменение рН раствора после осаждения покрытий (2). Состав (моль/л) раствора: NiSO4 – 0.12, NaH2PO2 – 0.36, HGly – 0.30, H2Succ – 0.20, Pb2+ – 10–5; pH – 4.8–6.8.
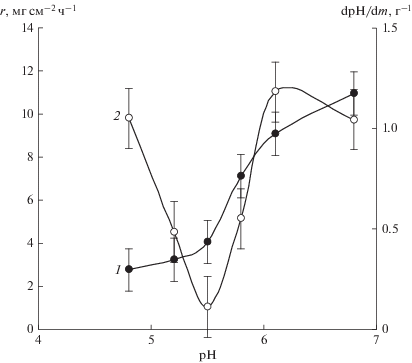
При этом наиболее эффективное буферирование рН наблюдается при рН около 5.5, что соответствует равновесию реакции
Увеличение концентрации глицина как основного лиганда для ионов никеля способствует увеличению скорости осаждения до молярного соотношения никель : глицин 1 : 2 (рис. 5), однако дальнейший рост содержания глицина несколько замедляет процесс восстановления никеля, по-видимому, из-за частичного образования более прочного триc-комплекса глицина.
Рис. 5.
Влияние концентрации глицина на скорость осаждения (1) и удельное изменение рН раствора после осаждения покрытий (2). Состав (моль/л) раствора: NiSO4 – 0.12, NaH2PO2 – 0.36, HGly – 0.05–0.40, H2Succ – 0.2, Pb2+ – 10–5; pH – 5.8.
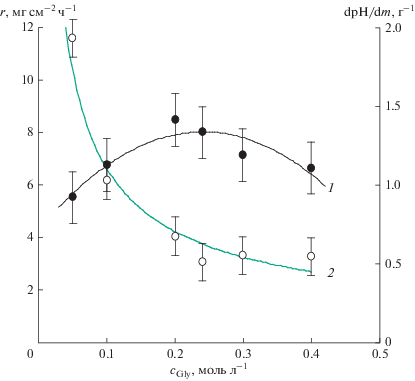
Несмотря на то, что вблизи изоэлектрической точки (pI = 6.2 [41]) глицин не проявляет буферных свойств, увеличение общей концентрации глицина приводит к стабилизации рН раствора (рис. 5). Можно предположить, что связывание ионов водорода происходит не только за счет протонирования сукцинат-ионов, но и в результате образования протонированных глицинатных комплексов никеля:
Концентрация ${\text{Ni}}({\text{HGly}})_{2}^{{2 + }},$ как следует из рис. 2, довольно велика при рН < 6.
Необходимо отметить, что приведенные результаты изменения рН в процессе осаждения относятся к объему раствора, тогда как вблизи межфазной границы, где в процессе реакции происходит подкисление раствора, величина рН может быть на 1–1.5 единицы меньше. Согласно рис. 1 и 2, при более низких значениях рН концентрация комплексного иона ${\text{Ni}}({\text{HGly}})_{2}^{{2 + }}$ несколько увеличивается, что должно приводить к росту скорости осаждения. Учет этого фактора позволяет устранить мнимое противоречие экспериментальных данных ранее установленному факту, что скорость осаждения в глицинатных растворах достигает наибольших значениях при значениях рН, близких к 7 [17, 18], хотя концентрация бис-глицинатного комплекса в среде, близкой к нейтральной, снижается. Кроме того, уменьшение кислотности раствора должно способствовать снижению скорости побочной реакции выделения водорода и более эффективному использованию восстановителя – гипофосфита на процесс формирования никель-фосфорных покрытий.
Таким образом, расчет ионных равновесий в глицинатно-сукцинатном растворе химического никелирования позволяет более глубоко понять роль каждого компонента раствора в процессе осаждения никель-фосфорного покрытия и оптимизировать количественный состав раствора для интенсификации процесса осаждения.
Если принять оптимальные концентрации ионов никеля и гипофосфита соответственно 0.12 и 0.36 моль/л, как установлено ранее [17, 18], а концентрацию глицина согласно полученным экспериментальным данным 0.2–0.3 моль/л (рис. 5) и янтарной кислоты 0.2–0.4 моль/л (рис. 3) для полного связывания ионов никеля в глицинатные и смешанные глицинатно-сукцинатные комплексы, это обеспечит стабильность раствора вследствие подавления образования гидроксокомплексов и гидроксида никеля. При этом рН раствора будет стабилизироваться на уровне 5.2–5.8 (рис. 4), что обеспечит постоянство состава и свойств получаемых покрытий; увеличение рН выше 5.8, хотя и приводит к росту скорости осаждения, не позволяет стабилизировать рН реакционной зоны раствора и соответственно состав, структуру и характеристики никель-фосфорных покрытий. Компенсировать недостаточную скорость осаждения можно увеличением температуры раствора (рис. 6).
Рис. 6.
Влияние температуры на скорость осаждения никель-фосфорных покрытий из глицинатно-сукцинатного раствора. Состав (моль/л) раствора: NiSO4 – 0.12, NaH2PO2 – 0.36, HGly – 0.24, H2Succ – 0.28, Pb2+ – 10–5; pH – 5.8.
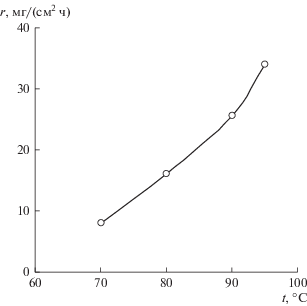
Экспериментальная проверка раствора оптимального состава подтвердила образование покрытий, содержащих 5–6 мас. % фосфора, со скоростью 8 мг/(см2 ч) (при 70°С), которую можно повысить до 30–34 мг/(см2 ч) (34–38 мкм/ч) увеличением температуры до 90–95°С. Полученные никель-фосфорные покрытия после термообработки при 400°С обладают микротвердостью 10–10.7 ГПа, что позволяет использовать их в качестве защитно-упрочняющих.
ЗАКЛЮЧЕНИЕ
Проведенные расчеты ионных равновесий в системе NiSO4–H2Sucс–HGly позволяют оценить истинный состав глицинатно-сукцинатного раствора химического никелирования и выявить роль глицина и янтарной кислоты в процессах, протекающих на растущей каталитической поверхности и в прилегающем к ней слое раствора. Предположено, что выделение металла происходит в основном из глицинатных комплексов никеля, прежде всего протонированного бис-глицинатного катиона, преобладающего при рН < 7, или бис- и трис-глицинатных комплексов при рН > 7, тогда как за буферирование раствора в слабокислой среде отвечают сукцинат-ионы и протонированные глицинатные комплексы никеля. Выдвинутые предположения подтверждаются экспериментальными данными по влиянию концентраций кислот и рН на скорость осаждения покрытия и поддержание оптимальной кислотности реакционной зоны. Теоретическое обоснование оптимального состава раствора подтверждено экспериментальными данными.
ОБОЗНАЧЕНИЯ
Список литературы
Zhang H., Zou J., Lin N., Tang B. Review On Electroless Plating Ni–P Coatings For Improving Surface Performance Of Steel // Surf. Rev. Lett. 2014. V. 21. № 4. P. 143. https://doi.org/10.1142/s0218625x14300020
Peeters P., Hoorn G.V.D., Daenen T., Kurowski A., Staikov G. Properties of electroless and electroplated Ni–P and its application in microgalvanics // Electrochim. Acta. 2001. V. 47. № 1–2. P. 161. https://doi.org/10.1016/s0013-4686(01)00546-1
Chen B.H., Hong L., Ma Y., Ko T.M. Effects of Surfactants in an Electroless Nickel-Plating Bath on the Properties of Ni–P Alloy Deposits // Ind. Eng. Chem. Res. 2002. V. 41. № 11. P. 2668. https://doi.org/10.1021/ie0105831
Shu X., He Z., Wang Y., Yin L. Mechanical properties of Ni-based coatings fabricated by electroless plating method // Surf. Eng. 2019. P. 1. https://doi.org/10.1080/02670844.2019.1662226
Panja B., Das S. K., Sahoo P. Tribological behavior of electroless ni–p coatings in various corrosive environments // Surf. Rev. Lett. 2016. V. 23. № 5. P. 1650040. https://doi.org/10.1142/s0218625x16500402
Czagany M., Baumli P., Kaptay G. The influence of the phosphorous content and heat treatment on the nano-micro-structure, thickness and micro-hardness of electroless Ni–P coatings on steel // Appl. Surf. Sci. 2017. V. 423. P. 160. https://doi.org/10.1016/j.apsusc.2017.06.168
Sudagar J., Lian J., Sha W. Electroless Nickel, Alloy, Composite and Nano Coatings – A Critical Review // J. Alloys Compd. 2013. V. 571. P. 183. https://doi.org/10.1016/j.jallcom.2013.03.107
Wang X.C., Cai W.B., Wang W.J., Liu H.T., Yu Z.Z. Effects of ligands on electroless Ni–P alloy plating from alkaline citrate–ammonia solution // Surf. Coat. Technol. 2003. V. 168. № 2–3. P. 300. https://doi.org/10.1016/s0257-8972(03)00013-6
Refaie O., Aboraia M.S., Oraby E.A., Gubner R., Rizk A.E. The effect of sodium citrate as a complex agent on the corrosion properties of the electroless Ni–P coating // Mater. Res. Express. 2018. V. 5. № 12. P. 126.
Ashtiani A.A., Faraji S., Iranagh S.A., Faraji A.H. The study of electroless Ni–P alloys with different complexing agents on Ck45 steel substrate // Arabian J. Chem. 2017. V. 10. P. 1541.
Jin Y., Yu H., Yang D., Sun D. Effects of complexing agents on acidic electroless nickel deposition // Rare Met. 2010. V. 29. № 4. P. 401. https://doi.org/10.1007/s12598-010-0138-8
Elhaloui T., Anik M., Ebn Touhami, Shaim A., Iyach K., Touir R., Sfaira M., Mcharfi M., Hammouti B. Investigation of ammonium acetate effect on electroless Ni–P deposits // J. Mater. Environ. Sci. 2015. V. 6. № 7. P. 2028.
Mayanna, S.M., Ramesh L., Sheshadri B.S. Electroless Nickel Plating—Influence of Mixed Ligands // Trans. IMF. 1996. V. 74. № 2. P. 66. https://doi.org/10.1080/00202967.1996.11871097
Vinokurov E.G., Mukhametova G.M., Burukhina T.F., Skopintsev V.D., Meshalkin V.P. Physicochemical Model of Selection of Complex Compounds for Electroless Metal Plating // Theor. Found. Chem. Eng. 2020. V. 54. № 3. P. 474. https://doi.org/10.31857/S0040357120030136 [Винокуров Е.Г., Мухаметова Г.М., Бурухина Т.Ф., Скопинцев В.Д., Мешалкин В.П. Физико-химическая модель выбора комплексныхсоединений при химическом осаждении металлических покрытий // Теор. осн. хим. технол. 2020. Т. 54. № 3. С. 354.]https://doi.org/10.1134/S0040579520030136
Sverdlov Y., Bogush V., Shacham-Diamand Y. Microstructure and Material Properties of Electroless CoWP Films obtained from Sulfamate Solutions // Microelectron. Eng. 2006. V. 83. № 11–12. P. 2243. https://doi.org/10.1016/j.mee.2006.10.012
Gylienė O., Vaškelis A., Tarozaitė R., Jagminienė A. Electrochemical investigations of Ni–P electroless deposition in solutions containing amino acetic acid // Chemija. 2007. V. 18. № 1. P. 1.
Vinokurov E.G., Morgunov A.V., Skopintsev V.D. Compositional Optimization of Chemical Copper-Doped Nickel-Phosphorus Coatings // Inorg. Mater. 2015. V. 51. № 8. P. 788. https://doi.org/10.7868/S0002337X15070192 [Винокуров Е.Г., Моргунов А.В., Скопинцев В.Д. Оптимизация состава химических никель-фосфорных покрытий, легированных медью // Неорг. матер. 2015. Т. 51. № 8. С. 859. ]https://doi.org/10.1134/S0020168515070195
Скопинцев В.Д. Моргунов А.В., Винокуров Е.Г., Невмятуллина Х.А. Повышение производительности процесса химического никелирования // Гальванотех. обраб. поверхн. 2016. Т. 24. № 3. С. 26. [Skopintsev V.D., Morgunov A.V., Vinokurov E.G., Nevmyatullina Kh.A. How to Increase the Productivity of Electroless Nickel Plating Process // Gal’vanotekh. Obrab. Poverkhn. 2016. V. 24. № 3. P. 26.] https://doi.org/10.47188/0869-5326_2016_24_3_26
Tarozaite R., Gyliene O., Stalnionis G. Adipate Adsorption and its Incorporation into NiP Coatings from Citrate Electroless Nickel Plating Solutions // Surf. Coat. Technol. 2005. V. 200. № 7. P. 2208. https://doi.org/10.1016/j.surfcoat.2004.07.099
Gao X.L., Yu G., Ouyang Y.J., Chen J.L., Lei X.P., Chen Y. Effects of Multiple Ligand Coordinations on Electroless Nickel Plating on Magnesium Alloys // Surface Engineering. 2008. V. 24. № 4. P. 295. https://doi.org/10.1179/174329408X326812
Tarozaite R., Sukackiene Z., Sudavičius A., Juškenas R., Selskis A., Jagminiene A., Norkus E. Application of Glycine Containing Solutions for Electroless Deposition of Co–P and Co–W–P Films and their Behavior as Barrier Layers // Mater. Chem. Phys. 2009. V. 117. № 1. P. 117. https://doi.org/10.1016/j.matchemphys.2009.05.016.31
Тарозайте Р., Гилене О. Регенерируемый цитратный раствор химического никелирования // Технол. констр. электрон. аппар. 2002. № 4–5. С. 43. [Tarozajte R., Gilene O. Regeneriruemyj citratnyj rastvor himicheskogo nikelirovaniya // Tekhnol. Konstr. Elektron. Appar. 2002. № 4–5. P. 43.]
Vinokurov E.G., Demidov A.V., Bondar V.V. Logistic model of ligand selection for chromium-plating electrolytes based on Cr(III) complexes // Russ. J. Coord. Chem. 2004. V. 30. № 11. P. 774. [Винокуров Е.Г., Демидов А.В., Бондарь В.В. Логистическая модель выбора лигандов для растворов хромирования на основе соединений Cr(III) // Коорд. хим. 2004. Т. 30. № 11. С. 822.]https://doi.org/10.1023/B:RUCO.0000047463.33590.33
Kuznetsov V.V., Golyanin K.E., Ladygina Y.S., Pshenichkina T.V., Lyakhov B.F., Pokholok K.V. Electrodeposition of iron–molybdenum alloy from ammonium–citrate solutions and properties of produced materials // Russ. J. Electrochem. 2015. V. 51. № 8. P. 748. [Кузнецов В.В., Голянин К.Е., Ладыгина Ю.Ш., Пшеничкина Т.В., Ляхов Б.Ф., Похолок К.В. Электроосаждение сплава железо-молибден из аммонийно-цитратных растворов и свойства полученных материалов // Электрохимия. 2015. Т. 51. № 8. С. 846.]
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. Электроосаждение цинк-никелевых покрытий из растворов оксалата аммония // Гальванотех. обраб. поверхн. 2019. Т. 27. № 1. С. 4. [Shekhanov R.F., Gridchin S.N., Balmasov A.V. Electrodeposition of Zn–Ni Coatings from Ammonium Oxalate Bath // Gal’vanotekh. Obrab. Poverkhn. 2019. V. 27. № 1. P. 4.] https://doi.org/10.47188/0869-5326_2019_27_1_4
Vinokurov E.G., Kuznetsov V.V. Bondar’ V.V. Aqueous solutions of Cr(III) sulfate: Modeling of equilibrium composition and physicochemical properties // Russ. J. Coord. Chem. 2004. V. 30. № 7. P. 496. https://doi.org/10.1023/B:RUCO.0000034791.29424.1b
Vinokurov E.G. Thermodynamic probability model of ligand selection in solutions designed for electrodeposition of alloys and multivalent metals // Prot. Met. Phys. Chem. Surf. 2010. V. 46. № 5. P. 615. [Винокуров Е.Г. Вероятностно-термодинамическая модель выбора лигандов при разработке составов растворов для электроосаждения сплавов и мультивалентных металлов // Физикохим. поверхн. защ. матер. 2010. Т. 46. № 5. С. 543.]https://doi.org/10.1134/S2070205110050205
Vinokurov E.G., Demidov A.V., Bondar’ V.V. Physicochemical model for choosing complexes for chromium-plating solutions based on Cr(III) compounds // Russ. J. Coord. Chem. 2005. V. 31. № 1. P. 14. [Винокуров Е.Г., Демидов А.В., Бондарь В.В. Физико-химическая модель выбора комплексов для растворов хромирования на основе соединений Cr(III) // Коорд. хим. 2005. Т. 31. № 1. С. 17.]https://doi.org/10.1007/s11173-005-0027-0
Vinokurov E.G., Bondar’ V.V. Logistic model for choosing ligands for alloy electrodeposition // Theor. Found. Chem. Eng. 2007. V. 41. № 4. P. 384. [Винокуров Е.Г., Бондарь В.В. Вероятностная модель выбора лигандов для электроосаждения сплавов // Теор. осн. хим. технол. 2007. Т. 41. № 4. С. 407.]https://doi.org/10.1134/S0040579507040070
Vinokurov E.G., Burukhina T.F., Bondar V.V. Mathematical model for choosing the preferable range of concentrations of ligands as components of solutions for alloy electrodeposition // Theor. Found. Chem. Eng. 2012. V. 46. № 4. P. 338. [Винокуров Е.Г., Бурухина Т.Ф., Бондарь В.В. Математическая модель выбора предпочтительной области концентраций лигандов как компонентов растворов для электроосаждения сплавов // Теор. осн. хим. технол. 2012. Т. 46. № 4. С. 396.]https://doi.org/10.1134/S0040579512040197
Sotskaya N.V., Aristov I.V., Goncharova L.G., Kravchenko T.A. Simulation of electroless plating of nickel with sodium hypophosphite // Russ. J. Appl. Chem. 1997. V. 70. № 3. P. 407. [Соцкая Н.В., Аристов И.В., Гончарова Л.Г., Кравченко Г.А. Математическое моделирование химического осаждения никеля гипофосфитом натрия // Журн. прикл. хим. 1997. Т. 70. № 3. С. 427.]
Vinokurov E.G. Mukhametova G.M., Vasil’ev V.V., Burukhina T.F., Skopintsev V.D. Influence of Characteristics of Nickel Complex Compounds on the Rate of Chemical Deposition and Composition of Nickel–Phosphorus Alloy // Theor. Found. Chem. Eng. 2019. V. 53. № 4. P. 544. [Винокуров Е.Г., Мухаметова Г.М., Васильев В.В., Бурухина Т.Ф., Скопинцев В.Д. Влияние характеристик комплексных соединений никеля на скорость химического осаждения и состав сплава никель–фосфор // Теор. осн. хим. технол. 2019. Т. 53. № 4. С. 446.]https://doi.org/10.1134/S0040579519040286
Brinkley S.R. Calculation of the equilibrium composition of systems of many constituents // J. Chem. Phys. 1947. V. 15. № 2. P. 107. https://doi.org/10.1063/1.1746420
Винокуров Е.Г., Скопинцев В.Д., Невмятуллина Х.А., Моргунов А.В. Ресурсосберегающая технология химического никелирования // Хим. пром-сть сегодня. 2016. № 10. С. 18. [Vinokurov E.G., Skopintsev V.D., Nevmyatullina Kh.A., Morgunov A.V. Resource-saving technology of electroless nickel plating // Khim. Prom-st. Segodnya. 2016. № 10. P. 18.]
Dolgikh O.V., Zuen V.T., Sotskaya. N.V. The Influence of Nickel Ions on the Buffer Capacity of Aqueous Solutions of Glycine // Russ. J. Phys. Chem. A. 2009. V. 83. № 3. P. 383. [Долгих О.В., Ву Тхи Зуен, Соцкая Н.В. Влияние ионов никеля на буферную емкость водных растворов глицина // Журн. физ. хим. 2009. Т. 83. № 3. С. 463.]https://doi.org/10.1134/S0036024409030108
Kandiner H.J., Brinkley S.R. Calculation of complex equilibrium relations // Ind. Eng. Chem. 1950. V. 42. № 5. P. 850. https://doi.org/10.1021/IE50485A030
Бугаевский А.А., Дунай Б.А. Расчет равновесного состава и связанных с ним величин на цифровых вычислительных машинах // Журн. анал. хим. 1971. Т. 26. № 2. С. 205.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высшая школа, 1993.
Шарнин В.А., Тукумова Н.В. Константы диссоциации янтарной кислоты в водно-этанольных растворах // Изв. высш. учебн. завед. Хим. хим. технол. 2007. Т. 50. № 6. С. 24. [Sharnin V.A., Tukumova N.V. Succinic Acid Dissociation Constants in Aqueous-Ethanol Solutions // Izv. Vyssh. Uchebn. Zaved., Khim. Khim. Tekhnol. 2007. V. 50. № 6. P. 24.]
Тукумова Н.В., Захаров О.В., Шарнин В.А. Комплексообразование ионов никеля (II) с янтарной кислотой в водно-этанольных растворах // Изв. высш. учебн. завед. Хим. хим. технол. 2007. Т. 50. № 12. С. 21. [Tukumova N.V., Zakharov O.V., Sharnin V.A. Complexation of Nickel(II) Ions and Succinic Acid in Aqueous-Ethanol Solutions // Izv. Vyssh. Uchebn. Zaved., Khim. Khim. Tekhnol. 2007. V. 50. № 12. P. 26.]
Kiss T., Sovago I., Gergely A. Critical Survey of the Stability Constants of Complexes of Glycine // Pure Appl. Chem. 1991. V. 63. № 4. P. 597. https://doi.org/10.1351/pac199163040597
Reddy D., Sethuram B., Rao T. N. Physico-chemical Studies of Ternary Chelates in Solution. I. Potentiometric Study of Ni(II)-Glycine-Phenylacetohydroxamic Acid System // Indian J. Chem. 1977. V. 15. P. 899.
Arnold A.P., Daignault S.A., Rabenstein D.L. Automated Equilibrium Titrator Based on a Personal Computer // Anal. Chem. 1985. V. 57. № 6. P. 1112. https://doi.org/10.1021/ac00283a034
Baes C.F., Mesmer R.E. The Hydrolysis of Cations. N.Y.: Wiley, 1976.
Arranz-Mascaros P., Lopez-Garzon R., Godino-Salido L., Gutierrez-Valero D. Reactivity of N-(6-amino-3-methyl-5-nitroso-4-oxo-3,4-dihydro-pyrimidin-2-yl)glycine with FeII, CoII, NiII, CdII and HgII metal ions // Trans. Met. Chem. 1998. V. 23. P. 501. https://doi.org/10.1023/A:1006932412218
Milic N.B., Bugarcic Z.D., Vasic M.V. Hydrolysis of the Nickel(II) in Potassium Chloride Medium // Bull. Soc. Chim., Beograd. 1980. V. 45. № 9. P. 349.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высшая школа, 1982.
Murai R., Kurakane K., Sekine T. The Stability Constants of Nickel(II) Complexes with Chloride, Thiocyanate, Sulfate, Thiosulfate, and Oxalate Ions, as Determined by a Solvent Extraction Method // Bull. Chem. Soc. Jpn. 1976. V. 49. № 1. P. 335. https://doi.org/10.1246/bcsj.49.335
Dickson A.G., Wesolowski D.J., Palmer D.A., Mesmer R.E. Dissociation Constant of Bisulfate Ion in Aqueous Sodium Chloride Solutions to 250°C // J. Phys. Chem. 1990. V. 94. № 20. P. 7978. https://doi.org/10.1021/j100383a042
Ismail N.M. Potentiometric Studies on Ternary Metal Complexes of some Aliphatic Acids and Amino Acids // J. Indian Chem. Soc. 1997. V. 74. № 5. P. 396.
Скопинцев В.Д., Винокуров Е.Г. Теоретические и прикладные аспекты автокаталитического формирования покрытий на основе сплава никель-фосфор. М.: ВИНИТИ, 2018.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


