Теоретические основы химической технологии, 2023, T. 57, № 4, стр. 371-378
Экстракция Mn(II) и Co(II) из хлоридных растворов глубоким эвтектическим растворителем ди(2-этилгексил)фосфорная кислота/ментол
И. В. Зиновьева a, А. М. Саломатин a, b, А. В. Кожевникова a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
b Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 29.05.2023
После доработки 03.06.2023
Принята к публикации 06.06.2023
- EDN: ZEACAL
- DOI: 10.31857/S0040357123040188
Аннотация
Изучена экстракция ионов Mn(II) и Co(II) из хлоридных растворов в системе с гидрофобным глубоким эвтектическим растворителем (HDES) на основе ди(2-этилгексил)фосфорной кислоты (Д2ЭГФК) и ментола в зависимости от кислотности водной фазы, состава HDES, концентрации хлорид-иона и объемного соотношения фаз системы. Установлен механизм экстракции исследуемых металлов. Проведен термодинамический анализ процесса экстракции в предложенной системе. Впервые проведена оценка возможности повторного использования HDES Д2ЭГФК/ментол на примере экстракции ионов Mn(II). Показана перспективность использования предложенного HDES для выделения металлов из водных растворов.
ВВЕДЕНИЕ
Литий-ионные аккумуляторы на сегодняшний день являются практически основными накопителями энергии и активно используются в электромобилях, портативных электронных устройствах (компьютерах, мобильных телефонах и планшетах), во возобновляемых источниках энергии (солнечной и ветровой) и др. [1, 2]. Как правило, литий-ионные аккумуляторы с расчетным сроком службы около 3–10 лет генерируют огромное количество отходов. По расчетам, до 2030 г. будет выброшено более 11 млн тонн отработанных литий-ионных аккумуляторов и только около 5% из них будут переработаны [3]. Более того, из-за быстро растущего спроса на литий-ионные аккумуляторы цена на важнейшие элементы (Li, Ni, Co, Mn и др.) [4] также значительно увеличивается. Поэтому эффективное восстановление ценных элементов из отработанных литий-ионных аккумуляторов чрезвычайно важно.
Наиболее доступным, универсальным и эффективным методом извлечения, разделения и очистки металлов является гидрометаллургический метод, включающий в себя выщелачивание, осаждение, жидкостную экстракцию и др. Осаждение чаще всего используется для удаления примесей Fe, Al и Cu. Экстракция растворителем обычно применяется для разделения NMC-металлов, таких как Mn, Co и Ni. В случае, если концентрация Cu в растворе высока, для его извлечения вместо осаждения также применяется экстракция. Литий обычно извлекается путем осаждения карбонатом натрия или диоксидом углерода [5]. Для проведения процесса выщелачивания уже предложены экологичные методы с применением гидрофильных глубоких эвтектических растворителей (DES) [6–8]. Они представляют собой смесь преимущественно двух компонентов, донора (HBD) и акцептора водородной связи (HBA), имеющую более низкую температуру плавления по сравнению с исходными компонентами. Их особенностями являются простота приготовления, дешевизна, возможность синтеза из растительного сырья, селективность, а также зачастую большая эффективность, чем растворов минеральных кислот или щелочей. Но необходимость выделения и очистки индивидуальных металлов из растворов выщелачивания является не менее важной задачей, для решения которой чаще всего применяют экстракцию.
Жидкостная экстракция является одним из наиболее перспективных, доступных, универсальных и эффективных методов извлечения, разделения и очистки металлов [9, 10]. В настоящее время наиболее перспективным классом растворителей для извлечения металлов из водных растворов являются гидрофобные глубокие эвтектические растворители [11]. Основными преимуществами данных растворителей являются доступность и большой выбор реагентов, что позволяет варьировать физико-химические свойства и достигать селективности по отношению к экстрагируемым металлам [12–14]. Совокупность этих и других преимуществ HDES делает их одним из самых перспективных экстрагентов, выгодно отличая от ионных жидкостей и классических экстрагентов.
В работе [15] впервые изучена экстракция металлов (индия и таллия) из соляно- и щавелевокислых растворов с помощью HDES на основе солей четвертичных аммониевых оснований, карбоновых кислот и ибупрофена. Авторы показали различие в механизме извлечения металлов в зависимости от содержания кислоты в водной фазе. Экстракция исследуемых ионов металлов синтезированным HDES в среде соляной кислоты происходила по анионообменному механизму. Интересно, что те же самые HDES способны извлекать металлы также и по катионообменному механизму при pH ≈ 3 благодаря карбоновой кислоте в своем составе. Ван Ош и др. использовали HDES на основе карбоновых кислот для извлечения ионов переходных и щелочных металлов [16]. Экстракция зависела от молярного соотношения HBA : HBD и была эффективна для ионов переходных металлов (степень экстракции >99%) из-за сродства карбоновых кислот к этим металлам. Ола и Мацумото использовали те же HDES (лидокаин и декановую кислоту) для разделения пары Fe/Mn [17]. Было установлено, что в зависимости от кислотности среды экстракция может происходить путем обмена с лидокаином или образования ионных пар с декановой кислотой, причем последний вариант является более благоприятным, так как предотвращает загрязнение водной фазы. Авторы показали высокую эффективность экстракции железа (~100% для 10 ммоль/л железа) и хорошую селективность по отношению к марганцу (коэффициенты разделения >100). С целью улучшения экологических преимуществ использования HDES Шеффер с соавторами синтезировали полностью натуральные гидрофобные HDES из терпенов для экстракции меди [18]. Авторы сообщили о высокой эффективности экстракции, особенно Cu, Fe и Zn при использовании декановой кислоты в сочетании с тимолом или ментолом. Однако экстракция сильно зависела от исходной концентрации металла. Когда концентрация Cu была ниже 0.01 моль/л, степень извлечения превышала 90%, но при исходной концентрации Cu 0.02 моль/л степень извлечения падала до значений ниже 50%.
Настоящее исследование направлено на изучение возможности выделения и разделения ионов Mn(II) и Co(II), зачастую совместно присутствующих в катодных материалах литий-ионных аккумуляторов [19], в экстракционной системе на основе HDES. В качестве донора водородной связи в HDES был выбран распространенный и эффективный экстрагент для извлечения ионов металлов – Д2ЭГФК [20, 21]. Акцептором водородной связи был выбран экологичный и доступный компонент – ментол, использование которого позволит не только избежать применения органических растворителей, но и снизить вязкость Д2ЭГФК [22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для экстракции использовали HDES на основе Д2ЭГФК (Acros Organic, 95%) и L-ментола (квал. “х. ч.”) без дополнительной очистки в мольном соотношении 1:1. Взвешенные на аналитических весах (Acculab ALC-210d4, США) реагенты помещали в пластиковые пробирки объемом 50 мл. Для приготовления глубокого эвтектического растворителя пробирки помещали в термостатированный шейкер (Enviro-Genie SI-1202, США) при температуре 343.15 К и перемешивали при 35 об/мин в течение 30 мин до образования гомогенной смеси. Растворы Mn(II) и Co(II) получали растворением хлоридов металлов (Химмед, >99%) в дистиллированной воде (рН 4.5, исходная концентрация металлов – 0.01 М).
Экстракцию проводили в градуированных центрифужных пробирках объемом 15 мл при соотношении водной и органической фаз 5 : 1 при стандартных условиях с использованием термостатированного шейкера. Реэкстракцию металлов проводили 0.5 М раствором соляной кислоты при соотношении водной и органической фаз 1 : 1. Градуированные пробирки помещали в шейкер и перемешивали при постоянной температуре в течение 20 мин (до установления термодинамического равновесия). Образцы после перемешивания центрифугировали при 2500 об/мин в течение 5 мин до полного расслоения фаз на центрифуге (SIA ELMI CM-6MT, Латвия). Затем фазы разделяли в делительных воронках. Концентрацию металлов в исходном растворе и в водной фазе после экстракции определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина, образующего комплексы с металлами, которые поглощают в видимой области спектра на следующих длинах волн, нм: Mn (502), Co (510) относительно холостых растворов [23]. Концентрацию ионов металлов в органической фазе определяли по разности между концентрациями в исходном растворе и в водной фазе после экстракции. Определение значений оптической плотности проводили на спектрофотометре (Экросхим ПЭ-5400УФ, Россия) в стеклянных кюветах l = 10 мм. Погрешность определения концентраций составляла <5%.
Значение рН водной фазы до и после экстракции определяли с использованием рН-метра (OHAUS Starter 5000, США) с комбинированным стеклянным электродом (STMICRO5 RU). Для расчета концентрации Д2ЭГФК в HDES была определена плотность растворителя на плотномере (Anton Paar DMA 1001, Австрия) с точностью измерения ± 0.0001 г/см3. Инфракрасные спектры органических растворов до и после экстракции были получены на ИК-спектрометре (Shimadzu IRTracer-100, Япония) в диапазоне 4000–600 см–1 с использованием приставки НПВО (Shimadzu MIRacle 10, Япония).
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Определение времени установления экстракционного равновесия является ключевым параметром процесса экстракции, особенно в случае гетерогенных систем на основе глубоких эвтектических растворителей. В сравнении с традиционными экстракционными системами, вязкость фазы HDES относительно высока вследствие образования водородных связей в HDES, замедляющих массоперенос веществ. Ранее было установлено, что значения плотности и вязкости HDES Д2ЭГФК/ментол при соотношении компонентов 1 : 1 при стандартных условиях являются удовлетворительными для проведения экстракционного процесса [22]. На рис. 1 представлены результаты исследования кинетики экстракции Mn(II) и Co(II) из хлоридных растворов в диапазоне от 1 до 60 мин. Видно, что время достижения термодинамического равновесия составляет 20 мин; все последующие эксперименты были выполнены при этом времени.
Рис. 1.
Зависимость степени извлечения ионов Mn(II) и Co(II) от времени контакта фаз; [Me] = = 0.01 моль/л, pH 4.5.
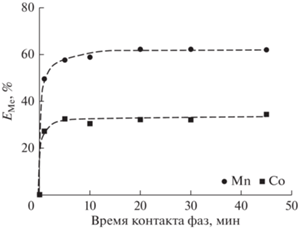
Сравнение полученных значений степени извлечения ионов Co(II) и Mn(II) предложенным HDES с извлечением металлов раствором Д2ЭГФК в толуоле (1.97 моль/л) в аналогичных условиях показало, что использование в качестве экстрагента HDES на основе Д2ЭГФК и ментола позволяет проводить экстракцию исследуемых ионов металлов из хлоридных растворов без потери эффективности извлечения и при этом избежать использования органического растворителя.
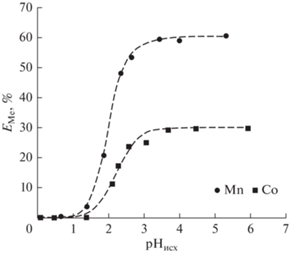
Изучена экстракция ионов Mn(II) и Co(II) в экстракционной системе на основе HDES Д2ЭГФК/ментол в зависимости от кислотности среды в диапазоне значений рН от 0 до 6 (рис. 2). Как видно из полученных данных, зависимости для ионов металлов имеют схожий характер: с увеличением значений рН степень извлечения возрастает для Mn(II) и Co(II) и достигает максимальных значений при рН 3.5 – 59.49 и 29.27%, соответственно.
Рис. 2.
Зависимость степени извлечения ионов Mn(II) и Co(II) от исходного значения рН водной фазы; [Me] = 0.01 моль/л.
Экспериментальные данные по экстракции Mn(II) и Co(II) из хлоридных растворов HDES Д2ЭГФК/ментол разного состава показывают возможность как совместного извлечения ионов металлов, так и возможность их разделения при большем содержании Д2ЭГФК в HDES (рис. 3). В табл. 1 представлены значения плотности и концентрации Д2ЭГФК при разном соотношении компонентов в HDES.
Рис. 3.
Зависимость коэффициента распределения ионов Mn(II) и Co(II) от концентрации Д2ЭГФК в HDES; [Me] = 0.01 моль/л, pH 4.5.
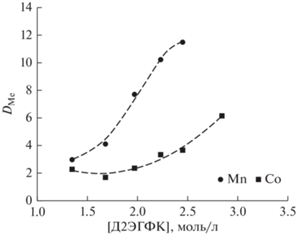
Таблица 1.
Плотность и концентрация Д2ЭГФК в HDES Д2ЭГФК/ментол различного состава при 25°C
| Д2ЭГФК/ментол | Плотность, г/см3 | [Д2ЭГФК], моль/л |
|---|---|---|
| 9 : 1 | 0.9641 | 2.84 |
| 7 : 3 | 0.9548 | 2.45 |
| 6 : 4 | 0.9497 | 2.23 |
| 5 : 5 | 0.9469 [22] | 1.97 |
| 4 : 6 | 0.9365 | 1.68 |
| 3 : 7 | 0.9305 | 1.35 |
Для интерпретации полученных данных по межфазному распределению ионов металлов в исследуемой системе было выполнено спектроскопическое исследование органической фазы до и после экстракции. Получены ИК-спектры HDES Д2ЭГФК/ментол до и после экстракции Mn(II) исходной концентрации 0.1 и 0.75 М (рис. 4).
Рис. 4.
ИК-спектры 1 – HDES, 2 – HDES после экстракции Mn из раствора с концентрацией 0.1 М, 3 – HDES после экстракции Mn из раствора с концентрацией 0.75 М.
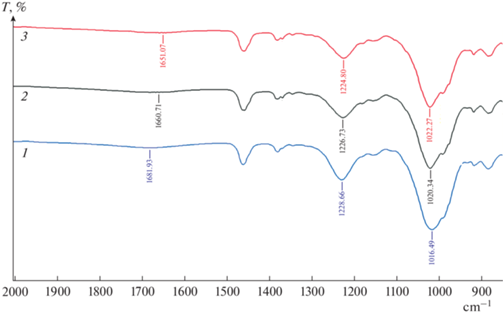
Сигналы групп P=O, P–O–C и O–H в обоих образцах HDES после экстракции сдвигаются относительно исходных. Валентным колебаниям группы P=O в гидрофобном глубоком эвтектическом растворителе до экстракции соответствует частота 1228 см–1, после – 1226 и 1225 см–1 при концентрациях 0.1 и 0.75 моль/л соответственно, что свидетельствует о координации P = O → Mn2+ ионов марганца к кислороду этой группы в комплексе, причем при увеличении исходной концентрации металла сдвиг увеличивается. Более четкий сдвиг наблюдается в случае деформационных колебаний O–H группы с 1681 см–1 в HDES до 1660 и 1651 см–1 при увеличении концентрации Mn в HDES после экстракции. Частота валентных колебаний фрагмента P–O–C [24] в HDES до экстракции – 1016 см–1, после – 1020 и 1022 см–1 при концентрациях 0.1 и 0.75 моль/л соответственно, что может быть объяснено тем фактом, что ионы марганца обмениваются на протоны молекул кислоты в процессе экстракции, что оказывает влияние на частоту колебаний соседних связей, а увеличение концентрации ионов сдвигает равновесие и частота колебаний изменяется существеннее.
В слабокислой среде экстракция цветных металлов ди(2-этилгексил)фосфорной кислотой протекает по катионобменному механизму, заключающемуся в обмене экстрагируемого металла на катион экстрагента на границе раздела фаз [21, 25]. Поскольку Mn(II) и Co(II) присутствуют в водной фазе при данных условиях преимущественно в виде катионных комплексов [26, 27], то их распределение в HDES фазу может происходить в виде солей ди(2-этилгексил)фосфорной кислоты. Таким образом, экстракцию ионов металлов можно представить в общем виде следующим уравнением:
(1)
${\text{Me}}_{{\left( {{\text{вод}}} \right)}}^{{2 + }} + 2{\text{H}}{{{\text{X}}}_{{\left( {{\text{орг}}} \right)}}} \leftrightarrow {\text{Me}}{{{\text{X}}}_{{2\left( {{\text{орг}}} \right)}}} + {\text{ }}2{\text{H}}_{{\left( {{\text{вод}}} \right){\text{\;}}}}^{ + }$(2)
${{K}_{{{\text{экстр}}}}} = \frac{{{{{\left[ {{\text{Me}}{{{\text{X}}}_{2}}} \right]}}_{{{\text{орг\;}}}}} \cdot \,\,~\left[ {{{{\text{H}}}^{ + }}} \right]_{{{\text{вод}}}}^{2}}}{{{{{\left[ {{\text{M}}{{{\text{e}}}^{{2 + }}}} \right]}}_{{{\text{вод\;}}}}} \cdot \,\,~\left[ {{\text{HX}}} \right]_{{{\text{орг}}}}^{2}}}.$Вышеприведенное уравнение можно записать в логарифмическом виде:
(3)
$\lg {\kern 1pt} {{D}_{{{\text{Me}}}}} = \lg {{K}_{{{\text{экстр}}}}}~\,\, + \,\,~2\lg {{\left[ {{\text{HX}}} \right]}_{{{\text{орг}}}}}~\,\, - ~\,\,2\lg {{[{{{\text{H}}}^{ + }}]}_{{{\text{вод}}}}},$(4)
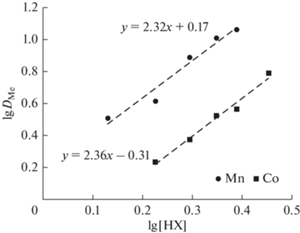
$\lg {\kern 1pt} {{D}_{{{\text{Me}}}}} = \lg {{K}_{{{\text{экстр}}}}}~\,\, + \,\,~2\lg {{\left[ {{\text{HX}}} \right]}_{{{\text{орг}}}}}~\,\, + \,\,~2{\text{pH}}{\text{.}}$Исходя из уравнения (4), изменение lgDMe в зависимости от изменения рН равновесной водной фазы должно быть линейным для Mn(II) и Co(II) с углом наклона 2, что подтверждается полученными результатами для обоих металлов (рис. 5). Видно, что углы наклона на билогарифмической зависимости показателя DMe от концентрации Д2ЭГФК в HDES равны 2.43 и 2.36 для Mn и Co, соответственно (рис. 6), что также подтверждает предложенный механизм экстракции. Анализ данных позволяет сделать вывод, что ионы металлов из хлоридных растворов с использованием HDES Д2ЭГФК/ментол извлекаются в виде катиона Me2+.
Рис. 5.
Логарифмическая зависимость коэффициента распределения ионов Mn(II) и Co(II) от значения рН равновесной водной фазы.
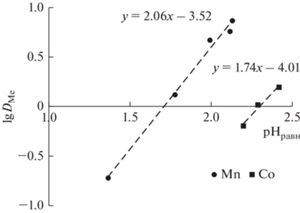
Рис. 6.
Билогарифмическая зависимость коэффициента распределения ионов Mn(II) и Co(II) от концентрации Д2ЭГФК в HDES.
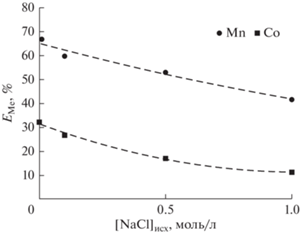
Изучено влияние хлорид-ионов на эффективность экстракции исследуемых металлов (рис. 7). Концентрация введенного в систему NaCl находилась в диапазоне 0.01–1 моль/л. Степень извлечения Mn(II) и Co(II) уменьшается с увеличением концентрации Cl– в водной фазе, что, вероятно, связано с образованием катионных комплексов марганца и кобальта, особенно при более высокой концентрации хлорид-ионов, которые не участвуют в механизме экстракции при использовании HDES на основе Д2ЭГФК. Тем самым, подтверждено, что ионы Cl- не принимают участие в предложенном механизме экстракции.
Рис. 7.
Зависимость степени извлечения ионов Mn(II) и Co(II) от концентрации NaCl; [Me] = = 0.01 моль/л, pH 4.5.
Установлена зависимость степени извлечения ионов Mn(II) и Co(II) от объемного соотношения водной и органической фаз (рис. 8). Экстракционный эксперимент был проведен при соотношении фаз 1 : 1 и далее с уменьшением органической фазы. C уменьшением объема органической фазы степень извлечения Mn(II) снижается с 88.64 до 62.29%, а в случае Co(II) – c 90.75 до 32.17%. Видно, что с увеличением объема водной фазы тенденция к разделению двух ионов металлов возрастает.
Рис. 8.
Зависимость степени извлечения ионов Mn(II) и Co(II) от соотношения фаз системы; [Me] = = 0.01 моль/л, pH 4.5.

Разработка химико-технологического процесса, его изучение и практическая реализация невозможны без предварительного термодинамического анализа. В ходе исследования были определены коэффициенты распределения ионов Mn(II) и Co(II) в диапазоне температур от 288.15 до 338.15 К. По полученным результатам построен график зависимости lgDMe от 1000/T (рис. 9), исходя из которого установлен угол наклона для расчета изменения энтальпии экстракции (ΔH) по формуле, вытекающей из уравнения Вант-Гоффа [28, 29]:
где R – универсальная газовая постоянная (8.314 Дж/моль K) и C – постоянная для системы. Значения изменения свободной энергии Гиббса (ΔG) и энтропии (ΔS) рассчитывали по уравнениюРис. 9.
Зависимость степени извлечения ионов Mn(II) и Co(II) от температуры; [Me] = 0.01 моль/л, pH 4.5.
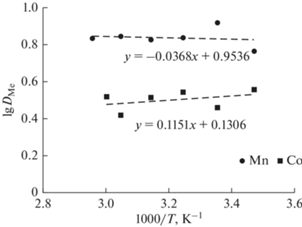
Таблица 2.
Термодинамические параметры экстракции Mn(II) и Co(II) в системе с HDES Д2ЭГФК/ментол при диапазоне температур 288.15–338.15 K
| Т, K | Mn | Co | ||||
|---|---|---|---|---|---|---|
| ΔH, кДж/моль | ΔG, кДж/моль | ΔS, Дж/моль K | ΔH, кДж/моль | ΔG, кДж/моль | ΔS, Дж/моль K | |
| 288.15 | –3.49 | –4.21 | 2.50 | –2.34 | –3.06 | 2.50 |
| 298.15 | –4.49 | –5.24 | 2.50 | –1.87 | –2.61 | 2.50 |
| 308.15 | –4.16 | –4.93 | 2.50 | –2.43 | –3.20 | 2.50 |
| 318.15 | –4.23 | –5.02 | 2.50 | –2.33 | –3.13 | 2.50 |
| 328.15 | –4.47 | –5.29 | 2.50 | –1.79 | –2.62 | 2.50 |
| 338.15 | –4.54 | –5.39 | 2.50 | –2.46 | –3.30 | 2.50 |
Экспериментальные значения изменения свободной энергия Гиббса и энтальпии для обоих металлов отрицательны, а изменение энтропии положительно, что означает самопроизвольное протекание реакции экстракции в исследуемой системе в условиях постоянной температуры и давления [28]. Экстракция Mn(II) и Co(II) является экзотермическим процессом, соответственно, более низкая температура наиболее благоприятна для экстракции в системе с HDES Д2ЭГФК/ментол. Сравнение термодинамических данных в таблице 3 показывает, что значения ΔH для Co(II) менее отрицательны, чем для Mn(II), что указывает на более слабое взаимодействие между Co-Д2ЭГФК, чем Mn-Д2ЭГФК [30].
Таблица 3.
Результаты последовательной экстракции Mn(II) из хлоридного раствора HDES Д2ЭГФК/ментол после его регенерации (соотношение объемов фаз = 1 : 1)
| % | |
|---|---|
| Экстракция I | 89.54 |
| Реэкстракция за 4 ступени | 99.36 |
| Экстракция II | 83.39 |
| Реэкстракция за 2 ступени | 99.83 |
| Экстракция III | 78.97 |
| Реэкстракция за 2 ступени | 99.73 |
| Экстракция IV | 76.36 |
Проведена оценка возможности повторного использования HDES Д2ЭГФК/ментол на примере извлечения ионов Mn(II). Для реэкстракции металла из органической фазы, полученной при его экстракции из хлоридных растворов рН 4.5, использовали 0.5М раствор соляной кислоты. В табл. 3 приведены данные по извлечению Mn(II) на каждой ступени экстракции после полной регенерации HDES. Степень реэкстракции Mn(II) соляной кислотой за одну ступень составляла около 90%. Использование нескольких ступеней реэкстракции позволяет достичь практически полного извлечения металлов в водную фазу. Показана возможность повторного использования HDES для экстракции Mn(II).
ЗАКЛЮЧЕНИЕ
Проведенные исследования по межфазному распределению ионов марганца и кобальта из хлоридных растворов в системе с гидрофобным глубоким эвтектическим растворителем дают возможность оценить поведение металлов при их экстракции из индивидуальных растворов и возможность повторного использования HDES в экстракционном цикле. В ходе настоящего исследования получены количественные характеристики экстракции Mn(II) и Co(II) в системе с HDES Д2ЭГФК/ментол. Установлен механизм экстракции металлов, который соответствует переходу металла в органическую фазу в виде Me2+. Изучена кинетика экстракции, влияние кислотности водной фазы, соотношение компонентов HDES, концентрации хлорид ионов и объемного соотношения фаз экстракционной системы на извлечение Mn и Co. В ходе термодинамического анализа установлено, что процесс экстракции в исследуемой системе является экзотермическом, и протекает самопроизвольно. Показана возможность повторного использования HDES для экстракции Mn(II).
Полученные результаты демонстрируют перспективность предложенной экстракционной системы на основе HDES Д2ЭГФК/ментол для решения практических задач.
Исследование выполнено за счет гранта Российского научного фонда № 20-13-00387, https://rscf.ru/project/20-13-00387/.
Список литературы
Golmohammadzadeh R., Faraji F., Rashchi F. Recovery of Lithium and Cobalt from Spent Lithium Ion Batteries (LIBs) Using Organic Acids as Leaching Reagents: A Review. Resour Conserv Recycl 2018, 136, 418–435, https://doi.org/10.1016/j.resconrec.2018.04.024
Pham H.D., Horn M., Fernando J.F.S., Patil R., Phadatare M., Golberg D., Olin H., Dubal D.P. Spent Graphite from End-of-Life Li-Ion Batteries as a Potential Electrode for Aluminium Ion Battery. Sustainable Materials and Technologies 2020, 26, e00230, https://doi.org/10.1016/j.susmat.2020.e00230
Garole D.J., Hossain R., Garole V.J., Sahajwalla V., Nerkar J., Dubal D.P. Recycle, Recover and Repurpose Strategy of Spent Li-ion Batteries and Catalysts: Current Status and Future Opportunities. ChemSusChem 2020, 13, 3079–3100. https://doi.org/10.1002/cssc.201903213
Or T., Gourley S.W.D., Kaliyappan K., Yu A., Chen Z. Recycling of Mixed Cathode Lithium-ion Batteries for Electric Vehicles: Current Status and Future Outlook. Carbon Energy 2020, 2, 6–43.https://doi.org/10.1002/cey2.29
Neumann J., Petranikova M., Meeus M., Gamarra J.D., Younesi R., Winter M., Nowak S. Recycling of Lithium-Ion Batteries—Current State of the Art, Circular Economy, and Next Generation Recycling. Adv Energy Mater 2022, 12, 2102917. https://doi.org/10.1002/aenm.202102917
Peeters N., Binnemans K., Riaño S. Solvometallurgical Recovery of Cobalt from Lithium-Ion Battery Cathode Materials Using Deep-Eutectic Solvents. Green Chemistry 2020, 22, 4210–4221. https://doi.org/10.1039/D0GC00940G
Pateli I.M., Thompson D., Alabdullah S.S.M., Abbott A.P., Jenkin,G.R.T., Hartley J.M. The Effect of PH and Hydrogen Bond Donor on the Dissolution of Metal Oxides in Deep Eutectic Solvents. Green Chemistry 2020, 22, 5476–5486. https://doi.org/10.1039/D0GC02023K
Zinov’eva I.V., Fedorov A.Ya., Milevskii N.A., Zakhodyaeva Yu.A., Voshkin A.A. Dissolution of Metal Oxides in a Choline Chloride–Sulphosalicylic Acid Deep Eutectic Solvent. Theoretical Foundations of Chemical Engineering 2021, 55, 663–670. https://doi.org/10.1134/S0040579521040370
Vasilyev F., Virolainen S., Sainio T. Numerical Simulation of Counter-Current Liquid–Liquid Extraction for Recovering Co, Ni and Li from Lithium-Ion Battery Leachates of Varying Composition. Sep Purif Technol 2019, 210, 530–540.https://doi.org/10.1016/j.seppur.2018.08.036
Vieceli N., Nogueira C.A., Pereira M.F.C., Durão F.O., Guimarães C., Margarido F. Optimization of Metals Extraction from Spent Lithium-Ion Batteries by Sulphuric Acid and Sodium Metabisulphite through a Techno-Economic Evaluation. J Environ Manage 2018, 228, 140–148.https://doi.org/10.1016/j.jenvman.2018.08.085
Florindo C., Branco L.C., Marrucho I.M. Quest for Green-Solvent Design: From Hydrophilic to Hydrophobic (Deep) Eutectic Solvents. ChemSusChem 2019, 12, 1549–1559.https://doi.org/10.1002/cssc.201900147
Zhu A., Bian X., Han W., Cao D., Wen Y., Zhu K., Wang S. The Application of Deep Eutectic Solvents in Lithium-Ion Battery Recycling: A Comprehensive Review. Resour Conserv Recycl 2023, 188, 106690. https://doi.org/10.1016/j.resconrec.2022.106690
Milevskii N.A., Zinov’eva I.V., Zakhodyaeva Yu.A., Voshkin A.A. Separation of Li(I), Co(II), Ni(II), Mn(II), and Fe(III) from Hydrochloric Acid Solution Using a Menthol-Based Hydrophobic Deep Eutectic Solvent. Hydrometallurgy 2022, 207, 105777.https://doi.org/10.1016/j.hydromet.2021.105777
Kozhevnikova A.V., Zinov’eva I.V., Zakhodyaeva Y.A., Baranovskaya V.B., Voshkin A.A. Application of Hydrophobic Deep Eutectic Solvents in Extraction of Metals from Real Solutions Obtained by Leaching Cathodes from End-of-Life Li-Ion Batteries. Processes 2022, 10, 2671. https://doi.org/10.3390/pr10122671
Tereshatov E.E., Boltoeva M.Yu., Folden C.M. First Evidence of Metal Transfer into Hydrophobic Deep Eutectic and Low-Transition-Temperature Mixtures: Indium Extraction from Hydrochloric and Oxalic Acids. Green Chemistry 2016, 18, 4616–4622.https://doi.org/10.1039/C5GC03080C
van Osch D.J.G.P., Parmentier D., Dietz C.H.J.T., van den Bruinhorst A., Tuinier R., Kroon M.C. Removal of Alkali and Transition Metal Ions from Water with Hydrophobic Deep Eutectic Solvents. Chemical Communications 2016, 52, 11987–11990.https://doi.org/10.1039/C6CC06105B
Ola P.D., Matsumoto M. Use of Deep Eutectic Solvent as Extractant for Separation of Fe (III) and Mn (II) from Aqueous Solution. Sep Sci Technol 2019, 54, 759–765. https://doi.org/10.1080/01496395.2018.1517796
Schaeffer N., Martins M.A.R., Neves C.M.S.S., Pinho S.P., Coutinho J.A.P. Sustainable Hydrophobic Terpene-Based Eutectic Solvents for the Extraction and Separation of Metals. Chemical Communications 2018, 54, 8104–8107.https://doi.org/10.1039/C8CC04152K
Schmuch R., Wagner R., Hörpel G., Placke T., Winter M. Performance and Cost of Materials for Lithium-Based Rechargeable Automotive Batteries. Nat Energy 2018, 3, 267–278. https://doi.org/10.1038/s41560-018-0107-2
Vieceli N., Reinhardt N., Ekberg C., Petranikova M. Optimization of Manganese Recovery from a Solution Based on Lithium-Ion Batteries by Solvent Extraction with D2EHPA. Metals (Basel) 2020, 11, 54. https://doi.org/10.3390/met11010054
Hoh Y.-C., Chuang W.-S., Lee B.-D., Chang C.-C. The Separation of Manganese from Cobalt by D2EHPA. Hydrometallurgy 1984, 12, 375–386. https://doi.org/10.1016/0304-386X(84)90008-2
Zinov’eva I.V., Kozhevnikova A.V., Milevskii N.A., Zakhodyaeva Yu.A., Voshkin A.A. Extraction of Cu(II), Ni(II), and Al(III) with the Deep Eutectic Solvent D2EHPA/Menthol. Theoretical Foundations of Chemical Engineering 2022, 56, 221–229. https://doi.org/10.1134/S0040579522020178
Ivanov A.V., Figurovskaya V.N., Ivanov V.M. Molecular Absorption Spectroscopy of 4-(2-Pyridilazo)Resorcinol Complexes as Alternative for the Atomic Absorption Spectroscopy. Moscow University Chemistry Bulletin 1992, 33, 570–574.
Jin Y., Ma Y., Weng Y., Jia X., Li J. Solvent Extraction of Fe3+ from the Hydrochloric Acid Route Phosphoric Acid by D2EHPA in Kerosene. J. Industrial and Engineering Chemistry 2014, 20, 3446–3452. https://doi.org/10.1016/j.jiec.2013.12.033
Yudaev P.A., Kolpinskaya N.A., Chistyakov E.M. Organophosphorous Extractants for Metals. Hydrometallurgy 2021, 201, 105558. https://doi.org/10.1016/j.hydromet.2021.105558
Gammons C.H., Seward T.M. Stability of Manganese (II) Chloride Complexes from 25 to 300°C. Geochim Cosmochim Acta 1996, 60, 4295–4311. https://doi.org/10.1016/S0016-7037(96)00275-X
Coleman J.S. Chloride Complexes of Cobalt(II) in Anion and Cation Exchangers. J. Inorganic and Nuclear Chemistry 1966, 28, 2371–2378.https://doi.org/10.1016/0022-1902(66)80128-8
Liu X. Thermodynamics of Solvent Extraction of Rare and Scattered Metal-Indium with Diethylhexylmonothiophosphoric Acid1. Chem Res Chin Univ 2006, 22, 111–113. https://doi.org/10.1016/S1005-9040(06)60057-3
Liu Y., Tong L.-H., Inoue Y., Hakushi T. Thermodynamics of Solvent Extraction of Metal Picrates with Crown Ethers: Enthalpy–Entropy Compensation. Part 2. Sandwiching 1 : 2 Complexation. J. Chem. Soc., Perkin Trans. 2 1990, 1247–1253. https://doi.org/10.1039/P29900001247
Yuan X., Cai Y., Chen L., Lu S., Xiao X., Yuan L., Feng W. Phosphine Oxides Functionalized Pillar[5]Arenes for Uranyl Extraction: Solvent Effect and Thermodynamics. Sep Purif Technol 2020, 230, 115843.https://doi.org/10.1016/j.seppur.2019.115843
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


