Теоретические основы химической технологии, 2023, T. 57, № 6, стр. 646-660
Денитрогенизация легких углеводородных фракций природными глубокими эвтектическими растворителями на серийном экстракционном оборудовании
Д. В. Лобович a, С. В. Соловьева a, Н. А. Милевский a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 25.09.2023
После доработки 27.09.2023
Принята к публикации 29.09.2023
- EDN: AHLESB
- DOI: 10.31857/S0040357123060131
Аннотация
Гидрофильные глубокие эвтектические растворители активно позиционируются как эффективные экстрагенты для удаления гетероциклических соединений из легких углеводородных фракций. Особый интерес вызывает подкласс натуральных глубоких эвтектических растворителей (Natural deep eutectic solvents, NaDES), поскольку в их состав входят вещества исключительно природного происхождения. Однако к настоящему времени отсутствуют систематические исследования этих процессов на экстракционном оборудовании. Для изучения процесса противоточной экстракции пиридина, хинолина и индола из модельного раствора легких углеводородных фракций на серийном оборудовании ряд NaDES на основе лимонной и яблочной кислот, ксилита и воды был впервые использован в данной работе. Продемонстрирована высокая экстракционная способность данных NaDES в лабораторных экспериментах, а также установлен механизм экстракции. Детальное исследование эффективности экстракции гетероциклов при варьировании различных условий позволило перейти к изучению процесса с использованием экстракторов типа смеситель–отстойник. Модельный раствор легких углеводородных фракций был очищен от пиридина, хинолина и индола до концентрации <1 ppm по схеме противоточной экстракции на каскаде из шести смесителей-отстойников.
ВВЕДЕНИЕ
При использовании продуктов нефтепереработки, например моторных топлив, содержащиеся в них гетероциклические соединения азота окисляются до их газообразных оксидов NOx. Попадание этих веществ в атмосферу является одной из главных проблем загрязнения окружающей среды [1, 2]. Как известно, содержание азотистых гетероциклических соединений в легких фракциях нефти может достигать 2% [3]. Использование каталитической гидроочистки, как основного метода глубокой очистки топлива, вызывает сложности при извлечении азотсодержащих соединений [4, 5].
В промышленности для извлечения гетероциклических соединений из продуктов нефтепереработки экстракционным методом традиционно используют N-метилпирролидон [6], сульфолан [7], диметилсульфоксид [8] и диметилформамид [9]. Эти вещества применяются уже несколько десятилетий, однако их использование приводит к трудностям с регенерацией, потери из-за летучести и выбросов в окружающую среду, пожароопасности и токсичности процесса в целом [10]. В последние годы проведено много исследований по поиску альтернативных растворителей для жидкостной экстракции [11–14]. Большое внимание долгое время уделялось ионным жидкостям, так как они имеют высокую экстракционную способность не только по отношению к ионам металлов [15], но и азотсодержащим соединениям [16–18]. В работе [19] извлечение пиридина из модельного топлива достигает 70% при использовании ионной жидкости 1-пентил-3-метилмидазолий бис(трифторметилсульфонил)имида. Высокие показатели извлечения хинолина (~99%) проявляют ионные жидкости на основе 1-метил-3-бутилимидазолия и 3(3-сульфопропил)имидазолия [20]. Извлечение индола из модельного раствора каменноугольной смолы в работе [21] достигает 95.2 и 81.9% ионными жидкостями 1,1,3,3-тетраметилгуанидин лактат и 1,1,3,3-тетраметилгуанидин перхлорат соответственно. Однако, помимо их известных достоинств, стоит отметить, что использование ионных жидкостей в промышленных процессах затруднительно так как их физико-химические свойства не достаточно удовлетворительны. В частности, ионные жидкости имеют высокую стоимость [20, 21], высокую вязкость [24], а их использование может вести к загрязнению окружающей среды [23, 24].
Глубокие эвтектические растворители (deep eutectic solvents DES) имеют лучшие физико-химические характеристики в сравнении с ионными жидкостями, а также их важным преимуществом является то, что они биоразлагаемые, их получение более простое, поскольку происходит простым смешением компонентов. Известно, что глубокие эвтектические растворители применяют как альтернативные экстрагенты в таких отраслях промышленности, как гидрометаллургия [27, 28], так же сообщалось, что DES на основе солей четвертичных аммониевых и фосфониевых оснований имеют высокую экстракционную способность по отношению к основным и кислотным соединениям азота. Например, глубокие эвтектические растворители на основе холин хлорида позволяют извлекать пиридин и карбазол на ~99.2 и ~96.3%, соответственно [29]. В работе [30] глубокие эвтектические растворители на основе метилтрифенилфосфоний бромида и уксусной кислоты показывают эффективность извлечения хинолина 93.6% и пиррола 98.5%. Такую высокую экстракционную способность имеют растворители, вторым компонентом которых являются кислоты. Глубокий эвтектический растворитель на основе холин хлорида и этиленгликоля в работе [29] извлекает карбазол с эффективностью 40.1%, а пиридин – 6.5%, глубокие эвтектические растворители на основе яблочной кислоты и фруктозы, лимонной кислоты и этиленгликоля количественно извлекают пиридин, не извлекая при этом индол. Однако применение глубоких эвтектических растворителей на основе солей четвертичных аммониевых и фосфониевых оснований на производстве затруднено ввиду их высокой вязкости.
В работе [31] были приготовлены природные глубокие эвтектические растворители (NaDES): яблочная кислота : лимонная кислота : вода в мольном соотношении 1 : 1 : 10 (MA–CA–H2O), лимонная кислота : ксилит : вода 1 : 1 : 10 (CA–Xyl–H2O) и яблочная кислота : ксилит : вода 1 : 1 : 10 (MA–Xyl–H2O), которые являются стабильными в широком температурном диапазоне и обладают низкой вязкостью (CA–Xyl–H2O – 11.09 ± 0.21 мПа с, MA–Xyl–H2O – 9.54 ± 0.08 мПа с, MA–CA–H2O – 9.24 ± 0.06 мПа с). Учитывая физико-химические свойства, доступность, дешевизну и экологичность компонентов, данные глубокие эвтектические растворители могут быть применены на реальном экстракционном оборудовании, поэтому в настоящей работе они были впервые использованы для экстракции пиридина, хинолина и индола из модельного раствора легких углеводородных фракций. С целью осуществления масштабирования процесса NaDES впервые были опробованы на серийном экстракционном оборудовании.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
Спецификация химических веществ, которые были использованы в данной работе представлена в табл. 1. Все вещества были использованы без дополнительной очистки.
Таблица 1.
Химические реактивы
| Вещество | Химическая формула | Чистота, % | Номер CAS | Поставщик |
|---|---|---|---|---|
| Яблочная кислота | С4Н6О5 | >99.0 | 97-67-6 | ХИММЕД |
| Лимонная кислота | C6H8O7 | >99.0 | 5949-29-1 | РЕАХИМ |
| Ксилит | C5H7(OH)5 | >99.0 | 87-99-0 | АМК-групп |
| н-Гексан | C6H14 | 99.7 | 110-54-3 | ХИММЕД |
| Индол | C8H7N | >99.0 | 120-72-9 | Acros Organics |
| Хинолин | C9H7N | >99.0 | 91-22-5 | Acros Organics |
| Пиридин | C5H5N | >99.0 | 110-86-1 | ХИММЕД |
Синтез NaDES
Глубокие эвтектические растворители MA–CA–H2O, CA–Xyl–H2O, MA–Xyl–H2O готовили по методике, описанной в литературе [31]. Навески компонентов глубокого эвтектического растворителя взвешивали на аналитических весах (OHAUS Explorer, Switzerland), помещали их в стакан, добавляли воду и перемешивали на магнитной мешалке (ULAB US-4150D, China) при температуре 60°С в течение 30 мин. После охлаждения до комнатной температуры образовывалась гомогенная жидкость. Все полученные смеси оставались стабильными при комнатной температуре.
Методика экспериментов по экстракции
Модельный раствор легких углеводородных фракций готовили путем растворения точных навесок гетероциклов в н-гексане. Процесс экстракции проводили в градуированных пластиковых пробирках с крышкой путем смешивания модельного раствора и глубокого эвтектического растворителя. Смесь перемешивали в шейкере (ELMI RM-1L, Riga, Latvia) при комнатной температуре (20°С) и скорости вращения 45 об/мин в течение 10 мин для достижения термодинамического равновесия и затем центрифугировали в течении 5 мин при 2500 об/мин (CM-6MT, SIA ELMI, Riga, Latvia). Остаточную концентрацию компонентов в н-гексане после экстракции определяли спектрофотометрическим методом в кварцевых кюветах с длиной оптического пути 1 мм. Длины волн, соответствующие максимуму поглощения для пиридина, индола и хинолина составляли 251, 266 и 271 нм соответственно. Концентрацию компонентов в фазе NaDES определяли по материальному балансу.
Количественные характеристики процесса экстракции определяли по формулам:
(2)
${{E}_{i}} = \frac{{n_{{{\text{in}}}}^{i} - {\text{\;}}n_{{{\text{org}}}}^{i}}}{{n_{{{\text{in}}}}^{i}}} \times 100,$Для установления механизма экстракции использовали 1Н ЯМР-спектры, полученные на Bruker Fourier 300 HD spectrometer (Billerica, MA, United States). В качестве растворителя использовали диметилсульфоксид-d6.
Эксперименты на экстракционном оборудовании
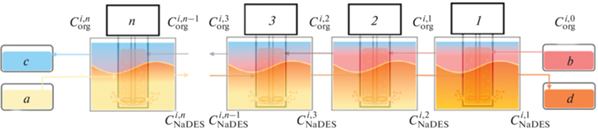
Для изучения процесса противоточной экстракции использовали установку, которая представляет собой каскад экстракторов типа смеситель-отстойник (SOLVEX, Россия) с объемом каждого аппарата 50 мл. Принципиальная схема установки представлена на рис. 1.
Рис. 1.
Схема противоточной экстракции: (a) – глубокий эвтектический растворитель (фаза NaDES), (б) – исходный раствор компонентов в н-гексане (органическая фаза), (в) – очищенная органическая фаза, (г) – фаза NaDES после экстракции.
Корпус экстрактора и мешалок выполнен из полипропиленовых плотно прилегающих друг к другу элементов в целях обеспечения коррозионной стойкости и препятствия улетучивания органической фазы. Общий вид собранной установки представлен на рис. 2. Вид ячейки каскада сверху представлен на рис. 3.
Рис. 3.
Вид сверху камеры смесителя-отстойника: (a) – камера-смеситель, (б) – мешалка, (в) – камера-отстойник.

Каждая ячейка представляет собой экстрактор типа смеситель-отстойник, состоящий из двух камер – цилиндрической камеры смешения (рис. 3а), в которую помещалась мешалка (рис. 3б) и происходил процесс диспергирования фаз и камеры-отстойника (рис. 3в), где происходил процесс расслаивания фаз и перелива в соответствующие выходы. Органическая фаза и фаза NaDES подводились в ячейки через соответствующие штуцеры a (рис. 4) с помощью перистальтического насоса (Shenchen Pump, Baoding, China). Расход органической фазы составлял 1.4 мл/мин, фазы NaDES – 2.8 мл/мин. После расслаивания в камере-отстойнике фаза NaDES выводилась из ячейки через штуцер b (рис. 4), а органическая фаза – через штуцер с (рис. 4).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве альтернативных экологически безопасных экстрагентов для извлечения пиридина, хинолина и индола из модельного раствора легких углеводородных фракций нефти предложены три природных глубоких эвтектических растворителя MA–CA–H2O, CA–Xyl–H2O и MA–Xyl–H2O. Экспериментально было изучено время установления экстракционного равновесия в системах на основе предложенных NaDES при объемном соотношении VNaDES/Vorg = 1/1 и начальных конентрациях Сpyr = 0.008 моль/л; Cquin = 0.005 моль/л; Cind = 0.003 моль/л, которое составило 1 мин для пиридина и хинолина и 10 мин для индола. Для удобства проведения последующих экспериментов контакт фаз проводили в течение 10 мин для всех гетероциклов. Степень извлечения пиридина и хинолина для всех NaDES составляет >97%, а в случае индола снижается в ряду MA–CA–H2O (60.5%) > MA–Xyl–H2O (44.3%) > CA–Xyl–H2O (34.4%). Менее эффективное извлечение индола вероятно связано с тем, что экстракция данных гетероциклов происходит по кислотно-основному механизму. Наличие основных центров в пиридине и хинолине способствует их извлечению с помощью кислот в составе NaDES. Поскольку неподеленная пара электронов атома азота в индоле является частью сопряженной системы ароматического кольца, основные свойства данная молекула не проявляет, что и объясняет его меньшую эффективность извлечения. Так же можно сделать вывод о том, что ксилит выступает в роли инертного компонента NaDES, поскольку гидроксильные группы в молекуле ксилита не обладают выраженными кислотными свойствами.
Для подтверждения вышесказанной теории следующим этапом настоящего исследования было установление механизма экстракции гетероциклов NaDES. 1Н ЯМР использовали для сравнения химических сдвигов атомов Н между индивидуальным гетероциклом и гетероциклом, связанным с NaDES. Взаимодействие между молекулами может возникать по трем механизмам:
(1) Водородная связь между кислотой Бренстеда (NH-группой индола) с основным центром Льюиса глубокого эвтектического растворителя;
(2) Водородная связь между основанием Льюиса (атомом азота) и кислотной группой −OH глубокого эвтектического растворителя;
(3) Слабое взаимодействие ароматических протонов гетероциклов и атомов кислорода карбоксильных групп кислот в NaDES.
Как показано на рис. 5 (1, 4, 7) H(a) из группы –NH индола, а также другие пики, соответствующие ароматическим атомам H смещаются в более сильное поле. Данные результаты подтверждают взаимодействие (1) и (3). В случае пиридина на рис. 5 (2, 5, 8) сигнал ароматического H(a) не смещается, но при этом H(b) и H(c) смещаются в более слабое поле. Из этого можно сделать вывод, что N отдал электрон активному атому H глубокого эвтектического растворителя и электроны его ароматических водородов (H(b) и H(c)) стали стремится к H(a), из чего следует предположение о сильном взаимодействии (2). На ЯМР спектрах хинолина на рис. 5 (3, 6, 9) сигналы ароматических H(b, e, f, g) смещаются в более слабое поле, из чего также можно сделать вывод о сильном взаимодействии (2). Полученные данные показывают, что для кислотного азота наблюдаются сильные взаимодействия (1) и (3), так как в состав глубокого эвтектического растворителя входят кислоты, возможно взаимодействие (1) проявляется слабо, это показывает более низкую экстрагируемость индола в сравнении с пиридином и хинолином. У оснóвного азота взаимодействие (2) является доминирующим и это указывает на высокую экстракционную способность глубоких эвтектических растворителей по отношению к хинолину и пиридину. Схожий механизм был предложен авторами работы [32] при экстракции гетероциклов dcPEG-250/TEACl.
В промышленных процессах содержание примесей в легких углеводородных фракциях – величина переменная, поэтому необходимо учитывать влияние этого параметра на характеристики экстракции [5, 33]. Однако как показали результаты экспериментов (рис. 6) степень извлечения экстрагируемых соединений практически не зависит от исходной концентрации. Соответственно, предложенные NaDESs подходят для очистки легких углеводородных фракций нефти от примесей азотсодержащих гетероциклических соединений во всем диапазоне их возможных концентраций в легких углеводородных фракциях.
Рис. 5.
1H ЯМР спектры: (a) – глубокий эвтектический растворитель, (b) – гетероциклический азотистый компонент, (c) – гетероциклический азотистый компонент в глубоком эвтектическом растворителе; 1-индол и глубокий эвтектический растворитель (MA–CA), 2-пиридин и глубокий эвтектический растворитель (MA–CA), 3-хинолин и глубокий эвтектический растворитель (MA–CA), 4-индол и глубокий эвтектический растворитель (MA–Xyl), 5-пиридин и глубокий эвтектический растворитель (MA–Xyl), 6-хинолин и глубокий эвтектический растворитель (MA–Xyl), 7-индол и глубокий эвтектический растворитель (CA–Xyl), 8-пиридин и глубокий эвтектический растворитель (CA–Xyl), 9‑хинолин и глубокий эвтектический растворитель (CA–Xyl).
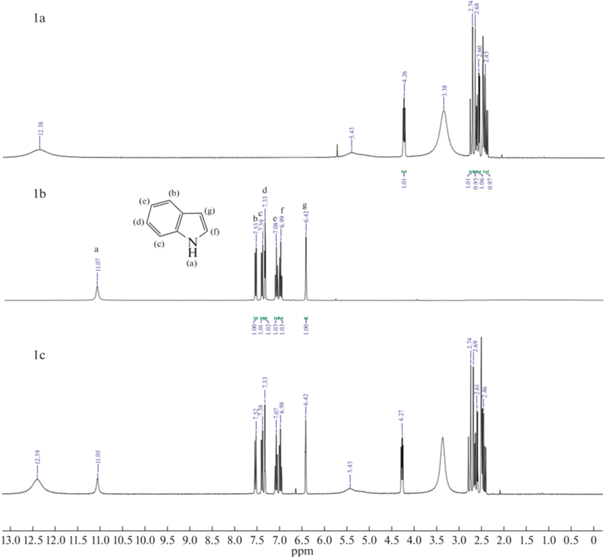
Рис. 5.
Продолжение.
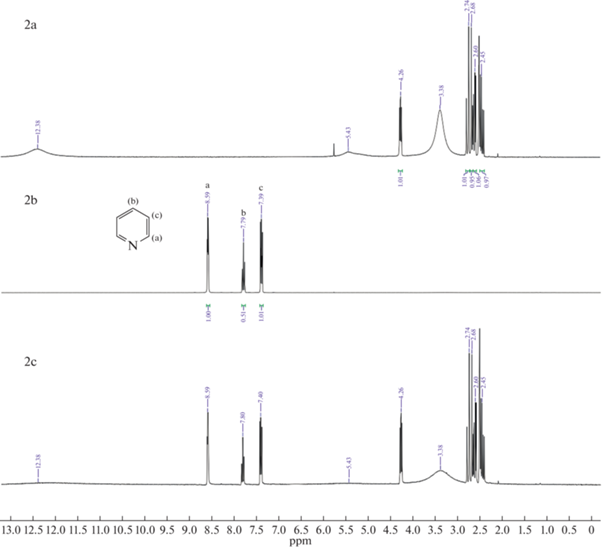
Рис. 5.
Продолжение.
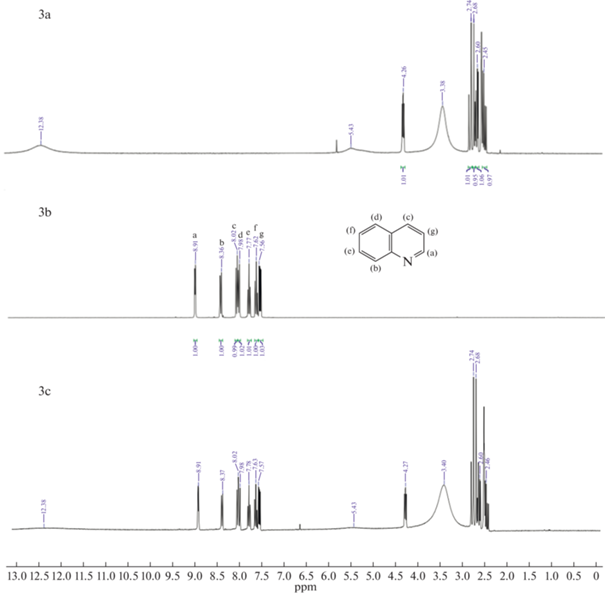
Рис. 5.
Продолжение.
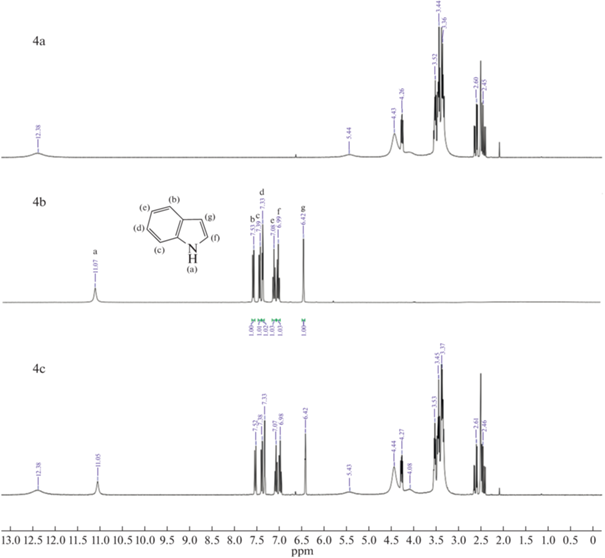
Рис. 5.
Продолжение.
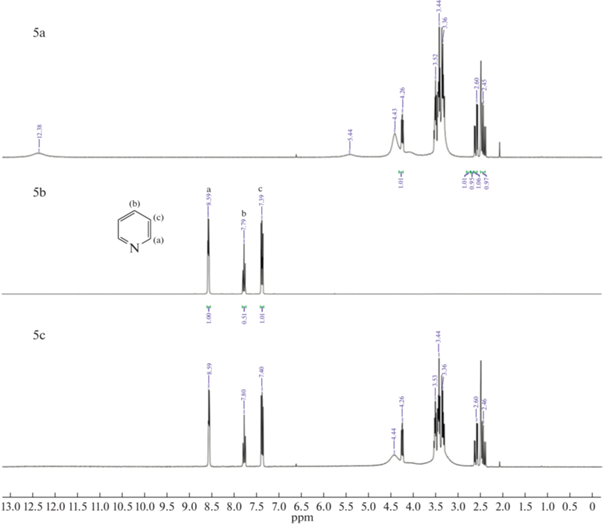
Рис. 5.
Продолжение.
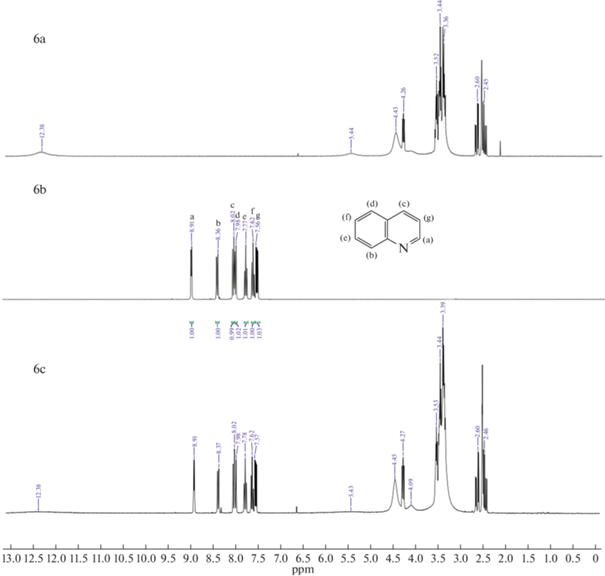
Рис. 5.
Продолжение.
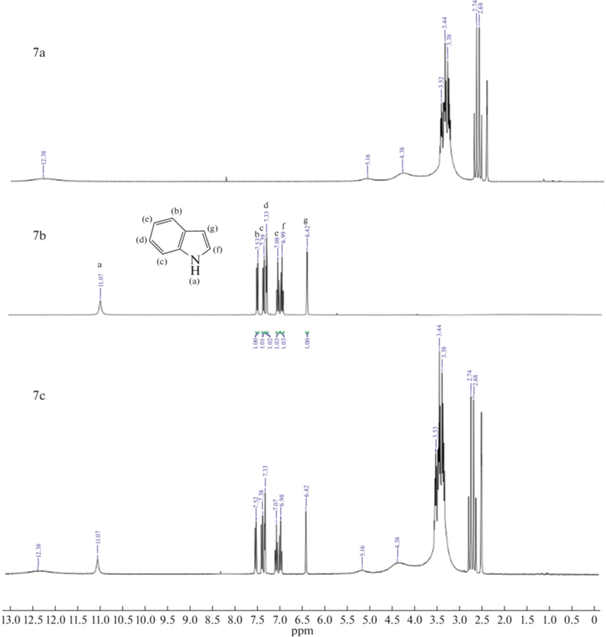
Рис. 5.
Окончание.
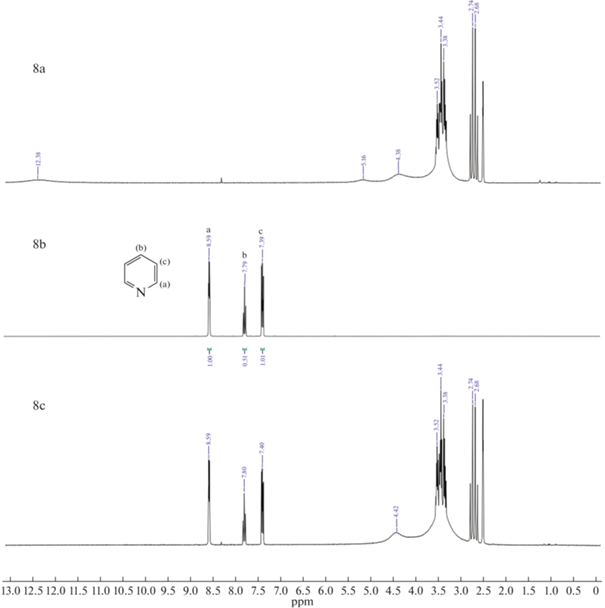
Рис. 6.
Зависимость степени извлечения пиридина (1), хинолина (2) и индола (3) из н-гексана MA–CA–H2O (а), MA–Xyl–H2O (б) и CA–Xyl–H2O (в) от исходной концентрации.
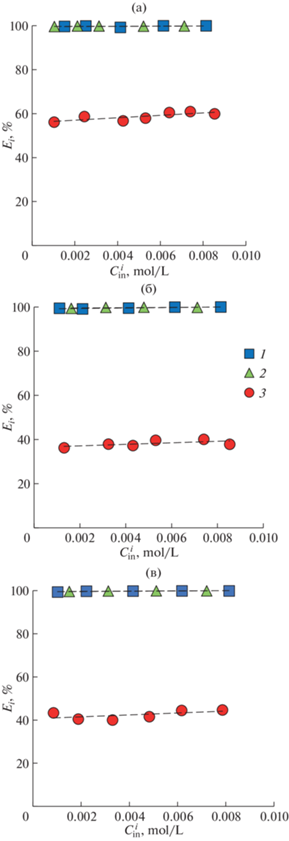
Изучено влияние объемного соотношения фаз на эффективность экстракции азотсодержащих гетероциклических соединений (рис. 7). Видно, что эффективность экстракции индола уменьшается c увеличением объема фазы н-гексана, при этом экстрагируемость пиридина и хинолина практически постоянна. Однако столь резкое падение эффективности экстракции индола при снижении объемного соотношения вероятно связано с его кислотными свойствами.
Рис. 7.
Зависимость степени извлечения пиридина (1), хинолина (2) и индола (3) из н-гексана MA–CA–H2O (а), MA–Xyl–H2O (б) и CA–Xyl–H2O (в) от объемного соотношения фаз. Сpyr = 0.008 моль/л; Cquin = = 0.005 моль/л; Cind = 0.003 моль/л.
Таким образом, для обеспечения высокой эффективности извлечения всех гетероциклов из н-гексана объемное соотношение фаз NaDES/н-гексан было выбрано 2/1 для дальнейшего проведения процесса на экстракционных установках. Полученные в данном разделе данные позволяют перейти к теоретическому изучению.
С целью масштабирования исследуемый процесс были реализован на установке, состоящей из каскада смесителей–отстойников, соединенных в противоточном режиме. Количество ступеней экстракции для выделения хинолина, индола и пиридина из н-гексана при найденых ранее условиях рассчитывалось по формуле:
(3)
$n = \frac{{\lg \left( {q~ - ~\frac{{\lambda \left( {q - 1} \right)}}{D}} \right)}}{{\lg ~\frac{D}{\lambda }}},$Из расчета следует, что для выделения компонентов до остаточной концентрации в органической фазе менее 1 ppm необходимо 6 ступеней экстракции.
Исходный раствор представлял собой смесь пиридина, хинолина и индола в н-гексане с концентрациями 0.008, 0.005 и 0.003 моль/л соответственно. Данный раствор подавался в аппарат с расходом 1.4 мл/мин, в то время как экстрагент подавался с расходом 2.8 мл/мин для достижения соотношения фаз в камере смешения VNaDES/Vorg = 2/1. После завершения эксперимента органическая фаза с остаточной концентрацией компонентов была отобрана из каждой ячейки и проанализирована спектрофотометрическим методом. Эффективность работы каскада экстракторов для извлечения индола, хинолина и пиридина из н-гексана до их содержания менее 1 ppm показана в табл. 2–4.
Таблица 2.
Концентрация компонентов в органической фазе на каждой ступени экстракции при использовании MA–CA–H2O
| Ступень | Сorg, ppm | ||
|---|---|---|---|
| пиридин | хинолин | индол | |
| 1 | <1 | 35 | 353 |
| 2 | <1 | <1 | 206 |
| 3 | <1 | <1 | 90 |
| 4 | <1 | <1 | 29 |
| 5 | <1 | <1 | 6 |
| 6 | <1 | <1 | <1 |
Таблица 3.
Концентрация компонентов в органической фазе на каждой ступени экстракции при использовании MA–Xyl–H2O
| Ступень | Сorg, ppm | ||
|---|---|---|---|
| пиридин | хинолин | индол | |
| 1 | 10 | 31 | 614 |
| 2 | <1 | <1 | 356 |
| 3 | <1 | <1 | 208 |
| 4 | <1 | <1 | 54 |
| 5 | <1 | <1 | 6 |
| 6 | <1 | <1 | <1 |
Таблица 4.
Концентрация компонентов в органической фазе на каждой ступени экстракции при использовании CA–Xyl–H2O
| Ступень | Сorg, ppm | ||
|---|---|---|---|
| пиридин | хинолин | индол | |
| 1 | 8 | 25 | 597 |
| 2 | <1 | <1 | 286 |
| 3 | <1 | <1 | 149 |
| 4 | <1 | <1 | 55 |
| 5 | <1 | <1 | 16 |
| 6 | <1 | <1 | <1 |
Результаты показывают, что очистка от азотистых гетероциклических соединений до их содержания менее 1 ppm достигается за 6 ступеней экстракции, при этом несмотря на разную экстракционную способность глубоких эвтектических растворителей по отношению к индолу, выделение компонентов выбранными NaDES достижимо за одинаковое количество ступеней экстракции. По результатам данного эксперимента можно сделать вывод о том, что физико-химические свойства используемых NaDES не затрудняют массообмен в экстракционном оборудовании.
ЗАКЛЮЧЕНИЕ
В работе предложены природные глубокие эвтектические растворители MA–CA–H2O, MA–Xyl–H2O и CA–Xyl–H2O для экстракции азотистых гетероциклических соединений из легких углеводородных фракций. Показана высокая экстракционная способность предложенных NaDES по отношению к азотистым гетероциклическим соединениям. Результаты экспериментов экстракции гетероциклических соединений NaDES в периодическом режиме позволили рассчитать и реализовать процесс в нерерывном режиме. С использованием противоточной схемы в каскаде смесителей-отстойников модельный раствор был денитронизирован за 6 ступеней экстракции до остаточного содержания гетероциклических соединений менее 1 ppm. Результаты данного исследования показывают возможность применения предложенных NaDES в технологических процессах очистки легких углеводородных фракций от азотсодержащих гетероциклических соединений.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках государственного задания Института общей и неорганической химии им. Курнакова РАН.
Исследования выполнены с использованием оборудования ЦКП ФМИ ИОНХ РАН.
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
| NaDES | Natural deep eutectic solvents |
| ЯМР | ядерный магнитный резонанс |
| dcPEG-250 | Poly(ethylene glycol) Diacid-250 |
| TEACl | Tetraethylammonium Chloride |
| Di | коэффициент распределения i-го компонента |
| Ei | степень извлечения i-го компонента из н‑гексана, % |
| $C_{{{\text{org}}}}^{i}$ | концентрация i-го компонента в органической фазе, моль/л |
| $C_{{{\text{NADES}}}}^{i}$ | концентрация i-го компонента в фазе NaDES, моль/л |
| $C_{{{\text{in}}}}^{i}$ | начальная концентрация i-го компонента в органической фазе, моль/л |
| $n_{{{\text{in}}}}^{i}$ | начальное количество вещества i-го компонента в органической фазе, моль |
| $n_{{{\text{org}}}}^{i}$ | количество вещества i-го компонента в органической фазе после экстракции. |
| VNaDES | объем фазы NaDES, л |
| Vorg | объем органической фазы, л |
| kj | коэффициент массопереноса |
| a | межфазная поверхность |
| cj,∞ | равновесная концентрация компонента в фазе j |
| cj | концентрация компонента в фазе j при времени t |
| t | время, с |
| n | количество ступеней экстракции |
| q | степень обеднения |
| $\lambda $ | объемное соотношение фаз |
Список литературы
Federal Register :: Control of Air Pollution From Motor Vehicles: Tier 3 Motor Vehicle Emission and Fuel Standards. – URL: https://www.federalregister.gov/ documents/2013/05/21/2013-08500/controlof-air-pollution-from-motor-vehicles-tier-3-motorvehicle-emission-and-fuel-standards
World health statistics 2022: monitoring health for the SDGs, sustainable development goals. URL: https://www.who.int/publications-detail-redirect/97892-40051157.
Wang Z., Wang Z., Sun Z., Ma K., Du L., Yuan R. Evolution of S/N containing compounds in pyrolysis of highly oily petroleum sludge // Fuel. 2022. V. 318. P. 123687.
Rashidi S., Khosravi Nikou M.R., Anvaripour B. Adsorptive desulfurization and denitrogenation of model fuel using HPW and NiO-HPW modified aluminosilicate mesostructures // Microporous and Mesoporous Materials. 2015. V. 211. P. 134–141.
Jiang X., Zhu S., Gao J., Yu Y., Xiong C., Li C., Yang W. Extractive removal of both basic and non-basic nitrogens from fuel oil by dicarboxyl-modified polyethylene glycol: Performance and mechanism // Fuel. 2019. V. 254. P. 115626.
Gaile A.A., Kostenko A.V., Semenov L.V., Koldobskaya L.L. Extraction of 1-Methylnaphthalene, Benzothiophene, and Indole with N-Methylpyrrolidone from Their Mixtures with Alkanes // Russian J. Applied Chemistry. 2005. V. 78. № 9. P. 1403–1407.
Lemaoui T., Benguerba Y., Darwish A.S., Hatab F.A., Warrag S.E.E., Kroon M.C., Alnashef I.M. Simultaneous dearomatization, desulfurization, and denitrogenation of diesel fuels using acidic deep eutectic solvents as extractive agents: A parametric study // Separation and Purification Technology. 2021. V. 256. P. 117861.
Mohsen-Nia M., Modarress H., Doulabi F., Bagheri H. Liquid + liquid equilibria for ternary mixtures of (solvent + aromatic hydrocarbon + alkane) // The J. Chemical Thermodynamics. 2005. V. 37. № 10. P. 1111–1118.
Mokhtar W.N.A.W., Bakar W.A.W.A., Ali R., Kadir A.A.A. Deep desulfurization of model diesel by extraction with N,N-dimethylformamide: Optimization by Box–Behnken design // J. Taiwan Institute of Chemical Engineers. 2014. V. 45. № 4. P. 1542–1548.
Rodriguez N.R., Requejo P.F., Kroon M.C. Aliphatic–Aromatic Separation Using Deep Eutectic Solvents as Extracting Agents // Industrial & Engineering Chemistry Research. 2015. V. 54. № 45. P. 11404–11412.
Zakhodyaeva Yu.A., Solov’ev V.O., Zinov’eva I.V., Rudakov D.G., Timoshenko A.V., Voshkin A.A. Interphase Distribution of Thiophene, Toluene, and o-Xylene in the Hexane–Polymer–Water Extraction System // Theoretical Foundations of Chemical Engineering. 2019. V. 53. № 4. P. 550–555.
Solov’ev V.O., Zakhodyaeva Yu.A., Voshkin A.A. On the Influence of Additives of Polymer, Sodium Nitrate, and 1-Methyl-2-Pyrrolidone on the Extraction of Thiophene in an n-Hexan–Water System // Theoretical Foundations of Chemical Engineering. 2020. V. 54. № 5. P. 894–899.
Soloviev V.O., Solovieva S.V., Zakhodyaeva Yu.A., Voshkin A.A. Extraction of Thiophene with Methyl Ether of Polyethylene Glycol 350 // Theoretical Foundations of Chemical Engineering. 2021. V. 55. № 6. P. 1178–1184.
Solov’ev V.O., Solov’eva S.V., Zakhodyaeva Y.A., Voshkin A.A. Extractive denitrogenization of liquid model fuel using polyethylene glycol methyl ether 350 // The Canadian J. Chemical Engineering. 2023. P. cjce.25096.
Kozhevnikova A.V., Zinov’eva I.V., Milevskii N.A., Zakhodyaeva Y.A., Voshkin A.A. Complex extraction of rare earth elements from nitrate solutions with a tri-n-octylamine-octanoic acid bifunctional ionic liquid // J. Molecular. Liquids. 2023. V. 390. P. 123073.
Królikowski M., Więckowski M., Zawadzki M. Separation of organosulfur compounds from heptane by liquid–liquid extraction with tricyanomethanide based ionic liquids. Experimental data and NRTL correlation // The J. Chemical Thermodynamics. 2020. V. 149. P. 106149.
Zhang Z., Li Y., Gao J., Yohannes A., Song H., Yao S. Removal of Pyridine, Quinoline, and Aniline from Oil by Extraction with Aqueous Solution of (Hydroxy)quinolinium and Benzothiazolium Ionic Liquids in Various Ways // Separations. 2021. V. 8. № 11. P. 216.
Królikowska M., Królikowski M., Domańska U. Effect of Cation Structure in Quinolinium-Based Ionic Liquids on the Solubility in Aromatic Sulfur Compounds or Heptane: Thermodynamic Study on Phase Diagrams // Molecules. 2020. V. 25. № 23. P. 5687.
Rogošić M., Sander A., Pantaler M. Application of 1-pentyl-3-methylimidazolium bis(trifluoromethylsulfonyl) imide for desulfurization, denitrification and dearomatization of FCC gasoline // The J. Chemical Thermodynamics. 2014. V. 76. P. 1–15.
Wang H., Xie C., Yu S., Liu F. Denitrification of simulated oil by extraction with H2PO4-based ionic liquids // Chemical Engineering J. 2014. V. 237. P. 286–290.
Zhang T., Bing X., Wang D., Gao J., Zhang L., Xu D., Zhang Y., Wang Y. Extraction and multi-scale mechanism explorations for separating indole from coal tar via tetramethylguanidine-based ionic liquids // J. Environmental Chemical Engineering. 2021. V. 9. № 3. P. 105255.
Jiao T., Ren C., Lin S., Zhang L., Xu X., Zhang Y., Zhang W., Liang P. The extraction mechanism research for the separation of indole through the formation of deep eutectic solvents with quaternary ammonium salts // J. Molecular Liquids. 2022. V. 347. P. 118325.
Dai Y., Van Spronsen J., Witkamp G.-J., Verpoorte R., Choi Y.H. Natural deep eutectic solvents as new potential media for green technology // Analytica Chimica Acta. 2013. V. 766. P. 61–68.
Tang B., Bi W., Tian M., Row K.H. Application of ionic liquid for extraction and separation of bioactive compounds from plants // J. Chromatography B. 2012. V. 904. P. 1–21.
Zuo Y., Wu J., Chen X., Wei N., Tong J. Green and low-cost deep eutectic solvents for efficient extraction of basic and non-basic nitrides in simulated oils // Separation and Purification Technology. 2023. V. 325. P. 124714.
Chandran D., Khalid M., Walvekar R., Mubarak N.M., Dharaskar S., Wong W.Y., Gupta T.C.S.M. Deep eutectic solvents for extraction-desulphurization: A review // J. Molecular Liquids. 2019. V. 275. P. 312–322.
Milevskii N.A., Zinov’eva I.V., Kozhevnikova A.V., Zakhodyaeva Y.A., Voshkin A.A. Sm/Co Magnetic Materials: A Recycling Strategy Using Modifiable Hydrophobic Deep Eutectic Solvents Based on Trioctylphosphine Oxide // International J. Molecular Sciences, 2023. V. 24. № 18. P. 14032.
Zinov’eva I.V., Kozhevnikova A.V., Milevskii N.A., Zakhodyaeva Yu.A., Voshkin A.A. Extraction of Cu(II), Ni(II), and Al(III) with the Deep Eutectic Solvent D2EHPA/Menthol // Theoretical Foundations of Chemical Engineering. 2022. V. 56. № 2. P. 221–229.
Ali M.C., Yang Q., Fine A.A., Jin W., Zhang Z., Xing H., Ren Q. Efficient removal of both basic and non-basic nitrogen compounds from fuels by deep eutectic solvents // Green Chemistry. 2016. V. 18. № 1. P. 157–164.
Darwish A.S., Abu Hatab F., Lemaoui T., A.Z. Ibrahim O., Almustafa G., Zhuman B., E.E. Warrag S., Hadj-Kali M.K., Benguerba Y., Alnashef I.M. Multicomponent extraction of aromatics and heteroaromatics from diesel using acidic eutectic solvents: Experimental and COSMO-RS predictions // J. Molecular Liquids. 2021. V. 336. P. 116575.
Santana A.P.R., Mora-Vargas J.A., Guimarães T.G.S., Amaral C.D.B., Oliveira A., Gonzalez M.H. Sustainable synthesis of natural deep eutectic solvents (NADES) by different methods // J. Molecular Liquids. 2019. V. 293. P. 111452.
Zhu S., Xu J., Cheng H., Gao J., Jiang X., Li C., Yang W. Poly(ethylene glycol) Diacid-Based Deep Eutectic Solvent with Excellent Denitrogenation Performance and Distinctive Extractive Behavior // Energy & Fuels. 2019. V. 33. № 10. P. 10380–10388.
Yao H., Yang D., Li C., Wang E. Intensification of water on the extraction of pyridine from n-hexane using ionic liquid // Chemical Engineering and Processing – Process Intensification. 2018. V. 130. P. 61–66.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии




