Успехи современной биологии, 2019, T. 139, № 6, стр. 577-582
Иммунометаболические ассоциации при заболеваниях сложного генеза
А. М. Земсков 1, В. М. Земсков 2, *, М. А. Луцкий 1, С. С. Попов 1, А. Н. Пашков 1, В. А. Земскова 1
1 Воронежский государственный медицинский университет им. Н.Н. Бурденко
Воронеж, Россия
2 Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского
Москва, Россия
* E-mail: arturrego@yandex.ru
Поступила в редакцию 10.05.2019
После доработки 13.05.2019
Принята к публикации 13.05.2019
Аннотация
На клинических моделях ишемического и геморрагического инсультов, отягощенных метаболическим синдромом, и диффузных заболеваний печени при оценке иммунобиохимических показателей и использовании формализованной статистики показано: формирование под влиянием метаболического синдрома качественно однотипной, количественно более выраженной при геморрагическом инсульте, реакции в виде дисбаланса первичных и вторичных продуктов свободно радикального окисления липидов и белков, преимущественной активации ферментативных и неферментативных механизмов антиоксидантной системы на фоне накопления провоспалительных цитокинов, а у пациентов с диффузными заболеваниями печени – наличие универсального механизма связи интенсивности окислительного стресса (свободнорадикальное окисление) с развитием цитолитического синдрома, отклонениями липидного обмена, иммунного статуса, инициации механизмов апоптоза.
ВВЕДЕНИЕ
Поскольку реализация феноменов иммунного реагирования неразрывно ассоциирована с метаболическими процессами – системой цАМФ/цГМФ (циклический аденозинмонофосфат/циклический гуанозинмонофосфат), синтезом нуклеиновых кислот, белков, антител, цитокинов, модификацией рецепторов иммунокомпетентных клеток, высвобождением регулирующих факторов – низкомолекулярных нуклеиновых кислот, острофазовых белков, продуктов распада иммунных глобулинов, активацией фагоцитарных ферментов и др. указанное функциональное единство иммуно-биохимических процессов является проявлением единого феномена – метаболического иммунитета с перспективной возможностью его направленной регуляции (Луцкий и др., 2011, 2016; Попов и др., 2014; Земсков и др., 2016).
МАТЕРИАЛЫ И МЕТОДЫ
На разрешение было поставлено исследование влияния признаков метаболического синдрома (МС) – увеличения индекса массы тела, уровня глюкозы, инсулина, дисбаланса липопротеидов высокой и низкой плотности, гипертонической болезни 1–2 стадии на иммунолабораторные расстройства у больных ишемическим (ИИ) и геморрагическим (ГИ) инсультами; изучение влияния метаболических нарушений при диффузных заболеваниях печени – диабетического неалкогольного стеатогепатита (НАСГ), алкогольного гепатита (АГ) и лекарственного гепатита (ЛГ) на степень цитолитического синдрома гепатоцитов, показатели липидного и углеводного обменов, иммунного статуса, интенсивность окислительного стресса и процессы апоптоза.
Под наблюдением находились 50 здоровых лиц, 50 больных с ИИ, 50 больных с ГИ, осложненными МС; 74 пациента с АГ, 87 с НАСГ и 105 больных с ЛГ.
У пациентов определяли: (1) индекс массы тела (ИМТ); (2) параметры углеводного обмена – глюкозу, инсулин, гликозилированный гемоглобин (Hb Alc); (3) липидного обмена – общего холестерина (ОХ), липопротеидов высокой и низкой плотности (ЛПВП и ЛПНП); (4) свободнорадикального окисления (СРО) липидов и белков – кетодиенов (КД), диеновых конъюгатов (ДК), малонового диальдегида (МДА), битирозиновых сшивок (БС), оснований Шиффа (ОШ); (5) показателей антиоксидантной системы – общей окислительной активности плазмы (ООА), общей окислительной способности (ООС), супероксиддисмутазы (СОД), витамина Е (ВЕ), восстановленного глутатиона (ВГ), общей антиокислительной активности липидов крови (ААЛ), глютатионпероксидазы (ГП), глутатионредуктазы (ГР), каталазы (К). В специальном исследовании для оценки интенсивности СРО и общей антиоксидантной активности применяли метод биохемилюминесценции. В качестве параметров цитокинового профиля использовали (6) интерлейкины 1, 2, 4, 6, 8 (ИЛ-1, -2, -4, -6, -8), интерферон гамма (ИНФ-γ), фактор некроза опухолей (ФНО); (7) иммунных – сывороточные иммунные глобулины основных классов (IgА, М, G), циркулирующие иммунные комплексы (ЦИК); (8) функции печени – аминотрансферазы (АКТФ), глютатионтранспептидазы (ГТП), холинэстеразы (ХЭ), аконитатгидратазы (аГ); (9) интенсивности апоптотических процессов – степень фрагментации ДНК лимфоцитов крови и активности каспаз (Попов, 2016).
С помощью параметрических и непараметрических критериев у больных учитывали отличия лабораторных показателей от нормативного уровня, от исходных параметров, от их значений после традиционной терапии. Для оценки вариаций параметров осуществляли группировку изученных показателей по методам исследования с ранговым рейтинговым анализом в двух версиях: путем определения рангов отличий величин параметров от заданного уровня по шкале (значительные – >66%, cредние – 33–66%, несущественные – <33% вариации) и выстраиванием показателей по порядку, согласно модульным значениям коэффициента диагностической ценности с подсчетом суммы рейтинговых номеров параметров с трактовкой, учитывая: чем она меньше – тем выше отличия. С помощью Kj выявляли сигнальные исходные и итоговые формулы расстройств иммунной системы (ФРИС), формулы смещения показателей (ФСП), формулы мишеней иммунокоррекции (ФМИ), ключевых показателей ФМИ, независимых от базового лечения больных (ФМИсоб) (Земсков и др., 1999, 2015; Энциклопедия …, 2013).
Для установления взаимосвязи метаболических параметров, окислительного стресса, апоптотических процессов с нарушениями иммунной системы у больных с диффузными заболеваниям печени с помощью комплекса статистических программ (Statistica 8.0 (StatSoft, Inc.)) были определены “умеренные” и “сильные” связи между изученными лабораторными показателями с коэффициентом ранговой корреляции Спирмена более 0.3 при уровне значимости Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трактовка иммунометаболических нарушений при патологических процессах основана на том, что процессы СРО занимают центральное место в метаболизме клетки, служат источником энергии, необходимой для жизнедеятельности, готовят пластический материал для создания и обновления клеточных структур, регулируют реакции, связанные с метаболизмом углеводов, липидов и белков. При ступенчатой деградации полиненасыщенных липидов в реакциях СРО образуются первичные, вторичные и конечные молекулярные продукты, играющие важную роль в процессах структурной модификации биомембран и изменений их физико-химических свойств (Vladimirov, Proskurnina, 2009). К первичным продуктам относят диеновые конъюгаты, кетодиены, к вторичным – малоновый диальдегид, битирозин, основания Шиффа.
В норме содержание продуктов СРО невелико, что достигается наличием в организме постоянно функционирующей эндогенной системы антиоксидантной защиты (АОЗ), ограничивающей процессы СРО липидов и белков с помощью ферментативных (супероксиддисмутазы, каталазы, пероксидазы, глутатионредуктазы, глутатионпероксидазы) и неферментативных (витамина Е, восстановленного глутатиона, общих тиолов, антирадикальной активности липидов крови) механизмов.
Указанные процессы ассоциированы с цитокиновой системой про- и противовоспалительных интерлейкинов, интерферонов, прочих факторов, регулирующих иммунные реакции, кроветворение, воспаление, процессы дифференцировки, регенерации клеток и др. (Soundravally, 2014).
Ишемический и геморрагический инсульты, осложненные метаболическим синдромом
Данные обследования больных с указанными заболеваниями обобщены в табл. 1.
Таблица 1.
Влияние метаболического синдрома на иммунолабораторные показатели у больных ишемическим и геморрагическим инсультами
| Показатель | Контроль нормы n = 50 |
ИИ + МС n = 50 |
ГИ + МС n = 50 |
ИИ от ГИ |
|---|---|---|---|---|
| ИМТ, кг/м2 | 20.5 ± 0.1 | 23.3 ± 0.1 | 24.7 ± 0.12 | |
| Показатели СРО | ||||
| КД, ОЕ/мл × 100 | 16.1 ± 0.5 | 17.0 ± 0.5* | 22.9 ± 2.2* | + |
| ДК, ОЕ/мл × 100 | 39.1 ± 0.1 | 42.2 ± 0.1* | 55.8 ± 0.2* | + |
| МДА, мкМ/мл | 1.6 ± 0.003 | 1.9 ± 0.003* | 1.7 ± 0.06* | – |
| БС, ОЕ/мл × 100 | 0.3 ± 0.002 | 0.4 ± 0.002* | 0.36 ± 0.002* | – |
| ОШ, ОЕ/мл × 100 | 30.8 ± 0.3 | 38.2 ± 0.2* | 34.9 ± 0.2* | – |
| Показатели АОС | ||||
| ВЕ, мкМ/л | 25.7 ± 0.3 | 19.2 ± 0.3* | 20.9 ± 0.4* | + |
| ВГ, мМ/л | 0.4 ± 0.001 | 0.44 ± 0.001* | 0.3 ± 0.002* | – |
| ААЛ, квант/с мл | 60.4 ± 0.4 | 40.3 ± 0.4* | 51.9 ± 0.3* | + |
| СОД, ОЕ/мг | 1.2 ± 0.02 | 1.3 ± 0.012* | 1.4 ± 0.001* | + |
| ГП, мкМ/л мин | 9.8 ± 0.05 | 8.5 ± 0.09 * | 20.9 ± 0.05* | + |
| ГР, мкМ/л мин | 367.9 ± 1.1 | 390.7 ± 2.9* | 401.5 ± 1.1* | + |
| К, мкМ/л мин | 36.6 ± 0.5 | 37.5 ± 0.5* | 39.6 ± 0.3* | – |
| Цитокины | ||||
| ИЛ-1, пг/мл | 1.4 ± 0.03 | 2.1 ± 0.02* | 3.5 ± 0.04* | + |
| ИЛ-4, пг/мл | 1.8 ± 0.05 | 1.1 ± 0.01* | 0.7 ± 0.03* | – |
| ИЛ-6, пг/мл | 2.9 ± 0.1 | 4.8 ± 0.4* | 5.9 ± 0.09* | + |
| ИЛ-8, пг/мл | 3.9 ± 0.01 | 6.7 ± 0.2* | 8.5 ± 0.08* | + |
| ИНФ-γ, пг/мл | 15.8 ± 0.3 | 22.5 ± 0.8* | 29.7 ± 0.6* | + |
| ФНО, пг/мл | 4.7 ± 0.1 | 12.1 ± 0.33* | 17.4 ± 0.1* | + |
Как следует из полученных данных, при ИИ и ГИ, отягощенных метаболическим синдромом (МС), у больных сформировалась однотипная качественная реакция: стимуляция от нормативного уровня образования первичных и вторичных продуктов СРО (ДК, КД, МДА, БС, ОШ), активация основных ферментативных механизмов АОС (СОД, К, ГР), кроме сниженного ГП и торможения неферментативных факторов (ВЕ, ВГ, ААЛ), накопление провоспалительных (ИЛ-1, ИЛ-6, ИЛ-8, ИНФ-γ, ФНО) и снижение противовоспалительного (ИЛ-4) цитокинов.
Указанные данные можно охарактеризовать как окислительный стресс на фоне активации воспалительных процессов.
При прямом сопоставлении значений иммунометаболических показателей при ГИ относительно ИИ, установлено преимущественное накопление первичных и уменьшение вторичных продуктов СРО, то есть их дисбаланс; увеличение концентрации большинства ферментативных, неферментативных факторов АОС и всех изученных провоспалительных цитокинов.
С помощью модуля Кj был выстроен итоговый снижающийся рейтинг изученных лабораторных параметров, относящихся к СРО, АОС, к цитокинам с определением вектора и степени изменений каждого и порядкового номера (ранга) показателя (Земсков и др., 2015).
Установлено, что при ишемическом инсульте снижающийся рейтинг показателей имел следующий
вид: ${\text{ИЛ6}}_{{\text{2}}}^{{\text{ + }}}$ → ${\text{ОШ}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ДК}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{КД}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{К}}_{{\text{1}}}^{{\text{ + }}}$ → → ${\text{ИЛ8}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{МДА}}_{1}^{ - }$ → ${\text{БС}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ИЛ1}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ФНО}}_{{\text{1}}}^{{\text{ + }}}$ → → ${\text{СОД}}_{{\text{1}}}^{{\text{ + }}}$ → 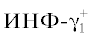 → ${\text{ГП}}_{{\text{3}}}^{{\text{ + }}}$ → ${\text{ВЕ}}_{1}^{ - }$ → ${\text{ААЛ}}_{1}^{ - }$ → → ${\text{ИЛ}}4_{2}^{ - }$ → ${\text{ГР}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ИЛ2}}_{{\text{2}}}^{{\text{ + }}}{\text{;}}$
→ ${\text{ГП}}_{{\text{3}}}^{{\text{ + }}}$ → ${\text{ВЕ}}_{1}^{ - }$ → ${\text{ААЛ}}_{1}^{ - }$ → → ${\text{ИЛ}}4_{2}^{ - }$ → ${\text{ГР}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ИЛ2}}_{{\text{2}}}^{{\text{ + }}}{\text{;}}$
при геморрагическом инсульте: ${\text{ДК}}_{{\text{2}}}^{{\text{ + }}}$ → ${\text{ФНО}}_{{\text{1}}}^{{\text{ + }}}$ → → ${\text{ИЛ2}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{КД}}_{{\text{2}}}^{{\text{ + }}}$ → ${\text{ОШ}}_{1}^{ - }$ → ${\text{К}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ИЛ6}}_{{\text{2}}}^{{\text{ + }}}$ → → ${\text{МДА}}_{1}^{ - }$ → ${\text{ИЛ8}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{БС}}_{1}^{ - }$ → ${\text{ВГ}}_{1}^{ - }$ → → ${\text{СОД}}_{1}^{ - }$ → ${\text{ВЕ}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ИЛ1}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ААЛ}}_{{\text{1}}}^{{\text{ + }}}$ → → ${\text{ИЛ}}4_{1}^{ - }$ → ${\text{ГП}}_{3}^{ + }$ → ${\text{ГР}}_{1}^{{\text{ + }}}.$
→ ${\text{ВЕ}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ИЛ1}}_{{\text{1}}}^{{\text{ + }}}$ → ${\text{ААЛ}}_{{\text{1}}}^{{\text{ + }}}$ → → ${\text{ИЛ}}4_{1}^{ - }$ → ${\text{ГП}}_{3}^{ + }$ → ${\text{ГР}}_{1}^{{\text{ + }}}.$
Подсчет суммы рангов лабораторных показателей, относящихся к отдельным вариантам обмена у больных, позволяет количественно сопоставить выраженность соответствующих изменений между собой.
Так, при ИИ + МС сумма рангов СРО составила 28, АОС – 96, цитокинов – 75; при ГИ + МС – соответственно – 24, 91, 59. Приведенные данные свидетельствуют, что геморрагический инсульт с метаболическим синдромом обусловливает более выраженные изменения окисления липидов и белков, антиоксидантной системы и цитокинового профиля.
Этот же метод расчета Кj позволяет определить сигнальные показатели ключевых формул лабораторных расстройств при обоих нозоформах заболеваний. При ИИ + МС формула имела вид: ${\text{ИЛ6}}_{{\text{2}}}^{{\text{ + }}}$${\text{ОШ}}_{{\text{1}}}^{{\text{ + }}}$${\text{ДК}}_{{\text{1}}}^{{\text{ + }}}$ – накопление провоспалительного ИЛ-6 второй степени, а также оснований Шиффа и диеновых конъюгатов первой степени; при ГИ + МС → ${\text{ДК}}_{{\text{2}}}^{{\text{ + }}}$${\text{ФНО}}_{{\text{2}}}^{{\text{ + }}}$${\text{ИЛ2}}_{{\text{2}}}^{{\text{ + }}}$ – стимуляция образования диеновых конъюгатов, ФНО альфа и ИЛ-2 средней выраженности во всех случаях.
Таким образом, у пациентов с ишемическим и геморрагическим инсультами, отягощенных метаболическим синдромом, формируется качественно однотипная и количественно более выраженная при ГИ реакция в виде дисбаланса первичных и вторичных продуктов свободнорадикального окисления липидов и белков, преимущественная активация ферментативных и неферментативных механизмов антиоксидантной системы на фоне накопления провоспалительных цитокинов.
Диффузные заболевания печени
У больных с алкогольным гепатитом было установлено, что биохимические показатели (АТФ, ГГТП, ОХ, ЛПНП) проявляли прямые внутри- и межсистемные ассоциации с параметрами иммунного статуса, свободнорадикального окисления и апоптотических процессов. При этом тесные прямые связи формировались между показателями степени повреждения гепатоцитов (аминтрансфераз, гамма-глутамилтранспептидаз) и гиперпродукцией IgА, IgG и ЦИК, а также с параметром биохемилюминесценции S, что свидетельствует о взаимном влиянии интенсивности свободнорадикального окисления биомолекул на повреждение клеток печени и нарушение иммунного статуса при АГ.
Показатели липидного спектра – ОХ, ЛПНП были непосредственно сопряжены как с нарушением свободнорадикального гомеостаза, так и с повреждением гепатоцитов.
При корреляционном анализе иммунные показатели проявляли множественные внутри- и межсистемные ассоциации между собой и другими биохимическими параметрами, отражая степень дисбаланса иммунной системы. Например, прямая ассоциация Ig разных классов и ЦИК с концентрациями ДК указывает на сопряженность процессов свободнорадикального окисления биомолекул и иммунных параметров.
В то же время параметры СРО были тесно ассоциированы с показателями апоптотических процессов, что подтверждает роль окислительного стресса в инициации механизмов запрограммированной клеточной гибели, характеризующейся активацией каскада внутриклеточных каспаз.
У больных с НАСГ корреляционные связи между параметрами степени цитолитического синдрома (АТФ, ГТП), сдвигами липидного обмена (ОХ, ЛПНП) и гликозилированным гемоглобином отражали значение гипергликемии при периферической инсулинорезистентности и нарушений липидного обмена в патогенезе сахарного диабета 2-го типа у пациентов с НАСГ.
Поскольку параметры интенсивности СРО биомолекул (ДК) имели выраженные связи с рядом биохимических показателей, установлено, что интенсификация свободнорадикальных процессов является одним из ключевых механизмов развития данного заболевания, а также обосновывает роль окислительного стресса как фактора патогенеза, лежащего в основе нарушений липидного и углеводного обменов.
Необходимо также отметить, что активация процессов пероксидного окисления липидов в печени сопровождается подавлением катаболизма холестерина в гепатоцитах, что, в свою очередь, способствует поддержанию повышенного уровня общего холестерина в крови.
При корреляционном анализе вариаций иммунных показателей была показана прямая ассоциация иммуноглобулинов и ЦИК с концентрацией ДК, с показателем интенсивности свободнорадикальных процессов – параметром биохемилюминесценции S, а также – с АТФ, ГТП, что указывает на сопряженность процессов СРО биомолекул и цитолитического синдрома в печени с нарушением иммунного статуса организма при НАСГ, развивающимся на фоне сахарного диабета 2-го типа.
Корреляционные связи апоптотических параметров также свидетельствовали об инициации механизмов запрограммированной клеточной гибели в результате чрезмерного образования свободных радикалов. При этом каспаза-1 была прямо ассоциирована с уровнем липопротеидов низкой плотности и гликозилированного гемоглобина. Поэтому, вероятно, апоптотические процессы могут быть связаны не только с гибелью β-клеток поджелудочной железы, но и с гиперпродукцией свободных радикалов в митохондриях в условиях гипергликемии, приводящей к блокаде гликолиза. Также известно, что развитие инсулиновой недостаточности при сахарном диабете 2-го типа связано с эффектом глюкозо- и липотоксичности за счет индукции окислительного стресса (Poitout, Robertson, 2002).
Анализ ассоциативных связей лабораторных параметров у больных с лекарственным гепатитом также показал образование тесных прямых связей между показателями биомолекул СРО и параметрами, отражающими степень повреждения гепатоцитов, дисбалансом иммунной системы и показателями апоптотических процессов.
Таким образом, установлен универсальный механизм связи интенсивности свободнорадикального окисления с развитием цитолитического синдрома, отклонениями липидного обмена, иммунного статуса, инициации механизмов апоптоза при развитии диффузных заболеваний печени.
ЗАКЛЮЧЕНИЕ
Таким образом, в статье подробно освещено функциональное единство иммуно-биохимических процессов, которое является проявлением единого феномена метаболического иммунитета, который может быть модифицирован под ряд конкретных клинических задач. Это единство тесно связано с функционированием регуляторной системы цАМФ/цГМФ, белков, цитокинов, ферментов, различных антител, нуклеиновых кислот, модификацией функции иммунокомпетентных, фагоцитарных и неиммунных клеток, рилизом острофазовых реактантов, иммунорегуляторными фрагментами иммуноглобулинов и многими другими процессами. Метаболический иммунитет является новой иммунной категорией, которая в настоящее время изучается чрезвычайно широко.
Список литературы
Земсков А.М., Земсков В.М., Караулов А.В. Клиническая иммунология. М.: Наука, 1999. 603 с.
Земсков А.М., Земсков В.М., Земскова В.А. и др. Настольная книга клинического иммунолога “Теоретические, практические и прикладные аспекты клинической иммунологии на современном этапе”. М.: Триада-Х, 2015. 704 с.
Земсков А.М., Земсков В.М., Земскова В.А. и др. Метаболический иммунитет // Вестник ВГУ. Серия: Химия, Биология, Фармация. 2016. № 2. С. 41–49.
Луцкий М.А. Есауленко И.Э., Земсков А.М. Окислительный стресс при цереброваскулярных заболеваниях и инсульте. М.: Медицина, 2011. 237 с.
Луцкий М.А., Земсков А.М., Савиных В.П. Рассеянный склероз. Современные аспекты этиопатогенеза, диагностики, особенности клинического течения и лечения. Воронеж, 2016. 167 с.
Попов С.С. Оценка и коррекция антиоксидантного статуса и апоптотических процессов у больных с диффузными заболеваниями печени: Автореф. дис … докт. мед. наук. Воронеж: Гос. мед. акад. им. Н.Н. Бурденко, 2016. 39 с.
Попов С.С., Пашков А.Н., Шульгин К.К., Агарков А.А. Интенсивность свободнорадикальных процессов и активность супероксиддисмутазы при хроническом алкогольном гепатите и применении препаратов, корригирующих уровень мелатонина // Наркология. 2014. № 4. С. 62–66.
Энциклопедия иммунологии в 5 томах. Т. 3. Справочные материалы / Ред. А.М. Земсков, В.М. Земсков, В.А. Черешнев. М.: Триада-Х, 2013. 445 с.
Poitout V., Robertson R.P. Minireview: secondary β-cell failure in type 2 diabetes – a convergence of glucotoxicity and lipotoxicity // Endocrinology. 2002. V. 143. P. 339–342.
Soundravally R. Association between proinflammatory cytokines and lipid peroxidation in patients with severe dengue disease around defervescence // Internat. J. Infect. Dis. 2014. V. 18. P. 68–72.
Vladimirov Yu.A., Proskurnina E.V. Free radicals and cell chemiluminescence // Biochemistry (Moscow). 2009. V. 74. № 13. P. 1545–1566.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


