Успехи современной биологии, 2020, T. 140, № 2, стр. 130-139
Астроциты мозга и синаптический диссонанс: нейродегенеративная и психическая патология
О. А. Гомазков *
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича
Москва, Россия
* E-mail: oleg-gomazkov@yandex.ru
Поступила в редакцию 16.10.2019
После доработки 16.10.2019
Принята к публикации 16.10.2019
Аннотация
Результаты экспериментальных и клинических исследований представили доказательства, что астроциты являются неотъемлемыми компонентами нейронных сетей. Астроциты могут влиять на синаптические процессы за счет модулирования активности нейро- и глиотрансмиттеров. Роль микроглии в организации сетевых пространств и в формировании нейроастроцитарных доменов рассматривается как один из ведущих механизмов памяти и когнитивной функции. Разлад на уровне синаптической нейротрансмиссии приводит к нарушениям этих процессов. Впервые представлен механизм, согласно которому астроциты как компоненты синаптических процессов становятся участниками нервно-психических заболеваний.
ВВЕДЕНИЕ
Благодаря исследованиям последних двадцати лет, вопреки привычной догме об астроглии как системе вспомогательных клеток мозга, сформировалось положение, что астроциты играют роль более значимую, нежели представление об эластичном каркасе, который обеспечивает лишь структурную и метаболическую поддержку нейронов. Современные исследования, сочетающие высокочувствительную электронную микроскопию, биохимические, компьютерные и нейрофизиологические методы, позволили получить сведения об особой роли клеток астроглии в регуляции синаптических процессов и формировании нейронных сообществ. Исходным аспектом взаимодействия нейронов и глиальных клеток являются клеточные связи с синапсами. Каждый основной класс глиальных клеток, включая астроциты, олигодендроциты и микроглию, выполняет важную роль в поддержании синаптической функции и возбудимости нейронов.
Астроцитарная концепция определяет астроглиальную систему как организующую службу особого характера. Одним из ведущих положений служит тезис, что, образуя сетевые нейроастроцитарные комплексы, эти объединения компонуются в структурные микродомены. Их назначение, как “сберегающих файлов”, акцентируется в качестве механизма фиксации и хранения памяти (Гомазков, 2019; Bernhardi et al., 2016). В итоге многих исследований сделан вывод, что активация глиальных клеток, вызванная травмой, ишемией или нейродегенерацией, значительно изменяет их поведение в отношении нейронных синапсов.
В данной статье впервые описан гипотетический механизм, согласно которому астроциты как компонеты синаптической дезинтеграции становятся участниками нейродегенеративных и психических расстройств мозга.
АСТРОГЛИЯ – НОВЫЙ ВЗГЛЯД НА НОВЫЕ ФУНКЦИИ
Исследования, сочетающие лазерную микроскопию, биохимические, нейрофизиологические и компьютерные методы, позволили получить сведения о роли астроглии в контроле синаптических процессов.
Астроциты представляют собой разнообразно организованные клетки, которые характеризуются небольшой сомой (диаметр <10 мкм) и разветвленными отростками. Для астроцитов характерно образование множественных контактов с нервными клетками и глиальными структурами. Морфо-логия и функции астроцитов различаются между регионами мозга. Более того, отдельные подклассы астроцитов могут существовать в пределах одной области мозга (Моргун и др., 2014).
Сравнительно-эволюционные работы показывают, что астроциты человека структурно наиболее сложны; их межклеточная сигнализация, реализуемая при участии глиальных нейротрансмиттеров и сопутствующих белков, становится более разнообразной, что указывает на высокую специализацию и, следовательно, на возможности выполнения совершенных функций в мозге человека (Oberheim et al., 2012).
При активации, вызываемой химическими влияниями, клетки астроглии демонстрировали изменения структуры и подвижности в направлении синаптических терминалей. Образуя формы “листочков” или ажурных покрывал, астроцитарная клетка может взаимодействовать с бόльшим количеством синапсов (Попов и др., 2003; Halassa et al., 2007).
Цитофизиологические исследования позволили сформулировать концепцию трехстороннего синапса, которая рассматривает астроциты как обязательные компоненты синаптического механизма, регулирующего информативное общение нейронов (Araque et al., 1999).
Астроциты могут влиять на синаптические процессы путем секреции различных молекул, которые участвуют в формировании нейронных сетей. Особую, инициирующую роль в сложной форме астронейронных отношений играют изменения уровня ионов Са2+. Анализ секреторной функции астроцитов привел к понятию глиотрансмиссии – термину, аналогичному нейротрансмиссии (Santello et al., 2012). В качестве ведущего глиотрансмиттера следует выделить глутамат, который активирует рецепторы NMDA, AMPA, каината для обеспечения быстрого сигнала. Другие глиотрансмиттеры (АТФ, аденозин, D-серин, ГАМК и др.) также влияют на нейронные мишени, обеспечивая бόльшие возможности синаптической пластичности. Астроциты служат местом синтеза и секреции белков, участвующих в “тонировании” регуляторных функций. Астроциты причастны к рилизингу интерлейкина-1, некротического фактора опухоли (TNF-α), нейротрофинов (BDNF и др.), нейропептида Y – тех биохимических факторов, которые определяют негативную (провоспалительную) или защитную (протективную) функцию.
АСТРОНЕЙРОННЫЕ ДОМЕНЫ. КОНЦЕПЦИЯ МЕХАНИЗМОВ ПАМЯТИ
Контакт астроцита с множеством синапсов предоставляет огромные возможности для взаимодействия популяций нейронов. Астроциты выполняют роль коммутирующих структур нейронной сети. Сформулирован вывод, что интегративная миссия астроцитов объединяет клеточное пространство в региональной и временнόй динамике головного мозга (Araque et al., 2014).
Описано четыре подтипа астроцитов в коре мозга человека. Они включают: протоплазматические астроциты серого вещества (2–6-й слои коры), межслойные астроциты (1-й слой коры), поляризованные астроциты (5–6-й слои), волокнистые астроциты, заполняющие белое вещество. К этому следует заметить, что у грызунов идентифицированы только протоплазматические и волокнистые клетки астроглии (Oberheim et al., 2006).
Сформулирована точка зрения (Pereira, Furlan, 2010), что протоплазматические астроциты действуют как центр, интегрирующий нейронные популяции. Особо значимым видится Са2+-зависимый карусельный механизм различных глио-/нейротрансмиттеров, которые по принципу домино участвуют в управлении синаптическими процессами. Поскольку волны мембранных потенциалов распространяются через щелевые соединения синапсов, включая другие типы астроцитов, астроглиальная сеть поддерживает информационную связь многообразных психофизиологических реакций.
Результаты цитоморфологических исследований показали, что в коре головного мозга астроциты в комплексе с нейронами образуют структурные микродомены. Каждый микродомен формируется как черепицеподобные пластования, образуя связи с соседними клетками (Bushong et al., 2002). Эти заключения служат основанием для нового понимания физиологических механизмов памяти. Было подсчитано, что каждый из таких доменов в коре мозга человека может включать до двух миллионов контактов, способных интегрировать синаптическую информацию. Объем и динамическая лабильность этих процессов может служить кодированию и хранению матриксов памяти (Robertson, 2013).
При использовании комбинаций электрофизиологического и гистологического подходов установлено, что астроциты влияют на тормозные сенсорные процессы в таламической области мозга. Изменения активности таламуса за счет влияния на mGlu2-рецепторы глутамата отражали участие астроцитов в контроле сенсорных процессов как компонентов обучения и памяти (Copeland et al., 2017).
Участие астроцитов в фиксации контекстуальной памяти, одного из аспектов когнитивной психологии, было рассмотрено с помощью критериев компьютерного анализа. Создана модель, которая ассоциируется с электрофизиологической картиной, наблюдаемой в экспериментах по формированию памяти (Tewari, Parpura, 2013).
Некоторые исследования выделяют зоны мозга, где функция астроцитов связана с механизмами памяти. Индукция тревожности в опытах на мышах снижает активность трансдукторного белка Rac1 в базолатеральной амигдале, влияя на изменения морфологии астроцитов (Liao et al., 2017). Экспрессия астроцитов и секреция глиотрансмиттера аденозина или воздействие на А1- и А2А-аденозиновые рецепторы снижали импульсацию в нейронах миндалины и, что особенно важно, нивелировали реакции страха (Martin-Fernandez et al., 2017).
В качестве рабочей концепции сформулирована точка зрения, что участие астроцитов в организации сетевых пространств и формировании доменов (информационных файлов), следует рассматривать как один из физиологических механизмов памяти и когнитивной функции (Гомазков, 2019).
НЕЙРОВОСПАЛЕНИЕ. ДВУЛИКАЯ РОЛЬ РЕАКТИВНЫХ АСТРОЦИТОВ
Активированные клетки астроглии представляют особые функциональные типы: классический (интактный), провоспалительный, провоцирующий клеточную патологию, и защитный антивоспалительный тип. Нарушение баланса между ними рассматривается как функциональная поляризация, характерная для патологического процесса с индукцией нейровоспаления (Jha et al., 2016).
Реактивность астроцитов инициируется сигналами, исходящими от “испорченных” нейронов. Множество примеров иллюстрирует то обстоятельство, что в зависимости от времени и контекста основной патологии реактивные астроциты могут усугубить процессы нейровоспаления или способствовать защите, иммуносупрессии и тканевому ремонту поврежденных клеток. Речь идет, таким образом, о двуликой роли астроцитов в условиях патологии, когда функции защиты и патогенеза оказываются в динамическом противостоянии.
Клетки астроглии причастны к разнообразным нейродегенеративным процессам при болезни Альцгеймера, болезни Паркинсона, хорее Гентингтона, ишемическом инсульте, психических заболеваниях. Дисфункцию астроцитов сопровождают явления окислительного стресса, нарушения структуры митохондрий, глутаматной токсичности, нейроапоптоза.
В результате многих исследований сделан вывод, что активация астроцитов, вызванная травмой, ишемией или нейродегенерацией, значительно меняет нейротрансмиттерные и цитоинтегративные процессы. В итоге, реактивные клетки астроглии непременно оказываются причастными ко многим этиологически разнородным заболеваниям.
Определены основные звенья сигнальных процессов, которые регулируют функциональную поляризацию астроцитов. Поврежденные нейроны и активированная микроглия секретируют белки, которые, взаимодействуя с рецепторами на плазматической мембране, меняют направления трансдукторного сигналинга. Эти процессы влияют на выбор вариантов сигнального каскада, таких как путь JAK/STAT3, путь NF-κB и киназы MAP. Следующий этап внутриклеточной регуляции в астроците связан с репрограммированием на уровне клеточного ядра – транскрипции, ведущей к изменению функции. Эти процессы влияют на характерные признаки реактивных астроцитов: изменения маркерного белка GFAP, их гипертрофию, профиль секреторной функции.
На основе каталога белков, секретируемых астроцитами, составлена классификация молекул, которая указывает на участие астроцитов в заболеваниях мозга различного генеза (Jha et al., 2018).
АСТРОЦИТЫ И СТАРЕНИЕ
Концепция клеточной дисфункции служит основной идеей представления о биологии старения мозга. Стареющие клетки с прогрессирующим нарушением клеточного цикла и формированием прооксидантных молекул накапливаются в определенных зонах мозга как источники нейродегенеративной патологии. Старение мозга сопровождается постепенным ухудшением памяти и когнитивных процессов. Эти явления обусловлены уменьшением числа нейрональных синапсов и количества их взаимодействий.
При старении астроциты демонстрируют изменения, характерные для клеток реактивного фенотипа: а) повышенную экспрессию глиальных белков GFAP и виментиновых волокон; б) увеличенную активность провоспалительных цитокинов; в) массивное формирование токсических агрегатов. Феноменология нейродегенерации клеток мозга описывается как следствие токсического повреждения астроцитарных митохондрий (Kubik, Philbert, 2015).
В опытах на животных выполнены сравнительные исследования возрастных нарушений памяти, ассоциируемые с различными зонами мозга. Анализ экспрессируемых генов выявил, что “старые” астроциты принимают, как правило, реактивный фенотип А1-подобных клеток. Однако в опытах на мышах с нокаутом цитокинов IL-1α, TNF и C1q, опосредующих образование фенотипа A1, экспрессия генов, регулирующих формирование реактивных астроцитов, была в значительной степени сниженной. Следовательно, эти молекулярные регуляторы, секретируемые астроглией, участвуют в реализации механизмов старения (Clarke et al., 2018).
В качестве одной из первых причин дисфункции астроцитов при старении рассматриваются изменения сигнальной активности ионов Са2+, регулирующих трансмиттерную функцию глутамата. Выявляемые по этому принципу различия у молодых и старых животных следует рассматривать как ключевой механизм трансмиттерной дизрегуляции астроцитов. Второй аспект анализа определяет в качестве причины старения активацию нейровоспаления с последующей гибелью нейронов (Sun et al., 2013).
В экспериментах с транскриптомами астроцитов старых мышей была определена экспрессия синапс-регулирующих генов в различных областях коры мозга. Отмечалось усиление активности генов, участвующих в элиминации синапсов; этот феномен совпадал со снижением когнитивных функций, определяемым старением (Boisvert et al., 2018).
При сравнительном исследовании гиппокампа у молодых и возрастных крыс выявлялись морфологические различия нейроастроглиального комплекса. Число астроцитов и длина их ветвей снижались в субдоменах зоны CA3 гиппокампа с признаками класматодендроза как показателя выраженной энцефалопатии. Однако было установлено, что астроциты и микроглия в гиппокампе старых крыс могут участвовать в очистке от клеточного мусора, накапливающегося, в частности, в связи с запрограммированной гибелью клеток (Lana et al., 2016).
При анализе медиаторных механизмов отмечены нарушения взаимодействия цитокинов в астроцитах. У “старых” астроцитов были снижены экспрессия фактора роста TGFβ и активность интерлейкинового рецептора IL-10(R1). На фоне экспериментально вызванного нейровоспаления “старые” астроциты были менее чувствительны к защитному действию цитокина IL-10 (Norden et al., 2016). В итоге, в процессе старения вследствие ослабления астроцитарного потенциала мозг становится более чувствительным к возрастным заболеваниям: болезни Альцгеймера, Паркинсона, ишемическому инсульту, комплексу психических расстройств и др.
Сущность формулируемых на этой основе позиций сводится к тому, что нарушения глионейрональной трансмиттерной функции астроцитов могут быть одной из ведущих причин нейродегенеративных и когнитивных нарушений в возрастном мозге.
АСТРОЦИТЫ И НЕЙРОКОГНИТИВНЫЕ НАРУШЕНИЯ
Принято считать, что когнитивные, или познавательные, процессы представляют наиболее сложно организованные функции головного мозга, которые служат рациональному и целенаправленному взаимодействию со средой обитания. Когнитивная функция определяется как одна из наиболее важных форм адаптации индивидуума.
Ключевым физиологическим механизмом когнитивного потенциала оказывается синаптическая нейротрансмиссия и формирование сопряженных нейронных сетей и доменов. Работа клеточных и биохимических систем обеспечивается лабильными нейроастроцитарными взаимодействиями, описанными выше.
В течение двух последних десятилетий получены результаты, которые свидетельствуют, что дисфункции нейронов и нейронных сетей, включая синаптические аномалии и последовательные нарушения нейротрансмиттеров, являются основными причинами психических расстройств. Помимо классической нейрональной доктрины нейропсихиатрии, новые данные позволяют предположить, что ментальные, когнитивные нарушения функций мозга связаны с постулируемой нейроастроцитарной концепцией. Концепцией, придающей решающее значение клеткам астроглии как организаторам информационной службы мозга (Гомазков, 2018). Эти представления послужили новому пониманию причин нейродегенеративных и психических заболеваний и, соответственно, определению новых терапевтических мишеней (Dallérac, Rouach, 2016).
Согласно данным информационной базы PubMed, по ключевому запросу “cognitive disorders, astrocytes” выявляется около 1000 публикаций в рейтинговых журналах за период 1980–2019 гг. Особо выделяется трехкратный всплеск интереса к этой теме за последние десять лет.
Нарушения синапсов и их потеря (прунинг) оказываются ведущими признаками многих нейродегенеративных заболеваний и, как следствие, основным коррелятом когнитивного расстройства. Диссонанс возбуждающей и ингибирующей активности синаптического аппарата связан с измененной активностью микроглии и астроцитов (реактивные формы) (DeKosky, Scheff, 1990; Terry et al., 1991; Henstridge et al., 2019). Ведущими компонентами болезни Альцгеймера служат бета-амилоид Aβ42 и гиперфосфорилированный тау-белок, которые формируют фибриллярные отложения с изменениями структуры нейронов и синаптических взаимодействий (Spires-Jones, Hyman, 2014). Установлена патогенетическая связь между изменениями внутриклеточного уровня Са2+ и активностью астроцитов, а также формированием токсичных форм амилоидных пептидов и тау-белка, с одной стороны, и прогрессирующей дисфункцией синапсов – с другой (Vincent et al., 2010).
Применение совершенных методов клеточной визуализации in situ и in vivo выявляет роль аберрантных сигналов Ca2+ в инициации нейровоспаления, связанного с реактивными астроцитами и нейральной патологией (Shigetomi et al., 2019). Подчеркивается инициирующая роль реактивных астроцитов в когнитивных нарушениях и деменции при цереброваскулярных расстройствах у человека (Price et al., 2018).
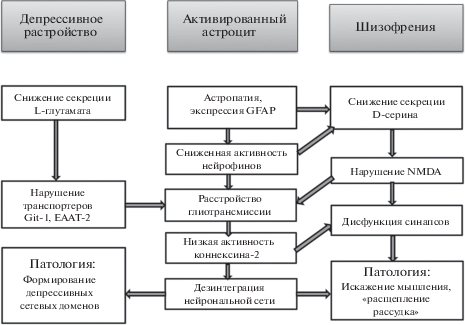
Общие и особенные черты депрессивного расстройства и шизофрении. Рассматриваются изменения структур и метаболизма активированных астроцитов: в центре – общие признаки, связанные с дисфункцией, типичные для реактивного астроцита, левая и правая части рисунка отражают особенные биохимические и физиологические изменения нейроглиотрансмиссии при депрессии и шизофрении. Нарушения нейромедиаторных процессов ведут к дезинтеграции сетевых нейронов и формированию доменов патологической сегрегации.
АСТРОЦИТЫ, СИНАПТИЧЕСКИЙ ДИССОНАНС И НЕЙРОПСИХИЧЕСКИЕ РАССТРОЙСТВА
Суммированы результаты, иллюстрирующие новый взгляд на роль астроглии при психических заболеваниях. Постулируется, что функциональная гетерогенность астроцитов связана с их участием в эмоциональных и когнитивных процессах (Elsayed, Magistretti, 2015). Постмортальные исследования мозга пациентов с психическими расстройствами обнаруживают изменения структур мозга, нарушения нейротрансмиссии и синаптическое ремоделирование при большом депрессивном расстройстве (БДР) (Cotter et al., 2002; Stockmeier et al., 2004).
Эти данные определяют новый подход к пониманию причин когнитивных расстройств, столь распространенных при патологии мозга. Представляемая информация о связи нейроастроцитарного комплекса с механизмами психических расстройств представляет обоснованную концепцию современной медицины (Verkhratsky et al., 2014; Koyama, 2015; Kato et al., 2017).
В клинической практике БДР, шизофрения, биполярное расстройство, эпилепсия определяются как различные диагностические категории. В то же время многочисленные исследования свидетельствуют, что клетки астроглии подвергаются сходным реактивным изменениям при всех этих типах заболеваний. В качестве одного из ведущих признаков патологии отмечается снижение плотности клеток астроглии и их атрофия. Изучение аутопсийного материала выявляет уменьшение числа астроцитов в гиппокампе, лобной коре и амигдале (Sheline et al., 1996; Bremner et al., 2000; Rajkowska, Stockmeier, 2013).
Серии экспериментальных работ иллюстрируют эти позиции. На модели депрессивного расстройства выявлено снижение секреции глутамата, основного нейромедиатора астроцитов: с помощью особых микрочипов, зондирующих ДНК в коре головного мозга, установлено снижение синтеза ключевых белков-транспортеров глутамата (Molnar et al., 2005). Нарушение везикулярной секреции и глиотрансмиттерной функции АТФ вызывало у животных симптомы депрессивного поведения (Cao et al., 2013). Генетический нокаут, приводящий к потере астроцитов, усугубляет депрессивное поведение, вызываемое длительным применением кортикостерона (Kong et al., 2014).
Среди новых факторов, которые могут участвовать в генезе синаптических нарушений, привлекает внимание астроцитарный белок коннексин-43 (CX43), как особый “контактер” щелевых синаптических каналов. Получены данные, свидетельствующие о роли астроцитарного CX43 в консолидации памяти страха в модельном эксперименте (Stehberg et al., 2012). Выявлено сниженное содержание СХ43 у пациентов с алкогольной зависимостью и депрессией (Miguel-Hidalgo et al., 2014).
Патогенез шизофрении сопровождается нарушениями восприятия, когнитивными и поведенческими нарушениями. Клинические исследования показывают, что заболевание связано со структурными нарушениями головного мозга, потерей клеток серого и белого вещества и расстройствами нейрональных связей. Гистологические исследования выявляют структурные и функциональные аномалии во всех типах глиальных клеток. Отмечается повышенный уровень глиального белка GFAP и других маркеров нейровоспаления, совпадающий с изменениями клеток астроглии (Laskaris et al., 2016).
Нарушения в астронейронной системе трехстороннего синапса и расстройство трансмиттерных механизмов рассматриваются как ключевые элементы в синаптической концепции шизофрении (Chelini et al., 2018). В серии работ описано, что одна из первичных причин шизофрении связана с дисфункцией L-глутамата и дофамина как медиаторов нейротрансмиссии в гиппокампе (Laruelle, 2014; Perez, Lodge, 2014). Данные клинического исследования подтверждают гиперэкспрессию астроцитарного транспортера глутамата GLT-1 в префронтальной коре. Как следствие развивается блокада нейротрансмиттерной функции с последующей нейротоксичностью (Matute et al., 2005). На рисунке схематически представлены этажи молекулярных изменений в реактивных астроцитах при развитии депрессии и шизофрении.
Биполярное расстройство (циркулярный психоз) представляет собой особый синдром, аффективное расстройство, включающее переменные фазы мании и депрессии. Пожизненное заболевание, затрагивающее примерно 2–5% популяции. Характерны состояния возбуждения, бессистемного мышления, дисфория. Изучение аутопсийного материала выявило у пациентов с биполярным расстройством уменьшение количества или плотности глиальных клеток в слоях префронтальной и передней поясной извилины коры головного мозга. Констатируется снижение содержания астроцитарного маркера GFAP во всех слоях орбитофронтальной коры. Наибольшие изменения относятся к астроцитам и олигодендроцитам, что указывает на причастность этих структур к патологии биполярного расстройства. Эти морфологические особенности сочетаются с изменениями активности нейротрофических факторов как важной особенностью заболевания (Keshavarz, 2017).
Классические препараты, используемые в терапии биполярного расстройства (соли лития, вальпроевая кислота и карбамазепин), влияли на экспрессию астроглиальных генов и нейротрансмиттерную функцию. Уточнено, что эти вещества влияют на ген TRPC1 (transient receptor potential channel 1), связанный с транспортом Са2+, основного регулятора активности астроцитов (Du et al., 2016). На основе концепции трехстороннего синапса построена психобиологическая модель биполярного расстройства, которая учитывает нарушения обработки информации в структуре астронейронного контента. Подтверждено, что подавление активности астроцитарных рецепторов влечет дисбаланс синтеза и рилизинга медиатора дофамина. Таким образом, нарушение функций астроцитарных рецепторов при обработке синаптической информации рассматривается в качестве причины маниакальной патологии и биполярного расстройства (Mitterauer, 2018).
Эти данные характеризуют новый подход в понимании причин когнитивных расстройств, типичных при патологии мозга. Сведения о связи нейроастроцитарного комплекса с механизмами психических расстройств подкрепляют обоснованную концепцию современной медицины. На этом основании высказывается соображение о рассмотрении сопряженных с астроцитами биохимических процессах как мишеней терапии нейродегенеративных и психических заболеваний.
ФАРМАКОЛОГИЧЕСКАЯ КОРРЕКЦИЯ АСТРОЦИТАРНОГО МЕХАНИЗМА
Новыми аргументами в рассмотрении связи астроцитов с нейродегенеративными и психическими заболеваниями могут служить результаты, полученные с клиническими препаратами.
Классические антидепрессанты: ингибиторы обратного захвата нейромедиаторов (флуоксетин, дулоксетин), антагонисты рецепторов дофамина (клозапин), блокаторы гиперактивности глутамата (рилузол) и др. – оказывают выраженное действие на астроциты, влияя на их морфологию, метаболизм и восстановление клеточного пула. Высказана гипотеза, что лечение антидепрессантами влияет не только на нейроны, но также активирует астроциты, стимулируя процессы реактивации кортикальной пластичности и перенастройку дезорганизованных нейронных сетей (Czéh, Di Benedetto, 2013).
Анализируется связь между фармакологической коррекцией синаптических щелевых каналов в астроцитах и БДР. Данные аутопсийных исследований и экспериментальные работы установили, что хронический стресс приводит к снижению экспрессии синаптического белка коннексина 43 (CX43) в префронтальной коре (Ren et al., 2018). В опытах на культуре астроцитов коры мозга установлено стимулирующее влияние аминотриптилина на экспрессию CX43. Этот эффект был опосредован активацией в астроцитах белков трансдукторного сигналинга p38 и c-Fos/AP-1 (Morioka et al., 2014).
В экспериментах на модели депрессивного расстройства, где были выявлены признаки глиальной патологии, рилузол восстанавливал показатели метаболического и поведенческого дефицита за счет коррекции уровня медиатора глутамата (Banasr et al., 2010). На крысах с моделированной депрессией флуоксетин нивелировал нарушения структуры синаптических дендритных шипиков и плотности синапсов в клетках пирамидальных СА1 полей (Hajszan et al., 2005). Терапия дезипрамином, флуоксетином, миансерином, хлорпромазином и пароксетином способствовала синтезу и секреции в астроцитах нейротрофинов BDNF, GDNF и фактора роста фибробластов (bFGF) – регуляторных белков, которые влияют на защитную функцию (Liu et al., 2012).
ЗАКЛЮЧЕНИЕ
В статье рассматривается особая роль астроцитов в рамках концепции глиотрансмиттерной регуляции синаптической пластичности. Современные исследования, сочетающие подходы цитомикроскопии, нейрофизиологии, биохимии и клиники, позволили получить новые сведения о роли клеток астроглии в вариативной регуляции синаптических и нейроинтегративных процессов в мозге. Синаптический механизм рассматривается как “входные ворота” для осуществления функций нервных клеток, поскольку астроциты играют ключевую роль в организации нейротрансмиссии и пластичности. Интегративная миссия астроцитов объединяет клеточное пространство головного мозга в региональной и временнόй динамике его функций.
Концепция глиотрансмиттерной медиации дает большой простор идеям, которые, с одной стороны, пролагают путь к пониманию механизмов когнитивных процессов и интеллекта, а с другой – могут объяснить первопричину нейродегенеративных и психических заболеваний.
Представление о нейроглиотрансмиттерной функции астроцитов открывает новые возможности для понимания нейродегенеративных процессов. При рассмотрении основных заболеваний: амилоид-зависимой патологии, болезней Гентингтона и Паркинсона, ишемического инсульта, а также психических расстройств – становится очевидной причастность функционально инвертированных реактивных астроцитов. Впервые представляется гипотетический механизм, согласно которому астроциты как посредники синаптической дезинтеграции становятся участниками психоневрологической патологии.
Эти разработки служат обоснованием для выявления новых средств терапевтического воздействия в соответствии с определением конкретных мишеней и путей нейрохимического диссонанса в системе синаптической регуляции.
Список литературы
Гомазков О.А. Астроциты – звезды, которые управляют мозгом. M.: ИКАР, 2018. 108 с.
Гомазков О.А. Астроциты как компоненты регуляции высших функций мозга // Нейрохимия. 2019. Т. 36 (4). С. 267–274.
Моргун А.В., Малиновская Н.А., Комлева Ю.К. и др. Структурная и функциональная гетерогенность астроцитов головного мозга // Бюл. сиб. мед. 2014. Т. 13 (5). С. 138–148.
Попов В.И., Медведев Н.И., Рогачевский В.В. и др. Трехмерная организация синапсов и астроглии в гиппокампе: новые структурно-функциональные парадигмы работы синапса // Биофизика. 2003. Т. 48 (2). С. 289–308.
Araque A., Parpura V., Sanzgiri R.P. et al. Tripartite synapses: glia, the unacknowledged partner // Trends Neurosci. 1999. V. 22 (5). P. 208–215.
Araque A., Carmignoto G., Haydon P.G. et al. Gliotransmitters travel in time and space // Neuron. 2014. V. 81 (4). P. 728–739.
Banasr M., Chowdhury G.M., Terwilliger R. et al. Glial pathology in an animal model of depression: reversal of stress-induced cellular, metabolic and behavioral deficits by the glutamate-modulating drug riluzole // Mol. Psychiatry. 2010. V. 15 (5). P. 501–511.
Bernhardi R., Eugenín-von Bernhardi J., Flores B., Eugenin J.L. Glial cells and integrity of the nervous system // Adv. Exp. Med. Biol. 2016. V. 949. P. 1–24.
Boisvert M.M., Erikson G.A., Shokhirev M.N. et al. The aging astrocyte transcriptome from multiple regions of the mouse brain // Cell Rep. 2018. V. 22 (1). P. 269–285.
Bremner J.D., Narayan M., Anderson E.R. et al. Hippocampal volume reduction in major depression // Am. J. Psychiatry. 2000. V. 157 (1). P. 115–118.
Bushong E.A., Martone M.E., Jones Y.Z. et al. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains // J. Neurosci. 2002. V. 22 (1). P. 183–192.
Cao X., Li L.P., Wang Q. et al. Astrocyte derived ATP modulates depressive-like behaviors // Nat. Med. 2013. V. 19 (6). P. 773–777.
Chelini G., Pantazopoulos H., Durning P. et al. The tetrapartite synapse: a key concept in the pathophysiology of schizophrenia // Eur. Psychiatry. 2018. V. 50. P. 60–69.
Clarke L.E., Liddelow S.A., Chakraborty C. et al. Normal aging induces A1-like astrocyte reactivity // PNAS USA. 2018. V. 115 (8). P. e1896.
Copeland C.S., Wall T.M., Sims R.E. et al. Astrocytes modulate thalamic sensory processing via mGlu2 receptor activation // Neuropharmacology. 2017. V. 121. P. 100–110.
Cotter D., Mackay D., Chana G. et al. Reduced neuronal size and glial cell density in area 9 of the dorsolateral prefrontal cortex in subjects with major depressive disorder // Cereb. Cortex. 2002. V. 12. P. 386–394.
Czéh B., Di Benedetto B. Antidepressants act directly on astrocytes: evidences and functional consequences // Eur. Neuropsychopharm. 2013. V. 23 (3). P. 171–185.
Dallérac G., Rouach N. Astrocytes as new targets to improve cognitive functions // Prog. Neurobiol. 2016. V. 144. P. 48–67.
DeKosky S.T., Scheff S.W. Synapse loss in frontal cortex biopsies in Alzheimer’s disease: correlation with cognitive severity // Ann. Neurol. 1990. V. 27. P. 457–464.
Du T., Rong Y., Feng R. et al. Chronic treatment with anti-bipolar drugs down-regulates gene expression of TRPC1 in neurons // Front. Cell. Neurosci. 2016. V. 10. P. 305.
Elsayed M., Magistretti P.J. A new outlook on mental illnesses: glial involvement beyond the glue // Front. Cell. Neurosci. 2015. V. 9. P. 468–477.
Hajszan T., MacLusky N.J., Leranth C. Short-term treatment with the antidepressant fluoxetine triggers pyramidal dendritic spine synapse formation in rat hippocampus // Eur. J. Neurosci. 2005. V. 21. P. 1299–1303.
Halassa M.M., Fellin T., Takano H. et al. Synaptic islands defined by the territory of a single astrocyte // J. Neurosci. 2007. V. 27. P. 6473–6477.
Henstridge C.M., Tzioras M., Paolicelli R.C. Glial contribution to excitatory and inhibitory synapse loss in neurodegeneration // Front. Cell. Neurosci. 2019. V. 13. Art. 63.
Jha M.K., Lee W.H., Suk K. Functional polarization of neuroglia: implications in neuroinflammation and neurological disorders // Biochem. Pharmacol. 2016. V. 103. P. 1–16.
Jha M.K., Kim J.H., Song G.J., Lee W.H. Functional dissection of astrocyte-secreted proteins: implications in brain health and diseases // Prog. Neurobiol. 2018. V. 162. P. 37–69.
Kato T.A., Myint A.M., Steiner J. Minding glial cells in the novel understandings of mental illness // Front. Cell. Neurosci. 2017. V. 11. P. 48.
Keshavarz M. Glial cells as key elements in the pathophysiology and treatment of bipolar disorder // Acta Neuropsychiatr. 2017. V. 29 (3). P. 140–152.
Kong H., Zeng X.N., Fan Y. et al. Aquaporin-4 knockout exacerbates corticosterone-induced depression by inhibiting astrocyte function and hippocampal neurogenesis // CNS Neurosci. Ther. 2014. V. 20 (5). P. 391–402.
Koyama Y. Functional alterations of astrocytes in mental disorders: pharmacological significance as a drug target // Front. Cell. Neurosci. 2015. V. 9. P. 261.
Kubik L.L., Philbert M.A. The role of astrocyte mitochondria in differential regional susceptibility to environmental neurotoxicants: tools for understanding neurodegeneration // Toxicol. Sci. 2015. V. 144. P. 7–16.
Lana D., Iovino L., Nosi D., Wenk G.L. The neuron-astrocyte-microglia triad involvement in neuroinflammaging mechanisms in the CA3 hippocampus of memory-impaired aged rats // Exp. Gerontol. 2016. V. 83. P. 71–88.
Laruelle M. Schizophrenia: from dopaminergic to glutamatergic interventions // Curr. Opin. Pharmacol. 2014. V. 14. P. 97–102.
Laskaris L.E., Di Biase M.A., Everall I. et al. Microglial activation and progressive brain changes in schizophrenia // Br. J. Pharmacol. 2016. V. 173. P. 666–680.
Liao Z., Tao Y., Guo X. et al. Fear conditioning downregulates Rac1 activity in the basolateral amygdala astrocytes to facilitate the formation of fear memory // Front. Mol. Neurosci. 2017. V. 10. P. 396.
Liu Q., Zhu H.Y., Li B. et al. Chronic clomipramine treatment restores hippocampal expression of glial cell line-derived neurotrophic factor in a rat model of depression // J. Affect. Disord. 2012. V. 141. P. 367–372.
Martin-Fernandez M., Jamison S., Robin L.M. et al. Synapse-specific astrocyte gating of amygdala-related behavior // Nat. Neurosci. 2017. V. 20. P. 1540–1548.
Matute C., Melone M., Vallejo-Illarramendi A., Conti F. Increased expression of the astrocytic glutamate transporter GLT-1 in the prefrontal cortex of schizophrenics // Glia. 2005. V. 49. P. 451–455.
Miguel-Hidalgo J.J., Wilson B.A., Hussain S. et al. Reduced connexin 43 immunolabeling in the orbitofrontal cortex in alcohol dependence and depression // J. Psychiatr. Res. 2014. V. 55. P. 101–109.
Mitterauer B.J. Psychobiological model of bipolar disorder based on imbalances of glial-neuronal information processing // Open J. Med. Psych. 2018. V. 7. P. 91–110.
Molnar M., Evans S.J., Tomita H. et al. Altered cortical glutamatergic and GABAergic signal transmission with glial involvement in depression // PNAS USA. 2005. V. 102 (43). P. 15653–15658.
Morioka N., Suekama K., Zhang F.F. et al. Amitriptyline up-regulates connexin43-gap junction in rat cultured cortical astrocytes via activation of the p38 and c-Fos/AP-1 signalling pathway // Br. J. Pharmacol. 2014. V. 171. P. 2854–2867.
Norden D.M., Trojanowski P.J., Walker F.R., Godbout J.P. Insensitivity of astrocytes to interleukin-10 signaling following peripheral immune challenge results in prolonged microglial activation in the aged brain // Neurobiol. Aging. 2016. V. 44. P. 22–41.
Oberheim X., Wang S., Goldman M., Nedergaard H. Astrocytic complexity distinguishes the human brain // Trends Neurosci. 2006. V. 29. P. 547–553.
Oberheim N.A., Goldman S.A., Nedergaard M. Heterogeneity of astrocytic form // Meth. Mol. Biol. 2012. V. 814. P. 23–24.
Pereira A., Furlan F.A. Astrocytes and human cognition: modeling information integration and modulation of neuronal activity // Prog. Neurobiol. 2010. V. 92. P. 405–420.
Perez S.M., Lodge D.J. New approaches to the management of schizophrenia: focus on aberrant hippocampal drive of dopamine pathways // Drug Des. Devel. Ther. 2014. V. 8. P. 887–896.
Price B.R., Norris C.M., Sompol P., Wilcock D.M. An emerging role of astrocytes in vascular contributions to cognitive impairment and dementia // J. Neurochem. 2018. V. 144. P. 644–650.
Rajkowska G., Stockmeier C.A. Astrocyte pathology in major depressive disorder: insights from human postmortem brain tissue // Curr. Drug Targets. 2013. V. 14 (11). P. 1225–1236.
Ren Q., Wang Z.Z., Chu S.F. et al. Gap junction channels as potential targets for the treatment of major depressive disorder // Psychopharmacology. 2018. V. 235. P. 1–12.
Robertson J.M. Astrocyte domains and the three-dimensional and seemless expression of consciousness and explicit memories // Med. Hypoth. 2013. V. 81. P. 1017–1024.
Santello M., Calì C., Bezzi P. Gliotransmission and the tripartite synapse // Adv. Exp. Med. Biol. 2012. V. 970. P. 307–312.
Sheline Y.I., Wang P.W., Gado M.H. et al. Hippocampal atrophy in recurrent major depression // PNAS USA. 1996. V. 93 (9). P. 3908–3913.
Shigetomi E., Saito K., Sano F., Koizumi S. Aberrant calcium signals in reactive astrocytes: a key process in neurological disorders // Int. J. Mol. Sci. 2019. V. 20 (4). P. e996.
Spires-Jones T.L., Hyman B.T. The intersection of amyloid beta and tau at synapses in Alzheimer’s disease // Neuron. 2014. V. 82 (4). P. 756–771.
Stehberg J., Moraga-Amaro R., Salazar C. et al. Release of gliotransmitters through astroglial connexin 43 hemichannels is necessary for fear memory consolidation in the basolateral amygdale // FASEB J. 2012. V. 26 (9). P. 3649–3657.
Stockmeier C.A., Mahajan G.J., Konick et al. Cellular changes in the postmortem hippocampus in major depression // Biol. Psychiatry. 2004. V. 56. P. 640–650.
Sun W., McConnell E., Pare J.F. et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult brain // Science. 2013. V. 339 (6116). P. 197–200.
Terry R.D., Masliah E., Salmon D.P. et al. Physical basis of cognitive alterations in Alzheimer’s disease: synapse loss is the major correlate of cognitive impairment // Ann. Neurol. 1991. V. 30. P. 572–580.
Tewari S., Parpura V. A possible role of astrocytes in contextual memory retrieval: an analysis obtained using a quantitative framework // Front. Comput. Neurosci. 2013. V. 7. P. 145.
Verkhratsky A., Rodrigues J.J., Steardo L. Astrogliopathy: a central element of neuropsychiatric diseases // Neuroscientist. 2014. V. 20. P. 576–588.
Vincent A.J., Gasperini R., Foa L., Small D.H. Astrocytes in Alzheimer’s disease: emerging roles in calcium dysregulation and synaptic plasticity // J. Alzh. Dis. 2010. V. 22. P. 699–714.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


