Успехи современной биологии, 2020, T. 140, № 2, стр. 116-129
Коррекция таксономического состава кишечной микробиоты человека: серин-треониновые протеинкиназы в качестве биомишеней
Н. В. Захаревич 1, *, В. Н. Даниленко 1
1 Институт общей генетики им. Н.И. Вавилова РАН
Москва, Россия
* E-mail: zakharevich@yandex.ru
Поступила в редакцию 09.01.2020
После доработки 09.01.2020
Принята к публикации 10.01.2020
Аннотация
Кишечная микробиота (КМ) играет важную роль в поддержании здоровья организма человека. В норме таксономический состав КМ характеризуется большим разнообразием и сбалансирован по родам и видам, но при различных заболеваниях этот баланс нарушается. Разные подходы к коррекции таксономического состава КМ известны и используются в настоящее время. К сожалению, большинство подходов одновременно влияют на широкий спектр микроорганизмов, что приводит к развитию дисбиотических расстройств. В данной работе предлагается обсудить возможность использования в качестве биомишеней бактериальные серин-треониновые протеинкиназы (СТПК), воздействовать на которые можно посредством селективных ингибиторов. В связи с тем, что большинство СТПК являются ключевыми регуляторами таких важных процессов, как деление и рост клетки, их ингибирование будет приводить к замедлению роста и функционирования микроорганизмов. Это особенно важно в тех случаях, когда коррекция таксономического состава КМ требует воздействия на пробиотические микроорганизмы. Таким образом, предлагаемый для обсуждения подход – селективно ингибировать бактериальные СТПК – представляет из себя более “мягкий” инструмент, нежели антибиотики, а поиск подходящих СТПК-биомишений может стать первым шагом на пути к разработке эффективных и селективных ингибиторов бактериальных СТПК.
ВВЕДЕНИЕ
В последние годы большое внимание уделяется изучению кишечной микробиоты (КМ) человека. Микроорганизмы, формирующие КМ, поддерживают функционирование не только самого микробного сообщества, но и организма хозяина в целом (Янковский, 2003; Oriach et al., 2016). КМ выполняет различные функции, начиная от участия в процессах формирования колонизационной резистентности организма хозяина и заканчивая способностью активировать и модулировать иммунную, гормональную и нервную системы хозяина (Янковский, 2003; Hemarajata, Versalovic, 2013). Функции микробиоты и ее состав зависят от пола и возраста человека, характера питания, экологических и социальных условий жизни, а также от состояния здоровья человека и приема различных лекарственных средств, не в последнюю очередь антибиотиков (Yatsunenko et al., 2012; Jandhyala et al., 2015). В норме таксономический состав КМ сбалансирован (по родам и видам), но при различных заболеваниях баланс нарушается (Sekirov et al., 2010; DuPont A., DuPont H., 2011; Cryan, Dinan, 2012; Oriach et al., 2016). Изменения таксономического баланса часто сопутствуют таким заболеваниям, как ожирение, аллергия, диабет 2-го типа (Д2Т) и др. (Sekirov et al., 2010; DuPont A., DuPont H., 2011; Cryan, Dinan, 2012; Oriach et al., 2016). Так, в работах по исследованию пациентов с Д2Т было показано: снижение у больных количества микроорганизмов, продуцирующих бутират (Qin et al., 2012); уменьшение количества бактерий типа Firmicutes и класса Clostridia (Larsen et al., 2010); увеличение числа некоторых оппортунистических патогенных микроорганизмов и бактерий рода Lactobacillus (Larsen et al., 2010; Qin et al., 2012) – по сравнению с контрольной группой здоровых людей.
Разработка различных подходов для коррекции таксономического состава КМ человека является важной и актуальной задачей. На настоящий момент наиболее известными подходами для коррекции состава КМ являются диеты, прием пробиотиков или антибиотиков и хирургические вмешательства. Все эти подходы зачастую только способствуют развитию дисбиотических расстройств, так как они одновременно воздействуют на широкий спектр микроорганизмов, а также подавляют ценную для человека пробиотическую составляющую КМ. Новой биомишенью для коррекции состава КМ человека могут стать серин-треониновые протеинкиназы (СТПК), для воздействия на которые можно использовать селективные ингибиторы.
СТПК идентифицированы в большинстве бактериальных геномов и являются одной из ключевых систем, участвующих в передаче сигналов у бактерий: они вовлечены в регуляцию различных процессов жизнедеятельности микроорганизмов, в том числе в процессы роста и деления клетки (Molle, Kremer, 2010; Ruggiero et al., 2012). Можно воздействовать на СТПК определенных групп бактерий с помощью селективных ингибиторов – результатом такого воздействия будет замедление роста и деления клетки (Bogoyevitch et al., 2005; Danilenko et al., 2011; Lougheed et al., 2011). Следовательно, воздействуя на СТПК селективными ингибиторами, можно влиять на таксономический состав КМ человека, не убивая микроорганизмы, а лишь замедляя их рост и функционирование. Таким образом, по сравнению, например, с антибиотиками, селективные ингибиторы СТПК будут более мягким средством.
Как определять не только бактериальные роды/виды (таксономический анализ), но и конкретные СТПК, для которых стоит искать (разрабатывать) селективные ингибиторы?
Ранее нами (лаборатория генетики микроорганизмов, Институт общей генетики им. Н.И. Вавилова РАН) была разработана классификация бактериальных СТПК (Захаревич, Даниленко, 2017; Zakharevich et al., 2012). Разработанная классификация основана на сигнатуре, состоящей из девяти аминокислотных остатков, расположенных в области связывания аденина. На основе сигнатуры СТПК и содержащие их роды (виды) бактерий были разделены на группы (Захаревич, Даниленко, 2017; Zakharevich et al., 2012). СТПК с одинаковой сигнатурой, принадлежащие к одной группе, способны взаимодействовать со сходными низкомолекулярными веществами, которые могут быть использованы в качестве селективных ингибиторов СТПК (Захаревич, Даниленко, 2017; Zakharevich et al., 2012). Такие ингибиторы хороши тем, что они будут селективны и по отношению к бактериальным родам, содержащим протеинкиназы с различными сигнатурами. Таким образом, используя предложенную классификацию и селективные ингибиторы, подобранные к конкретным СТПК-биомишеням, можно добиться замедления роста определенных бактериальных групп КМ (Захаревич, Даниленко, 2017). Согласно этой концепции, селективные ингибиторы бактериальных СТПК могут стать новым, более мягким инструментом, способным корректировать таксономический состав КМ; инструментом, который может быть использован в качестве дополнительного средства при борьбе с заболеваниями, при которых происходит сбой таксономического баланса КМ.
В данной работе будут описаны причины выбора в качестве биомишеней СТПК, и приведен пример поиска СТПК-биомишеней и возможного практического применения селективных ингибиторов СТПК для коррекции таксономический состава КМ при Д2Т.
БАКТЕРИАЛЬНЫЕ СЕРИН-ТРЕОНИНОВЫЕ ПРОТЕИНКИНАЗЫ ЭУКАРИОТИЧЕСКОГО ТИПА
СТПК эукариотического типа – одна из основных систем, участвующих в передаче сигналов у бактерий (Huang et al., 2015). СТПК эукариотического типа, названные так за свое структурное сходство с протеинкиназами эукариот, у которых они были обнаружены первыми, еще называют киназами хэнковского типа, так как именно Хэнкс и соавторы описали их доменную структуру (у эукариот) и выделили 12 консервативных субдоменов, характеризующихся различными консервативными мотивами и аминокислотными остатками (Hanks, 2003). Стоит отметить, что эти субдомены характерны как для эукариотических, так и для бактериальных СТПК (Pereira et al., 2011).
На настоящий момент полностью секвенировано огромное число бактериальных геномов, и СТПК идентифицированы в большинстве из них (Pereira et al., 2011; Cousin et al., 2013). СТПК встречаются у бактерий, ведущих различный образ жизни, в том числе, и у представителей комменсальной микробиоты кишечника человека и других животных. Особенно широко СТПК представлены у грамположительных бактерий (Av-Gay, Everett, 2000; Petrickova, Petricek, 2003; Novakova et al., 2005; Fiuza et al., 2008). СТПК участвуют в регуляции многих аспектов жизнедеятельности бактерий, включая такие важные процессы как деление и рост клетки (Elizarov et al., 2000; Molle, Kremer, 2010; Ruggiero et al., 2012), образование биопленок (Hussain et al., 2006), ответ на окислительный стресс (Neu et al., 2002), формирование вирулентности (Av-Gay, Everett, 2000; Wiley et al., 2006; Danilenko et al., 2011) и многие другие (Pereira et al., 2011; Burnside, Rajagopal, 2012; Wright, Ulijasz, 2014).
Детально изучены и описаны СТПК патогенных микроорганизмов (Wright, Ulijasz, 2014). Большое количество работ посвящено исследованию СТПК M. tuberculosis (Av-Gay, Everett, 2000; Alber, 2009; Chao et al., 2010; Molle, Kremer, 2010), тогда как о СТПК представителей комменсальной микробиоты кишечника человека известно в настоящее время не много. В связи с этим расширение знаний о СТПК различных микрооргани-змов является интересной, важной и актуальной задачей (Захаревич, 2017).
Распространение СТПК эукариотического типа у бактерий
С момента своего открытия в середине 1950-х гг. механизм фосфорилирования–дефосфорилирования белка был признан одним из ведущих механизмов регуляции молекулярных процессов в ответ на внутренние и внешние сигналы. Несмотря на очевидные достоинства такого механизма в качестве инструмента для регуляции функциональной активности белка, наличие и природа процессов фосфорилирования белков у бактерий долгое время (в течение 1960–1970-х гг.) являлись предметом споров. Эти сомнения были рассеяны в середине 1980-х гг. в связи с открытием у бактерий двухкомпонентных систем (Egger et al., 1997). Классическая двухкомпонентная регуляторная система состоит из сенсорной гистидинкиназы и родственного ей регулятора ответа (Зорина, 2013; Klumpp, Krieglstein, 2002). Но гистидиновые протеинкиназы не были схожи с серин-треониновыми протеинкиназами, которые доминировали в процессах фосфорилирования белков у эукариот. Таким образом, двухкомпонентные системы рассматривались исключительно в качестве бактериального механизма.
Пионерские работы Муньос-Дорадо и соавторов в 1991 г. на Myxococcus xanthus, а также исследования других групп авторов показали, что многие виды бактерий все же кодируют протеинкиназы, демонстрирующие структурное сходство с эукариотическими сериновыми, треониновыми и тирозиновыми киназами (Muñoz-Dorado et al., 1991; Krupa, Srinivasan, 2005; Pereira et al., 2011; Cousin et al., 2013). Эти протеинкиназы и были отнесены к так называемым киназам эукариотического типа. На настоящий момент известно, что микроорганизмы обладают широким спектром протеинкиназ, фосфорилирующих белки по различным аминокислотным остаткам, включая гистидин, цистеин, аспарагиновую кислоту, аргинин, серин, треонин и тирозин; но большинство киназ эукариотического типа у бактерий катализируют фосфорилирование серина и треонина и, таким образом, упоминаются в литературе как СТПК эукариотического типа (Manuse et al., 2016).
Не все бактериальные СТПК являются СТПК эукариотического типа. Существуют так называемые атипичные киназы. В качестве примера можно привести киназу YihE из E. coli (Zheng et al., 2007). Рассматриваемая киназа в общем гомологична СТПК эукариотического типа, но в ней не сохранены все характерные субдомены (Scheeff, Bourne, 2005). Также в ряде обзоров было описано несколько других СТПК не эукариотического типа (Alexander et al., 1995; Duncan et al., 1995; Yang et al., 1996).
Геномная эра значительно расширила семейство белков СТПК. Публикация в 1995 г. полной последовательности генома бактерии Haemophilus influenzae (гемофильной палочки) положила начало лавине информации о макромолекулярных последовательностях (Fleischmann et al., 1995). По мере того как количество секвенированных геномов бактерий росло, возрастало и количество идентифицированных СТПК по всем бактериальным семействам (Leonard et al., 1998; Ponting et al., 1999). Первыми были охарактеризованы СТПК почвенного микроорганизма Myxococcus xanthus (Muñoz-Dorado et al., 1991; Perez et al., 2008). В дальнейшем подобные киназы были обнаружены и описаны для Streptococcus pneumoniae (Novakova et al., 2005), Bacillus subtilis (Madec et al., 2002), Mycobacterium tuberculosis (Av-Gay, Everett, 2000) и для многих других бактерий (Petrickova, Petricek, 2003; Fiuza et al., 2008).
На настоящий момент СТПК идентифицированы в большинстве секвенированных бактериальных геномов: они обнаружены у почвенных и у патогенных микроорганизмов, а также у бактерий – представителей комменсальной микробиоты кишечника человека и животных. Особенно широко СТПК представлены у грамположительных бактерий, в частности, у актинобактерий и фирмикутов (Danilenko et al., 2011). Некоторые бактериальные роды, такие как Lactobacillus, Staphylococcus и Streptococcus обладают всего одним–двумя генами СТПК, тогда как для рода Mycobacterium характерно наличие более 10 СТПК на геном (Prisic, Husson, 2014), для рода Nocardia – более 20 СТПК (Алексеева и др., 2015), а для рода Streptomyces – более 30 СТПК на геном (Petrickova, Petricek, 2003). Выбор организмов для проектов по секвенированию геномов, конечно, влияет на общий образ распределения СТПК у бактерий (Petrickova, Petricek, 2003).
Одной из самых изученных киназ в настоящее время является СТПК PknB из M. tuberculosis (Ortiz-Lombardia et al., 2003; Wehenkel et al., 2006; Mieczkowski et al., 2008; Lombana et al., 2010). Детальное изучение инактивированных мутантов данной киназы и ее кристаллической структуры в комплексе с АТФ-конкурентными ингибиторами позволило выдвинуть ключевые идеи о механи-змах, регулирующих этот класс ферментов (Wehenkel et al., 2006). В связи с высокой гомологией доменов киназы PknB с киназами других грамположительных бактерий, PknB является моделью для исследования бактериальных СТПК.
Количество СТПК эукариотического типа, найденных у бактерий, продолжает расти и по сей день. Эти ферменты в настоящее время считаются повсеместно распространенными, так как открытые рамки считывания, кодирующие эукариотические протеинкиназы, обнаружены и у эукариот, и у бактерий, и у архей (Smith, King, 1995; Zhang et al., 1998; Kennelly, 2002; Manning et al., 2002; Krupa, Srinivasan, 2005; Endicott et al., 2012). Распространенность этих протеинкиназ указывает на то, что процессы фосфорилирования белков играют заметную роль у большинства организмов, населяющих нашу планету, и что этот механизм регуляции оказался древней, чем предполагалось ранее (Захаревич, 2017; Kennelly, 2002).
СТРУКТУРА БАКТЕРИАЛЬНЫХ СЕРИН-ТРЕОНИНОВЫХ ПРОТЕИНКИНАЗ
СТПК принадлежат к семейству протеинкиназ, относящихся к однокомпонентным системам передачи сигнала. В отличие от двухкомпонентных систем, которые состоят из двух специальных белков (датчика и регулятора), однокомпонентные системы сочетают в себе оба этих свойства: свойства датчика и регулирующие свойства (Ulrich et al., 2005; Ruggiero et al., 2012). Как правило, эти свойства находятся в двух разных доменах, сенсорном и регуляторном, с различной клеточной локализацией. Действуя и как датчики, и как регуляторы, СТПК имеют модульную структурную организацию, в которой сенсорный домен является внеклеточным и соединен с внутриклеточным доменом киназы посредством трансмембранного домена (Jones, Dyson, 2006).
СТПК должны взаимодействовать как минимум с двумя субстратами, то есть иметь специальный центр связывания АТФ или других доноров остатков фосфата, а также обладать центром связывания белка-субстрата, на который и осуществляется перенос фосфатной группы. Эти два центра связывания должны располагаться рядом, так как только в этом случае возможен эффективный перенос остатка фосфата; и помимо этого протеинкиназы должны иметь каталитический центр, обеспечивающий сам процесс фосфорилирования (Гусев, 2000).
Цитоплазматический домен СТПК
Цитоплазматический домен СТПК состоит из каталитического киназного домена и околомембранного домена. Околомембранный домен очень гибок, и его положение по отношению к каталитическому домену киназы, а также его функция не определены (Manuse et al., 2016). Известно, что он фосфорилируется по двум остаткам треонина и предположительно вносит свой вклад в активацию СТПК (Duran et al., 2005; Roumestand et al., 2011; Manuse et al., 2016).
Несмотря на то, что СТПК имеют разную субстратную специфичность, регулируются различными низкомолекулярными соединениями и взаимодействуют с разными регуляторными белками, структура их каталитического домена имеет много общих черт (Гусев, 2000). Каталитический домен большинства протеинкиназ (участок молекулы белка, обеспечивающий перенос фосфата с АТФ на белок) образован двумя долями, соединенными гибким шарниром (полипептидной цепью). Верхняя N-концевая доля обеспечивает связывание АТФ, а нижняя С-концевая доля – связывание белкового субстрата. Катализ осуществляется при участии аминокислотных остатков, расположенных в шарнирном участке (Гусев, 2000). N-доля включает в себя: альфа-спираль αС, играющую важную роль в каталитической активности СТПК; Р-петлю, которая представляет собой обогащенную глицином гибкую петлю (Manuse et al., 2016), участвующую в передаче фосфата в ходе каталитического цикла; мотив, включающий в себя остаток лизина Lys40 и помогающий закрепить и сориентировать молекулу АТФ (Manuse et al., 2016). C-доля также включает в себя важные мотивы, представленные каталитической и активационной петлями. Каталитическая петля влияет на расположение иона магния в комплексе с АТФ (Manuse et al., 2016), а активационная петля является важным регуляторным элементом, контролирующим киназную активность и участвующим в определении субстратной специфичности (Nolen et al., 2004). Стоит отметить, что двухдолевая структура характерна и для эукариотических СТПК (Huse, Kuriyan, 2002; Ortiz-Lombardia et al., 2003).
Внеклеточный домен СТПК
Несмотря на доказанную ключевую роль бактериальных СТПК в регуляции ответов на воздействия окружающей среды и, следовательно, важность внеклеточных частей этих белков (сенсорных доменов) в восприятии изменений окружающей среды, информации о структурной организации сенсорных доменов на сегодня недостаточно (Ruggiero et al., 2012).
Известно, что каталитические домены многих бактериальных СТПК эукариотического типа связаны с дополнительным доменом(ами) (Krupa, Srinivasan, 2005). Разнообразие в модульной организации этих доменов характерно и наблюдается у микроорганизмов, которые содержат большое количество СТПК, например у Mycobacterium tuberculosis (11 СТПК) или у Streptomyces coelicolor (34 СТПК) (Petrickova, Petricek, 2003; Perez et al., 2008). Такие дополнительные внеклеточные домены могут быть ферментативными, и зачастую они опосредуют связывание лиганда или белок–белковые взаимодействия.
Большинство грамположительных бактерий содержит, по крайней мере, одну трансмембранную СТПК эукариотического типа, состоящую из цитоплазматического каталитического киназного домена, связанного при помощи трансмембранного участка с внеклеточным доменом. Распространенный тип внеклеточных доменов – это PASTA- (penicillin-binding protein and ser/thr kinase-associated) домены (Yeats et al., 2002). Впервые PASTA-домены были обнаружены при изучении кристаллической структуры белка PBP2X (penicillin-binding protein 2x) у бактерии Streptococcus pneumoniae, которая содержит два таких домена, имеющих шаровидную организацию (Dessen et al., 2001). В противоположность этому, для PASTA-доменов киназы PknB M. tuberculosis и киназы PrkC из S. aureus характерна линейная организация этих доменов (Barthe et al., 2010; Paracuellos et al., 2010).
Проводились исследования структуры PASTA-доменов киназы PrkC из S. aureus (Mir et al., 2011; Ruggiero et al., 2011). PrkC содержит четыре внеклеточных домена, три из которых представлены PASTA-доменами, а анализ четвертого домена показал его структурное сходство с иммуноглобулин-подобными доменами (Berisio et al., 2012). Экспонирование аномально большого числа доноров и акцепторов водородной связи может наделять иммуноглобулин-подобные домены клейкими – адгезивными – свойствами (Richardson J., Richardson D., 2002; Vitagliano et al., 2007; De Simone et al., 2011), или же, по аналогии с субъединицами пилей из Е. coli, иммуноглобулин-подобный домен PrkC может быть вовлечен в связывание пептидогликана (Ruggiero et al., 2011; Berisio et al., 2012).
Число PASTA-доменов может варьировать. Так, например, протеинкиназа PksC из Streptomyces clavuligerus содержит всего один PASTA-домен, тогда как семь PASTA-доменов описано для киназы B0MM44 из Eubacterium siraeum (Manuse et al., 2016). Киназа StkP из Streptococcus pneumoniae, как и PknB, содержит четыре PASTA-домена, а у киназы Stk1 из Staphylococcus aureus найдено только три PASTA-домена (Manuse et al., 2016). В дополнение к PASTA-доменам внеклеточная часть СТПК может также содержать и другие домены, например уже описанные выше иммуноглобулин-подобные домены (Ruggiero et al., 2011; Squeglia et al., 2011).
Ряд бактериальных СТПК обладает внеклеточными доменами, отличными от PASTA-доменов. Наиболее часто встречаются следующие внеклеточные домены: TPR-повторы, повторы WD40, GAF-домены, PD40-повторы и др. TPR-повторы участвуют в различных функциях, например в белок–белковом взаимодействии при сборке мультибелковых комплексов (D’Andrea, Regan, 2003). Повторы WD40 участвуют в сигнальной трансдукции – в передаче сигнала (Neer et al., 1994). Помимо этого, повторы WD40 также участвуют в координации сборки мультибелковых комплексов и могут служить в качестве жесткого каркаса для белок–белковых взаимодействий (Smith et al., 1999). Домены GAF, предположительно, участвуют в регуляции различных сигнальных событий у бактерий (Tyagi at al., 2010). PD40-повторы связаны с повторами WD40 и могут служить основой для построения третичной структуры типа β-пропеллера; а данная структура, в свою очередь, может выполнять функции “белковой платформы”, на основе которой возможна сборка различных белковых комплексов (Tyagi at al., 2010). Внеклеточный домен может быть представлен также APH (aminoglycoside phosphotransferase)-доменами (Wright, Thompson, 1999).
Еще один из возможных типов внеклеточных доменов описан для трансмембранной киназы PknD из M. tuberculosis и представляет собой симметричную структуру, напоминающую β-пропеллер с шестью лопастями, расположенными симметрично вокруг центральной поры (Good et al., 2004; Pereira, 2011; Ruggiero et al., 2012). Аналогичные внеклеточные домены встречаются в эукариотических белках с широким разнообразием функций, тогда как среди бактерий, по-видимому, такой тип внеклеточного домена присутствует только у микобактерий (Pereira et al., 2011). Стоит помнить, что не все бактериальные протеинкиназы являются мультимодульными. Доменная архитектура различных бактериальных киназ подробно описана в работе Тиаги с соавт. (Захаревич, 2017; Tyagi et al., 2010).
КАТАЛИТИЧЕСКИЙ И АКТИВАЦИОННЫЙ МЕХАНИЗМ СЕРИН-ТРЕОНИНОВЫХ ПРОТЕИНКИНАЗ
В зависимости от относительной ориентации N- и С-долей домены эукариотических СТПК могут принимать “открытую” или “закрытую” конформацию, каждой из которых соответствует неактивное и активное состояние (Cox et al., 1994; Manuse et al., 2016).
Одной из особенностей, позволяющей отличить бактериальные СТПК от эукариотических, является конформация активационной петли. У эукариот эта петля, как правило, не упорядочена и блокирует активный сайт, когда он не фосфорилируется (Johnson et al., 1996). Таким образом, она играет роль ворот, закрывающих доступ к каталитическому сайту. После фосфорилирования активационная петля принимает альтернативную конформацию, открывающую АТФ доступ, и является составной частью сайта связывания мишени (Huse, Kuriyan, 2002). Активационная петля у бактерий, наоборот, разупорядоченная, хотя и показано, что она фосфорилируется и полностью активна in vitro (Manuse et al., 2016). Это говорит о том, что в дополнение к фосфорилированию необходимы другие события, включающие связывание субстрата, для того чтобы генерировать активное состояние у бактериальных СТПК. Эта гипотеза подтверждается фосфорилированием белка GarA из M. tuberculosis (Villarino et al., 2005).
Изучение структур бактериальных СТПК продемонстрировало конформационное сходство бактериальных СТПК с эукариотическими СТПК. Действительно, консервативные структурные особенности характерны как для эукариотических, так и для бактериальных киназ, и включают в себя каталитический домен, представленный двумя долями, а также области, в которых расположены остатки, вовлеченные в передачу фосфата, что еще раз подтверждает консервативность механизма фосфорилирования (Ruggiero et al., 2012; Захаревич, 2017).
ФУНКЦИИ СЕРИН-ТРЕОНИНОВЫХ ПРОТЕИНКИНАЗ
В литературе описано участие СТПК эукариотического типа в процессах деления клеток и биосинтеза клеточной стенки (Fiuza et al., 2008; Liebeke et al., 2010; Molle, Kremer, 2010; Ruggiero et al., 2012). Известно также, что СТПК играют существенную роль в образовании биопленок (Madec et al., 2002; Hussain et al., 2006), в спорообразовании (Madec et al., 2002) и в реакции на стресс (Neu et al., 2002; Absalon et al., 2009); помимо этого СТПК вовлечены в транспорт глюкозы и потребление гликогена (Nariya, Inouye, 2003; Deol et al., 2005), участвуют во вторичном метаболизме и формообразовании (Umeyama et al., 2002), в биосинтезе пуринов (Rajagopal et al., 2005), и, конечно же, СТПК вовлечены в формирование вирулентности у патогенных микроорганизмов (Av-Gay, Everett, 2000; Rajagopal et al., 2006; Wiley et al., 2006). Такая универсальность этих ферментов отражена в разнообразии внеклеточных доменов, которые сопровождают более консервативный каталитический домен киназы (Av-Gay, Everett, 2000; Petrickova, Petricek, 2003; Tyagi at al., 2010).
Для СТПК характерно следующее свойство: одна СТПК способна регулировать большое разнообразие белков, важных для различных клеточных функций, в том числе транскрипции и трансляции, деления клеток, состояния покоя (диапауза), устойчивости к антибиотикам, бактериальной персистенции и экспрессии факторов вирулентности (Wright, Ulijasz, 2014). Разнообразие субстратов СТПК было продемонстрировано несколькими протеомными исследованиями. Некоторые примеры: M. tuberculosis, для которой был выявлен 301 белковый субстрат для 11 СТПК (Av-Gay, Everett, 2000; Prisic et al., 2010); L. monocytogenes, у которой было обнаружено 62 субстрата для двух ее СТПК (Lima et al., 2011); S. agalactiae, у которой было обнаружено 10 потенциальных субстратов для единственной известной у нее СТПК (Silvestroni et al., 2009). Стоит также отметить, что количество СТПК (однокомпонентных систем) на бактериальный геном обычно гораздо меньше, чем двухкомпонентных систем (Wright, Ulijasz, 2014).
Постоянно растущий список субстратов СТПК эукариотического типа включает в себя разнообразнейшие белки. В последнее время пришли к выводу, что СТПК напрямую модулируют транскрипционную машину у многих патогенных микроорганизмов (Wright, Ulijasz, 2014). Такая форма регулирования служит дополнительным средством, при помощи которого бактерии могут изменить свой транскриптом в ответ на специфичные внешние раздражители (Wright, Ulijasz, 2014). Тем не менее, идентификация и описание специфических субстратов СТПК затруднительны, скорее всего, из-за их разнородности. Также следует подчеркнуть, что большинство субстратов идентифицируется путем фосфопротеомных подходов и/или при анализе киназ in vitro, или с помощью сайт-направленного мутагенеза, а подтверждения in vivo на настоящий момент отсутствуют (Pereira et al., 2011).
О функциях СТПК стало известно гораздо больше с выявлением трехмерной кристаллической структуры PknB из M. tuberculosis (Ortiz-Lombardia et al., 2003). При изучении кристаллической структуры киназного домена PknB была предложена модель, в которой происходит димеризация внутриклеточных киназных доменов в ответ на связывание PASTA-доменами муропептидов, что приводит в результате к фосфорилированию серина и треонина (Madec et al., 2002; Mieczkowski et al., 2008). Поскольку бета-лактамы структурно напоминают пептидогликановые фрагменты (муропептиды), была выдвинута гипотеза, что внеклеточные домены СТПК, содержащие PASTA-домены, могут связывать и эти фрагменты (Manuse et al., 2016). Эта гипотеза была подтверждена (Shah et al., 2008), когда было обнаружено, что киназа PrkC (B. subtilis) сигнализирует споре о том, что “можно” выйти из состояния покоя в ответ на связывание пептидогликановых фрагментов внеклеточным доменом киназы. Помимо этого, в ряде других исследований было показано in vitro, что PASTA-домены киназ PknB, PrkC, Stk1 и StkP способны связывать бета-лактамы и различные другие пептидогликановые фрагменты (Paracuellos et al., 2010; Maestro et al., 2011; Mir et al., 2011; Squeglia et al., 2011). В то же время, до сих пор обсуждается способность всех PASTA-доменов взаимодействовать с различными пептидогликанами и предполагается что PASTA-домены, не обладающие такой способностью, выполняют в клетке структурную роль (Manuse et al., 2016). Интересно, что PASTA-домены не обнаружены у эукариот, а у бактерий встречаются, в частности, у Firmicutes и Actinobacteria.
Также известно, что имеет место перекрестное взаимодействие между СТПК эукариотического типа и двухкомпонентными системами. Например, фактор транскрипции Mrp у M. xanthus находится под контролем как двухкомпонентных систем MrpA/MrpB, так и СТПК эукариотического типа Pkn8 и Pkn14 (Sun, Shi, 2001; Nariya, Inouye, 2005). Аналогичным образом, двухкомпонентная система CovR/CovS и СТПК эукариотического типа Stk1 совместно регулируют экспрессию β-хемолизина/цитолизина, что имеет решающее значение для выживания стрептококков группы B в кровотоке и для их устойчивости (резистентности) к окислительному стрессу (Rajagopal et al., 2006).
Если принять во внимание широкий спектр важнейших клеточных процессов, в которых участвуют бактериальные СТПК, становится понятным, почему эти ферменты предлагаются в качестве кандидатов в биомишени при разработке новых лекарственных средств (Захаревич, Даниленко, 2017; Маслов и др., 2017; Danilenko et al., 2011). Этому только способствует низкое сходство между бактериальными и человеческими СТПК (около 30%). Так, в последнее время был использован метод высокопроизводительного скрининга для идентификации малых молекул, нацеленных на киназу PknB M. tuberculosis (Villarino et al., 2005; Lougheed et al., 2011). Эти исследования позволили определить новый класс АТФ-конкурентных ингибиторов (Захаревич, 2017; Wehenkel et al., 2006; Ruggiero et al., 2012).
МЕТОДЫ КЛАССИФИКАЦИИ СЕРИН-ТРЕОНИНОВЫХ ПРОТЕИНКИНАЗ
Попытки классифицировать СТПК начались с эукариотических киназ и работы Хэнкса и Хантера, в которой было проведено ручное выравнивание аминокислотных последовательностей 65 каталитических доменов протеинкиназ (Hanks, Hunter, 1995; Hanks, 2003). Это исследование позволило идентифицировать консервативные субдомены (c I по XII) и мотивы, характерные для эукариотических СТПК. Развитие технологий полногеномного секвенирования привело к построению филогенетического дерева эукариотических киназ и к идентификации различных классов этих ферментов (Manning et al., 2002). Но корреляции между филогенией и сходством сайтов связывания обнаружено не было (Bamborough et al., 2008; Karaman et al., 2008; Kinnings, Jackson, 2009). Таким образом, возникла потребность в создании более функциональной классификации, отражающей различия в сайтах связывания. Такая классификация, в том числе, востребована при разработке селективных ингибиторов СТПК.
Из литературных данных известно о различных подходах и методах, применяющихся при классификации киназ. Большинство существующих классификаций основано на сравнении последовательностей всего каталитического домена СТПК (Tyagi et al., 2010). Более современные методы сочетают информацию о структуре и последовательности киназ и анализируют аминокислотные остатки, выстилающие активные сайты связывания (Röttig et al., 2010). Ряд авторов для классификации киназ использует комбинированные подходы, основанные одновременно на сравнении их аминокислотных последовательностей и кристаллических структур (Scheeff, Bourne, 2005). Также существуют методы, нацеленные на быстрое сравнение белковых сайтов связывания, основанные на геометрическом соответствии сайтов друг другу. Геометрическое соответствие определяется общими атомными особенностями посредством выявления максимально общего подграфа или клики (Brakoulias, Jackson, 2004). Этот метод примечателен тем, что сходство в данном случае совсем необязательно видно при сравнении последовательностей и структур. Такие подходы дают дополнительное понимание процессов молекулярного распознавания. Помимо этого, известно об исследовании структур эукариотических протеинкиназ, которые были классифицированы на подсемейства, с использованием хемометрического подхода – такая классификация также хороша тем, что она не зависит от сходства белковых последовательностей (Naumann, Matter, 2002). Все описанные методы различаются областью своей применимости, вычислительной сложностью и необходимыми для их применения данными. В большинстве случаев наряду с аминокислотными последовательностями белков требуется их пространственная структура, а она на настоящий момент предсказана лишь для небольшого количества СТПК (Henrich et al., 2010; Volkamer et al., 2010).
Как уже было сказано выше, существуют различные классификации бактериальных СТПК. С-концевая часть СТПК, взаимодействующая с субстратом, довольно вариабельна. В связи с этим для классификации, как правило, используется более консервативная N-концевая часть киназы, взаимодействующая с АТФ. Даже рассматривая сайт связывания АТФ, можно выделить более и менее консервативные участки как функционально, так и структурно. В меньшей степени информативными для классификации СТПК являются наиболее структурно и эволюционно консервативные области, например остатки, вовлеченные в передачу фосфата, а также области связывания фосфата и рибозы. В 2012 г. нами был предложен свой подход по разбиению СТПК на группы (Zakharevich et al., 2012). Мы обратили свое внимание на область связывания аденина, которая, являясь наиболее функционально консервативной частью киназы, одновременно представляет собой более структурно вариабельную область, по сравнению с вышеописанными участками киназ. По результатам проведенного исследования нами было отобрано девять вариабельных аминокислотных остатков, боковые цепи которых экспонированы в область связывания аденина. Выбранные остатки составили сигнатуру аденин-связывающего кармана. Консервативность рассматриваемых сигнатурных остатков различна. На основе сигнатуры из девяти аминокислотных остатков и была проведена классификация бактериальных СТПК. По итогам классификации все рассмотренные нами на тот момент киназы были разделены на 20 групп. Классификация СТПК также позволила разделить исследуемые бактериальные роды и виды на группы, где для каждой группы характерна специфичная (только для нее) конфигурация области связывания аденина: форма, объем, глубина области связывания. Далее было выдвинуто следующее предположение: селективные ингибиторы, нацеленные на одну из групп, не будут (или будут очень слабо) взаимодействовать с киназами из других групп. Практическим применением классификации может стать ее использование при разработке селективных ингибиторов бактериальных СТПК (Захаревич, 2017).
СЕРИН-ТРЕОНИНОВЫЕ ПРОТЕИНКИНАЗЫ В КАЧЕСТВЕ БИОМИШЕНЕЙ – ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
Чтобы продемонстрировать возможность использования СТПК в качестве биомишеней, нами был разработан алгоритм поиска СТПК – кандидатов в биомишени для коррекции таксономического состава КМ при Д2Т (Захаревич, Даниленко, 2018, 2019). Были проанализированы доступные данные из трех независимых исследований: метагеномные данные КМ от взрослых мужчин и женщин в возрасте от 13 до 86 лет, проживающих в Китае (Qin et al., 2012); метагеномные данные КМ от 70-летних европейских женщин (Karlsson et al., 2013); 147 метагеномных образцов КМ, выделенных от здоровых взрослых мужчин и женщин в возрасте от 18 до 40 лет, проживающих в США (HMP, Human Microbiome Project).
Согласно результатам сравнительного таксономического анализа 126 кишечных метагеномов здоровых людей и 114 кишечных метагеномов от людей с Д2Т из двух независимых исследований (Qin et al., 2012; Karlsson et al., 2013), было отобрано восемь бактериальных родов: Acidaminococcus, Desulfovibrio, Enterococcus, Lactobacillus, Leuconostoc, Megamonas, Megasphaera, Parvimonas, количество которых было увеличено в образцах от людей с Д2Т, по сравнению с контрольной группой (рисунок) (Захаревич, Даниленко, 2018, 2019). Дополнительный анализ 147 метагеномных образцов показал, что медианные значения относительного содержания в КМ, подсчитанные для каждого из восьми бактериальных родов (для этих данных), не превышали аналогичных значений для этих родов в КМ от лиц с Д2Т, как для метагеномных данных из исследования Кина с соавт., так и для метагеномных данных из исследования Карлссона с соавт. (Захаревич, Даниленко, 2018, 2019; Qin et al., 2012; Karlsson et al., 2013).
На рисунке (б) значения для рода Desulfovibrio не так сильно различаются между контрольной группой и группой с Д2Т. Несмотря на это, данный род всe равно был взят для рассмотрения, так как в ряде исследований также отмечалось увеличение количества микроорганизмов, относящихся к семейству Desulfovibrionaceae, у людей с Д2Т и ожирением (Zhang et al., 2010; Xiao et al., 2014). Увеличение количества данных микроорганизмов может быть связано с тем, что они являются потенциальными производителями эндотоксинов, которые могут быть причиной хронических воспалений в кишечнике, сопутствующих Д2Т (Zhang et al., 2010).
Медианные значения относительного содержания в КМ родов, количество которых было увеличено для лиц с Д2Т, в проанализированных метагеномах. (а) – значения для метагеномных данных из исследования Кина и соавт. (Qin et al., 2012); (б) – значения для метагеномных данных из исследования Карлссона и соавт. (Karlsson et al., 2013): род Megamonas отсутствует, так как для данного набора метагеномов род Megamonas был идентифицирован только в метагеномах из группы с Д2Т. По оси ординат данные представлены в логарифмическом масштабе. Относительное содержание микроорганизмов в метагеномах получено с помощью программы MetaPhlAn v2.0 (http://huttenhower.sph.harvard.edu/metaphlan2).
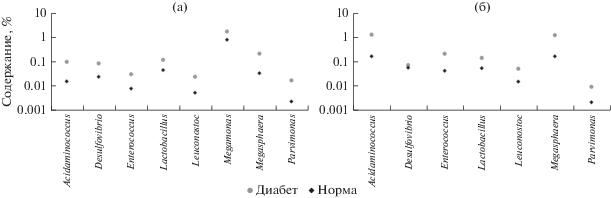
После таксономического анализа были отобраны все СТПК, относящиеся к восьми выбранным бактериальным родам, из метагеномов с Д2Т. Киназы были отобраны для всех родов, кроме рода Parvimonas, для которого не удалось идентифицировать (in silico) СТПК в анализируемых метагеномных образцах (с Д2Т). Возможно, это связано с низким количественным содержанием этого рода в изученных метагеномах, как это видно на рисунке.
Во всех отобранных СТПК была идентифицирована сигнатура из девяти аминокислотных остатков. По сигнатуре протеинкиназы были разделены на группы в соответствии с разработанной ранее классификацией (Zakharevich et al., 2012). Так как цель исследования заключалась в том, чтобы найти биомишени (бактериальные СТПК), воздействие на которые будет максимально безопасным для человека, было проведено сравнение сигнатур отобранных СТПК с сигнатурами, характерными для человеческих киназ. Распределение человеческих киназ по группам, согласно разработанной классификации, было выполнено, описано и опубликовано нами ранее (Захаревич, Даниленко, 2017).
В результате всех предпринятых шагов СТПК из следующих четырех бактериальных родов были предложены в качестве кандидатов в биомишени: Acidaminococcus (WP_009015884.1), Desulfovibrio (WP_062252584.1), Lactobacillus (WP_103205347.1), Leuconostoc (WP_036087829.1) (Захаревич, Даниленко, 2018, 2019). В скобках указаны идентификаторы конкретных СТПК из базы данных NCBI.
Стоит отметить, что различия в возрасте, типе питания и ряде других факторов могут влиять на состав микробиоты, это следует учитывать при проведении такого рода исследований. Именно в связи с этим, для проведенного нами исследования были выбраны данные из разных работ – нас интересовало их пересечение. Представленные результаты являются первым шагом в поиске СТПК-биомишеней и призваны помочь в разработке селективных ингибиторов СТПК для конкретных бактериальных родов и видов КМ человека. В свою очередь применение в будущем селективных ингибиторов СТПК способно облегчить протекание заболеваний, в частности Д2Т, путем коррекции таксономического состава КМ.
ЗАКЛЮЧЕНИЕ
Идея воздействовать на бактериальные СТПК селективными ингибиторами не нова (Cohen, 2002; Wehenkel et al., 2008; Danilenko et al., 2011). Проведенные, в том числе в нашей лаборатории, работы показали, что, несмотря на консервативную структуру каталитического домена киназы, поиск и разработка низкомолекулярных соединений, действующих селективно, возможны (Захаревич, Даниленко, 2017, 2018, 2019). Классификация СТПК, разработанная нами в 2012 г., заложила фундамент для исследований в этом направлении (Zakharevich et al., 2012). Не вызывает сомнений тот факт, что разработка селективных ингибиторов СТПК бактерий, составляющих комменсальную микробиоту кишечника человека, – это не простая задача, требующая более глубоких исследований как минимум по трем следующим направлениям:
1) сравнительный анализ таксономического состава КМ людей различных этнических групп (территориально обособленных); при этом данный анализ должен проводиться отдельно для взрослого населения и для детей, у которых еще не сформировалась КМ; также данный анализ должен осуществляться на метагеномных данных;
2) поиск и характеристика СТПК тех групп бактерий, особенно социально значимых, для которых они еще не описаны;
3) in silico поиск низкомолекулярных соединений, способных селективно связываться с СТПК, из определенных групп с последующей экспериментальной проверкой предлагаемых соединений.
Исследования КМ с точки зрения поиска путей коррекции ее таксономического состава – интересная и актуальная задача, так как КМ – это сообщество микроорганизмов, эволюционирующее вместе с человеком на протяжении огромного отрезка времени и на настоящий момент еще очень мало изученное, несмотря на то, что нарушения в этом “дополнительном органе” сопутствуют большому числу заболеваний, а иногда и служат для них триггером.
Список литературы
Алексеева М.Г., Мавлетова Д.А., Колчина Н.В. и др. Выделение и очистка рекомбинантных белков серин-треониновых протеинкиназ штамма Bifidobacterium longum B379M и изучение их активности // Биохимия. 2015. Т. 10. С. 1578–1587.
Гусев Н.Б. Протеинкиназы: строение, классификация, свойства и биологическая роль // Сорос. образоват. журн. 2000. Т. 6. № 12. С. 4–12.
Захаревич Н.В. Серин-треониновые протеинкиназы грамположительных бактерий: классификация, генетическая структура и предполагаемые функции: Дис… канд. биол. наук. М.: ИОГен РАН, 2017. 166 с.
Захаревич Н.В., Даниленко В.Н. Серин-треониновые протеинкиназы бактерий – потенциальная мишень для регуляции состава микробиоты человека // Вестн. РГМУ. 2017. № 2. С. 20–29.
Захаревич Н.В., Даниленко В.Н. Серин-треониновые протеинкиназы – кандидаты в биомишени для коррекции таксономического состава кишечной микробиоты при диабете 2 типа // Научный форум: медицина, биология и химия / Сб. ст. по мат. XVII м/н. науч.-практ. конф. № 9 (17). М.: МЦНО, 2018. С. 6–16.
Захаревич Н.В., Даниленко В.Н. Серин-треониновые протеинкиназы – потенциальная биомишень для коррекции таксономического состава кишечной микробиоты человека при диабете 2 типа // Биотехнология – медицине будущего / Мат. Всерос. мультиконф. с м/н. участ. Новосибирск: Офсет-ТМ, 2019. С. 102.
Зорина А.А. Эукариотические протеинкиназы цианобактерий // Физиол. раст. 2013. Т. 60. № 5. С. 625–633.
Маслов Д.А., Беккер О.Б., Алексеева М.Г. и др. Ингибиторы серин-треониновых протеинкиназ классов аминопиридинов и аминопиримидинов – кандидаты в препараты для лечения лекарственно-устойчивых форм туберкулеза // Вестн. РГМУ. 2017. № 1. С. 42–47.
Янковский Д.С. Состав и функции микробиоценозов различных биотопов человека // Здоровье женщины. 2003. № 4 (16). С. 145–158.
Absalon C., Obuchowski M., Madec E. et al. CpgA, EF-Tu and the stressosome protein YezB are substrates of the Ser/Thr kinase/phosphatase couple, PrkC/PrpC, in Bacillus subtilis // Microbiology. 2009. V. 155. P. 932–943.
Alber T. Signaling mechanisms of the Mycobacterium tuberculosis receptor Ser/Thr protein kinases // Curr. Opin. Struct. Biol. 2009. V. 19. P. 650–657.
Alexander C., Bilgin N., Lindschau C. et al. Phosphorylation of elongation factor Tu prevents ternary complex formation // J. Biol. Chem. 1995. V. 270. P. 14541–14547.
Av-Gay Y., Everett M. The eukaryotic-like Ser/Thr protein kinases of Mycobacterium tuberculosis // Trends Microbiol. 2000. V. 8. P. 238–244.
Bamborough P., Drewry D., Harper G. et al. Assessment of chemical coverage of kinome space and its implications for kinase drug discovery // J. Med. Chem. 2008. V. 51. P. 7898–7914.
Barthe P., Mukamolova G.V., Roumestand C., Cohen-Gonsaud M. The structure of PknB extracellular PASTA domain from Mycobacterium tuberculosis suggests a ligand-dependent kinase activation // Structure. 2010. V. 18. P. 606–615.
Berisio R., Ciccarelli L., Squeglia F. et al. Structural and dynamic properties of incomplete immuno-globulin-like fold domains // Prot. Pept. Lett. 2012. V. 19. P. 1045–1053.
Bogoyevitch M.A., Barr R.K., Ketterman A.J. Peptide inhibitors of protein kinases – discovery, characterisation and use // Biochim. Biophys. Acta. 2005. V. 1754. № 1–2. P. 79–99.
Brakoulias A., Jackson R.M. Towards a structural classification of phosphate binding sites in protein–nucleotide complexes: an automated all-against-all structural comparison using geometric matching // Proteins. 2004. V. 56. P. 250–260.
Burnside K., Rajagopal L. Regulation of prokaryotic gene expression by eukaryotic-like enzymes // Curr. Opin. Microbiol. 2012. V. 15. № 2. P. 125–131.
Chao J., Wong D., Zheng X. et al. Protein kinase and phosphatase signaling in Mycobacterium tuberculosis physiology and pathogenesis // Biochim. Biophys. Acta. 2010. V. 1804. № 3. P. 620–627.
Cohen P. Protein kinases – the major drug targets of the twenty first century? // Nat. Rev. Drug Discov. 2002. V. 1. № 4. P. 309–315.
Cousin C., Derouiche A., Shi L. et al. Protein-serine/threonine/tyrosine kinases in bacterial signaling and regulation // FEMS Microbiol. Lett. 2013. V. 346. № 1. P. 11–19.
Cox S., Radzio-Andzelm E., Taylor S.S. Domain movements in protein kinases // Curr. Opin. Struct. Biol. 1994. V. 4. № 6. P. 893–901.
Cryan J.F., Dinan T.G. Mind-altering microorganisms: the impact of the gut microbiota on brain and behavior // Nat. Rev. Neurosci. 2012. V. 13. № 10. P. 701–712.
D’Andrea L.D., Regan L. TPR proteins: the versatile helix // Tr. Biochem. Sci. 2003. V. 28. P. 655–662.
Danilenko V.N., Osolodkin D.I., Lakatosh S.A. et al. Bacterial eukaryotic type serine-threonine protein kinases: from structural biology to targeted antiinfective drug design // Curr. Top. Med. Chem. 2011. V. 11. P. 1352–1369.
Deol P., Vohra R., Saini A.K. et al. Role of Mycobacterium tuberculosis Ser/Thr kinase PknF: implications in glucose transport and cell division // J. Bacteriol. 2005. V. 187. P. 3415–3420.
De Simone A., Dhulesia A., Soldi G. et al. Experimental free energy surfaces reveal the mechanisms of maintenance of protein solubility // PNAS USA. 2011. V. 108. P. 21057–21062.
Dessen A., Mouz N., Gordon E. et al. Crystal structure of PBP2x from a highly penicillin-resistant Streptococcus pneumoniae clinical isolate: a mosaic framework containing 83 mutations // J. Biol. Chem. 2001. V. 276. P. 45106–45112.
Duncan L., Alper S., Arigoni F. et al. Activation of cell-specific transcription by a serine phosphatase at the site of asymmetric division // Science. 1995. V. 270. P. 641–644.
DuPont A.W., DuPont H.L. The intestinal microbiota and chronic disorders of the gut // Nat. Rev. Gastroenterol. Hepatol. 2011. V. 8. № 9. P. 523–531.
Duran R., Villarino A., Bellinzoni M. et al. Conserved autophosphorylation pattern in activation loops and juxtamembrane regions of Mycobacterium tuberculosis Ser/Thr protein kinases // Biochem. Bioph. Res. Comm. 2005. V. 333. № 3. P. 858–867.
Egger L.A., Park H., Inouye M. Signal transduction via the histidyl-aspartyl phosphorelay // Gen. Cells. 1997. V. 2. P. 167–184.
Elizarov S.M., Mironov V.A., Danilenko V.N. Calcium-induced alterations in the functioning of protein serine/threonine and tyrosine kinases in Streptomyces fradiae cells // IUBMB Life. 2000. V. 50. № 2. P. 139–143.
Endicott J.A., Noble M.E.M., Johnson L.N. The structural basis for control of eukaryotic protein kinases // Ann. Rev. Biochem. 2012. V. 81. P. 587–613.
Fiuza M., Canova M.J., Zanella-Cleon I. et al. From the characterization of the four serine/threonine protein kinases (PknA/B/G/L) of Corynebacterium glutamicum toward the role of PknA and PknB in cell division // J. Biol. Chem. 2008. V. 283. P. 18099–18112.
Fleischmann R.D., Adams M.D., White O. et al. Whole-genome random sequencing and assembly of Haemophilus influenza Rd // Science. 1995. V. 269. № 5223. P. 496–512.
Good M.C., Greenstein A.E., Youngm T.A. et al. Sensor domain of the Mycobacterium tuberculosis receptor Ser/Thr protein kinase, PknD, forms a highly symmetric beta propeller // J. Mol. Biol. 2004. V. 339. P. 459–469.
Hanks S.K. Genomic analysis of the eukaryotic protein kinase superfamily: a perspective // Genome Biol. 2003. V. 4. № 5. P. 111.
Hanks S.K., Hunter T. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification // FASEB J. 1995. V. 9. P. 576–596.
Hemarajata P., Versalovic J. Effects of probiotics on gut microbiota: mechanisms of intestinal immunomodulation and neuromodulation // Therap. Adv. Gastroenterol. 2013. V. 6. № 1. P. 39–51.
Henrich S., Salo-Ahen O.M.H., Huang B. et al. Computational approaches to identifying and characterizing protein binding sites for ligand design // J. Mol. Recogn. 2010. V. 23. P. 209–219.
HMP, NIH Human Microbiome Project. https://hmpdacc.org/
Huang X., Pinto D., Fritz G., Mascher T. Environmental sensing in Actinobacteria: a comprehensive survey on the signaling capacity of this phylum // J. Bacteriol. 2015. V. 197. № 15. P. 2517–2535.
Huse M., Kuriyan J. The conformational plasticity of protein kinases // Cell. 2002. V. 109. P. 275–282.
Hussain H., Branny P., Allan E. A eukaryotic-type serine/threonine protein kinase is required for biofilm formation, genetic competence, and acid resistance in Streptococcus mutans // J. Bacteriol. 2006. V. 188. P. 1628–1632.
Jandhyala S.M., Talukdar R., Subramanyam C. et al. Role of the normal gut microbiota // World J. Gastroenterol. 2015. V. 21. № 29. P. 8787–8803.
Johnson L.N., Noble M.E., Owen D.J. Active and inactive protein kinases: structural basis for regulation // Cell. 1996. V. 85. P. 149–158.
Jones G., Dyson P. Evolution of transmembrane protein kinases implicated in coordinating remodeling of gram-positive peptidoglycan: inside versus outside // J. Bacteriol. 2006. V. 188. P. 7470–7476.
Karaman M.W., Herrgard S., Treiber D.K. et al. A quantitative analysis of kinase inhibitor selectivity // Nat. Biotechnol. 2008. V. 26. P. 127–132.
Karlsson F.H., Tremaroli V., Nookaew I. et al. Gut metagenome in European women with normal, impaired and diabetic glucose control // Nature. 2013. V. 498. P. 99–103.
Kennelly P.J. Protein kinases and protein phosphatases in prokaryotes: a genomic perspective // FEMS Microbiol. Lett. 2002. V. 206. № 1. P. 1–8.
Kinnings S.L., Jackson R.M. Binding site similarity analysis for the functional classification of the protein kinase family // J. Chem. Inf. Model. 2009. V. 49. P. 318–329.
Klumpp S., Krieglstein J. Phosphorylation and dephosphory-lation of histidine residues in proteins // Eur. J. Biochem. 2002. V. 269. P. 1067–1071.
Krupa A., Srinivasan N. Diversity in domain architectures of Ser/Thr kinases and their homologues in prokaryotes // BMC Genom. 2005. V. 6. P. 129.
Larsen N., Vogensen F.K., van den Berg F.W.J. et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults // PLoS One. 2010. V. 5. № 2. P. e9085.
Leonard C.J., Aravind L., Koonin E.V. Novel families of putative protein kinases in bacteria and archaea: evolution of the “eukaryotic” protein kinase superfamily // Genome Res. 1998. V. 8. P. 1038–1047.
Liebeke M., Meyer H., Donat S. et al. A metabolomic view of Staphylococcus aureus and its Ser/Thr kinase and phosphatase deletion mutants: involvement in cell wall biosynthesis // Chem. Biol. 2010. V. 17. P. 820–830.
Lima A., Duran R., Schujman G.E. et al. Serine/threonine protein kinase PrkA of the human pathogen Listeria monocytogenes: biochemical characterization and identification of interacting partners through proteomic approaches // J. Proteomics. 2011. V. 74. P. 1720–1734.
Lombana T.N., Echols N., Good M.C. et al. Allosteric activation mechanism of the Mycobacterium tuberculosis receptor Ser/Thr protein kinase, PknB // Structure. 2010. V. 18. P. 1667–1677.
Lougheed K.E., Osborne S.A., Saxty B. et al. Effective inhibitors of the essential kinase PknB and their potential as anti-mycobacterial agents // Tuberculosis. 2011. V. 91. P. 277–286.
Madec E., Laszkiewicz A., Iwanicki A. et al. Characterization of a membrane-linked Ser/Thr protein kinase in Bacillus subtilis, implicated in developmental processes // Mol. Microbiol. 2002. V. 46. P. 571–586.
Maestro B., Novakova L., Hesek D. et al. Recognition of peptidoglycan and beta-lactam antibiotics by the extracellular domain of the Ser/Thr protein kinase StkP from Streptococcus pneumonia // FEBS Lett. 2011. V. 585. P. 357–363.
Manning G., Whyte D.B., Martinez R. et al. The protein kinase complement of the human genome // Science. 2002. V. 298. P. 1912–1934.
Manuse S., Fleurie A., Zucchini L. et al. Role of eukaryotic like serine/threonine kinases in bacterial cell division and morphogenesis // FEMS Microbiol. Rev. 2016. V. 40. № 1. P. 41–56.
Mieczkowski C., Iavarone A.T., Alber T. Auto-activation mechanism of the Mycobacterium tuberculosis PknB receptor Ser/Thr kinase // EMBO J. 2008. V. 27. P. 3186–3197.
Mir M., Asong J., Li X. et al. The extracytoplasmic domain of the Mycobacterium tuberculosis Ser/Thr kinase PknB binds specific muropeptides and is required for PknB localization // PLoS Pathog. 2011. V. 7. P. e1002182.
Molle V., Kremer L. Division and cell envelope regulation by Ser/Thr phosphorylation: Mycobacterium shows the way // Mol. Microbiol. 2010. V. 75. № 5. P. 1064–1077.
Muñoz-Dorado J., Inouye S., Inouye M. A gene encoding a protein serine/threonine kinase is required for normal development of M. xanthus, a gram-negative bacterium // Cell. 1991. V. 67. P. 995–1006.
Nariya H., Inouye S. An effective sporulation of Myxococcus xanthus requires glycogen consumption via Pkn4-activated 6-phosphofructokinase // Mol. Microbiol. 2003. V. 49. P. 517–528.
Nariya H., Inouye S. Identification of a protein Ser/Thr kinase cascade that regulates essential transcriptional activators in Myxococcus xanthus development // Mol. Microbiol. 2005. V. 58. P. 367–379.
Naumann T., Matter H. Structural classification of protein kinases using 3D molecular interaction field analysis of their ligand binding sites: target family landscapes // J. Med. Chem. 2002. V. 45. P. 2366–2378.
Neer E.J., Schmidt C.J., Nambudripad R., Smith T.F. The ancient regulatory-protein family of WD-repeat proteins // Nature. 1994. V. 371. P. 297–300.
Neu J.M., MacMillan S.V., Nodwell J.R., Wright G.D. StoPK-1, a serine/threonine protein kinase from the glycopeptide antibiotic producer Streptomyces toyocaensis NRRL 15009, affects oxidative stress response // Mol. Microbiol. 2002. V. 44. P. 417–430.
Nolen B., Taylor S., Ghosh G. Regulation of protein kinases; controlling activity through activation segment conformation // Mol. Cell. 2004. V. 15. P. 661–675.
Novakova L., Saskova L., Pallova P. et al. Characterization of a eukaryotic type serine/threonine protein kinase and protein phosphatase of Streptococcus pneumoniae and identification of kinase substrates // FEBS J. 2005. V. 272. P. 1243–1254.
Oriach C.S., Robertson R.C., Stanton C. et al. Food for thought: the role of nutrition in the microbiota-gut-brain axis // Clin. Nutr. Exp. 2016. V. 6. P. 25–38.
Ortiz-Lombardia M., Pompeo F., Boitel B., Alzari P.M. Crystal structure of the catalytic domain of the PknB serine/threonine kinase from Mycobacterium tuberculosis // J. Biol. Chem. 2003. V. 278. P. 13094–13100.
Paracuellos P., Ballandras A., Robert X. et al. The extended conformation of the 2.9-A crystal structure of the three-PASTA domain of a Ser/Thr kinase from the human pathogen Staphylococcus aureus // J. Mol. Biol. 2010. V. 404. P. 847–858.
Pereira S.F., Goss L., Dworkin J. Eukaryote-like serine/threonine kinases and phosphatases in bacteria // Microbiol. Mol. Biol. Rev. 2011. V. 75. № 1. P. 192–212.
Perez J., Castaneda-Garcia A., Jenke-Kodama H. et al. Eukaryotic-like protein kinases in the prokaryotes and the myxobacterial kinome // PNAS USA. 2008. V. 105. P. 15950–15955.
Petrickova K., Petricek M. Eukaryotic-type protein kinases in Streptomyces coelicolor: variations on a common theme // Microbiology. 2003. V. 149. P. 1609–1621.
Ponting C.P., Aravind L., Schultz J. et al. Eukaryotic signalling domain homologues in archaea and bacteria. Ancient ancestry and horizontal gene transfer // J. Mol. Biol. 1999. V. 289. P. 729–745.
Prisic S., Husson R.N. Mycobacterium tuberculosis serine/threonine protein kinases // Microbiol. Spectr. 2014. V. 2. № 5. P. 1–26.
Prisic S., Dankwa S., Schwartz D. et al. Extensive phosphory-lation with overlapping specificity by Mycobacterium tuberculosis serine/threonine protein kinases // PNAS USA. 2010. V. 107. P. 7521–7526.
Qin J., Li Y., Cai Z. et al. A metagenome-wide association study of gut microbiota in type 2 diabetes // Nature. 2012. V. 490. P. 55–60.
Rajagopal L., Vo A., Silvestroni A., Rubens C.E. Regulation of purine biosynthesis by a eukaryotic-type kinase in Streptococcus agalactiae // Mol. Microbiol. 2005. V. 56. P. 1329–1346.
Rajagopal L., Vo A., Silvestroni A., Rubens C.E. Regulation of cytotoxin expression by converging eukaryotic-type and two-component signaling mechanisms in Streptococcus agalactiae // Mol. Microbiol. 2006. V. 62. P. 941–957.
Richardson J.S., Richardson D.C. Natural beta-sheet proteins use negative design to avoid edge-to-edge aggregation // PNAS USA. 2002. V. 99. P. 2754–2759.
Röttig M., Rausch C., Kohlbacher O. Combining structure and sequence information allows automated prediction of substrate specificities within enzyme families // PLoS Comput. Biol. 2010. V. 6. P. e1000636.
Roumestand C., Leiba J., Galophe N. et al. Structural insight into the Mycobacterium tuberculosis Rv0020c protein and its interaction with the PknB kinase // Structure. 2011. V. 19. P. 1525–1534.
Ruggiero A., Squeglia F., Marasco D. et al. X-ray structural studies of the entire extracellular region of the serine/threonine kinase PrkC from Staphylococcus aureus // Biochem. J. 2011. V. 435. P. 33–41.
Ruggiero A., De Simone P., Smaldone G. et al. Bacterial cell division regulation by Ser/Thr kinases: a structural perspective // Curr. Prot. Pept. Sci. 2012. V. 13. № 8. P. 756–766.
Scheeff E.D., Bourne P.E. Structural evolution of the protein kinase-like superfamily // PLoS Comput. Biol. 2005. V. 1. № 5. P. e49.
Sekirov I., Russell S.L., Antunes L.C.M. et al. Gut microbiota in health and disease // Physiol. Rev. 2010. V. 90. № 3. P. 859–904.
Shah I.M., Laaberki M.H., Popham D.L., Dworkin J. A eukaryotic-like Ser/Thr kinase signals bacteria to exit dormancy in response to peptidoglycan fragments // Cell. 2008. V. 135. P. 486–496.
Silvestroni A., Jewell K.A., Lin W.J. et al. Identification of serine/threonine kinase substrates in the human pathogen group B. streptococcus // J. Proteome Res. 2009. V. 8. P. 2563–2574.
Squeglia F., Marchetti R., Ruggiero A. et al. Chemical basis of peptidoglycan discrimination by PrkC, a key kinase involved in bacterial resuscitation from dormancy // J. Am. Chem. Soc. 2011. V. 133. P. 20676–20679.
Smith R.F., King K.Y. Identification of a eukaryotic-like protein kinase gene in Archaebacteria // Prot. Sci. 1995. V. 4. P. 126–129.
Smith T.F., Gaitatzes C., Saxena K., Neer E.J. The WD repeat: a common architecture for diverse functions // Trends Biochem. Sci. 1999. V. 24. P. 181–185.
Sun H., Shi W. Genetic studies of mrp, a locus essential for cellular aggregation and sporulation of Myxococcus xanthus // J. Bacteriol. 2001. V. 183. P. 4786–4795.
Tyagi N., Anamika K., Srinivasan N. A framework for classification of prokaryotic protein kinases // PLoS One. 2010. V. 5. P. e10608.
Ulrich L.E., Koonin E.V., Zhulin I.B. One-component systems dominate signal transduction in prokaryotes // Trends Microbiol. 2005. V. 13. P. 52–56.
Umeyama T., Lee P.C., Horinouchi S. Protein serine/threonine kinases in signal transduction for secondary metabolism and morphogenesis in Streptomyces // App. Microbiol. Biotechnol. 2002. V. 59. P. 419–425.
Villarino A., Duran R., Wehenkel A. et al. Proteomic identification of M. tuberculosis protein kinase substrates: PknB recruits GarA, a FHA domain-containing protein, through activation loop-mediated interactions // J. Mol. Biol. 2005. V. 350. P. 953–963.
Vitagliano L., Ruggiero A., Pedone C., Berisio R. A molecular dynamics study of pilus subunits: insights into pilus biogenesis // J. Mol. Biol. 2007. V. 367. P. 935–941.
Volkamer A., Griewel A., Grombacher T., Rarey M. Analyzing the topology of active sites: on the prediction of pockets and subpockets // J. Chem. Inf. Model. 2010. V. 50. P. 2041–2052.
Wehenkel A., Fernandez P., Bellinzoni M. et al. The structure of PknB in complex with mitoxantrone, an ATP-competitive inhibitor, suggests a mode of protein kinase regulation in mycobacteria // FEBS Lett. 2006. V. 580. P. 3018–3022.
Wehenkel A., Bellinzoni M., Graca M. et al. Mycobacterial Ser/Thr protein kinases and phosphatases: physiological roles and therapeutic potential // Biochim. Biophys. Acta. 2008. V. 1784. № 1. P. 193–202.
Wiley D.J., Nordfeldth R., Rosenzweig J. et al. The Ser/Thr kinase activity of the Yersinia protein kinase A (YpkA) is necessary for full virulence in the mouse, mollifying phagocytes, and disrupting the eukaryotic cytoskeleton // Microb. Pathog. 2006. V. 40. P. 234–243.
Wright G.D., Thompson P.R. Aminoglycoside phosphotransferases: proteins, structure, and mechanism // Front Biosci. 1999. V. 4. P. D9–D21.
Wright D.P., Ulijasz A.T. Regulation of transcription by eukaryotic-like serine-threonine kinases and phosphatases in gram-positive bacterial pathogens // Virulence. 2014. V. 5. № 8. P. 863–885.
Xiao S., Fei N., Pang X. et al. A gut microbiota-targeted dietary intervention for amelioration of chronic inflammation underlying metabolic syndrome // FEMS Microbiol. Ecol. 2014. V. 87. № 2. P. 357–367.
Yang X., Kang C.M., Brody M.S., Price C.W. Opposing pairs of serine protein kinases and phosphatases transmit signals of environmental stress to activate a bacterial transcription factor // Gen. Dev. 1996. V. 10. P. 2265–2275.
Yatsunenko T., Rey F.E., Manary M.J. et al. Human gut microbiome viewed across age and geography // Nature. 2012. V. 486. № 7402. P. 222–227.
Yeats C., Finn R.D., Bateman A. The PASTA domain: a betalactam-binding domain // Tr. Biochem. Sci. 2002. V. 27. P. 438.
Zakharevich N.V., Osolodkin D.I., Artamonova I.I. et al. Signatures of the ATP-binding pocket as a basis for structural classification of the serine/threonine protein kinases of gram-positive bacteria // Proteins. 2012. V. 80. № 5. P. 1363–1376.
Zhang C.C., Gonzalez L., Phalip V. Survey, analysis and genetic organization of genes encoding eukaryotic-like signaling proteins on a cyanobacterial genome // Nucl. Acids Res. 1998. V. 6. P. 3619–3625.
Zhang C., Zhang M., Wang S. et al. Interactions between gut microbiota, host genetics and diet relevant to development of metabolic syndromes in mice // ISME J. 2010. V. 4. № 2. P. 232–241.
Zheng J., He C., Singh V.K. et al. Crystal structure of a novel prokaryotic Ser/Thr kinase and its implication in the Cpx stress response pathway // Mol. Microbiol. 2007. V. 63. P. 1360–1371.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


