Успехи современной биологии, 2020, T. 140, № 2, стр. 140-148
Идентификация коротких пептидов в составе полипептидных комплексов, выделенных из органов животных
И. К. Журкович 1, Н. Г. Ковров 1, Г. А. Рыжак 2, Е. С. Миронова 2, *, В. Х. Хавинсон 2, 3
1 Институт токсикологии ФМБА России
Санкт-Петербург, Россия
2 Санкт-Петербургский институт биорегуляции и геронтологии
Санкт-Петербург, Россия
3 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: katerina.mironova@gerontology.ru
Поступила в редакцию 17.12.2019
После доработки 17.12.2019
Принята к публикации 30.12.2019
Аннотация
Полипептидные комплексы, выделенные из сосудов, хрящей, слизистой оболочки бронхов, головного мозга, поджелудочной железы и синтезированные на основе анализа их аминокислотного состава короткие пептиды KED, AED, EDG, AEDL, EDR, KEDW, соответственно, обладают сходными биологическими эффектами. Методом УЭЖХ-МС в составе полипептидного комплекса сосудов выявлен трипептид KED (0.02%), в составе комплекса хрящей – трипептид AED (0.02%). В составе комплекса слизистой оболочки бронхов были выявлены трипептид EDG (0.028%) и тетрапептид AEDL (0.06%). Полипептидный комплекс головного мозга содержит в своем составе трипептид EDR (0.024%), комплекс поджелудочной железы – тетрапептид KEDW (0.035%). Биологические эффекты полипептидных комплексов обусловлены эффектами входящих в их состав коротких пептидов.
ВВЕДЕНИЕ
Ранее методами масс-спектрометрии и высокоэффективной жидкостной хроматографии (ВЭЖХ) было показано, что в состав полипептидного комплекса эпифиза входит биологически активный пептид AEDG, обладающий теми же биологическими эффектами, что и полипептидный комплекс эпифиза (Хавинсон и др., 2017).
В Санкт-Петербургском институте биорегуляции и геронтологии была разработана технология выделения ряда полипептидных комплексов из различных органов и тканей молодых животных (сосудов, хрящей, слизистой оболочки бронхов, головного мозга, поджелудочной железы). Кроме того, на основе анализа аминокислотного состава экстрагированных полипептидных комплексов были сконструированы и синтезированы короткие пептиды: трипептиды KED, AED, EDG, EDR и тетрапептиды AEDL, KEDW.
Полипептидный комплекс сосудов и короткий пептид KED обладают выраженными вазопротекторными свойствами и являются эффективными средствами в терапии патологии сердечно-сосудистой системы у людей пожилого возраста. KED способствовал коррекции метаболического сосудистого синдрома и заболеваний, сопровождающихся нарушением проницаемости сосудистой стенки и ломкостью капилляров (Китачёв и др., 2013). Одним из возможных механизмов действия пептида KED является эпигенетическая регуляция экспрессии генов, кодирующих белки-маркеры функциональной активности эндотелия (Козлов и др., 2016). KED при пероральном применении способствовал увеличению дистанции безболевой ходьбы на 40% по сравнению с контрольной группой (Китачёв и др., 2013). Кроме того, у этих же пациентов трипептид был эффективен в терапии васкулогенной эректильной дисфункции. После применения KED скорость кровотока в магистральных артериях полового члена статистически значимо возрастала по сравнению с контрольной группой (Китачёв и др., 2014). Кроме того, в экспериментах было установлено, что пептид KED нормализует микроциркуляцию у крыс с индуцированным пародонтитом. Применение этого пептида оказывало нормализующее влияние на состояние стенок капилляров, повышая их резистентность и проницаемость, а такжe на состояние микроциркуляторного русла слизистой оболочки десны и пародонта (Хавинсон и др., 2006). В органотипических культурах клеток, полученных от молодых и старых животных, и в диссоциированных культурах эндотелиоцитов сосудов при их старении пептид KED стимулировал синтез пролиферотропного белка Ki67, экспрессия которого снижается при старении клеток. Методами молекулярного докинга выявлена возможность связывания пептида KED с промоторными участками гена MKI67 (гена белка Ki67) (Хавинсон и др., 2014г). Пептид KED снижает синтез Е-селектина – молекулы адгезии, участвующей в формировании атеросклеротических бляшек, при старении эндотелия сосудов in vitro (Хавинсон и др., 2014а). Получены данные о повышении резистентности капилляров кожи у пациентов с гиповитаминозом под влиянием пептида KED, выражающиеся в уменьшении количества кровоизлияний по сравнению с контрольной группой при проведении манжеточной пробы Румпеля–Лееде–Кончаловского. Аналогичное повышение резистентности капилляров и нормализация микроциркуляции крови наблюдалась у больных сенильной пурпурой – заболеванием, поражающим людей пожилого и старческого возраста вследствие повышения ломкости сосудов (Хавинсон и др., 2006).
Комплекс хрящей и трипептид AED изучены при лечении заболеваний опорно-двигательного аппарата, в частности дегенеративно-дистрофических заболеваний суставов и позвоночника. Использование AED способствовало увеличению количества и усилению функции кальцитонин-продуцирующих клеток щитовидной железы, улучшало трофику клеток костной и хрящевой тканей и, таким образом, способствовало нормализации метаболизма клеток этих тканей (Хавинсон и др., 2007а). Применение трипептида AED статистически значимо улучшало минеральную плотность костной ткани скелета крыс (Поворознюк и др., 2007). Выявлено, что пептид AED обладает также выраженным нефропротекторным эффектом, способствуя снижению экскреции белка и концентрации электролитов в моче (Заморский и др., 2015). Установлено, что пептид AED активирует рост клеток почек, снижая экспрессию маркеров старения р16, р21, р53 и повышая экспрессию белка молодости SIRT-6 (Хавинсон и др., 2014в). Трипептид AED в 2 раза повышал пролиферативную способность и в 1.5 раза снижал уровень апоптоза в клетках почечного эпителия при их старении (Хавинсон и др., 2014б).
Комплекс слизистой оболочки бронхов, трипептид EDG и тетрапептид AEDL регулируют функции бронхолегочной системы. Установлено, что пептид АЕDL способствовал нормализации клеточного состава ткани слизистой оболочки бронхов при анализе течения острого воспаления легких в результате бактериального повреждения, при хроническом фиброзном воспалительном процессе и сублетальном гипероксическом повреждении легких у животных (Khavinson et al., 2009). AEDL может связываться с ДНК и регулировать экспрессию генов и синтез белков, вовлеченных в дифференцировку и поддержание функциональной активности клеток бронхиального эпителия (Khavinson et al., 2014). Пептид EDG представляет собой синтетический трипептид, обладающий стресспротекторным действием. Стресспротекторные свойства пептида EDG реализуются посредством регуляции уровня биогенных аминов в головном мозге и крови, влияния на экспрессию гена c-fos и снижения активности энкефалиназ в крови (Хавинсон и др., 2007б).
Полипептидный комплекс головного мозга и трипептид EDR обладают нейропротекторными свойствами. Пептид EDR снижает апоптоз и повышает синтез серотонина в нейронах коры головного мозга при их старении. Пероральное применение пептида EDR было эффективным у больных с черепно-мозговой травмой, церебрастенией, при снижении памяти и внимания у лиц пожилого возраста (Умнов и др., 2013). Кроме того, пептид EDR обладает выраженным антиоксидантным действием (Хавинсон и др., 2013). В первичной культуре нейронов гиппокампа мышей в условиях амилоидной синаптотоксичности (модель болезни Альцгеймера) пептид EDR повышал количество грибовидных шипиков нейронов до уровня нормы (Красковская и др., 2017). После применения EDR улучшалась когнитивная деятельность макак-резусов (Macaca mulatta) (Кузнецова и др., 2019). Было также отмечено более стойкое повышение физической работоспособности в группе крыс, получавших трипептид EDR, которое не прекращалось и после окончания приема препарата (Беляева и др., 2015). EDR снижал влияние пренатального стресса на структуру поведения и когнитивные функции крыс за счет изменения активации серотонин- и дофаминергической систем и понижения активности каспазы-3 в мозге. При окклюзии сонных артерий введение EDR способствовало возрастанию содержания адренергических медиаторов ДОФА и дофамина в коре больших полушарий, адреналина и норадреналина в стволовых структурах (Менджерицкий и др., 2012; Карантыш и др., 2013).
Комплекс поджелудочной железы и тетрапептид KEDW регулируют функции поджелудочной железы. У больных сахарным диабетом 2-го типа под влиянием KEDW статистически значимо снижался уровень глюкозы натощак и при стандартном глюкозотолерантном тесте. Также отмечено уменьшение концентрации в плазме инсулина и индекса инсулинорезистентности (Коркушко и др., 2011). Применение курса KEDW приводило к снижению уровня глюкозы в крови старых самок макак-резусов. Действие KEDW также сопровождалось нормализацией уровня инсулина и C-пептида в плазме крови, что свидетельствует о его восстанавливающем эффекте нарушенной толерантности к глюкозе у старых животных (Гончарова и др., 2015). Установлено, что KEDW проникает через мембрану в ядро и ядрышко клетки (Fedoreyeva et al., 2011). Вероятно, его геропротекторное действие в отношении поджелудочной железы связано с регуляцией транскрипции генов факторов дифференцировки. Тетрапептид KEDW стимулировал экспрессию факторов дифференцировки ацинарных (Pdx1, Ptfla) и островковых (Pdx1, Pax6, Pax4, Foxa2, NKx2.2) клеток поджелудочной железы в “молодых” и “старых” культурах. Индуцируемая KEDW дифференцировка клеток поджелудочной железы может являться одним из механизмов его антидиабетического и противовоспалительного действия (Хавинсон и др., 2012).
В связи с изложенным возникло предположение, что в описанных выше полипептидных комплексах могут содержаться короткие пептиды, имеющие сходную с ними биологическую активность. При этом ранее анализ пептидного состава полипептидных комплексов, экстрагированных из тканей животных, не проводился. Цель работы – идентификация коротких пептидов в полипептидных комплексах, выделенных из органов животных, методом ультраэффективной жидкостной хроматомасс-спектрометрии (УЭЖХ-МС).
МАТЕРИАЛЫ И МЕТОДЫ
В Институте токсикологии ФМБА России методом УЭЖХ-МС был проведен анализ шести лиофилизированных препаратов полипептидных комплексов на содержание в их составе семи целевых коротких пептидов. Анализ выполнен с применением хроматографа Acquity UPLC I-class с тандемным МС-детектором TDQ Xevo (Waters, США), свидетельство о поверке № 242/8506-2018 от 31 октября 2018 г. Хроматографическая колонка Acquity UPLC BEH C18 1.7um 2.1 × 100 mm. Подвижная фаза состояла из: компонента А — 0.05% раствор трифторуксусной кислоты в воде и компонента В — ацетонитрил.
Градиентное элюирование проводили согласно табл. 1.
Таблица 1.
Режим хроматографического элюирования
| Время, мин | Компонент А, % | Компонент В, % |
|---|---|---|
| 0 | 100 | 0 |
| 3 | 100 | 0 |
| 9 | 35 | 65 |
| 12 | 35 | 65 |
Скорость потока элюента составляла 0.2 мл/мин. Температура термостата колонки – 40°С. Температура термостата отделения для проб – 7°С. Объем ввода пробы – 10 мкл.
Условия МС-детектирования представлены в табл. 2.
Таблица 2.
Условия МС-детектирования (Acquity)
| Тип ионизации | Ионизация электростатическим распылением при атмосферном давлении (ESI) |
|---|---|
| Диапазон массовых чисел | 50–1250 Да |
| Полярность детектируемых ионов | Детектирование положительных ионов |
| Температура газа-осушителя | 350°С |
| Напряжение на капилляре | 3.0 кВ |
| Скорость потока газа-осушителя | 600 л/ч |
Испытуемые и стандартные образцы анализировали в виде 1 и 0.1% водных растворов соответственно.
Критериями идентификации пептидов служили хроматографические параметры удерживания и массовые числа.
Количественные измерения выполнены методом внешнего стандарта. Концентрацию целевого компонента в испытуемых препаратах в мг/г (Х) вычисляли по формуле:
где S и S0 – площади пиков целевого компонента на хроматограммах растворов испытуемого и стандартного образцов соответственно; С0 – концентрация определяемого пептида в растворе стандартного образца в мг/мл.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
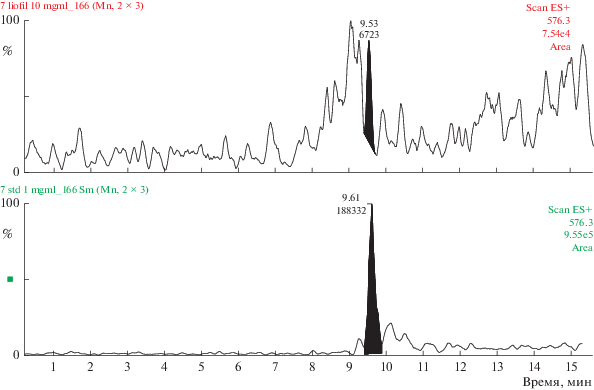
Полученные данные свидетельствуют о том, что 0.02% состава комплекса сосудов представлено трипептидом KED (табл. 3, рис. 1). Содержание AED в комплексе хрящей аналогично – 0.02% (табл. 3, рис. 2). Трипептид EDG составляет 0.028% (табл. 3, рис. 3), а тетрапептид AEDL – 0.06% (табл. 3, рис. 4) в комплексе слизистой оболочки бронхов соответственно. Комплекс головного мозга содержит в своем составе 0.024% трипептида EDR (табл. 3, рис. 5), а комплекс поджелудочной железы – 0.035% тетрапептида KEDW (табл. 3, рис. 6).
Таблица 3.
Определение коротких пептидов в комплексах методом УЭЖХ-МС
| Полипептидный комплекс | Короткий пептид | Содержание пептида в комплексе, мг/г |
|---|---|---|
| Сосудов | KED | 0.2 |
| Хрящей | AED | 0.2 |
| Бронхов | EDG | 0.28 |
| AEDL | 0.6 | |
| Головного мозга | EDR | 0.24 |
| Поджелудочной железы | KEDW | 0.35 |
Рис. 1.
Определение трипептида KED в комплексе сосудов методом УЭЖХ-МС. Внизу – хроматограмма KED (стандартный образец), сверху – хроматограмма KED в составе комплекса сосудов.
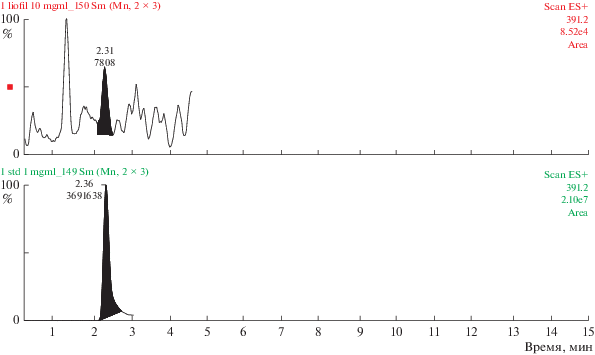
Рис. 2.
Определение трипептида AED в комплексе хрящей методом УЭЖХ-МС. Внизу – хроматограмма AED (стандартный образец), сверху – хроматограмма AED в составе комплекса хрящей.

Рис. 3.
Определение трипептида EDG в комплексе слизистой оболочки бронхов методом УЭЖХ-МС. Внизу – хроматограмма EDG (стандартный образец), сверху – хроматограмма EDG в составе комплекса слизистой оболочки бронхов.
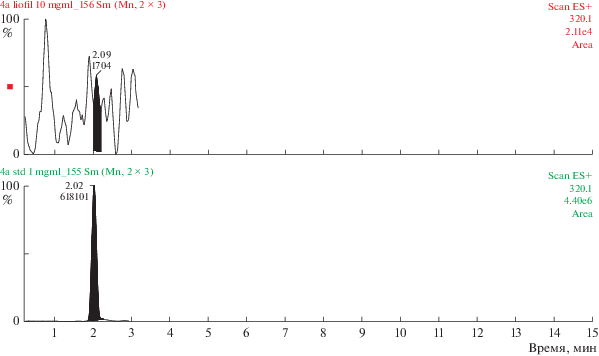
Рис. 4.
Определение тетрапептида AEDL в комплексе слизистой оболочки бронхов методом УЭЖХ-МС. Внизу – хроматограмма AEDL (стандартный образец), сверху – хроматограмма AEDL в составе комплекса слизистой оболочки бронхов.
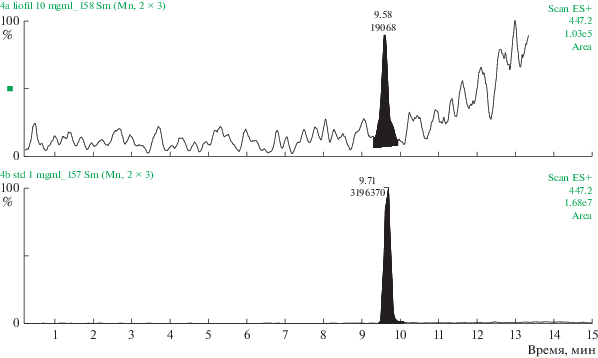
Рис. 5.
Определение трипептида EDR в комплексе головного мозга методом УЭЖХ-МС. Внизу – хроматограмма EDR (стандартный образец), сверху – хроматограмма EDR в составе комплекса головного мозга.
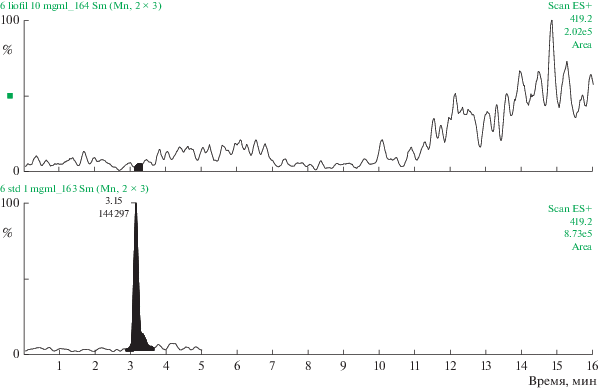
Рис. 6.
Определение тетрапептида KEDW в комплексе поджелудочной железы методом УЭЖХ-МС. Внизу – хроматограмма KEDW (стандартный образец), сверху – хроматограмма KEDW в составе комплекса поджелудочной железы.
Таким образом, короткие пептиды являются минорными компонентами исследованных препаратов полипептидных комплексов. Относительное содержание коротких пептидов составляет не более 0.6 мг/г.
ЗАКЛЮЧЕНИЕ
В составе полипептидных комплексов, выделенных из сосудов, хрящей, слизистой оболочки бронхов, головного мозга, поджелудочной железы, с помощью высокотехнологичных физико-химических методов анализа (УЭЖХ-МС) были выявлены пептиды KED, AED, EDG, AEDL, EDR, KEDW, обладающие биологическими эффектами, сходными с полипептидными комплексами. Результаты проведенного исследования дают основание полагать, что изученные короткие пептиды, идентифицированные в полипептидных комплексах, являются их активными компонентами.
Список литературы
Беляева Г.С., Давыдова О.К., Ерофеев А.И. и др. Исследование актопротекторных свойств трипептида пинеалона // Биотехносфера. 2015. Т. 2. № 38. С. 25–31.
Гончарова Н.Д., Иванова Л.Г., Оганян Т.Э. и др. Коррекция тетрапептидом Панкрагеном нарушенной толерантности к глюкозе у старых самок макак резусов // Успехи геронтол. 2015. Т. 28. № 3. С. 579–585.
Заморский И.И., Щудрова Т.С., Линькова Н.С. и др. Пептиды восстанавливают функциональное состояние почек при цисплатиновой острой почечной недостаточности // Бюл. эксперим. биол. мед. 2015. Т. 159. № 6. С. 708–712.
Карантыш Г.В., Абрамчук В.А., Рыжак Г.А., Менджерицкий А.М. Пептидная регуляция поведения и медиаторного баланса у старых крыс в условиях окклюзии сонных артерий // Фундам. исслед. 2013. Т. 6. С. 1406–1410.
Китачёв К.В., Сазонов А.Б., Козлов К.Л. и др. Роль вазоактивного пептида в лечении хронической артериальной недостаточности нижних конечностей // Успехи геронтол. 2013. Т. 26. № 2. С. 292–296.
Китачёв К.В., Сазонов А.Б., Козлов К.Л. и др. Эффективность пептидного биорегулятора сосудов в комплексной терапии васкулогенной эректильной дисфункции у лиц старших возрастных групп // Успехи геронтол. 2014. Т. 27. № 1. С. 156–159.
Козлов К.Л., Болотов И.И., Линькова Н.С. и др. Молекулярные аспекты действия вазопротекторного пептида KED при атеросклерозе и рестенозе // Успехи геронтол. 2016. Т. 29. № 4. С. 646–650.
Коркушко О.В., Хавинсон В.Х., Шатило В.Б. и др. Перспективы применения Панкрагена для коррекции метаболических нарушений у людей пожилого возраста // Бюл. эксперим. биол. мед. 2011. Т. 151. № 4. С. 436–438.
Красковская Н.А., Куканова Е.О., Линькова Н.С. и др. Трипептиды восстанавливают количество шипиков нейронов в модели болезни Альцгеймера in vitro // Клет. технол. в биол. и мед. 2017. Т. 2. С. 101–104.
Кузнецова Т.Г., Голубева И.Ю., Трофимова С.В. и др. Влияние трипептида Пинеалона на реабилитацию когнитивных функций в процессе старения на примере макак-резусов (Macaca mulatta) // Вестн. Моск. ун-та. Серия XXIII. Антропол. 2019. Т. 1. С. 62–73.
Менджерицкий А.М., Карантыш Г.В., Абрамчук В.А., Рыжак Г.А. Влияние короткого пептида на нейродегенеративные процессы у крыс, перенесших пренатальную гипоксию // Нейрохимия. 2012. Т. 29. № 3. С. 229–234.
Поворознюк В.В., Хавинсон В.Х., Макогончук А.В. и др. Изучение влияния пептидных регуляторов на структурно-функциональное состояние костной ткани крыс при старении // Успехи геронтол. 2007. Т. 20. № 2. С. 134–137.
Умнов Р.С., Линькова Н.С., Хавинсон В.Х. Нейропротекторные эффекты пептидных биорегуляторов у людей разного возраста: обзор литературы // Успехи геронтол. 2013. Т. 26. № 4. С. 667–671.
Хавинсон В.Х., Григорьев Е.И., Малинин В.В., Рыжак Г.А. Патент РФ № 2295970, 2006.
Хавинсон В.Х., Григорьев Е.И., Малинин В.В., Рыжак Г.А. Патент РФ № 2299741. 2007а.
Хавинсон В.Х., Григорьев Е.И., Малинин В.В., Рыжак Г.А. Патент РФ № 2304444. 2007б.
Хавинсон В.Х., Дурнова А.О., Полякова В.О. и др. Влияние Панкрагена на дифференцировку клеток поджелудочной железы при их старении // Бюл. эксперим. биол. мед. 2012. Т. 154. № 10. P. 498–501.
Хавинсон В.Х., Копылов А.Т., Васьковский Б.В. и др. Идентификация пептида AEDG в полипептидном комплексе эпифиза // Бюл. эксперим. биол. мед. 2017. Т. 164. № 7. С. 52–55.
Хавинсон В.Х., Кузник Б.И., Рыжак Г.А. Пептидные биорегуляторы – новый класс геропротекторов. Сообщение 2. Результаты клинических исследований // Успехи геронтол. 2013. Т. 26. № 1. С. 20–37.
Хавинсон В.Х., Линькова Н.С., Елашкина Е.В. и др. Молекулярные аспекты антиатеросклеротического действия коротких пептидов // Клет. технол. в биол. и мед. 2014а. Т. 3. С. 185–189.
Хавинсон В.Х., Линькова Н.С., Полякова В.О. и др. Пептиды регулируют экспрессию сигнальных молекул в клеточных культурах почек при старении in vitro // Бюл. эксперим. биол. мед. 2014б. Т. 157. № 2. С. 227–230.
Хавинсон В.Х., Тарновская С.И., Линькова Н.С. и др. Трипептиды замедляют процесс старения в культурах клеток почек // Успехи геронтол. 2014в. Т. 27. № 4. С. 651–656.
Хавинсон В.Х., Тарновская С.И., Линькова Н.С. и др. Эпигенетические аспекты пептидной регуляции пролиферации эндотелия сосудов при его старении // Успехи геронтол. 2014г. Т. 27. № 1. С. 108–114.
Fedoreyeva L.I., Kireev I.I., Khavinson V.Kh., Vanyushin B.F. Penetration of short fluorescence-labeled peptides into the nucleus in HeLa cells and in vitro specific interaction of the peptides with deoxyribooligonucleotides and DNA // Biochemistry. 2011. V. 76. № 11. P. 1210–1219.
Khavinson V.Kh., Ryzhak G.A., Grigoriev E.I. Patent US № 7625870. 2009.
Khavinson V.Kh., Tendler S.M., Vanyushin B.F. et al. Peptide regulation of gene expression and protein synthesis in bronchial epithelium // Lung. 2014. V. 192. P. 781–791.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


