Успехи современной биологии, 2020, T. 140, № 3, стр. 278-288
Кишечный фактор прогрессирования ВИЧ-инфекции
Г. Р. Хасанова 1, 2, О. И. Биккинина 3, В. А. Анохин 1, И. А. Аниховская 4, М. Ю. Яковлев 4, 5, *
1 Казанский государственный медицинский университет
Казань, Россия
2 Республиканский центр по профилактике и борьбе со СПИД и инфекционными заболеваниями
Казань, Россия
3 Страховая организация Universal Mugenat при подразделении социального обеспечения № 10
Барселона, Испания
4 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
5 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
Москва, Россия
* E-mail: yakovlev-lps@yandex.ru
Поступила в редакцию 03.03.2020
После доработки 09.03.2020
Принята к публикации 10.03.2020
Аннотация
Прогрессирование иммунодефицита у ВИЧ-инфицированных больных не может быть обеспечено лишь прямым повреждающим CD4+-лимфоциты действием вируса. Результаты многочисленных исследований свидетельствуют о важной роли избыточной активации иммунной системы в патогенезе заболевания. В качестве одного из очень важных факторов развития иммуносупрессии рассматривается (как это, на первый взгляд, ни выглядит парадоксальным) гиперактивация иммунной системы и различной степени выраженности системное воспаление, индуктором которого является кишечный эндотоксин. Прямое участие липополисахаридов грамотрицательных бактерий в этом процессе подтверждается высоким уровнем содержания их и sCD14 в кровотоке, а также изменениями активности антиэндотоксинового иммунитета у большей части больных с ВИЧ-инфекцией, находящихся на разных стадиях прогрессирования заболевания. Избыточное поступление кишечного липополисахарида в кровь может быть следствием как репликации вируса в эпителии, CD4+-клетках и макрофагах кишечника с повреждением кишечного барьера, так и дисбиоза, который имеет место уже в начале заболевания. Дальнейшие исследования в этом направлении могут существенно повысить эффективность антиретровирусной терапии ВИЧ-инфекции.
ВВЕДЕНИЕ
ВИЧ-инфекция характеризуется хроническим течением и при отсутствии антиретровирусной терапии (АРВТ) – неблагоприятным прогнозом. Однако уже первыми исследованиями были описаны случаи необычно медленного прогрессирования ВИЧ-инфекции, когда у пациентов в отсутствие лечения сохранялся достаточно высокий уровень СD4+-клеток, защищавший их от развития оппортунистических инфекций. Несколько позже применительно к таким пациентам (с вирусной нагрузкой ниже 50 копий/мл в течение многих лет) стал использоваться термин “элитные контроллеры”. Математическая модель механизма прогрессирования заболевания (Ho et al., 1995), основанная на массовой гибели клеток-мишеней (преимущественно CD4+) является крайне упрощенной, поскольку не в состоянии объяснить ряд крайне важных фактов: не более 0.1–1% СD4+-клеток крови содержат ВИЧ, все лимфоциты на момент проникновения в них вируса уже активированы (то есть фактически обречены на скорую гибель) и большая часть погибших CD4+ не содержат ВИЧ (Mattapallil et al., 2005; Picker, Watkins, 2005); инфекция иммунодефицита обезьян – натуральных “натуральных хозяев” (дымчатых мангобеев и зеленых мартышек) – не прогрессирует, маркеры системного воспаления у них не выявляются, вопреки тому, что уровень виремии значительно выше такового у людей с ВИЧ-инфекцией (Sumpter et al., 2007); CD8+-лимфоциты, не являющиеся мишенью для ВИЧ, также демонстрируют большую скорость пролиферации и активации (Hellerstein et al., 2003). Эти факты в определенной степени ставят под сомнение абсолютизацию ведущей роли прямого действия ВИЧ на CD4+ в генезе СПИД. Вместе с тем неоспорим тот факт, что высокий уровень виремии является основным промоутером прогрессирования инфекции. На данном постулате базируется обоснование эффективности АРВТ – наиболее успешного метода контроля ВИЧ-инфекции. И все же минимальный уровень репликации вируса не всегда сочетается c отсутствием клинического прогрессирования заболевания. В частности, наблюдение продолжительностью более 16 лет за когортой “элитных контроллеров” Caн-Францискo показало снижение CD4+-клеток до уровня ниже 350 клеток в 1 мкл у 15% пациентов и развитие клинической симптоматики СПИД у 7% больных (Hunt et al., 2008). В другом исследовании только 46% из 69 “элитных контроллеров” удалось сохранить количество CD4+-клеток на уровне более 500 клеток в 1 мкл сыворотки крови в течение 8 лет наблюдения (Grabar et al., 2009). Одновременно с этим продемонстрирована возможность непрогрессирования заболевания даже при высоком уровне виремии (Okulicz et al., 2009). О чем это может говорить? Однозначно, лишь о наличии иного механизма его развития, напрямую не связанного с повреждающим действием вируса на лимфоциты CD4. Вероятно, этот механизм связан с участием кишечного фактора в патогенезе СПИД и прежде всего кишечного липополисахарида (ЛПС) в индукции системного воспаления, принципиальная возможность которого была постулирована треть века назад (Яковлев, 1988, 2003, 2013). Рассмотрению этого аспекта патогенеза ВИЧ-инфекции и посвящена настоящая публикация.
ГИПЕРАКТИВАЦИЯ ИММУННОЙ СИСТЕМЫ И ПРОГРЕССИРОВАНИЕ ВИЧ-ИНФЕКЦИИ
В 1988 г. (Ascher, 1988) и пятью годами позже (Grossman et al., 1993) было высказано предположение o решающей роли гиперактивации иммунной системы в развитии иммуносупрессии при ВИЧ-инфекции. В соответствии с этим предположением гибель СD4+-лимфоцитов квалифицируется не столько следствием репликации в них вируса, сколько предшествующей их активации на фоне ВИЧ-инфекции, а развитие СПИДа является финалом цепи событий, обусловливающих плохо контролируемую гиперактивацию иммунитета. Спустя некоторое время было обнаружено (Giorgi et al., 2002), что степень активации иммунной системы (повышение экспрессии CD38-белка на Т-лимфоцитах) является основным маркером прогрессирования заболевания. И результаты наших исследований подтвердили существенное увеличение содержания в сыворотке крови маркеров воспаления: IL-1β, ферритина, С-реактивного белка и фактора некроза опухоли-α (TNF-α), что характерно для всех ВИЧ-инфицированных пациентов независимо от стадии заболевания (Хасанова и др., 2013б; Anikhovskaya et al., 2015). Это свидетельствует об универсальной роли системного воспаления в индукции СПИД и согласуется с исследованием, результаты которого показали (Tesselaar et al., 2003), что при экспериментальном хроническом воспалении у мышей формируются оппортунистические процессы (на фоне иммунной дисфункции) и в отсутствие вирусной инфекции. Важная, если не главная, роль гиперактивации иммунной системы в прогрессировании ВИЧ-инфекции признается большинством исследователей. Она основана на многих фактах: прямое активирующее действие ВИЧ на Т-лимфоциты (Herbeuval et al., 2005); способность ВИЧ активировать врожденный иммунитет через Toll-like рецепторы (TLR) (Beignon et al., 2005) и продукцию провоспалительных цитокинов (TNF-α, IL-1 и др.) с последующей индукцией апоптоза активированных Т-клеток (Badley et al., 2000); уменьшение числа или дисфункция T-регуляторных клеток, которые в норме подавляют избыточную активацию иммунитета (West et all., 2006); транслокация микробов (и их продуктов) в кровь, обусловливающая активацию синтеза провоспалительных цитокинов посредством TLR2, 4, 5, 6 (Weiss et al., 2004). Последнее может быть следствием репликации вируса в энтероцитах и их гибели с нарушением целостности кишечного барьера. Повышенная проницаемость стенки кишки обусловливает избыточное поступление в кровь лигандов врожденного иммунитета и может рассматриваться в качестве непосредственной причины гиперактивации иммунитета. Именно этот сегмент иммунной системы отвечает за синтез провоспалительных цитокинов и в конечном итоге определяет уровень активности адаптивного звена, который располагает несопоставимо большим числом рецепторов (1014–1016), способных метить к уничтожению как чужеродные, так собственные антигены, в том числе и синтетической природы (Medzhitov et al., 1997). Ключевыми рецепторами врожденного сегмента иммунной системы являются TLR. Эти рецепторы находятся преимущественно на наружной части клеточной мембраны, за исключением TLR3, 7, 8, 9, которые располагаются внутри нее. Лигандами этого уникального семейства рецепторов являются наиболее консервативные (общие) структуры молекул бактерий, вирусов, простейших и грибов. Их вполне достаточно для успешного противостояния инфекционному агенту в первые часы и дни его внедрения.
Центральное место среди рецепторов врожденного иммунитета, расположенных снаружи клеточной мембраны, занимает ЛПС-рецептор – TLR4. Это обусловлено отличиями TLR4 от других рецепторов семейства TLR по механизмам взаимодействия с лигандом и передачи сигнала к ядру (рис. 1) (Nova et al., 2019). Для взаимодействия эндотоксина с TLR4 необходимы: ЛПС-связывающий белок (синтезируемый печенью), адаптерный белок MD2, свободный CD14 и фиксированный на мембране CD14. Только при наличии всех этих факторов ЛПС способен активировать синтез провоспалительных цитокинов, без которых невозможно не только воспаление как аварийный механизм иммунной защиты, но и функционирование иммунной системы в умеренном физиологическом режиме работы (Яковлев, 2013).
ЭНДОТОКСИН КАК ИНДУКТОР СИСТЕМНОГО ВОСПАЛЕНИЯ ПРИ ВИЧ-ИНФЕКЦИИ
Эндотоксин, а точнее, обязательный для всех ЛПС гидрофобный фрагмент его молекулы как субстанция с огромным спектром биологических эффектов является ключевым игроком в развитии системного воспаления. При этом оно может проявляться не только в виде катастрофы, угрожающего для жизни состояния с явлениями полиорганной недостаточности, но и в виде хронического вялотекущего процесса, сопровождающегося нарушениями гомеостаза (Яковлев, 2013; Аниховская и др., 2019). Отечественными учеными получены факты, свидетельствующие об участии кишечного ЛПС в индукции или, по меньшей мере, патогенезе аутоиммунных заболеваний (системной красной волчанки, акантолитической пузырчатки) и аллергозов, сахарного диабета 1-го и 2-го типов, эндогенных иридоциклитов и эндофтальмитов, хронической воспалительной патологии органов малого таза и женского бесплодия, атеросклероза и острого инфаркта миокарда, нервной анорексии, а также в старении, в ранних реакциях адаптации новорожденных и др. (Уразаев и др., 1992; Яковлев, 2005, 2013; Энукидзе и др., 2007; Аниховская и др., 2016; Гордиенко и др., 2016; Enukidze et al., 2006; Vyshegurov et al., 2006; Okorokov et al., 2011, 2012; Anikhovskaya et al., 2014, 2015; Gordienko et al., 2019; Pokusaeva et al., 2019). Что касается ВИЧ-инфекции, то уже более 15 лет назад была обнаружена in vitro способность ЛПС, связываясь с TLR4 эндотелиальных клеток человека, индуцировать транскрипцию ВИЧ (Equils et al., 2001). Следовательно, репликация вируса, помимо всего прочего, поддерживается активацией TLR4. Выявленная корреляция уровня плазменного ЛПС с толерантностью моноцитов к ЛПС ex vivo (Brenchley et al., 2006), а также с маркерами активации Т-клеток позволила сделать предположение о том, что и активация Т-клеток у больных ВИЧ-инфекцией является результатом ЛПС-опосредованной стимуляции моноцитов. Доказана также стимуляция репликации вируса в макрофагах и спленоцитах под действием ЛПС. Причем, если активация ВИЧ-1 в спленоцитах осуществляется опосредованно через выброс TNF-α и IL-1 активированными моноцитами, стимуляция репликации ВИЧ-1 в макрофагах, которые являются важнейшим резервуаром ВИЧ, обусловлена, видимо, активацией TLR4 через МАРК–NF-κB-путь. Соответственно, супрессия молекул, вовлеченных в этот процесс, несет в себе потенциал контроля над течением ВИЧ-инфекции (Brenchley et al., 2006).
Опубликованы результаты исследований в Северной Америке и Европе, в которых показана связь высоких уровней маркеров микробной транслокации с чрезмерной активацией иммунной системы при ВИЧ-инфекции (Jiang et al., 2009). Продемонстрировано (Marchetti et al., 2011), что высокий уровень ЛПС на начальном этапе течения инфекции ассоциирован с ускоренными темпами прогрессирования заболевания вне зависимости от количества CD4+-клеток и концентрации вируса в крови. У больных с ВИЧ-инфекцией выявлены (Brenchley et al., 2006) высокие уровни ЛПС в плазме крови в сочетании с увеличением уровней sCD14 и ЛПС-связывающего белка, а также снижение уровня антител (АТ) к ЛПС. В противоположность этому, констатированы (Nowroozalizadeh et al., 2010) высокие уровни ЛПС лишь у пациентов с симптомами оппортунистических инфекций.
Продемонстрировано (Trøseid et al., 2010) значимое повышение ЛПС и HMGB1 (маркер тканевого некроза и иммунной активации) на фоне ВИЧ-инфекции, причем у выходцев из Африки и Азии уровни ЛПС были выше, нежели у европейцев. На основании результатов когортного исследования, проведенного в Уганде, сделан вывод (Redd et al., 2009, 2010) об отсутствии связи прогрессирования ВИЧ-инфекции с микробной транслокацией. В противоположность этому, исследование (Lester et al., 2009), проведенное в Кении в популяции женщин, занимающихся коммерческим сексом, установило четкую ассоциацию между темпами прогрессирования ВИЧ-инфекции и концентрацией ЛПС в плазме крови. Помимо этого, авторами отмечено уменьшение толерантности к эндотоксину у людей с ВИЧ-инфекцией, что позволило им предположить, что ВИЧ-инфекция вызывает дисрегуляцию TLR с извращенным ответом на субклиническую эндотоксинемию (Lester et al., 2009). Похожие результаты были обнаружены и нами при определении интегральных показателей системной эндотоксинемии (СЭЕ). Статистически значимо высокие концентрации ЛПС были отмечены во всех исследуемых группах, включая группу лиц с латентной стадией заболевания, без клинических и лабораторных признаков иммунодефицита, что подтверждает постоянство феномена микробной транслокации и наличие системного воспаления (различной степени интенсивности) на всех этапах развития заболевания. Отличались от нормативных и иные показатели СЭЕ, которые интегрально оценивают активность антиэндотоксинового иммунитета. У большей части пациентов концентрация АТ к гидрофобной и гидрофильной частям молекулы ЛПС была ниже установленной физиологической нормы (у 63% и у 81.2% соответственно). Лишь у 2.9% и у 1.4% обследованных пациентов уровни соответствующих АТ находились в диапазонах физиологической нормы (Хасанова и др., 2014).
Концентрация АТ к гидрофобной части молекулы ЛПС была выше физиологической нормы у 34% пациентов, к гидрофильной – у 17.4% обследованных лиц, что можно рассматривать в качестве возможного маркера начинающегося или вялотекущего синдрома системного воспалительного ответа, мощным индуктором которого является эндотоксин (Яковлев, 2005; Sandler et al., 2011).
Таким образом, ВИЧ-инфекция на любой стадии заболевания характеризуется существенным увеличением уровня ЛПС в плазме крови, равно как и концентрации многих маркеров воспалительного ответа. Само по себе повышение уровня ЛПС в сыворотке крови не обязательно должно быть связано с активностью воспалительных реакций в организме, так как реализация и сила патогенного действия ЛПС зависят от многих факторов, в частности, от состояния ЛПС-связывающих систем крови (Яковлев, 2013; Sandler et al., 2011). Кроме того, у людей без существенных нарушений состояния здоровья ЛПС довольно быстро опсонизируется и выводится, что создает проблемы при оценке его уровня в крови, особенно, если это небольшие количества (Redd et al., 2009). Весьма информативным в этом плане является оценка уровня растворимого рецептора CD14 (sCD14), который можно рассматривать как маркер реализовавшегося взаимодействия ЛПС и TLR4, а концентрация его в крови отражает своего рода результативную эндотоксинемию (Sandler et al., 2011). Подтверждением этого является выявленное нами повышение показателей sCD14 у большей части пациентов с ВИЧ-инфекцией, опять же, находящихся на различных стадиях инфекционного процесса (рис. 2). Установлена положительная корреляция концентрации в крови sCD14 со стадией ВИЧ-инфекции и отрицательная – с содержанием CD4+-клеток, что позволяет говорить о связи высоких уровней sCD14 с прогрессированием ВИЧ-инфекции. В связи с тем, что достоверная оценка прогноза возможна лишь в когортных исследованиях, таковое было нами осуществлено. Была проведена оценка темпов прогрессирования заболевания в выборке ВИЧ-инфицированных пациентов, не получающих АРВТ. Для когорты больных с концентрацией sCD14, превышающей максимальные показатели здоровых (2.94 пг/мл), был продемонстрирован статистически значимо больший риск быстрого прогресса иммуносупрессии в течение двух лет наблюдения, нежели для когорты больных с меньшим уровнем sCD14 (показатель относительного риска RR = 7.86; 95% ДИ: 1.14–53.94). Интересно то, что на результат не влияли ни стадия заболевания, ни исходный уровень CD4+-лимфоцитов. Наблюдение за пациентами, начавшими АРВТ, показало, что высокие уровни sCD14 на момент начала терапии ассоциировались с большим риском иммунологической неэффективности лечения (то есть отсутствием подъема CD4+-клеток) на протяжении 2 лет наблюдения (Хасанова и др., 2012). Полученные результаты согласуются с данными (Sandler et al., 2011), демонстрирующими, что высокий уровень sCD14 ассоциирован с общим повышением уровня смертности в ВИЧ-популяции. Эти факты, а также выявленные связи уровня ЛПС в плазме крови и sCD14 с большинством исследованных маркеров воспаления (Хасанова и др., 2012, 2014), позволяют констатировать наличие существенной роли ЛПС в индукции системного воспаления у ВИЧ-инфицированных пациентов и, соответственно, в прогрессировании заболевания.
Рис. 2.
Концентрация sCD14 (Ме, мкг/мл) на разных стадиях ВИЧ-инфекции (по: Хасанова и др., 2012, 2014). Уровень статистической значимости различий показателей 3 и 4 стадии p = 0.0006; 4 стадии и контрольной группы – p = 0.00002; 3 стадии и контрольной группы – p = 0.0001.

Роль микробной транслокации и последующей индукции системного воспалительного ответа продемонстрирована и при изучении группы пациентов с анемией хронического заболевания (АХЗ). АХЗ – патологический синдром, традиционно ассоциируемый с хроническим воспалением, является одной из немногих описанных на сегодня нозологий, которую можно рассматривать в качестве клинического маркера иммунодефицита. Анемия является частой проблемой в ВИЧ-популяции, при этом у большей части пациентов по клинико-лабораторным данным можно говорить о наличии у них именно АХЗ (Хасанова и др., 2011). По нашим данным, концентрации ЛПС и sCD14, равно как и ряда провоспалительных цитокинов, у ВИЧ-инфицированных пациентов с АХЗ существенно превышали показатели пациентов с железодефицитной анемией, что может косвенно свидетельствовать о большей выраженности микробной транслокации у пациентов с АХЗ (Хасанова и др., 2011). Действие ЛПС на процессы гемопоэза общеизвестно и опосредовано главным образом через острофазный белок гепсидин, который, взаимодействуя с трансмембранным белком ферропортином, снижает дуоденальную абсорбцию железа и высвобождение железа из моноцитов и макрофагов, результатом чего является дефицит железа в крови и в кроветворных органах при избытке его в клетках системы фиксированных макрофагов (Ganz, 2005). Степень выраженности вирусной нагрузки прямо коррелирует с тяжестью течения АХЗ (Хасанова и др., 2011). В связи с этим было логично предположить, что АРВТ будет эффективна в лечении данного вида анемии у пациентов с ВИЧ-инфекцией, что и было подтверждено: на фоне АРВТ было отмечено улучшение показателей гемоглобина или купирование анемии у большей части больных с изолированной АХЗ и даже при сочетанных с дефицитом железа формах (Хасанова и др., 2012). О чем может свидетельствовать эта взаимосвязь? О способности АРВТ блокировать (или замедлять) репликацию вируса, в том числе, и в клетках кишечника (а этого и следовало ожидать), значит, и предотвращать (или уменьшать) повреждение кишечного барьера. Последнее находит свое подтверждение в работах наших зарубежных коллег: АРВТ обусловливает снижение (но не купирование) интенсивности транслокации микробных продуктов через кишечную стенку (Brenchley et al., 2006; Jiang et al., 2009). С одной стороны, этот факт подтверждает наше предположение, а с другой, – свидетельствует в пользу того, что и в условиях сохранности кишечного барьера ЛПС проникает в системный кровоток, являясь облигатным фактором гомеостаза (Яковлев, 2005, 2013; Аниховская и др., 2019; Okorokov et al., 2012; Pokusaeva et al., 2019). Исходя из этого, было логично предположить, что средства снижения концентрации ЛПС (энтеросорбенты, эубиотики, желчегонные и др.) в общем кровотоке (Аниховская и др., 2014), ранее показавшие свою эффективность в терапии иных заболеваний (Энукидзе и др., 2007; Яковлев, 2013; Enukidze et al., 2006; Vyshegurov et al., 2006; Okorokov et al., 2012), могут быть полезны и при купировании проявлений анемии у ВИЧ-инфицированных больных. И оказалось, что это действительно так: улучшились показатели гемоглобина, СЭЕ, маркеров системного воспаления, самочувствие больных и уменьшились проявления кишечной дисфункции, причем более выражена динамика лабораторных показателей была у больных с АХЗ, не получающих АРВТ (Anikhovskaya et al., 2015). Последнее можно, по-видимому, объяснить тем, что в группе с АРВТ положительный эффект терапии с включением антиэндотоксиновой составляющей может маскироваться положительным влиянием самой АРВТ на течение АХЗ. Таким образом, представляется возможным заключить – кишечный фактор является крайне важным (если не ключевым) элементом индукции системного воспаления и прогрессирования ВИЧ-инфекции.
НАРУШЕНИЕ БАРЬЕРНОЙ ФУНКЦИИ СТЕНКИ КИШКИ И МИКРОБНАЯ ТРАНСЛОКАЦИЯ ПРИ ВИЧ-ИНФЕКЦИИ
Кишечник, вне всякого сомнения, – наиболее емкий резервуар грамотрицательных микроорганизмов в теле человека. Одновременно с этим, он является, по-видимому, основным полем боя иммунной системы с вирусом на начальных стадиях заболевания. Кишечные СD4+-лимфоциты принимают на себя основной удар в первые месяцы заболевания ввиду того, что именно на слизистых оболочках локализована большая часть Т-клеток; помимо этого, они в высокой степени экспрессируют CCR5-рецепторы, то есть уже являются активированными (Mattapallil et al., 2005). Массовая гибель CD4+-лимфоцитов кишечника в острую стадию ВИЧ-инфекции становится невосполнимой потерей для иммунной системы организма. Разные масштабы этой потери определяют различные темпы дальнейшего прогрессирования болезни (Picker, Watkins, 2005). Даже комбинированная АРВТ кардинально ситуации не меняет. Если пул периферических лимфоцитов у 70–80% больных, получающих АРВТ, восстанавливается до уровня, близкого физиологическому, то у большей части (70%!) этих же пациентов восстановления числа CD4+-лимфоцитов кишечника не наблюдается вовсе, даже при условии непрерывно проводимой терапии в течение длительного времени. Среднее число CD4+-клеток кишечника через несколько лет терапии с подавлением вирусной репликации в крови составляет лишь 50–60% от уровня здоровых людей (Mehandru et al., 2006). У пациентов, получающих АРВТ, в стенке кишечника выявляется значительное число активированных CD4+- и CD8+-лимфоцитов. На основании этого было высказано предположение о возможном продолжении репликации ВИЧ в Т-лимфоцитах кишечника даже на фоне эффективной АРВТ (Furtado et al., 1999). В качестве механизма, мешающего восстановлению кишечных СD4+-клеток на фоне лечения, можно рассматривать хроническое воспаление стенки кишки, сочетающееся с формированием фиброза в пейеровых бляшках, зафиксированного уже на начальных стадиях заболевания. Изменения архитектоники лимфоидных образований кишечника напрямую связаны со способностью кишечных СD4+-лимфоцитов к регенерации и, вследствие этого, с прогнозом заболевания (Schacker et al., 2005).
Нами было выявлено снижение числа как всего пула лимфоцитов, так и CD4+-клеток при морфологическом исследовании стенки кишки пациента, погибшего на 4В стадии ВИЧ-инфекции от криптококкового менингита (рис. 3).
Рис. 3.
Гистологические срезы слизистой двенадцатиперстной кишки погибшего ВИЧ-инфицированного пациента (а–г) и биоптат слизистой двенадцатиперстной кишки условно здорового пациента (контроль) (д–з). У пациента с ВИЧ-инфекцией прослеживается обеднение слизистой кишечника в отношении как всего пула лимфоцитов, так и CD4+-клеток в сравнении с материалом, полученным от пациента без ВИЧ-инфекции. а, д – CD3-рецепторы; б, е – CD4-рецепторы; в, ж – ядра клеток; г, з – суммарное прокрашивание. Образцы обработаны моноклональными антителами. Увеличение: 400х. Шкала: 50 мкм (по: Boichuk et al., 2015).
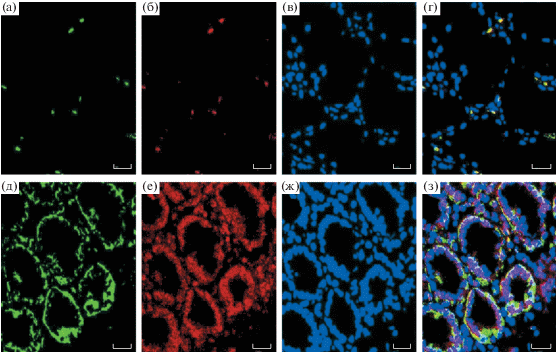
В дополнение к этому выявлен факт наличия большого числа плазмоцитоидных дендритных клеток (CD303+) в ткани кишки. Учитывая параллельно наблюдавшийся нами факт уменьшения содержания в крови пациентов с ВИЧ-инфекцией дендритных клеток (Boichuk et al., 2015), можно говорить об их перераспределении (селективном накоплении) в желудочно-кишечном тракте. Примечательно то, что количество активированных дендритных клеток (CD123+) в стенке кишки сопоставимо с контролем; соответственно, увеличение количества дендритных клеток в кишечнике не сопровождается увеличением их активности. Выявленный факт представляет определенный интерес, так как результаты исследований на животных моделях демонстрируют, что CD303+-клетки, предварительно инкубированные с ЛПС, обладают способностью конвертировать CD4+CD25+T-лимфоциты в Foxp3+-регуляторные T-клетки, подавляя, тем самым, выброс провоспалительных цитокинов макрофагами (Zheng et al., 2012). Возможно, что миграция CD303+-лимфоцитов в кишечник может являться попыткой организма защититься от избыточного воспаления.
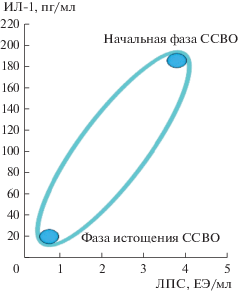
Помимо этого, повышению проницаемости стенки кишечника может способствовать нарушение связей между клетками эпителия. Было установлено (Nazli et al., 2010), что экспозиция ВИЧ-1 как с кишечным, так и с генитальным эпителием, приводит к повышению проницаемости эпителия уже через 2–4 ч после начала воздействия. Через 24 ч после экспозиции с различными штаммами ВИЧ-1 проницаемость эпителия кишечника для бактерий возрастала на 39–48%, клеток генитального тракта – на 30–60%, что сопровождалось повышением уровня бактериальной транслокации для E. coli HB101. Измерялась также проницаемость для ЛПС. После обработки монослоя эпителиальных клеток вирусом иммунодефицита человека содержание ЛПС в базолатеральном супернатанте повышалось на 47.3% в сравнении с контролем. Целостность и структура самих эпителиальных клеток при этом не страдала. Авторы считают, что повышение проницаемости обусловлено чрезмерной продукцией воспалительных цитокинов TNF-α, IL-6, IL-8, MCP-1 непосредственно эпителиальными клетками, подвергшимися воздействию вируса (Nazli et al., 2010). Вполне возможно, что повторяющиеся пики эндотоксиновой агрессии связаны с циклическим процессом репликации ВИЧ в эпителии, с повреждением кишечного барьера и, как следствие, c индукцией синдрома системного воспалительного ответа (ССВО), носящего волнообразный характер, когда гиперактивация иммунитета, обусловленная эндотоксиновой агрессией, сменяется его истощением – иммунодефицитом (рис. 4) (Anikhovskaya et al., 2015). При этом нужно понимать, что ЛПС – хотя и главный, но не единственный участник этого процесса, поскольку экзотоксины стафилококка и кандиды способны потенцировать биологические свойства ЛПС, тогда как вирусы, скорее всего, снижать (Аниховская и др., 2019).
Рис. 4.
Периодичность ССВО при ВИЧ-инфекции, когда фаза ЛПС-индуцированной гиперактивации иммунной системы сменяется ее истощением, связана с циклами репликации вируса и обусловленным ими повреждением кишечного барьера (по: Anikhovskaya et al., 2015).
Существенную роль в поддержании микробной транслокации и дисбаланса иммунной системы могут играть нарушения микробного состава кишечника, в том числе спровоцированные приемом антибиотиков (Mattapallil et al., 2005). Изменения микробиоценоза кишечника выявляются уже на начальных стадиях ВИЧ-инфекции (Brenchley et al., 2006; Nowak et al., 2015; Dillon et al., 2016). Проведенное нами бактериологическое исследование кала 317 пациентов с ВИЧ-инфекцией выявило высокую частоту нарушений микробиоценоза кишечника (они отмечены у 94% больных) независимо от клинической стадии заболевания и характера стула – уменьшение количественного содержания представителей облигатной кишечной микрофлоры, преимущественно бифидобактерий, с избыточным ростом условно-патогенных аэробных микроорганизмов, лидирующую позицию среди которых занимали S. аureus и грибы рода Candida. Более низкие уровни CD4+-клеток ассоциировались с нарастанием выраженности нарушений микробиоценоза кишечника (Хасанова и др., 2013а). Известна также выраженная иммуномодулирующая и противовоспалительная активность представителей нормобиоты кишечника, к примеру, лактобактерий, которые способны, в том числе, подавлять продукцию провоспалительных цитокинов активированными ЛПС моноцитами (Lin et al., 2008). Представители индигенной микрофлоры ответственны за обеспечение должных метаболических процессов в кишечном эпителии, за пролиферацию клеток слизистой кишки и за устойчивость ее к различным агрессивным воздействиям. Они участвуют в дифференцировке кишечных CD4+-лимфоцитов и в активации регуляторных Т-клеток (Smith et al., 2014; Lazar et al., 2018; Brown et al., 2019). Баланс между Th17 и регуляторными Т-клетками, в значительной степени обеспечиваемый индигенной кишечной микрофлорой, в соответствии с современными представлениями, рассматривается как важнейшее условие успешной защиты человеческого организма как от развития аутоиммунных заболеваний, так и от воспалений инфекционного генеза (Freiberg et al., 2017).
ЗАКЛЮЧЕНИЕ
В прогрессировании ВИЧ-инфекции решающую роль играет кишечный фактор. ВИЧ-индуцированное повреждение кишечного барьера лежит в основе развития синдрома системного воспалительного ответа на эндотоксиновую агрессию кишечного происхождения. Особенностью ССВО при ВИЧ-инфекции является его цикличность, которая связана с периодами репликации ВИЧ в энтероцитах и с обусловленной ей повышенной кишечной проницаемостью. В лечении ВИЧ-инфекции достигнуты серьезные успехи благодаря использованию комбинированной АРВТ, которая у большей части ВИЧ-инфицированных приводит к подавлению репликации вируса, увеличению количества CD4+-лимфоцитов и снижению риска смерти от оппортунистических заболеваний. Тем не менее, АРВТ далеко не всегда приводит к купированию ЛПС-индуцированного системного воспаления, которое ассоциируется с отсутствием восстановления количества СD4+-клеток, повышенным риском развития опухолей и заболеваний, на первый взгляд не связанных с ВИЧ. Представляется возможным констатировать, что ВИЧ-инфекция по своей сути провоцирует преждевременное старение организма хроническим ЛПС-индуцированным системным воспалением, которое носит циклический характер.
Таким образом, наряду с прямым повреждающим действием вируса существенная роль в патогенезе ВИЧ-инфекции принадлежит эндотоксиновому фактору. Для повышения эффективности лечебно-профилактического процесса и увеличения продолжительности жизни ВИЧ-инфицированных целесообразно начинать АРВТ сразу после постановки диагноза с целью максимальной защиты слизистой кишечника. При этом необходимо дополнительно использовать комплекс средств, действие которых направлено на предупреждение поступления ЛПС в системный кровоток и на выведение его избыточных количеств из организма: энтеросорбенты, желчегонные препараты, пробиотики и др., в том числе препараты селективной энтеросорбции ЛПС, основанные на аптамерах (Аниховская и др., 2019).
Список литературы
Аниховская И.А., Кубатиев А.А., Майский И.А. и др. Направления поиска средств снижения концентрации эндотоксина в общей гемоциркуляции // Патогенез. 2014. № 12 (4). С. 25–30.
Аниховская И.А., Салахов И.М., Яковлев М.Ю. Кишечный эндотоксин и стресс в адаптации и старении // Вестн. РАЕН. 2016. № 16 (1). С. 19–24.
Аниховская И.А., Белоглазов В.А., Гордиенко А.И. и др. Краткая история изучения роли кишечного фактора в старении и/или индукции системного воспаления: достижения, проблемы, перспективы // Патогенез. 2019. № 17 (1). С. 4–17. https://doi.org/10.25557/2310-0435.2019.01.4-17
Гордиенко А.И., Белоглазов В.Н., Кубышкин А.В. Дисбаланс показателей гуморального антиэндотоксинового иммунитета и низкоинтенсивное воспаление при сахарном диабете 1 и 2 типа // Патол. физиол. эксперим. терапия. 2016. № 60 (3). С. 61–67.
Уразаев Р.А., Крупник А.Н., Яковлев М.Ю. Эндотоксинемия в раннем периоде адаптации новорожденных и их матерей // Казан. мед. журн. 1992. № 2. С. 114.
Хасанова Г.Р., Анохин В.А., Абросимова А.А., Нагимова Ф.И. Оценка вероятности развития анемии у больных с ВИЧ-инфекцией с использованием метода Каплана–Майера // Соврем. технол. мед. 2011. № 4. С. 109–112.
Хасанова Г.Р., Биккинина О.И., Анохин В.А. и др. Кишечный эндотоксин как вероятный индуктор системного воспалительного ответа при ВИЧ-инфекции // Практич. мед. 2012. № 1 (56). С. 52–55.
Хасанова Г.Р., Анохин В.А., Биккинина О.И. и др. Нарушения микробиоценоза кишечника у больных ВИЧ-инфекцией // Казан. мед. журн. 2013а. № 94 (1). С. 34–39.
Хасанова Г.Р., Биккинина О.И., Акчурина Л.Б. и др. Системный воспалительный ответ и прогрессирование ВИЧ-инфекции // Вестн. соврем. клин. мед. 2013б. № 6 (3). С. 21–27.
Хасанова Г.Р., Анохин В.А., Нагимова Ф.И. Значение уровня растворимого рецептора CD14 для прогноза прогрессирования ВИЧ-инфекции // Практич. мед. 2014. № 4. С. 119–123.
Энукидзе Г.Г., Аниховская И.А., Марачев А.А., Яковлев М.Ю. Антиэндотоксиновое направление в лечении хронического воспаления и женского бесплодия / Новые лечебно-диагностические технологии. Кн. 3. М.: Моск. учебники, 2007. 80 с.
Яковлев М.Ю. Роль кишечной микрофлоры и недостаточность барьерной функции печени в развитии эндотоксинемии и воспаления // Казан. мед. журн. 1988. №5. С. 353–358.
Яковлев М.Ю. “Эндотоксиновая агрессия” как предболезнь или универсальный фактор патогенеза заболеваний человека и животных // Успехи соврем. биол. 2003. Т. 123. № 1. С. 31–40.
Яковлев М.Ю. Кишечный липополисахарид: системная эндотоксинемия – эндотоксиновая агрессия – SIR-синдром и полиорганная недостаточность как звенья одной цепи // Бюл. ВНЦ РАМН. 2005. № 6. С. 91–96.
Яковлев М.Ю. Кишечный эндотоксин и воспаление // Дерматовенерология. Национальное руководство / Ред. Ю.С. Бутов, Ю.К. Скрипкина, О.Л. Иванова. М.: ГЭОТАР-Медиа, 2013. С. 99–110.
Anikhovskaya I.A., Golishev I.S., Tebloev K.I., Yakovlev M.Yu. The role of endotoxin agression in pathogenesis of acute myocardial infaction // Hum. Physiol. 2014. V. 40. № 3. P. 348.
Anikhovskaya I.A., Kubatiev A.A., Khasanova G.R., Yakovlev M.Yu. Endotoxin is a component in the pathogenesis of chronic viral diseases // Hum. Physiol. 2015. V. 41. № 3. P. 328.
Ascher M.S. AIDS as immune system activation: a model for pathogenesis // Clin. Exp. Immunol. 1988. № 73. P. 165–167.
Beignon A.S., McKenna K., Skoberne M. et al. Endocytosis of HIV-1 activates plasmacytoid dendritic cells via Toll-like receptor-viral RNA interactions // J. Clin. Inves. 2005. № 115. P. 3265–3275.
Boichuk S.V., Khaiboullina S.F., Ramazanov B.R. et al. Gut-associated plasmacytoid dendritic cells display an immature phenotype and upregulated granzyme B in subjects with HIV/AIDS // Front. Immunol. 2015. № 6. P. 485. https://doi.org/10.3389/fimmu.2015.00485
Badley A.D., Pilon A.A., Landay A., Lynch D.H. Mechanisms of HIV-associated lymphocyte apoptosis // Blood. 2000. V. 96. P. 2951–2964.
Brenchley J.M., Price D.A., Schacker T.W. et al. Microbial translocation is a cause of systemic immune activation in chronic HIV // Nat. Med. 2006. № 12. P. 1365–1371.
Brown E.M., Kenny D.J., Xavier R.J. Gut microbiota regulation of T cells during inflammation and autoimmunity // Ann. Rev. Immunol. 2019. V. 37. P. 599.
Dillon S.M., Frank D.N., Wilson C.C. The gut microbiome and HIV-1 pathogenesis: a two way street // AIDS. 2016. V. 30 (18). P. 2737–2751. https://doi.org/10.1097/QAD.0000000000001289
Enukidze G.G., Anikhovskaya I.A., Marachev A.A., Yakovlev M.Yu. Endotoxin agression in the pathogenesis of chronic inflamatory diseases of small pelvis organs and infertility, or an antiendotoxin approach to their treatment // Hum. Physiol. 2006. V. 32. № 3. P. 351–356.
Equils O., Faure E., Thomas L. et al. Bacterial lipopolysaccharide activates HIV longterminal repeat through Toll-like receptor 4 // J. Immunol. 2001. V. 166. P. 2342–2347. https://doi.org/10.4049/jimmunol.166.4.2342
Freiberg M.S., Chang C.H., Skanderson M. et al. Association between HIV infection and the risk of heart failure with reduced ejection fraction and preserved ejection fraction in the antiretroviral therapy era: results from the Veterans Aging Cohort study // JAMA Cardiol. 2017. № 2. P. 536–546. https://doi.org/10.1001/jamacardio.2017.0264
Furtado M.R., Callaway D.S., Phair J.P. et al. Persistence of HIV-1 transcription in peripheral-blood mononuclear cells in patients receiving potent antiretroviral therapy // N. Engl. J. Med. 1999. V. 340 (21). P. 1614–1622. https://doi.org/10.1056/NEJM199905273402102
Ganz T. Hepcidin: a regulator of intestinal iron absorption and iron recycling by macrophages // Best Pract. Res. Clin. Haematol. 2005. V. 18. P. 171–182. https://doi.org/10.1016/j.beha.2004.08.020
Giorgi J.V., Lyles R.H., Matud J.L. et al. Predictive value of immunologic and virologic markers after long or short duration of HIV-1 infection // J. Acquir. Imm. Defic. Syndr. 2002. V. 29. P. 346–355.
Gordienko A.I., Beloglazov V.A., Kubyshkin A.V. et al. Humoral anti-endotoxin immunity imbalance as a probable factor in the pathogenesis of autoimmune diseases // Hum. Physiol. 2019. V. 45 (3). P. 337–341.
Grabar S., Selinger-Leneman H., Abgral S. et al. Prevalence and comparative characteristics of long-term nonprogressors and HIV controller patients in the French Hospital Database on HIV // AIDS. 2009. V. 23. P. 1163–1169. https://doi.org/10.1097/QAD.0b013e32832b44c8
Grossman Z., Bentwich Z., Herverman R.B. From HIV infection to AIDS: are the manifestations of effective immune resistance misinterpreted? // Clin. Immunol. Immunpathol. 1993. V. 69. P. 123–135.
Hellerstein M.K., Hoh R.A., Hanley M.B. et al. Subpopulations of long-lived and short-lived T cells in advanced HIV-1 infection // J. Clin. Invest. 2003. V. 112. P. 956–966. https://doi.org/10.1172/JCI17533
Herbeuval J.P., Hardy A.W., Boasso A. et al. Regulation of TNF-related apoptosis-inducing ligand on primary CD4+ T cells by HIV-1: role of type I IFN-producing plasmacytoid dendritic cells // PNAS USA. 2005. V. 102. P. 13974–13979. https://doi.org/10.1073/pnas.0505251102
Ho D.D., Neumann A.U., Perelson A.S. et al. Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection // Nature. 1995. V. 373. P. 123–126. https://doi.org/10.1038/373123a0
Hunt P.W., Brenchley J., Sinclair E. et al. Relationship between T cell activation and CD4+ T cell count in HIV-seropositive individuals with undetectable plasma HIV RNA levels in the absence of therapy // J. Infect. Dis. 2008. V. 197. P. 126–133. https://doi.org/10.1086/524143
Jiang W., Lederman M.M., Hunt P. et al. Plasma levels of bacterial DNA correlate with immune activation and the magnitude of immune restoration in persons with antiretroviral-treated HIV infection // J. Infect. Dis. 2009. V. 199. P. 1177–1185. https://doi.org/10.1086/597476
Lazar V., Ditu L.-M., Pircalabioru G.G. et al. Aspects of gut microbiota and immune system interactions in infectious diseases, immunopathology, and cancer // Front. Immunol. 2018. V. 9. P. 1830. https://doi.org/10.3389/fimmu.2018.01830
Lester R.T., Yao X.D., Ball T.B. et al. HIV-1 RNA dysregulates the natural TLR response to subclinical endotoxemia in Kenyan female sex-workers // PLoS One. 2009. V. 4. P. 5644. https://doi.org/10.1371/journal.pone.0005644
Lin Y.P., Thibodeaux C.H., Peña J.A. Probiotic Lactobacillus reuteri suppress proinflammatory cytokines via C-Jun // Inflamm. Bowel. Dis. 2008. V. 14. P. 1068–1083.
Marchetti G., Cozzi-Lepri A., Merlini E. et al.; ICONA Foundation Study Group. Microbial translocation predicts disease progression of HIV-infected antiretroviral-naive patients with high CD4 cell count // AIDS. 2011. V. 25 (11). P. 1385–1394. https://doi.org/10.1097/QAD.0b013e3283471d10
Mattapallil J.J., Douek D.C., Hill B. Massive infection and loss of memory CD4+ T cells in multiple tissues during acute SIV infection // Nature. 2005. V. 434 (7037). P. 1093–1097. https://doi.org/10.1038/nature03501
Medzhitov R., Preston-Hurlburt P., Janeway C.A.Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity// Nature. 1997. V. 388. P. 394–397.
Mehandru S., Poles M.A., Tenner-Racz K. et al. Lack of mucosal immune reconstitution during prolonged treatment of acute and early HIV-1 infection // PLoS Med. 2006. V. 3 (12). P. 484. https://doi.org/10.1371/journal.pmed.0030484
Nazli A., Chan O., Dobson-Belaire W.N. et al. Exposure to HIV-1 directly impairs mucosal epithelial barrier integrity allowing microbial translocation // PloS Pathog. 2010. V. 6 (4). P. 1000852. https://doi.org/10.1371/journal.ppat.1000852
Nova Z., Skovierova H., Calkovska A. Alveolar-capilary membrane-related pulmonary cells as a target in endotoxin-induced acute lung injury // Int. J. Mol. Sci. 2019. V. 20 (4). P. 831.
Nowak P., Troseid M., Avershina E. et al. Gut microbiota diversity predicts immune status in HIV-1 infection // AIDS. 2015. V. 29 (18). P. 2409–2418. https://doi.org/10.1097/QAD.0000000000000869
Nowroozalizadeh S., Månsson F., da Silva Z. et al. Microbial translocation correlates with the severity of both HIV-1 and HIV-2 infections // J. Infect. Dis. 2010. V. 201 (8). P. 1150–1154. https://doi.org/10.1086/651430
Okorokov P.L., Anikhovskaya I.A., Volkov I.E., Yakovlev M.Yu. Intestinal endotoxin as a trigger of type 1 diabetes mellitus // Hum. Physiol. 2011. V. 37. № 2. P. 247.
Okorokov P.L., Anikhovskaya I.A., Yakovleva M.M. et al. Nutritional factors of inflammation induction or lipid mechanism of endotoxin transport // Hum. Physiol. 2012. V. 38. № 6. P. 649.
Okulicz J.F., Marconi V.C., Landrum M.L. et al. Clinical outcomes of elite controllers, viremic controllers, and long-term nonprogressors in the US Department of Defense HIV natural history study // J. Infect. Dis. 2009. V. 200. P. 1714–1723. https://doi.org/10.1086/646609
Picker L.J., Watkins D.I. HIV pathogenesis: the first cut is the deepest // Nat. Immunol. 2005. V. 6. P. 430–432. https://doi.org/10.1038/ni0505-430
Pokusaeva D.P., Anikhovskaya I.A., Korobkova L.A. et al. Prognostic importance of systemic endotoxinemia indicators in atherogenesis // Hum. Physiol. 2019. V. 45 (5). P. 543–551. https://doi.org/10.1134/S036211971905013X
Redd A.D., Dabitao D., Bream J.H. et al. Microbial translocation, the innate cytokine response, and HIV-1 disease progression in Africa // PNAS USA. 2009. V. 106. P. 6718–6723. https://doi.org/10.1073/pnas.0901983106
Redd A.D., Eaton K.P., Kong X. et al. C-reactive protein levels increase during HIV-1 disease progression in Rakai, Uganda, despite the absence of microbial translocation // AIDS. 2010. V. 54. P. 556–559. https://doi.org/10.1097/QAI.0b013e3181e0cdea
Sandler N.G., Wand H., Roque A. et al. Plasma levels of soluble CD14 independantly predict mortality in HIV-infection // J. Infect. Dis. 2011. V. 203 (6). P. 780–790. https://doi.org/10.1093/infdis/jiq118
Schacker T.W., Reilly C., Beilman G.J. et al. Amount of lymphatic tissue fibrosis in HIV infection predicts magnitude of HHART-associated change in peripheral CD4 cell count // AIDS. 2005. V. 19. P. 2169–2171. https://doi.org/10.1097/01.aids.0000194801.51422.03
Smith C.J., Ryom L., Weber R. et al. Trends in underlying causes of death in people with HIV from 1999 to 2011 (D:A:D): a multicohort collaboration // Lancet. 2014. V. 384 (9939). P. 241–248. https://doi.org/10.1016/S0140-6736(14)60604-8
Sumpter B., Dunham R., Gordon S. et al. Correlates of preserved CD4(+) T cell homeostasis during natural, nonpathogenic simian immunodeficiency virus infection of sooty mangabeys: implications for AIDS pathogenesis // J. Immunol. 2007. V. 178. P. 1680–1691. https://doi.org/10.4049/jimmunol.178.3.1680
Tesselaar K., Arens R., van Schijndel G.M. et al. Lethal T cell immunodeficiency induced by chronic costimulation via CD27–CD70 interactions // Nat. Immunol. 2003. V. 4. P. 49–54. https://doi.org/10.1038/ni869
Trøseid M., Nowak P., Nyström J. et al. Elevated plasma levels of lipopolysaccharide and high mobility group box-1 protein are associated with high viral load in HIV-1 infection: reduction by 2-year antiretroviral therapy // AIDS. 2010. V. 2 (11). P. 1733–1737. https://doi.org/10.1097/QAD.0b013e32833b254d
Vyshegurov Ya.Kh., Anikhovskaya I.A., Rascheskov A.Yu. et al. Etiology of endotoxin agression and its role as an obligate pathogenic factor in iridocyclites different origins // Hum. Physiol. 2006.V. 32. № 6. P. 726–730.
Weiss L., Donkova-Petrini V., Caccavelli L. et al. Human immunodeficiency virus-driven expansion of CD4+CD25+ regulatory T cells, which suppress HIV-specific CD4 T-cell responses in HIV-infected patients // Blood. 2004. V. 104. P. 3249–3256. https://doi.org/10.1182/blood-2004-01-0365
West A.P., Koblansky A.A., Gosh S. Recognition and signaling by Toll-like receptors // Ann. Rev. Cell Dev. Biol. 2006. V. 22. P. 409–437.
Zheng D., Cao Q., Lee V.W. et al. Lipopolysaccharide-pretreated plasmacytoid dendritic cells ameliorate experimental chronic kidney disease // Kidney Int. 2012. V. 81 (9). P. 892–902. https://doi.org/10.1038/ki.2011.471
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



