Успехи современной биологии, 2020, T. 140, № 6, стр. 584-600
Современные представления о токсинах высших грибов: циклические пептиды
А. А. Ховпачев 1, *, В. А. Башарин 1, С. В. Чепур 2, **, С. В. Волобуев 3, ***, М. А. Юдин 2, А. С. Гоголевский 2, А. С. Никифоров 2, Л. Б. Калинина 3, М. А. Тюнин 2
1 Военно-медицинская академия им. С.М. Кирова МО РФ
Санкт-Петербург, Россия
2 Государственный научно-исследовательский испытательный институт военной медицины МО РФ
Санкт-Петербург, Россия
3 Ботанический институт им. В.Л. Комарова Российской академии наук
Санкт-Петербург, Россия
* E-mail: vtmz@vmeda.org
** E-mail: gniiivm_2@mail.ru
*** E-mail: rbo.fungi@binran.ru
Поступила в редакцию 17.06.2020
После доработки 17.06.2020
Принята к публикации 17.06.2020
Аннотация
В продолжение обсуждения ядовитых соединений макромицетов, рассмотрена роль токсинов циклопептидной структуры в формировании патологических процессов. Подчеркнута медико-биологическая значимость фаллоидинового синдрома – мицетизма, который возникает в результате интоксикации аманитинсодержащими грибами. Приведен краткий обзор токсикологически значимых видов макромицетов, в том числе на территории России. Описан комплексный подход в исследовании эволюционно-генетических путей приобретения свойства токсичности в различных родах. Рассмотрены общие пути биосинтеза и особенности молекулярного строения аманитотоксинов, фаллотоксинов и виротоксинов. Представлены сведения об их токсикокинетике и транспортных системах, задействованных в процессе их клеточной пенетрации. Проанализирована популяционная изменчивость транспортных систем. Обобщены данные по рецепторам токсичности. На примере РНК-полимераз и актина показана различная направленность токсического процесса, вызываемого сходными по строению соединениями. Сделан вывод о том, что выяснение неизвестных механизмов действия токсинов в составе плодовых тел ядовитых грибов может стать ключом для успешного оказания медицинской помощи при фаллоидиновом синдроме.
ВВЕДЕНИЕ
Циклические пептиды (циклопептиды) представляют собой соединения, образованные протеиногенными и непротеиногенными аминокислотами, которые замкнуты посредством амидных связей. В группе циклопептидов грибов описано около 290 индивидуальных соединений, большую часть которых продуцируют микромицеты, эндофитные и морские грибы (Wang et al., 2017). Несмотря на то, что количество идентифицированных веществ этой группы постепенно нарастает, им присуще относительно небольшое разнообразие структурного скелета. Это, в свою очередь, определяет общие черты в биологической активности, которые на уровне токсических доз характеризуют их как цитотоксиканты (Brindisi et al., 2016; Ramm et al., 2017).
Из соединений, продуцируемых макромицетами, к токсинам причисляют циклопептиды с индольным центром, сгруппированные как аматоксины (аманитотоксины), фаллотоксины и виротоксины. Эти соединения обладают ядовитыми свойствами, которые на порядок превышают таковые у остальных известных циклопептидов высших грибов (Wieland, 1983; Walton, 2018).
Токсины высших грибов представляют важный таксономический признак (Funga Nordica …, 2012). Кроме этого, аманитотоксины служат ценным реагентом для изучения биосинтеза полимеров нуклеиновых кислот, а при помощи методик на основе фиксирования фаллотоксинами исследуют работу микрофиламентов эукариот (Bhaskaran, Yu, 1994; Falcigno et al., 2001).
Область исследования токсинов тесно связана со многими клиническими разделами медицины, в том числе токсикологии, поэтому их изучение актуально также в практическом отношении. Среди ядовитых грибов, аманитотоксин-содержащие макромицеты представляют особый интерес, поскольку лечение интоксикаций ими несет длительный и сложный характер, в то время как средства с широкой антидотной мощностью в отношении их не известны (Мусселиус, Рык, 2002; Magdalan et al., 2009; Rodrigues et al., 2020). Это, равно как и сам факт высокой летальности, требует более детального рассмотрения механизмов токсического действия аманитина, в том числе особенностей молекулярного строения и участков его взаимодействия с рецепторами, определяющими токсичность (Garcia et al., 2019).
Отравления аманитинсодержащими макромицетами сопряжены с возникновением первичного гепатотоксического синдрома группы цитотоксических поражений печени – 1А по классификации мицетизмов Spoerke, Rumack (1994), который также носит название фаллоидинового (цит. по: White et al., 2019). Регистрация данных состояний представляет определенные сложности, что связано с особенностями токсикокинетики аманитотоксинов (Зарафьянц, 2016). Тем не менее, с фаллоидиновым синдромом связывают более 90% летальных исходов от пищевых интоксикаций неинфекционной этиологии. По различным оценкам, уровень смертности при фаллоидиновом синдроме за последние 10 лет был снижен благодаря достижениям в интенсивной терапии с трансплантологией и в настоящий момент составляет от 8.7 до 30% (Мусселиус, Рык, 2002; Brandenburg, Ward, 2016; Govorushko et al., 2019). В то же время, пятилетняя выживаемость после ургентной трансплантации печени, потребность в которой в случаях средней и тяжелой степени интоксикации составляет от 60 до 94%, не достигает 38.5% (Krasnodębski et al., 2016; Kieslichova et al., 2018).
В целом можно полагать, что, как и другие группы токсинов высших грибов, ядовитые соединения циклопептидной структуры до настоящего времени не до конца изучены. Таким образом, в продолжение обсуждения ядовитых соединений высших грибов (Ховпачев и др., 2020), предпринята попытка обобщения сведений о молекулярном строении, механизмах действия токсинов циклопептидной структуры, биологическом разнообразии и токсикологической значимости их продуцентов.
РОЛЬ ЦИКЛОПЕПТИДНЫХ ТОКСИНОВ ВЫСШИХ ГРИБОВ В ФОРМИРОВАНИИ ПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ
Основные механизмы токсического действия грибов, вызывающих фаллоидиновый синдром, преимущественно опосредованы аманитотоксинами. Считают, что причина такой избирательности сопряжена с отсутствием всасывания фаллотоксинов и виротоксинов в желудочно-кишечном тракте (Walton, 2018). В то же время, присутствующие в некоторых плодовых телах (базидиомах, базидиокарпах) грибов рода Amanita Pers. высокомолекулярные белковые токсины: фаллолизин (ЛД50 = 40 мкг/кг, кролик, внутривенно), токсофаллин и токсовирин, термолабильны при температурах более 39.0°С и подвержены протеолизу в просвете кишки (Faulstich et al., 1983).
Представляя серьезную проблему для клиницистов по сегодняшний день, аманитин – один из древнейших ядов, которые применяли в криминальных целях. Среди исторических персонажей, которые, как считают, отравлены аманитинсодержащими грибами, стоят: греческий драматург Еврипид, римский император Клавдий и его сын Британник, папа Климент VII (Джулио Медичи), император Карл VI, Даниэль Фаренгейт и Наталья Нарышкина – мать Петра I (Супотницкий, 2011; Walton, 2018). В случае с семьей и придворной охраной Клавдия, благодаря “Анналам” Тацита, известно и имя отравительницы – Лукуста (цит по: Кнабе, 1981). Тем не менее, исторические описания отравлений, даже когда в источниках указано происхождение яда, содержат в себе немало клинических деталей, которые нельзя объяснить на основании современных представлений о механизмах ядовитости аманитотоксинов, что, в свою очередь, может ставить их этиологию под сомнение (Супотницкий, 2011).
Биологическое разнообразие продуцентов
Со времен древнеримской отравительницы Лукусты, благодаря которой токсины бледной поганки были прозваны “ядом царей”, список грибов, содержащих индольные циклопептиды, был значительно расширен. К числу ядовитых и смертельно ядовитых видов макроскопических грибов относят некоторых представителей родов Amanita Pers., Galerina Earle, Lepiota (Pers.) Gray и, возможно, Conocybe Fayod (Нездойминого, 1996; Малышева, 2018; Вишневский, 2019; Funga Nordica …, 2012). С учетом перорального механизма бытовых интоксикаций, их токсикологическое значение определено внешним подобием и сходным субстратом произрастания со съедобными видами (Мусселиус, Рык, 2002).
Из числа ядовитых Amanita в России, помимо общеизвестной бледной поганки, или Мухомора зеленого (Amanita phalloides (Vaill. ex Fr.) Link), распространение получили М. весенний = М. белый (A. verna (Bull.) Lam. (= A. phalloides var. verna (Bull.) Lanzi)) и М. вонючий, или белая поганка (A. virosa Bertill.) (Гуревич и др., 1995; Wieland, 1983).
Токсинообразующие базидиомы рода Amanita ограничены секцией Phalloideae. Следует отметить, что на данный момент в мире известно около 60 видов ядовитых мухоморов, вызывающих фаллоидиновый синдром (Pulman et al., 2016; Luo et al., 2018). Помимо перечисленных видов, наибольшее количество отравлений ассоциировано в Северной Америке с A. bisporigera G.F. Atk., A. suballiacea (Murrill) Murrill, а в Восточной Азии – A. exitialis Zhu L. Yang et T.H. Li, A. fuliginea Hongo и A. subjunquillea S. Imai (Madhok et al., 2006; Wei et al., 2017; Brandenburg, Ward, 2018; Govorushko et al., 2019; White et al., 2019). В свою очередь, внутри секции Phalloideae самые базальные, рано дивергировавшие таксоны, не производят ядовитые циклопептиды и, по сути, съедобны. Так, посредством филогенетической реконструкции (Cai et al., 2014), на примере 4 непродуцирующих токсины видов A. areolata T. Oda, C. Tanaka et Tsuda, А. hesleri Bas, A. mutabilis Beardslee и A. crassiconus Bas, было показано, что способность к продуцированию ядовитых соединений в некоторых линиях этой секции была утеряна.
Известны сообщения о распространении ядовитых бициклопептидов среди мухоморов вне секции Phalloideae. Так, в работе (Faulstich, Cochet-Meilhac, 1976) методами радиоиммуноанализа и ингибирования РНК-полимераз было показано наличие от 0.2 до 16 нг/г аматоксинов в плодовых телах A. muscaria (L.) Lam., A. rubescens Pers., A. citrina Pers. и A. pantherina (DC.) Krombh. Кроме этого, в исследовании были выявлены те же концентрации токсинов в съедобных плодовых телах Agaricus sylvaticus Schaeff. (шампиньон лесной), Boletus edulis Bull. (белый гриб) и Cantharellus cibarius Fr. (лисичка). Однако, при дальнейшем изучении, представленные данные не были подтверждены, что по мнению (Wieland, 1983) указывает на нарушения в ходе преаналитического этапа исследования 1976 г.
Сделать однозначное и обобщенное заключение об уровнях бициклопептидов в макромицетах затруднительно, поскольку данные получены в исследованиях с различной стандартизацией процедур (Yilmaz et al., 2015). С другой стороны, разброс уровней токсинов рассматриваемых базидиомицетов слишком высок, чтобы его можно было объяснить просто ошибочной индикацией и, вероятно, представляет естественную изменчивость, по крайней мере, частично. В качестве фактора, обусловливающего уровень вариабельности токсинов в составе плодовых тел, обсуждают генетическую нестабильность, по аналогии с высшими аскомицетами, у которых она изучена более детально (Luo et al., 2012). Кроме этого, не до конца понятны таксономические и географические вариации содержания токсина, а также его накопление внутри клеточных компартментов.
Однако полагают, что общее содержание основных токсичных аманитинов (α, β и γ) в свежих плодовых телах бледной поганки (A. phalloides) варьирует от 0.1 до 0.5 мг/г, что соответствует от 1 до 5 мг/г в высушенных. Так, свежая базидиома A. phalloides массой 100 г может содержать более 20 мг активных аматоксинов. Учитывая, что достаточной дозой для смерти человека массой 70 кг может быть 7 мг, одно такое плодовое тело гриба среднего размера эквивалентно 3.0 ЛД50 (Yilmaz et al., 2015). Что касается бледной поганки, отмечают ее низкую изменчивость по содержанию токсинов, а также редкую встречаемость плодовых тел в составе вида, в которых токсины отсутствуют. В свою очередь, для М. весеннего, или белого (A. verna), характерен более высокий разброс: известны случаи идентификации только фаллотоксинов в отсутствии аманитотоксинов, или их полного отсутствия в составе базидиокарпов (Гуревич и др., 1995).
Как и у мухоморов, способность к биосинтезу токсинов не универсальна для рода Galerina в целом, будучи ограниченной подродом Naucoriopsis. В России токсикологическое значение отводят Галерине окаймленной (Galerina marginata (Batsch) Kühner), которая по результатам филогенетического анализа (Gulden et al., 2001) включает в себя пять ранее обособленных видов: Г. осеннюю (G. autumnalis (Peck) A.H. Sm. et Singer), Г. орегонскую (G. oregonensis A.H. Sm.), Г. одноцветную (G. unicolor (Vahl) Singer) и Г. ядовитую (G. venenata (Vahl) Singer). Кроме этого, из числа видов, отнесенных к подроду Naucoriopsis, в нашей стране встречают базидиомы Г. Яапа (G. jaapii A.H. Sm. et Singer) и Г. ложномиценовидной (G. pseudomycenopsis Pilát) (Нездойминого, 1996). В отличие от G. marginata, которые ошибочно принимают за съедобные опята, последние могут быть случайно собранными с целью достижения наркотического опьянения по причине сходства с псилоцибинсодержащими видами. В Китае описаны случаи бытовых интоксикаций вследствие ошибочного потребления плодовых тел G. sulciceps (Berk.) Boedijn, а также G. fasciculata Hongo и G. helvoliceps (Berk. et M.A. Curtis) Singer в Японии (Muraoka et al., 1999; Xiang et al., 2017).
К числу проявляющих ядовитые свойства в нашей стране относят 5 видов рода Lepiota: Лепиоту коричнево-красную (Lepiota brunneoincarnata Chodat et C. Martín), Л. каштановую (L. castanea Quél.), Л. ядовитую (L. helveola Bres.), Л. лиловую (L. lilacea Bres.), Л. розоватую (L. subincarnata J.E Lange; L. s. var. josserandii (Bon ex Boiffard) Gminder; L. josserandii Bon ex Boiffard) (Мусселиус, Рык, 2002; Sun et al., 2019).
Род Conocybe – крупный таксон семейства Bolbitiaceae (Малышева, 2018). Распространено представление, что данный род включает 2 аманитотоксинсодержащих вида. Единственное сообщение об аутопсии пострадавшего с семиотикой, соответствующей фаллоидиновому синдрому и ассоциированной с Коноцибе нитевидной (Conocybe filaris (Fr.) Kühner (= Pholiotina filaris (Fr.) Singer)), представлено у Брэди с соавт. (Brady et al., 1975). Не отрицая значимости исследования, с момента появления которого C. filaris включают во все списки ядовитых грибов, необходимо отметить, что за период, прошедший с 1975 г., не известен ни один случай интоксикации человека или животного грибами этого вида, а также идентификации в них аманитина, которые нашли бы отражение в рецензируемом издании (Walton, 2018).
Наличие фаллотоксинов и генов, ответственных за их продукцию, было показано для К. молочной (C. apala (Fr.) Arnolds (= C. albipes Hauskn.)). Это первый известный вид, продуцирующий фаллотоксины за пределами рода Amanita. Тем не менее, суммарные уровни фаллотоксинов в базидиомах C. apala находят очень низкими, около 3 нг/г свежей массы, что эквивалентно 30 нг/г в высушенных грибах, или в 105 раз ниже, чем обычно встречают у таких видов, как A. phalloides (Luo et al., 2009).
Биосинтез
Общие черты химического строения циклопептидных токсинов опосредованы общими механизмами биосинтеза. Грибы продуцируют большинство циклических соединений с помощью нерибосомальных пептид-синтетаз (nonribosomal peptide-synthetase, NRPS) (Wang et al., 2017). В то же время, рассматриваемые токсины относят к группе синтезированных на рибосомах и посттрансляционно модифицированных пептидов (ribosomally synthesized and post-translationally modified peptides, RiPPs). Следует отметить, что биосинтез базидиомами Amanita аманито- и фаллотоксинов – первый изученный рибосомальный путь образования циклопептидов в грибах (Walton et al., 2010; Matinkhoo et al., 2018).
Последовательность белков-предшественников индолсодержащих полипептидов кодируется семейством генов MSDIN и регулируется альтернативным сплайсингом. Протеолиз предшественника происходит посредством фермента пролил-олигопептидазы В (POPB) (Walton et al., 2010; Pulman et al., 2016; Luo et al., 2018) до 34–37 аминокислот.
Кроме POPB, известна пролилолигопептидаза типа A (POPА), которая не участвует в биосинтезе токсинов и получила широкое распространение среди базидиомицетов, в то время как большинство аскомицетов не содержит ее. POPB характерна только для токсинообразующих видов и не проявляет субстратной специфичности в отношении насыщенных пролином пептидов. Как и некоторые сериновые протеазы растений, POPB обладает циклазной активностью в отношении пептидов, содержащих от 7 до, по меньшей мере, 16 аминокислот, с оптимумом в 8–9 остатков (Sgambelluri et al., 2017). Вследствие этого, после элиминации концевых аминокислотных последовательностей, она образует целый ряд моноциклически замкнутых соединений. Так, помимо ядовитых бициклопептидов, в составе некоторых видов секции Phalloideae рода Amanita выявляют еще антаманид, биологически-инертные циклоаманиды A–J3, аманекситид, и 6 видов ядовитых виротоксинов (Luo et al., 2020). Из них антаманид – Val1-Pro2-Pro3-Ala4-Phe5-Pro6-Pro7-Phe8-Phe9 – проявляет антидотные свойства в отношении аманитинов на культурах гепатоцитов, однако присутствует в плодовых телах в недостаточных для реализации защитного эффекта концентрациях (Montanaro et al., 1971). Тем не менее, к ограничивающим факторам клинического применения антаманида относят ингибирование эффлюкса аманитотоксина из гепатоцитов. В результате на организменном уровне его эффекты оценивают как неоднозначные (Wieland, 1983). Следует отметить, что биологическая инертность сопутствующих циклоаманидов не была обоснована, поскольку ее пристально не изучали (Wang et al., 2017). В то же время, неизвестна их роль в процессе взаимодействия с аманитотоксинами, в частности – влияние на клеточный транспорт последних.
Кроме рассматриваемых видов, протеазы с циклазной активностью участвуют в биосинтетических путях и других макромицетов. Так, известны 9 типов омфалотинов A–I Омфалота маслинового (Omphalotus olearius (DC.) Singer) и N-метилированные гимнопептиды A и B Гимнопилуса веретеноногого (Gymnopus fusipes (Bull.) Gray). Несмотря на показанную высокую антипролиферативную активность, гимнопептиды и омфалотины представляют ограниченное токсикологическое значение, поскольку описания отравлений G. fusipes отсутствуют, а в качестве основного токсина O. olearius позиционируют мускарин (Vanyolos et al., 2016; Ramm et al., 2017). Помимо этого, среди аскомицетов рода Xylaria Hill ex Schrank встречают циклические трипептиды группы ксилоалленолида с высокой цитотоксической, а также инсектицидной и противогрибковой активностями (Wang et al., 2017).
Причины наличия одинаковых токсинов у различных родов спорны. Считают, что токсинообразование бициклопептидов как результат конвергентной гомологии, возникшей в ходе однонаправленного действия естественного отбора, и теория общего предшественника маловероятны (Wang et al., 2017). Исходя из анализа последовательностей MSDIN и POPB различных видов, показана высокая вероятность участия механизма горизонтальной передачи генов от Amanita к Galerina (Luo et al., 2018). В целом, данный механизм обмена наследственной информацией играет большую роль в изменчивости макромицетов, поскольку в “типичном” грибном геноме от 0.1 до 2.8% последовательностей ДНК могут быть результатом горизонтальной передачи генов (Wisecaver et al., 2015). В связи с тем, что кластеры, кодирующие POPB токсинообразующих видов рода Lepiota, не похожи на последовательности геномов мухоморов, рассматривают возможное наличие дополнительных механизмов их наследования. Анализ молчащих замещений нуклеотидных последовательностей генов также указывает на единое происхождение пептидного пути в роде Amanita. При этом, их азиатские субпопуляции, потерявшие свойства токсичности, относят к более базальным, в сравнении с европейскими и американскими (Pulman et al., 2016; Luo et al., 2018).
Как и базидиомы Galerina, ни один из видов Lepiota не продуцирует фаллотоксины. Однако, геном L. subincarnata кодирует до пяти предсказанных типов нетоксичных циклопептидов. В целом, разнообразие семейства генов MSDIN в Lepiota попадает в промежуточное положение между родом Galerina, среди видов которого встречают только последовательность, ответственную за синтез α-аманитина, и родом Amanita, некоторые представители которого содержат более 30 различных видов белков-предшественников циклопептидов (Pulman et al., 2016).
Отражая предназначение и биологическую роль токсинов, показано, что ключевым фактором в активации генов, ответственных за синтез циклопептидов плодовыми телами Amanita, выступает наличие эктотрофной микоризы, а биосинтез токсина за счет экспрессии ферментов мицелием Galerina нарастает in vitro в условиях низкой концентрации глюкозы (Luo et al., 2012, 2020).
Химическое строение
Структурно группа ядовитых циклопептидов макромицетов занимает промежуточное положение между циклопептидными токсинами растений и микроорганизмов за счет своих особенностей. Так, аманитотоксины и фаллотоксины отличает от токсинов белковой и полипептидной структуры других организмов присутствие γ-гидро-ксилированных и D(+)-аминокислот, а также наличие индолил-тиоэфирной связи Trp2-Cys6, образующей триптатиониновый мостик второго цикла. Входящая в состав токсинов сульфоксид-сульфонная группа при триптофане Trp2, наравне с пептидным остовом, представляет одно из главных условий их ядовитых свойств (Falcigno et al., 2001; Rodrigues et al., 2020). Следует отметить, что на данный момент триптатиониновый мостик не был найден ни в одном соединении естественного происхождения за рамками рассматриваемых. В то же время, для животных и растительных токсинов характерна циклизация за счет дисульфидных связей (Matinkhoo et al., 2018). Эти особенности позволяют циклопептидам макромицетов быть термостабильными в широком диапазоне и устойчивыми к действию большинства протеолитических ферментных систем млекопитающих.
Из деcяти известных грибных гидроксилированных бициклооктапептидов, с общей структурой Ile1-Trp2-Gly3-Ile4-Gly5-Cys6-Asn7-Pro8, к аманитотоксинам отнесены всего семь (рис. 1, 1–7 ). В состав молекулы менее токсичных полипептидов: амануллина (8), амануллиновой кислоты (9) и проамануллина (10) – вместо гидроксиизолейцина входит изолейцин (Ile1), лишающий их токсических свойств. Все аманитотоксины, кроме θ-аманитина (5), продуцируемого лишь некоторыми штаммами G. marginata, были выделены из A. phalloides (Wieland, 1983; Walton, 2018).
Рис. 1.
Химическая структура и токсичность аманитотоксинов (адаптировано по: Wieland, 1983; Walton, 2018).
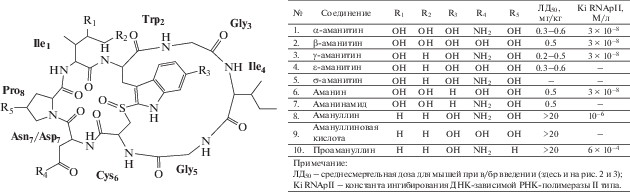
Рис. 2.
Химическая структура и токсичность фаллотоксинов (адаптировано по: Wieland, 1983; Walton, 2018).
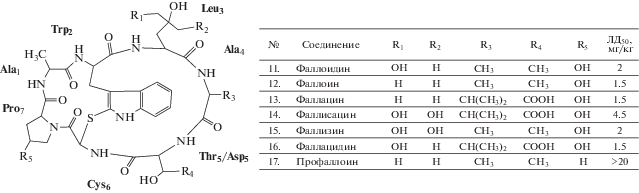
Рис. 3.
Химическая структура и токсичность виротоксинов (адаптировано по: Loranger, 1985; Walton, 2018).

Рис. 4.
Химическая структура индол-трипептидного токсина ясплакинолида губки Jaspis johnstoni Schmidt, 1862.

Рис. 5.
Токсикокинетика аманитотоксинов. Распределение основных транспортных белков человека, среди которых пропускная способность в отношении аматоксинов показана только для органических анион-транспортных пептидов 1В3 и 1B1 (адаптировано по: Manautou et al., 2010).
Последовательность аминокислотных остатков аманитотоксинов заложена в двух генах, отличных для α- и β-аманитина. Показано, что различия между этими двумя токсинами (Asn7 или Asp7), происходит не из-за посттрансляционной модификации (например, деамидирование Asn в Asp), тогда как лабораторно превращение β- в α-аманитин достигают амидированием в присутствии этоксикарбонилхлорида (CAS 541-41-3) (Wieland, 1983; Wisecaver et al., 2015). В работе (Pulman et al., 2016) отмечено, что уровни β-аманитина, представленные в некоторых исследованиях, могут быть ложно завышены, из-за артефактного деамидирования α-аманитина. Остальное разнообразие аманитотоксинов обусловлено вариабельностью посттрансляционного гидро-ксилирования и отражает отношения структура–активность.
В части, касающейся сульфоксида, его восстановление до сульфида или тиоэфира и окисление до сульфона не снижают токсичности для мышей. В то же время, левовращающие (S)-сульфоксидные формы аманитотоксинов в 20 раз менее токсичны в сравнении с (R)-энантиомерами (Ma-tinkhoo et al., 2018). Кроме сульфоксид-сульфонной группы, еще одним важным элементом токсичности бициклопептидов считают наличие β-поворота при Ile4, посредством которого возникает изменение направления полипептидной цепи (Baumann et al., 2008). Кроме этого, α- и β-аманитин содержат 4,5-дигидрокси-L-Ile1. В то же время, γ-аманитин представляет собой α-аманитин, только с наличием 4(γ)- и отсутствием 5(δ)‑гидроксильной группы при Ile1, а δ-аманитин – наоборот, с наличием только 5(δ)-ОН. Аналогично, ε-аманитин представляет β-аманитин без 5(δ)-OH.
Триптаминовый центр аманитотоксинов гидро-ксилирован в С5-положении (5-OH-Trp). 5-OH при Trp2 не относят к необходимому условию токсичности. Так, аманинамид и аманин, представляя собой α- и β-аманитин без 5-OH при Trp2, сравнимы с ними по уровню среднесмертельных доз. Однако, направленный на выявление 5-OH-Trp2, тест Вилланда–Мейкснера, как наиболее простой метод предварительного анализа на присутствие индолсодержащих циклопептидов в составе макромицетов, не выявляет аманинамид и аманин (A. virosa, L. brunneoincarnata) и выдает ложноположительные результаты при наличии 5-МеО-псилоцибина (Walton, 2018).
Разница по Asn/Asp7 обусловливает кислотно-основные различия среди токсинов (Montanaro et al., 1971). Однако, ввиду отсутствия данных о влиянии точек ионизации на токсикокинетику, кроме способности β-аманитина к раздражению слизистых оболочек, трудно сделать определенные выводы относительно особенностей токсикологического профиля отдельных соединений.
Среднесмертельные дозы наиболее ядовитых аманитотоксинов для мелких грызунов варьируют от 0.2 до 0.6 мг/кг, что может быть экстраполировано на людей, несмотря на видовые различия. При ретроспективной оценке токсичности для человека было показано, что 0.1 мг/кг α-аманитина представляет абсолютно эффективную дозу по критерию развития крайне тяжелой фульминантной печеночной недостаточности (Yilmaz et al., 2015).
Фаллотоксины включают в свой состав как минимум 7 индивидуальных соединений с общей аминокислотной последовательностью: Ala1-Trp2-Leu3-Ala4-Thr5-Cys6-Pro7 (рис. 2). Суффикс -аци в наименованиях токсинов: фаллацин (13), фаллисацин (14) и фаллацидин (16), указывает на то, что они обладают кислыми свойствами вследствие замещения Asp5 для Thr5. Суффикс -дин – на присутствие дигидрокси-Leu в положении 3: фаллоидин (11), тогда как -зин указывает на наличие тригидрокси-Leu3: фаллизин (15) (Wieland, 1983; Loranger, 1985; Walton, 2018). При парентеральном введении ЛД50 этих циклопептидов составляет от 1.5 до 4.5 мг/кг, кроме менее токсичного профаллоина (17) – ЛД50 > 20 мг/кг.
Из числа фаллотоксинов фалацидин и фаллоидин относят к первично зрелым токсинам, в то время как остальные – к продуктам посттрансляционной модификации. Вариабельность их аминокислотных последовательностей заключена в положениях 4: Ala или Val, и 5: Thr или Asp, что обусловлено дуализмом кодирующих генов (Pulman et al., 2016).
К важным заместителям, влияющими на отношения структура–активность фаллотоксинов, относят боковые радикалы при Ala1, Trp2, Cys6 и Pro7. В то же время, количество гидроксилов при Leu3, как и модификация их различными заместителями, не влияет на уровень токсичности. Норфаллоин, который структурно отличает от фаллоина наличие норвалина вместо изолейцина Ile в положении 3, сохраняет токсичность, подтверждая, что, в отличие от аматоксинов, гидро-ксилы не играют значимой роли в связывании фаллотоксинов. Тем не менее, показано, что для сохранения ядовитых свойств при Leu3 необходима разветвленная боковая цепь (Falcigno et al., 2001). Кроме этого, замена дигидрокси-L-Leu3 на D-изомер в фаллисацине или фаллизине устраняет их токсичность, что отражает важность стерической конфигурации данного участка в целом. Изменение соседнего D-Ala в положении 4 на L-Ala также снижает ядовитые свойства токсинов (Matinkhoo et al., 2018).
Как и аматоксины, фаллотоксины содержат триптатиониновую связь, однако искусственно синтезированные бициклические гексапептиды и октапептиды на основе фаллоидина нетоксичны. Расщепление мостика Trp2-Cys6 устраняет токсичность фаллотоксинов (Falcigno et al., 2001). Отмечено, что они устойчивы в кислой среде в меньшей степени в сравнении с аманитотоксинами, поэтому могут частично разрушаться в желудке (Wieland, 1983). Отсутствие 5-ОН при Trp2 не позволяет выявлять их посредством теста Вилланда–Мейкснера.
Замена Ala1 лишает токсины ядовитых свойств. Пролин в положении 7 фаллотоксинов содержит 4-(S)-гидроксил, то есть Pro7 – цис-изомер. В активных аманитотоксинах пролин располагает транс-конфигурацией, в то время как фаллотоксины с 4-(R)-ОН-Pro7 лишены ядовитости. Сама гидроксильная группа также вносит вклад в сохранение токсичности фаллотоксинов, о чем свидетельствует разница между ЛД50 фаллоина (12) и профаллоина (17), а также отсутствие токсичности у модифицированного до ацетил-Pro-фаллоидина (Zanotti et al., 1999).
Виротоксины, помимо A. virosa, выделены еще из плодовых тел A. subpallidorosea Hai J. Li и A. suballiacea (Murrill) Murrill (Wei et al., 2017). В наибольшем количестве среди виротоксинов эти виды содержат вироизин (20) и вироидин (21). Стереоизомер последнего – алавироидин (18), экстрагированный из A. suballiacea, содержит 2-(S), 4-(S)-дигидрокси-Leu3 вместо изомера 2-(S), 4-(R) – у вироидина, хотя и не отличается от него по активности (рис. 3). Показано наличие дезоксовироидина (22) у собранного в Китае A. exitialis (Deng et al., 2011), однако, Вэй с соавт. (Wei et al., 2017) ставят эти данные под сомнение.
Структуры виротоксинов (18–23) представляют варианты аминокислотных последовательностей фаллоидина, в положении 4 которых произведена заменена Ala на Val. Отсутствие ковалентно-замкнутого триптатионинового цикла не лишает виротоксины ядовитых свойств, что может быть объяснено сохранением конфигурации молекулы за счет ионного взаимодействия. Методом ядерного магнитного резонанса показано, что виротоксины сохраняют стабильную трехмерную структуру, более сходную с бициклическими фаллотоксинами, чем с моноциклизованными по триптатиониновому мостику, которые присутствуют в плодовых телах как популяция нетоксичных конформеров (Bhaskaran, Yu, 1994). Вне царства грибов похожей конфигурацией домена взаимодействия, также лишенной 2 ковалентно-замкнутого цикла, обладает ясплакинолид (рис. 4). В свою очередь, этот трипептид морской губки Jaspis johnstoni Schmidt, 1862 реализует механизм токсичности подобно фаллотоксинам (Pospich et al., 2020).
Тем не менее, при сравнении с фаллотоксинами, наличие у виротоксинов метилсульфинил-Trp2, дигидрокси-Pro7 и D-Ser6 придает им отличительные особенности в ходе реализации токсического эффекта (Zanotti et al., 1999; Walton, 2018). На основе синтетических производных вироизина Занотти с соавт. (Zanotti et al., 1999) пришли к выводу, что гидроксильная группа при D-Ser6 важна, в сравнении с другими перечисленными остатками, в меньшей степени.
На основании ранних работ Виланда, а также совсем недавних, из области секвенирования генома видов, продуцирующих аманитины, известно, что токсинам с индольным центром сопутствуют многие, возможно сотни, циклических пептидов, биологическую активность которых еще предстоит оценить (цит по: Walton, 2018). Так, недавно при помощи геном-ориентированного подхода, из 4 смертельно ядовитых мухоморов секвенировано и выделено 12 новых циклических пептидов (циклоаманиды G1–J3), из которых больше половины не дают отдельных пиков в ходе высокоэффективной жидкостной хроматографии (Luo et al., 2020).
Токсикокинетика
К причинам, по которым фаллотоксины не ядовиты при пероральном приеме, относят отсутствие поглощения их клетками кишки, следовательно, и способности к пенетрации энтерогематического барьера. Тем не менее, гибель животных в ходе моделирования интоксикаций при парентеральном способе введения фаллоидина наблюдают в более ранние сроки, около 2–5 ч, в сравнении с аманитином – более 30 ч. Причисляя виротоксины к моноциклическим вариантами фаллотоксинов, считают, что с точки зрения реализации токсического эффекта они ведут себя также (Oda et al., 2005).
В условиях интоксикации аманитотоксинами, как цитотоксическими агентами, повреждению подвержены все органы и системы (Зарафьянц, 2016). В отличие от α-, β-аманитин оказывает выраженный раздражающий эффект, в том числе на органы дыхания и зрения, и абсорбирует через кожные покровы и слизистые оболочки (Kaya et al., 2014). При пероральном поступлении аманитотоксины обнаруживают в крови через 90–120 мин после начала интоксикации. Они не связывают белки плазмы крови, до 60% токсинов кумулируют в печени и, не подвергаясь метаболизму, элиминируют из организма в неизменном виде. Показано, что период их полуэлиминации варьирует от 26.7 до 49.6 мин, а общий клиренс – от 2.7 до 6.2 мл/кг мин (Fiume et al., 1977; Jaeger et al., 1993).
Вследствие гепатоэнтеральной рециркуляции (ГЭР) токсины в желчевыводящей системе формируют более значимый пул, чем внутрисосудистый (Sun et al., 2019). При этом, соотношение их концентраций в крови и желчи дозозависимо меняется. Показано, что при внутрипортальном введении α-аманитина свиньям в дозах 0.35 и 0.15 мг/кг, пиковая концентрация его в плазме крови составляет в среднем 220 и 80 нг/мл, в то время как в желчи – 153 и 100 нг/мл соответственно. Однако, между большим кругом кровообращения и портальной венозной сетью его содержание не отличается. Токсин выявляют в плазме крови в течение 30–36 ч, в то время как в желчи он присутствует в 1.5–2 раза дольше, а в моче – до 4 сут (Thiel et al., 2011).
Помимо экспериментальных исследований, клинически было показано, что в период с 8 ч и до 3–4 сут после начала интоксикации концентрация аманитина в моче может превышать сывороточные уровни в 100–150 раз, при этом до 80% токсина элиминирует через клубочки в отсутствии реабсорбции (Kieslichova et al., 2018). Частичное депонирование нефроцитами до 3% от всего циркулирующего токсина приводит к развитию тубулярного некроза, который клинически проявляется острым почечным повреждением с анурией, а также присоединением к нарушениям кислотно-основного состояния (КОС) канальцевого ацидоза (Мусселиус, Рык, 2002).
Аманитотоксины обладают ограниченной способностью проникать в некоторые компартменты распределения, ограниченные плотными барьерами, такими как гематоэнцефалический (ГЭБ) и гематоплацентарный. Несмотря на то, что аманитин не проникает через ГЭБ, течение печеночной энцефалопатии в своих конечных стадиях сопровождается измененным сознанием, метаболической комой, отеком головного мозга, а непосредственно перед смертью – скачком внутричерепного давления, которое может приводить к смерти по механизму гибели мозга. Тем не менее, при интравентрикулярном введении аманитотоксины также обладают высокой токсичностью. Так, для крыс внутрижелудочковая токсичность α-аманитина составляет ЛД50 = 10 мкг/кг (Montanaro et al., 1971). При этом, его внутригиппокампальное введение вызывает нарушения долговременной памяти у крыс уже в дозе 25 пг/особь, что используют как инструмент в исследовании ее белковой природы (Igaz et al., 2002).
Несмотря на общепризнанное представление об отсутствии пенетрации фаллотоксинов из просвета кишки в кровоток, не исключена возможность их резорбции в условиях энтеральной недостаточности и нарушенной работы барьера. Кроме этого, известны экспериментальные данные, утверждающие обратное. Так, в исследовании (Sun et al., 2018) при энтеральном введении собакам от 1.0 до 4.0 ЛД50 экстракта A. exitialis помимо аманитинов в желчи и сыворотке крови в течение 2 сут определяли фаллацидин, а скорость его элиминации из сосудистого русла в среднем составляла Т1/2 = 0.62 ч. Не отрицая того, что пенетрация фаллацидина в кровоток у собак может быть опосредована межвидовыми различиями и не отражать реальное положение вещей у человека, подобная возможность должна быть подвергнута более детальной клинической проверке.
Поглощение клетками
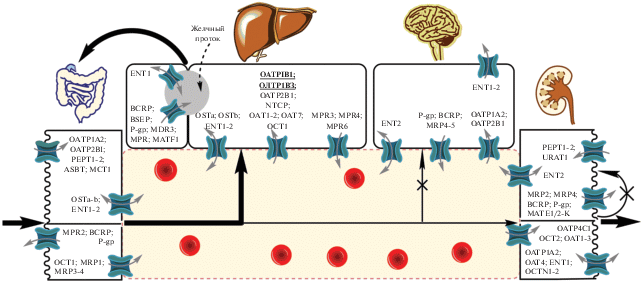
В целом, уровень способности токсинов бициклопептидной структуры к проникновению в ткани связывают с специфическим транспортом (рис. 5). Для перорально поглощенных аманитинов печень представляет основной орган-мишень и первый орган, в который они попадают из желудочно-кишечного тракта посредством портальной венозной сети. Более высокая биодоступность аманитотоксинов для гепатоцитов, в сравнении с другими типами клеток, в первую очередь обусловлена наличием специфических для органа транспортеров парных желчных кислот: органического анион-транспортирующего полипептида 1B3 (OATP1B3) и Na+ –таурохолат-котранспортерного полипептида (NTCP), локализованных на синусоидальных мембранах гепатоцитов. Так, константа Михаэлиса OATP1B3 в отношении аманитина варьирует от 3.1 до 4.2 мкМ/л, а гибель половины клеток, экспрессирующих его на поверхности, наблюдают in vitro в течение 48 ч при культуральной концентрации токсина 0.1 мкМ/л (Letschert et al., 2006).
Роль OATP-опосредованного поглощения в процессе реализации токсического действия бициклопептидов была продемонстрирована у генетически нокаутированных грызунов. Так, OATP1B3-отрицательные крысы были полностью резистентными к действию аманитина, в то время как были чувствительны к фаллацидину. Между тем, при моделировании интоксикаций у крыс, в транспорте фаллотоксинов задействован преимущественно OATP1B2 (Lu et al., 2008). В случае человека, в качестве основного белка-переносчика фаллотоксинов позиционируют OATP1B1 – Кm = 6.0 мкМ/л (Kaplan et al., 2008).
Наличие избирательного транспорта дает повод для обоснования способности конкурирующих за переносчики соединений проявлять защитный эффект в отношении бициклопептидов. К числу применяемых в клинической практике средств, снижающих взаимодействие аманитина с OATP1B3, относят бензилпенициллин (IC50 = 25 мкМ/л) и инъекционные формы силибинина (IC50 = 0.4 мкМ/л). Кроме этого, сравнимую эффективность могут оказывать рифампицин (IC50 = 0.8 мкМ/л) и циклоспорин А (IC50 = 0.3 мкМ/л) (Letschert et al., 2006). В то же время, амфотерицин B делает клетки более проницаемыми и, следовательно, более чувствительными к аманитину. Относительно NTCP-переносчика существует мнение, что его роль в транспорте аманитотоксинов может быть преувеличена. Тем не менее, в клинической практике рекомендуют средства, направленные на ингибирование NTCP, к числу которых относят глюкокортикостероидные препараты (Garcia et al., 2019).
С момента открытия первого OATP-переносчика в 1994 г. охарактеризовано около 300 их представителей у более чем 40 видов млекопитающих, включая 11 – у человека. На основании 40% идентичности аминокислотных последовательностей OATP, среди них у человека выделяют шесть групп (Manautou et al., 2010). Семейство OATP1B3 описаны как pH-зависимые гепатобилиарные транспортеры, чья активность может сильно варьировать в условиях смещения локального кислотно-основного состояния (Thomson et al., 2016). Показано, что в условиях нарастания тканевого ацидоза происходит стимуляция OATP1B3-опосредованного транспорта парных желчных кислот и стероидных глюкуронидов, скорость которого, достигая при рН = 6.5 уровня 160%-ной исходной активности, в дальнейшем снижается. В то же время, в условиях щелочного сдвига, скорость транспорта убывает, принимая минимальные значения при рН > 8 (Li et al., 1998).
В настоящий момент механизмы работы органических анион-транспортирующих полипептидов не до конца ясны. В качестве противоиона в работе OATP-переносчиков был определен бикарбонат (Powell et al., 2014). В других исследованиях также было показано, что OATP-опосредованный транспорт связан с оттоком бикарбоната, однако в качестве противоиона был представлен восстановленный глутатион (Li et al., 1998). Тем не менее, подобные результаты в других работах были плохо воспроизводимы, поэтому вопросы дальнейшего поиска тонких механизмов работы переносчика, а также способов воздействия на него через градиент противоионов, остаются открытыми (Mahagita et al., 2007; Thomson et al., 2016).
Ген, определяющий OATP1B3-переносчик, известен популяционной изменчивостью. Уровень экспрессии анион-транспортного полипептида 1B3 повышен у лиц кавказской национальности (Burt et al., 2016). Кроме этого, экспрессия белка в высоких количествах характерна для некоторых клеточных элементов новообразований. Рассматривают несколько видов генетических полиморфизмов OATP1B3, при этом частоты аллелей, значимых для снижения транспорта ксенобиотиков, достигают 10–15% (Powell et al., 2014). Несмотря на отсутствие полноценных исследований, носители измененных типов белков-переносчиков среди людей могут быть менее чувствительны к токсическому действию бициклопептидов.
Ингибирование переносчика достижимо как в условиях прямого, так и опосредованного воздействия, которое может быть осуществлено за счет регуляции его гликозилирования, убиквинирования и фосфорилирования. Считают, что уровни гликозилированного пула переносчика варьируют с возрастом и могут играть роль в его пропускной способности (Thomson et al., 2016). Показано, что повышенное фосфорилирование OATP1B3 после активации протеинкиназы C форбол-12-миристат-13-ацетатом (CAS 17673-25-5) сопровождает быстрое подавление транспортной функции белка. Функциональные последствия посттрансляционной модификации посредством присоединения молекул убиквинона для функциональной активности OATP1B3 все еще остаются неясными (Powell et al., 2014).
Тем не менее, по данным многих исследований почти все типы тканей млекопитающих чувствительны к аманитотоксинам и фаллотоксинам, что указывает на участие альтернативного переносчика, или другого вида транспорта (Зарафьянц, 2016; Wieland, 1983; Loranger, 1985). Гибель 50% инкубируемых элементов клеточных культур нефроцитов, экспрессирующих на своей поверхности только OATP1B1, наблюдали при концентрации аманитина 10 мкМ/л. В свою очередь, это может быть объяснено высоким уровнем гомологии последовательностей 1B1 и 1B3 семейств транспортных комплексов, которая может составлять до 80% (Lu et al., 2008). Для индукции апоптоза не экспрессирующих на мембране и 1B1-, и 1B3-типы транспортных белков необходимы большие концентрации токсина. При повышении количества последнего в конечном счете также наблюдают дистрофические изменения и клеточную гибель (Letschert et al., 2006). Помимо этого, факт чувствительности некоторых растений к бициклопептидам указывает на возможное участие иных вспомогательных механизмов (Walton, 2018).
В условиях целостного организма ядовитые соединения могут быть подвергнуты реакции токсификации. Например, белковые конъюгаты бициклопептидов могут быть в 50–100 раз токсичнее, чем нативные соединения. Следует отметить, что в число реакционноспособных протеинов не входит альбумин (Fiume et al., 1977). Помимо этого, попытка создать моноклональные антитела в их отношении оказалась беспрецедентным примером того, как иммуноглобулины, или их фрагменты, могут усиливать активность токсина (Faulstich et al., 1988). Считают, что механизм поглощения некоторых конъюгатов токсин–белок может быть опосредован через эндоцитоз (Walton, 2018).
Ингибирование транскрипции аманитотоксинами
Попадая внутрь клетки, аманитотоксины инактивируют как ДНК-зависимую РНК-полимеразу II RNApII (α-аманитин), так и РНК-полимеразу III RNApIII (β-аманитин), связываясь с аминокислотными остатками С-концевого ретинол-связывающего участка RPB1 (retinol binding protein) и триггерной петли запуска TL (trigger loop). Так, α-аманитин проявляет сродство к RNApII – Kd = 6.4 ×10–9 М/л при 37°C в концентрации 10 мкг/л, ингибируя ее активность на 60–70% и снижая синтез гетерогенной ядерной – предшественника матричной (информационной) РНК. В то же время, RNApIII опосредует синтез рибосомной 5S, транспортной и других малых РНК (Montanaro et al., 1971; Nguyen, 1996). Критическое значение в ингибировании синтеза полимеров нуклеиновых кислот отведено задействованности His1085 участка TL. Так, показано, что замена гистидина в положении 1085 фермента на аланин или фенилаланин делает его высокоустойчивым к α-аманитину (Kaplan et al., 2008).
Известно несколько модельных соединений, которые снижают ДНК-зависимую РНК-активность (Garcia et al., 2019). Однако, в сравнении с ними аманитотоксины проявляют на порядок превосходящую токсичность за счет индукции повышенной скорости деградации RNApII, при этом напрямую не активируя систему протеолитических клеточных ферментов. Показано, что его медленное и необратимое связывание с участками RPB1 и TL представляет сигнал для индукции биодеградации. Этот механизм позволяет аманитину, в отличие от актиномицина D и 5,6-дихлор-1-бета-D-рибофуранозилбензимидазола (CAS 53-85-0), проявляющим сходный уровень афинности к данному домену, снижать период полужизни фермента. Кроме этого, время полужизни RNApII при различных концентрациях α-аманитина составляет в среднем: 5 мкг/л – 8 ч, 20 мкг/л – 4 ч, 100 мкг/л – 2 ч (Nguyen, 1996). Ускорение биодеградации лимитированных пулов ДНК-зависимых РНК-полимераз и рибонуклеиновых полимеров выступает серьезным ограничением временных рамок в реализации широкой мощности средствами с потенциальной антидотной эффективностью (Garcia et al., 2019).
После воздействия аматоксина клетки страдают от дефицита функционально-активных белков, что приводит к недостатку транскрипционной информации и к их гибели. Наличие целой цепочки событий, а также медленно деградирующего пула резервной мРНК объясняет, почему некроз печени происходит с некоторой задержкой. К критическим факторам для выживания гепатоцитов отнесен период времени, в течение которого токсины присутствуют внутри клетки в концентрации, достаточной для ингибирования процесса транскрипции (≥1 мкг/л), что, в свою очередь, зависит от их содержания во внеклеточной среде и пропускной способности OATP1B3 (Lu et al., 2008).
Помимо антиферментного механизма действия, аманитотоксины, как и другие бициклопептиды грибов, за счет переходной сульфоксид-сульфонной группы при триптофане оказывают мощный прооксидантный мембранотоксический эффект. При прямом взаимодействии с мембранами митохондрий это вызывает нарушение окислительного фосфорилирования и приводит к активации лизосом, что также привносит свой вклад в цитотоксическое действие. Кроме этого, интоксикация аманитином уже в малых дозах, по сравнению со среднесмертельными, приводит к снижению концентрации внутриклеточного глутатиона и повышению продуктов перекисного окисления липидов (Zheleva et al., 2007).
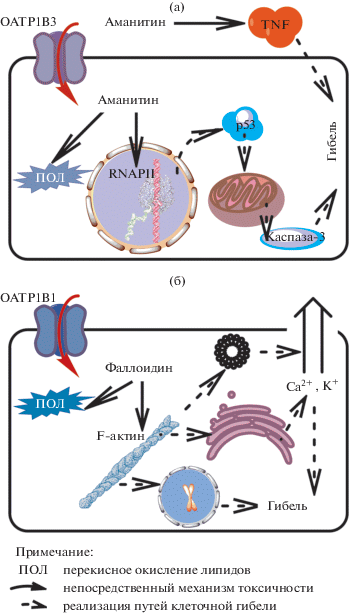
Совокупность механизмов действия амато-ксинов индуцирует гибель клетки, которая происходит преимущественно через TNF- и p53-индуцированный апоптоз (рис. 6а). Активация протеина р53 при блоке RNApII происходит с помощью двух независимых механизмов. Она связана, во-первых, с уменьшением ядерного экспорта мРНК, и, во-вторых, – опосредована запуском фосфорилаз, опосредующих присоединение фосфорного остатка к триггеру ее запуска – Ser15 (Derheimer et al., 2007).
На клеточном уровне наблюдают отсроченную фрагментацию и конденсацию хроматина, а на тканевом и органном – диссеминированные геморрагические изменения и жировое перерождение (Зарафьянц, 2016). При фаллоидиновом синдроме выделяют 2 пика гибели. Гибель в гастроинтестинальный период интоксикации связывают с нарушениями водно-электролитного баланса и кислотно-основного состояния, а также развитием гипогликемии и прямым повреждением миокарда аманитином. В печеночную стадию летальные исходы связаны с развитием труднокупируемых кровотечений на фоне коагулопатии и синдрома диссеминированного внутрисосудистого свертывания, а также неврологическими нарушениями, опосредованными отеком мозга (кома, судороги), реже – вследствие кардиомиопатии или инфекционных осложнений (Мусселиус, Рык, 2002; Krasnodębski et al., 2016).
Прорыв последнего десятилетия в исследованиях, связанных с изучением рецепторного участка взаимодействия аманитина, представляет многообещающее условие для успешного поиска специфических средств терапии. Обнадеживающими могут быть данные последних исследований полимиксина В, оказывающего “молчаливое” сродство к ДНК-зависимой РНК-полимеразе (Garcia et al., 2019), которое, впрочем, оспаривают (Rodrigues et al., 2020). В то же время, использование в качестве средства этиотропной терапии фаллоидинового синдрома уже одобренного для клинического применения препарата побуждает исследователей к более детальной оценке его эффективности.
Нарушение работы микрофиламентов фаллотоксинами и виротоксинами
Цитотоксичность фаллотоксинов и виротоксинов возникает в результате их взаимодействия с актином (Wieland, 1983; Falcigno et al., 2001). Как известно, актин – это белок, который образует микрофиламенты цитоскелета и сократительного аппарата мышечной ткани. Таким образом, он участвует во многих типах клеточного движения, включая цитокинез, везикулярный транспорт, движение органелл и поддержание общей формы клетки. Актин существует в динамическом равновесии между мономерными формами (G-актин) и полимером (F-актин).
Одним из ключевых моментов равновесия считают реакцию гидролиза аденозинтрифосфата (АТФ). В ходе деполимеризации F-актин проходит по крайней мере через три различных состояния, в зависимости от кинетики дефосфорилирования АТФ, в реакции которых большую роль отводят конформационным изменениям остатков His73 и Arg177.
Фаллотоксины связывают все формы актина во всех типах эукариотических клеток и их компартментах, включая цитоплазму, органнеллы и ядро. В качестве участка связывания с актином выступает домен токсина, состоящий из остатков Pro7, Ala4 и сульфоксид-сульфонной группы, чье сродство к клеточным филаментам определено показателем Kd = 20 нМ/л (Walton, 2018). В присутствии токсина скорость реакции полимеризации актина может возрастать до 30 раз. Считают, что фаллоидин посредством отмены высвобождения фосфата из F-актина может как стабилизировать полимер, так и ингибировать его деполимеризацию (Oda et al., 2005). Наиболее вероятным путем ингибирования высвобождения фосфата фаллоидином полагают его взаимодействие с участком His73 и Arg177. Стехиометрия связывания фаллоидина подлежит дальнейшему уточнению, однако по последним данным, доменов стабилизации актина может быть несколько. Отмечено, что актин в составе мышечных волокон гораздо менее чувствителен к токсину, что связывают с гидрофобным характером окружающих этот сайт аминокислотных остатков (Pospich et al., 2020).
В результате блока деполимеризации актина в мономерные формы, возникают нарушения функции цитоскелета, что сопровождает падение скорости всех видов внутриклеточного транспорта, а также активация лизосом (Falcigno et al., 2001). Кроме этого, блок деполимеризации актина напрямую и опосредованно, через активность каспаз и кальпаинов, связан с деградацией ДНК. Коллапс актиновых филаментов также нарушает необходимое поверхностное механическое напряжение клеток. Вследствие этого возникает разрушение межклеточных контактов, которое осуществляет вторичную индукцию клеточной гибели (White et al., 2001). Структурным перестройкам филаментов сопутствуют нарушения внутриклеточного переноса ионов и повышение их концентрации в сосудистом русле при утечке из вакуолизированных клеток (рис. 6б). Возникающая в результате электролитных погрешностей электрическая нестабильность миокарда на ранних сроках интоксикации фаллотоксинами представляет непосредственную причину гибели животных (Loranger, 1985). Тем не менее, с учетом тканевой избирательности, опосредованной OAT1B1-переносчиком, токсин причисляют к гепатотоксичным ядам (Wieland, 1983).
Ультрафиолетовые спектры взаимодействия виротоксинов с актином отличны от таковых при инкубации клеток с фаллотоксинами, что отражает наличие различной кинетики в ходе реакции. Считают, что, кроме этого, виротоксины по неуточненному механизму могут оказывать прямое повреждающее действие на биологические мембраны. В ходе моделирования экспериментальной патологии это приводит к большим, по сравнению с аматоксинами и фаллотоксинами, дистрофическим, геморрагическим и некротическим изменениям (Loranger, 1985).
Эволюционное значение
На данный момент мало что известно о биологической роли и селективных преимуществах синтеза токсичных бициклопептидов макромицетами. В то же время, синтез вторичных метаболитов, не участвующих в основном обмене, представляет энергозатратный процесс, который биологически не выгоден. Плодовые тела высших грибов – относительно кратковременные структуры, которые как источник питательных веществ привлекают множество различных микофагов. Противоречием в реализации антифидантной защиты от микофагов выступает то, что бициклопептиды безвкусны (по крайней мере, для человека), а гибель носит отсроченный характер. С этой точки зрения, в сравнении с бициклопептидами, в реализации антифидантной стратегии большей эффективностью обладают вызывающие отвращение горькие быстродействующие токсины, либо метаболиты с эметическим (рвотным) эффектом. Одно из возможных объяснений такого противоречия могло бы состоять в том, что к бициклопептидам чувствительны некоторые мухи, нематоды и слизни. Кроме этого, чувствительность РНК-полимераз неядовитых грибов превышает таковую в 100–150 раз в сравнении с токсин-положительными видами (Walton, 2018). В связи с этим полагают, что токсины циклопептидной структуры нацелены на биологические виды с медленным передвижением, а млекопитающие могут быть побочной жертвой в давней борьбе между циклопептид-продуцирующими грибами и их экологически значимыми антагонистами (Wisecaver et al., 2015).
ЗАКЛЮЧЕНИЕ
Таким образом, рассматриваемые токсины обладают принципиально разными механизмами действия, исход которых – цитотоксичность. Кроме этого, они располагают высокой активностью и узкой специфичностью, что возникает в результате избирательной и длительной коэволюции. Исходя из теории границы минимальных молярных летальных доз (Антонов, 1994), циклопептидные токсины высших грибов могут соответствовать характеристикам, близким к самым ядовитым веществам в своей весовой категории.
Понимание механизмов токсического действия дает нам не только представление о причинах патологических процессов, но и возможность научиться ими управлять, предотвращая критические проявления интоксикаций. Несмотря на то, что бициклопептиды изучены в большей степени, в сравнении другими видами токсинов макромицетов, остается нерешенным ряд практических для медицины проблем. Например, вызывает удивление факт отсутствия OATP1B3 на поверхности энтероцитов. С учетом избирательной способности к пенетрации аманитина, это предполагает наличие другого способа специфического преодоления им энтерального барьера, который неэффективен для фаллотоксинов и виротоксинов. Вместе с этим, не уточнен переносчик, опосредующий экскрецию токсина в просвет желчных протоков, что может представлять принципиальное значение для предупреждения реакций токсификации в ходе терапии. Не выяснен механизм деградации пула полимеров рибонуклеиновых кислот, который, вероятно, представляет один из главных факторов, лимитирующих период эффективных терапевтических мероприятий. Ответы на эти вопросы могут послужить основой дальнейшего совершенствования оказания медицинской помощи при фаллоидиновом синдроме.
Список литературы
Антонов Н.С. Химическое оружие на рубеже двух столетий. М.: Прогресс, 1994. С. 131.
Вишневский М.В. Ядовитые грибы России. М.: Проспект, 2019. 448 с.
Гуревич Л.С., Журкович И.К., Нездойминого Э.Л. Изучение токсинов Amanita verna (Bull.: Fr.) Vitt. и Amanita virosa (Fr.) Bertill. методом высокоэффективной жидкостной хроматографии // Микол. фитопатол. 1995. Т. 29. № 3. С. 32–39.
Зарафьянц Г.Н. Судебно-медицинская диагностика отравлений некоторыми ядовитыми грибами при летальном исходе в стационаре // Суд.-мед. экспертиза. 2016. № 1. С. 22–28.
Кнабе Г.С. Корнелий Тацит: Время. Жизнь. Книги. Серия: Научные биографии. М.: Наука, 1981. С. 172.
Малышева Е.Ф. Семейство больбитиевые. Определитель грибов России: Порядок агариковые. Вып. 2. СПб.: Нестор–история, 2018. 416 с.
Мусселиус С.Г., Рык А.А. Отравления грибами. М.: Демиург-АРТ, 2002. 310 с.
Нездойминого Э.Л. Семейство паутинниковые. Определитель грибов России: Порядок агариковые. Вып. 1. СПб.: Наука, 1996. 408 с.
Супотницкий М.В. Несостоявшаяся биологическая война. Часть I. Боги – “биотеррористы” и древние отравители // Офицеры. 2011. № 5. С. 56–61. (Цикл статей по истории биологического оружия).
Ховпачев А.А., Башарин В.А., Чепур С.В. и др. Современные представления о токсинах высших грибов: простые азотсодержащие соединения // Успехи соврем. биол. 2020. Т. 140. №4. С. 378–394.
Baumann K., Zanotti G., Faulstich H. A β-turn in α-amanitin is the most important structural feature for binding to RNA polymerase II and three monoclonal antibodies // Prot. Sci. 2008. V. 3. № 5. P. 750–756.
Bhaskaran R., Yu C. NMR spectra and restrained molecular dynamics of the mushroom toxin viroisin // Int. J. Pept. Prot. Res. 1994. V. 43. № 4. P. 393–401.
Brady L., Benedict R., Tyler V. et al. Identification of Conocybe filaris as a toxic basidiomycete // Lloydia. 1975. V. 38. № 3. P. 172–173.
Brandenburg W., Ward K. Mushroom poisoning epidemio-logy in the United States // Mycology. 2018. V. 110. № 4. P. 637–641.
Brindisi M., Maramai S., Brogi S. et al. Development of novel cyclic peptides as proapoptotic agens // Eur. J. Med. Chem. 2016. V. 117. P. 301–320.
Burt H., Riedmaier A., Harwood M. et al. Abundance of hepatic transporters in Caucasians: a meta-analysis // Drug Metab. Dispos. 2016. V. 44. P. 1550–1561.
Cai Q., Tulloss R., Tang L. et al. Multi-locus phylogeny of lethal amanitas: implications for species diversity and historical biography // BMC Evol. Biol. 2014. V. 14. № 143. 16 p.
Deng W., Li T., Xi P. et al. Peptide toxin components of Amanita exitialis basidiocarps // Mycology. 2011. V. 103. P. 946–949.
Derheimer F., O’Hagan H., Krueger H. et al. RPA and ATR link transcriptional stress to p53 // PNAS USA. 2007. V. 104. № 31. P. 12778–12783.
Falcigno L., Costantini S., D’Auria G. et al. Phalloidin synthetic analogues: structural requirements in the interaction with F–actin // Chemistry. 2001. V. 7. P. 4665–4673.
Faulstich H., Cochet–Meilhac M. Amatoxins in edible mushrooms // FEBS Lett. 1976. V. 64. № 1. P. 73–75.
Faulstich H., Buehring H., Seitz J. Physical properties and function of phallolysin // Biochemistry. 1983. V. 22. № 19. P. 4574–4580.
Faulstich H., Kirchner K., Derenzini M. Strongly enhanced toxicity of the mushroom toxin α-amanitin by an amatoxin–specific Fab or monoclonal antibody // Toxicon. 1988. V. 26. № 5. P. 491–499.
Fiume L., Sperti S., Montanaro L. et al. Amanitins do not bind to serum albumin // Lancet. 1977. V. 309. № 8021. P. 1111.
Funga Nordica: agaricoid, boletoid, clavarioid, cyphelloid and gastroid genera / Eds H. Knudsen, J. Vesterholt. Copenhagen: Nordsvamp, 2012. 1083 p.
Garcia J., Costa V., Bovolini A. et al. An effective antidotal combination of polymyxin B and methylprednisolone for α–amanitin intoxication // Arch. Toxicol. 2019. V. 93. № 5. P. 1449–1463.
Govorushko S., Rezaee R., Dumanov J. et al. Poisoning associated with the use of mushrooms: a review of the global pattern and main characteristics // Food Chem. Toxicol. 2019. V. 128. P. 267–279.
Gulden G., Dunham S., Stockman J. DNA studies in the Galerina marginata complex // Mycol. Res. 2001. V. 105. P. 432–440.
Igaz L., Vianna M., Medina J. et al. Two time periods of hippocampal mRNA synthesis are required for memory consolidation of fear-motivated learning // J. Neurosci. 2002. V. 22. № 15. P. 6781–6789.
Jaeger A., Jehl F., Flesch F. et al. Kinetics of amatoxins in human poisoning: therapeutic implications // J. Toxicol. Clin. Toxicol. 1993. V. 31. № 1. P. 63–80.
Kaplan C., Larsson K., Kornberg R. The RNA polymerase II trigger loop functions in substrate selection and is directly targeted by α-amanitin // Mol. Cell. 2008. V. 3. № 5. P. 547–556.
Kaya E., Surmen M., Yaykasli K. et al. Dermal absorption and toxicity of alpha-amanitin in mice // Cutan. Ocul. Toxicol. 2014. V. 33. № 2. P. 154–160.
Kieslichova E., Frankova S., Protus M. et al. Acute liver failure due to Amanita phalloides poisoning: therapeutic approach and outcome // Transplant. Proc. 2018. V. 50. № 1. P. 192–197.
Krasnodębski M., Grąt M., Hołówko W. et al. Results of liver transplantation in patients with acute liver failure due to Amanita phalloides and paracetamol (acetaminophen) intoxication // Gastroenterol. Rev. 2016. V. 11. № 2. P. 90–95.
Letschert K., Faulstich H., Keller D. et al. Molecular characterization and inhibition of amanitin uptake into human hepatocytes // Toxicol. Sci. 2006. V. 91. № 1. P. 140–149.
Li L., Lee T., Meier P., Ballatori N. Identification of glutathione as a driving force and leukotriene substrate for OATP1, the hepatic sinusoidal organic solute transporter // J. Biol. Chem. 1998. V. 273. № 26. P. 16184–16191.
Loranger A. Toxicity of peptides of Amanita virosa mushrooms in mice // Fund. Appl. Toxicol. 1985. V. 5. № 6. P. 1144–1152.
Lu H., Choudhuri S., Ogura K. et al. Characterization of organic anion transporting polypeptide 1b2–null mice: essential role in hepatic uptake/toxicity of phalloidin and microcystin–LR // Toxicol. Sci. 2008. V. 103. № 1. P. 35–45.
Luo H., Hallen–Adams H., Scott–Craig J., Walton J. Ribosomal biosynthesis of α-amanitin in Galerina marginata // Fung. Genet. Biol. 2012. V. 49. P. 123–129.
Luo H., Hallen–Adams H., Walton J. Processing of the phalloidin proprotein by prolyl oligopeptidase from the mushroom Conocybe albipes // J. Biol. Chem. 2009. V. 284. № 27. P. 18070–18077.
Luo H., Zhou Sh., Li X. et al. Novel cyclic peptides from lethal Amanita species through a genomic approach, and major peptide toxins in the ectomycorrhizal association: preprint (ver. 1) – Text: electronic. Research Square [website]. 2020. https://www.researchsquare.com/article/rs–14384/v1. https://doi.org/10.21203/rs.2.23821/v1
Luo H., Cai Q., Lüli Y. et al. The MSDIN family in amanitin-producing mushrooms and evolution of the prolyl oligopeptidase genes // IMA Fung. 2018. V. 9. P. 225–242.
Madhok M., Scalzo A., Blume C. et al. Amanita bisporigera ingestion: mistaken identity, dose-related toxicity, and improvement despite severe hepatotoxicity // Pediatr. Emerg. Care. 2006. V. 22. P. 177–180.
Magdalan J., Ostrowska A., Piotrowska A. et al. Failure of benzylpenicillin, N-acetylcysteine and silibinin to reduce α-amanitin hepatotoxicity // In Vivo. 2009. V. 23. № 3. P. 393–399.
Mahagita C., Grassl S., Piyachaturawat P. et al. Human organic anion transporter 1B1 and 1B3 function as bidirectional carriers and do not mediate GSH-bile acid cotransport // Am. J. Physiol. Gastr. Liv. Physiol. 2007. V. 293. № 1. P. 271–278.
Manautou J., Campion S., Aleksunes L. Regulation of hepatobiliary transporters during liver injury // Comp. Toxicol. 2010. V. 9. P. 175–220.
Matinkhoo K., Pryyma A., Todorovic M. et al. Synthesis of the death-cap mushroom toxin α-amanitin // J. Amer. Chem. Soc. 2018. V. 140. № 21. P. 6513–6517.
Montanaro N., Novello F., Stirpe F. Effect of alpha-amanitin on ribonucleic acid polymerase II of rat brain nuclei and on retention of avoidance conditioning // Biochem. J. 1971. V. 125. № 4. P. 1087–1090.
Muraoka S., Fukamachi N., Mizumoto K., Shinozawa T. Detection and identification of amanitins in the wood-rotting fungi Galerina fasciculata and Galerina helvoliceps // Appl. Environ. Microbiol. 1999. V. 65. № 9. P. 4207–4210.
Nguyen V. In vivo degradation of RNA polymerase II largest subunit triggered by alpha-amanitin // Nucl. Acids Res. 1996. V. 24. № 15. P. 2924–2929.
Oda T., Namba K., Maeda Y. Position and orientation of phalloidin in F-actin determined by X-ray fiber diffraction analysis // Biophys. J. 2005. V. 88. № 4. P. 2727–2736.
Pospich S., Merino F., Raunser S. Structural effects and functional implications of phalloidin and jasplakinolide binding to actin filaments // Structure. 2020. V. 28. № 4. P. 437–449.
Powell J., Farasyn T., Kock K. et al. Novel mechanism of impaired function of organic anion-transporting polypeptide 1B3 in human hepatocytes: post-translational regulation of OATP1B3 by protein kinase C activation // Drug Metabol. Disposit. 2014. V. 42. № 11. P. 1964–1970.
Pulman J., Childs K., Sgambelluri R. et al. Expansion and diversification of the MSDIN family of cyclic peptide genes in the poisonous agarics Amanita phalloides and A. bisporigera // BMC Genomics. 2016. V. 17. № 1038. 14 p.
Ramm S., Krawczyk B., Mühlenweg A. et al. A self-sacrificing N-methyltransferase is the precursor of the fungal natural product omphalotin // Angew. Chem. Int. Ed. Eng. 2017. V. 56. P. 9994–9997.
Rodrigues D., Pires das Neves R., Carvalho A. et al. In vitro mechanistic studies on α-amanitin and its putative antidotes: preprint – Text: electronic // Springer: Archiv. Toxicol. [website]. 2020. URL: https://link.springer.com/article/10.1007/s00204-020-02718-1#change-history.
Sgambelluri R., Smith M., Walton J. Versatility of prolyl oligopeptidase B in peptide macrocyclization // ACS Synth. Biol. 2018. V. 7. № 1. P. 145–152.
Sun J., Zhang H., Li H. et al. A case study of Lepiota brunneoincarnata poisoning with endoscopic nasobiliary drainage in Shandong, China // Toxicon. 2019. V. 161. P. 12–16.
Sun J., Zhang Y., Niu Y. et al. Effect of biliary drainage on the toxicity and toxicokinetics of Amanita exitialis in beagles // Toxins (Basel). 2018. V. 10. № 6. P. 21–25.
Thiel C., Thiel K., Klingert W. et al. The enterohepatic circulation of amanitin: kinetics and therapeutical implications // Toxicol. Lett. 2011. V. 203. № 2. P. 142–146.
Thomson M., Hines R., Schuetz E. et al. Expression patterns of organic anion transporting polypeptides 1B1 and 1B3 protein in human pediatric liver // Drug Metabol. Disposit. 2016. V. 44. № 7. P. 999–1004.
Vanyolos A., Dekany M., Kovacs B. et al. Gymnopeptides A and B, cyclic octadecapeptides from the mushroom Gymnopus fusipes // Organ. Lett. 2016. V. 18. № 11. P. 2688–2691.
Walton J. The Cyclic peptide toxins of Amanita and other poisonous mushrooms. Cham: Springer Int. Publ., 2018. 231 p.
Walton J., Hallen-Adams H., Luo H. Ribosomal biosynthesis of the cyclic peptide toxins of Amanita mushrooms // Biopolymers. 2010. V. 94. № 5. P. 659–664.
Wang X., Li Y., Zhang X. et al. Structural diversity and biological activities of the cyclodipeptides from fungi // Molecules. 2017. V. 22. № 12. 86 p.
Wei J., Wu J., Chen J. et al. Determination of cyclopeptide toxins in Amanita subpallidorosea and Amanita virosa by high-performance liquid chromatography coupled with high-resolution mass spectrometry // Toxicon. 2017. V. 133. P. 26–32.
White J., Weinstein S., De Haro L. et al. Mushroom poisoning: a proposed new clinical classification // Toxicon. 2019. V. 157. P. 53–65.
White S., Williams P., Wojcik K. et al. Initiation of apoptosis by actin cytoskeletal derangement in human airway epithelial cells // Am. J. Resp. Cell Mol. Biol. 2001. V. 24. № 3. P. 282–294.
Wieland T. The toxic peptides from Amanita mushrooms // Int. J. Pept. Prot. Res. 1983. V. 22. № 3. P. 257–276.
Wisecaver J., Slot J., Rokas A. Correction: the evolution of fungal metabolic pathways // PLoS Genet. 2015. V. 11. № 9. 11 p.
Xiang H., Zhou Y., Zhou C. et al. Investigation and analysis of Galerina sulciceps poisoning in a canteen // Clin. Toxicol. 2017. V. 56. № 5. P. 365–369.
Yilmaz I., Ermis F., Akata I. et al. A case study: what doses of Amanita phalloides and amatoxins are lethal to humans? // Wild. Environ. Med. 2015. V. 26. № 4. P. 491–496.
Zanotti G., Kobayashi N., Munekata E. et al. D-configuration of serine is crucial in maintaining the phalloidin-like conformation of viroisin // Biochem. 1999. V. 38. № 33. P. 10723–10729.
Zheleva A., Tolekova A., Zhelev M. Free radical reactions might contribute to severe alpha-amanitin hepatotoxicity – A hypothesis // Med. Hypoth. 2007. V. 69. № 2. P. 361–367.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии