Успехи современной биологии, 2022, T. 142, № 1, стр. 25-36
Многофункциональные свойства пробиотических штаммов Lactococcus lactis ssp. lactis
Е. В. Сорокина 1, И. А. Стоянов 2, А. М. Абдуллаева 2, Л. Г. Стоянова 1, *
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
Москва, Россия
2 Московский государственный университет пищевых производств
Москва, Россия
* E-mail: stoyanovamsu@mail.ru
Поступила в редакцию 06.08.2021
После доработки 17.09.2021
Принята к публикации 17.09.2021
- EDN: KPMXRP
- DOI: 10.31857/S0042132422010070
Аннотация
Проведен анализ литературы РИНЦ и Web of Science по многофункциональности полезных свойств мезофильных молочнокислых бактерий Lactococcus lactis ssp. lactis, используемых человеком на протяжении столетий при приготовлении ферментированных продуктов как способа консервации молока и пищевого сырья. Lactococcus lactis ssp. lactis могут стать ресурсом для различных биологически активных веществ – потенциальных метабиотиков, таких как: бактериоцины, органические кислоты, короткоцепочечные жирные кислоты, антиоксиданты, адгезины, нейромедиаторы. Описаны новые области их применения в качестве поставщиков биопротекторных агентов для профилактической терапии, разработки пероральных вакцин, что имеет важное значение для профилактики и борьбы с инфекциями, представляющими дополнительную опасность для пациентов в период пандемии COVID-19.
ВВЕДЕНИЕ
В третьем тысячелетии воздействие на организм человека экологически неблагоприятных факторов внешней среды, психоэмоциональных перегрузок приводит к ухудшению эпидемиологической ситуации, увеличению числа инфекционных заболеваний. Бесконтрольное применение химиотерапевтических препаратов, в том числе антибиотиков, сопровождается снижением иммунитета и увеличением количества патогенных и условно-патогенных микробов, резистентных к антибиотикам, что приводит к значительному снижению эффективности антибиотикотерапии. Количество инфекционных заболеваний, отличающихся затяжным и хроническим течением, причиной которых являются условно-патогенные микроорганизмы и различные патогены, увеличивается. 27 февраля 2017 в Женеве Всемирная Организация Здравоохранения (ВОЗ) опубликовала новый список устойчивых к антибиотикам “приоритетных патогенов”, включающий 12 семейств бактерий, которые представляют наибольшую угрозу для здоровья человека, среди них – Acinetobacter, Pseudomonas и различные бактерии сем. Enterobacteriaceae, а именно: Enterobacter spp., Serratia spp., Proteus spp., Providencia spp., Morganella spp. Это постановление ВОЗ призвано стимулировать фундаментальные исследования по борьбе с растущей глобальной устойчивостью к существующим противомикробным лекарственным средствам (News release WHO, 2017).
Ввиду этого большое значение имеет вопрос поиска новых эффективных биологически активных веществ с антибактериальным, противогрибковым и противовирусным действием, основным источником которых являются природные соединения, синтезируемые микроорганизмами. Организм взрослого человека содержит триллионы микроорганизмов, представляющих сотни видов, тысячи подвидов и вариантов штаммов (в совокупности известных как микробиом) (Шендеров и др., 1997; Prakash et al., 2011), и любые изменения в микробиоме могут сильно влиять на здоровье человека (Суворов, 2009; Воеводкина, Хайтович, 2020).
Актуальной проблемой, имеющей экономическое и социальное значение, является продление сроков годности пищевых продуктов без использования химических консервантов. Потребность пищевой промышленности, сельского хозяйства в безвредных и эффективных препаратах, защищающих продукты питания от контаминантов, растет с каждым годом. Используемые в настоящее время химические препараты и консерванты накапливаются в почве и воде, вследствие чего среди патогенных и условно-патогенных микробов – контаминантов продуктов питания и пищевого сырья растет число полирезистентных форм возбудителей не только пищевых, но и инфекционных инфекций. Продвижение идей по повышению качества пищевой продукции, рациональному потреблению пищевой продукции, как важнейшей составляющей укрепления здоровья, является задачей государственной политики РФ (Роспотребнадзор, 2020).
Lactococcus lactis ssp. lactis КАК БИОКОНСЕРВАНТЫ
Молочнокислые бактерии (МКБ) используются человеком на протяжении столетий при приготовлении ферментированных продуктов как способа увеличения сроков годности молока и другого пищевого сырья.
В производстве молочных продуктов особое значение имеет род Lactococcus, к которому относят пять видов L. garvieae, L. piscium, L. plantarum, L. raffinolactis и L. lactis. Первые исследования лактококков были проведены Джозефом Листером, который пытался доказать теорию Пастера о микробной природе брожения. Используя кипяченое молоко в качестве питательной среды, он впервые непреднамеренно выделил чистую бактериальную культуру Lactococcus lactis (Teuber, 1995).
Молочнокислое брожение, сопровождающееся понижением pH в связи с выделением молочной кислоты, является важным условием для подавления роста нежелательных микроорганизмов. Низкий pH (до 4.2) изменяет степень диссоциации органических кислот, что позволяет им проникать через клеточную мембрану, поражая, таким образом, цитоплазму патогенного микроорганизма. Ведущее место в объяснении явления антагонизма отводится специфическим антимикробным веществам белковой природы – бактериоцинам – гетерогенным антибактериальным веществам, в основном, пептидам, разнообразным по уровню активности, спектру и механизму действия, молекулярной массе и физико-химическим свойствам. Белковый компонент в структуре бактериоцинов определяет их ингибиторную активность, также они обладают быстродействующим механизмом, с помощью которого образуются поры в мембранах бактерий даже при очень низких концентрациях. Таким образом, бактериоциновые фрагменты долго не находятся в организме человека или окружающей среде, что сводит к минимуму возможность штаммов взаимодействовать с деградированными фрагментами антибиотиков: это общая отправная точка в развитии устойчивости к бактериоцинам по сравнению с обычными антибиотиками, которые являются вторичными метаболитами. Основные различия между бактериоцинами и обычными антибиотиками приведены в табл. 1 (Стоянова и др., 2012; Lactic acid …, 2012).
Таблица 1.
Основные отличия между бактериоцинами молочнокислых бактерий и антибиотиками
| Характеристика | Бактериоцины | Антибиотики |
|---|---|---|
| Синтез | Рибосомальный | Вторичные метаболиты |
| Спектр биологической активности | Узкий | Широкий |
| Диапазон активности | нМ–мкМ | мкМ–мМ |
| Деградация протеолитических ферментов | Высокая | Средняя, низкая |
| Термостабильность | Высокая | Низкая |
| Диапазон рН | Широкий | Узкий |
| Цвет/вкус/запах | Нет | Есть |
| Возможный механизм развития резистентности клетки-мишени | Адаптация путем изменения состава клеточных мембран | Возникает спонтанно, вследствие мутаций |
| Принцип действия | Образование пор, ингибирование синтеза клеточной стенки | Нарушение синтеза клеточной стенки, белка; подавление синтеза нуклеиновых кислот |
| Токсичность по отношению к эукариотическим клеткам | Относительно нетоксичны | Токсичны |
| Индукция синтеза генно-инженерными методами | Да | Нет |
Наиболее изученным бактериоцином является низин – единственный из антибиотиков с 1998 г. имеет статус “GRAS” (Generally Recognized As Safe), установленный Европейским парламентом (Council, European Parliament. Regulation …, 1997) и разрешенный для использования в пищевой промышленности (индекс Е234) как пищевая добавка и используемый в РФ (ГОСТ Р 57646-2017) (Abdullaeva et al., 2020). Препараты низина содержат 2.5% активного компонента низина с антибиотической активностью 1000 МЕ/мг (МЕ – международная единица). Продуцентами этого бактериоцина являются лактококки L. lactis ssp. lactis – стрептококки серологической группы N, которые по систематическому положению выделены из группы микроорганизмов рода Streptococcus, включающего патогенные формы, и под новым названием Lactococcus, не вызывающие инфекционных заболеваний человека и животных (Общая микробиология …, 2005; Bernbom et al., 2006).
Выявлена способность коммерческого низина с пептидным компонентом предотвращать микробное заражение обработанных им упаковок колбасных изделий при длительном хранении по сравнению с необработанной бактериоцином продукцией, что указывает на перспективность применения бактериоцина в качестве безопасного пищевого антибактериального препарата. Исследования показали эффективность использования низина для увеличения срока годности сырокопченых и вареных колбас (Abdullaeva et al., 2020). Только на 34-й день хранения количество мезофильных аэробных и факультативно-анаэробных микроорганизмов снизилось относительно нормы и составило 1.1 × 101 КОЕ/г по сравнению с 1 × 103 КОЕ/г (значение для необработанного бактериоцином продукта).
Рядом работ показана безвредность низина. Низин эффективно разлагается α-химотрипсином, присутствующим в желудочно-кишечном тракте (ЖКТ). Низин не является чужеродным веществом для пищеварительного тракта, поскольку низинобразующие лактококки были выделены из слизистой носоглотки и кала животных и людей. Установлено, что низинобразующие штаммы имеют функцию поддержания равновесия группы молочнокислых бактерий кишечного тракта человека и животных. Низин эффективен, в основном, только против грамположительных споровых бактерий и не эффективен против патогенов, относящихся к грамотрицательным бактериям и микроскопическим грибам, колонизирующим пищевые продукты при хранении, и являющихся основной причиной их порчи и вызывающих заболевания у людей (Willey, van der Donk, 2007).
Синтез бактериоцинов – наследственная особенность бактерий, проявляющаяся в том, что каждый штамм способен образовывать один или несколько определенных, строго специфичных для него антибиотических веществ. В последние годы все большее внимание уделяется поиску новых штаммов, обладающих антимикробным потенциалом. Поэтому ведется усиленный поиск продуцентов антибиотических веществ среди бактерий непатогенных для человека с широким спектром антимикробного действия.
На кафедре микробиологии МГУ им. М.В. Ломоносова проведен скрининг, идентификация бактериоцинпродуцирующих МКБ из коровьего и кобыльего молока – национальных продуктов смешанного молочнокислого и спиртового брожения (курунги, кумыса) Московского региона, Бурятии, Башкирии и Ирана (Стоянова и др., 2006). Выделено более 50 штаммов молочнокислых бактерий Lactococcus, не вызывающих инфекционные заболевания человека и животных (Общая микробиология, 2005). С использованием классических микробиологических методов и на основе анализа нуклеотидных последовательностей фрагмента гена 16S рРНК идентифицированы до вида 26 культур МКБ, обладающих антимикробным действием на патогенные микроорганизмы.
Следует отметить, что лактококки, выделенные из молочных продуктов регионов Бурятии и Ирана (штаммы 194, К-205, IR4), отличались высоким уровнем ингибиторной активности, обладали более широким спектром антибактериального действия: эффективно подавляли рост как грамположительных, так и грамотрицательных бактерий: Alcaligenes faecalis, Proteus vulgaris, Escherichia coli, Pseudomonas aeruginosa, Pseudomonas fluorescens. Эти штаммы проявляли и фунгицидное действие, подавляли рост мицелиальных грибов и дрожжей: Aspergillus niger, Penicillium chrysogenum, Fusarium oxysporum, Rhodotorula aurantiaca, Candida albicans, которые являются сапрофитной микробиотой Бурятии и Ирана. Получение новых штаммов МКБ, обладающих фунгицидной активностью, в дальнейшем будет направлено на решение проблемы порчи продуктов питания плесневыми грибами и микробами – контаминантами продуктов питания и пищевого сырья (Stoyanova et al., 2010; Crowley et al., 2019). Выделенный из молока коров из Бурятии эффективный пробиотический штамм включает антибиотический комплекс, состоящий из двух бактериоцинов (лантибиотик низина с молекулярной массой М = 3.353 кДа и пептид с М = 2.589 кДа, состоящий из 20-ти аминокислотных остатков, ингибирующий рост грамотрицательных бактерий), а также фунгицидный алкилароматический кетон, обладающий фунгицидным действием (Устюгова и др., 2011).
Среди опасных контаминантов – возбудителей болезней пищевого происхождения, связанных с потреблением недоброкачественных продуктов и создающих возможные риски для здоровья человека, являются Salmonella sрp., Campylobacter sрp., Listeria monocytogenes, Staphylococcus aureus, энтеропатогенная Escherichia coli и др. (Уша, 2017).
Полученные методом слияния протопластов родственных штаммов лактококков новые гибридные штаммы в 10–14 раз превышали активность родительских штаммов по синтезу низина, обладали ускоренным синтезом бактериоцинов при изменении спектра потребляемых углеводов и как большей, так и меньшей чувствительностью к разным группам антибиотиков (Стоянова и др., 2009).
Антимикробные комплексы, отличающиеся по молекулярной массе, значениям электрофоретической подвижности и биологическим свойствам, определены как новые антибиотики. Компоненты, содержащие альдегиды и алкилароматические кетоны, отвечали за противогрибковую активность (Стоянова и др., 2020).
Штаммы хранятся в коллекции ВКПМ ФГУП “ГосНИИгенетика” (http://www.genetika.ru/vkpm) и в коллекции микроорганизмов кафедры микробиологии биологического факультета МГУ им. М.В. Ломоносова.
ПРОБИОТИКИ НА ОСНОВЕ Lactococcus lactis ssp. lactis
Микробиота кишечника влияет на ряд биологических процессов, важных для здоровья и долголетия человека. Состав микробов изменяется в ответ на внешние факторы, такие как несбалансированное питание, недостаток физической активности, курение, условия проживания (Voigt еt al., 2014; Feng еt al., 2018).
МКБ являются постоянными обитателями ЖКТ и способны успешно конкурировать с гнилостными бактериями, обитающими в кишечнике. Они могут служить альтернативой антибиотикам при борьбе с полирезистентными штаммами – возбудителями инфекций (Trafalska, Grzybowska, 2004). Антимикробное действие этой группы бактерий используется в разной форме людьми в течение столетий в отношении специфических групп микроорганизмов, включая некоторые патогенные формы, развивающиеся в продуктах питания в процессе хранения и выделяющие энтеротоксины, что является причиной желудочно-кишечных заболеваний. И.И. Мечников обобщил разрозненные экспериментальные данные в области изучения явления антагонизма молочнокислых бактерий. Учение Мечникова о преждевременной старости человека в связи с постоянной интоксикацией организма продуктами жизнедеятельности гнилостных бактерий кишечника получило не только широкое признание, но и практическое применение (Cуворов, 2009; Stoyanova, Semenova, 2021).
В настоящее время во всем мире отмечается повышенный интерес населения и врачей к пробиотикам, а именно к их лечебному и профилактическому действию.
Впервые термин “пробиотики” был употреблен Лилли и Стилвелом (Lilly, Stilwell, 1965). Под этим подразумевались живые бактерии, которые должны были ограничить использование антибиотиков в животноводстве (Vrese, Schrezenmeir, 2008). Все последующие годы этот термин много раз уточнялся. На данный момент существует определение, принятое ВОЗ: Пробиотики – это живые микроорганизмы, применение которых в адекватных количествах оказывает оздоравливающий эффект на организм человека. Они улучшают баланс микроорганизмов в тонком кишечнике и изменяют структуру микробиоты в отделах толстого кишечника.
Важное свойство пробиотиков – это положительное действие на организм человека в целом (Hill et al., 2014). Были показаны различные эффекты пробиотиков при различных желудочно-кишечных нарушениях, включая воспалительные заболевания кишечника (ВЗК), синдром раздраженного кишечника (СРК), вагинальные инфекции и снижение иммунитета. Также некоторые пробиотики были исследованы в отношении эффекта при атопической экземе (Makrgeorgou et al., 2018), ревматоидном артрите (Mohammed et al., 2017) и циррозе печени (Pereg et al., 2011). Имеются клинические доказательства роли пробиотиков в снижении уровня холестерина (Albano et al., 2018). Установлено, что у низинобразующих штаммов есть функция поддержания экологического равновесия группы молочнокислых бактерий ЖКТ человека и животных (Eckburg et al., 2005; Kimoto-Niro et al., 2007).
Молочнокислое брожение – процесс анаэробного окисления углеводов, в частности лактозы, конечным продуктом которого является молочная кислота. Процесс протекает под действием МКБ, подразделяющихся на гомоферментативные, которые сбраживают углеводы с образованием до 90% молочной кислоты, и гетероферментативные, которые при брожении образуют половину или меньше лактата. При этом из глюкозы кроме молочной кислоты образуется ацетат, диоксид углерода, иногда этанол.
Лактазная недостаточность (ЛН) – это наиболее часто встречаемая форма нарушения метаболизма лактозы, которая наблюдается почти у 4 млрд чел. во всем мире. Превалирующая актуальность ЛН у детей раннего возраста обусловлена тем, что молоко является для них основным продуктом питания (Bhatnagar, Aggarwal, 2007). Проблема неусвояемости молочного сахара в нашей стране распространена повсеместно. В последние десятилетия появилась тенденция к ухудшению ситуации. По оценкам ученых каждый третий имеет дефицит фермента лактазы, отвечающего за расщепление сахара из молока. У большинства эта проблема проявляется довольно слабо или периодически (Di Costanzo et al., 2018). Это свойство является аргументом для использования лактококков L. lactis ssp. lactis, поскольку в результате молочнокислого брожения лактоза, трудно усвояемая людьми с лактазной недостаточностью, превращается в легко доступную для ЖКТ молочную кислоту, что сочетается с кислотным гидролизом трудноусвояемой молекулы основного белка молока – казеина, и тем самым повышается польза важного продукта питания, каким является молоко (Savaiano, 2014).
У мезофильных L. lactis ssp. lactis есть ряд преимуществ по сравнению с другими МКБ, например, лактобациллами и бифидобактериями, наиболее распространенными пробиотиками. Если экспонента кривой роста у лактобацилл и бифидобактерий наступает через 2–3 сут, то у лактококков – к 6–10 ч. Лактококки не имеют вирулентных форм, у L. lactis ssp. lactis установлен статус “GRAS”, что означает: в целом признаны безопасными.
В последние годы возрос интерес к аутологичным штаммам микроорганизмов – представителям протективной микробиоты, из которых состоят аутопробиотики (собственные пробиотики для жизни и здоровья). Аутопробиотик получают из собственных (аутопробиотических) бактерий – обитателей ЖКТ конкретного пациента, и предназначены они для коррекции его микробиоты (Ильин и др., 2013).
Расширяется спектр применения пробиотиков как одного из методов коррекции микробиоты человека и животных, это влечет за собой увеличение спектра задач и проблем, которые они могли бы решить (Trush et al., 2020). Вследствие устойчивости бактерий к антибиотикам из-за их широкого применения в лечении болезней человека и животных, проблема поиска новых антимикробных препаратов более значима для медицины (Yoneyama, Katsumata, 2006).
В процессе отбора микроорганизма важно правильно определить его таксономическую принадлежность, так как правильная идентификация штамма на видовом уровне важна для оценки его безопасности, условий роста и метаболических характеристик. Это играет важную роль при производстве коммерческих пробиотических препаратов, так как влияет на их потенциальную эффективность, безопасность и, следовательно, на доверие потребителей (Осипова, 2013). Под понятием “безопасность” подразумевают, прежде всего, наличие или отсутствие факторов патогенности у данного штамма, которое можно определить с помощью метода полимеразной цепной реакции (ПЦР). Отсюда появляются критерии отбора микроорганизмов, входящих в состав пробиотических препаратов (Kalliomäki et al., 2008). Исследования микробиома человека показывают, что для разработки пробиотических агентов необходимо выбирать штаммы бактерий, обладающие особыми свойствами, такими как: способность клеток прикрепляться к стенкам кишечника, устойчивость к желчи и кислотам, синтез бактериоцинов, антиоксидантная активность и выживаемость в кишечнике (Klimko et al., 2020). Одним из наиболее перспективных направлений является использование про-, пре- и синбиотиков, терапевтическое действие которых многократно доказано научными исследованиями, а также выделение новых пробиотических штаммов МКБ из продуктов функционального питания. Это означает, что сбалансированное или несбалансированное питание всегда приводит к структурному или функциональному изменению состава микробиома, имеющего значительные последствия для здоровья человека. Накопленные в области нутрициологии и микробиологии данные также свидетельствуют о штаммоспецифичности благоприятного воздействия пробиотиков на здоровье человека (Norris et al., 2013). Наибольшее воздействие на здоровье и поведение человека оказывает весь бактериальный ансамбль кишечника, а не отдельные его виды. Кроме того, уже известны некоторые молекулярные механизмы этого воздействия и бактерии, ответственные за его контроль, от метаболического синдрома до сердечно-сосудистых заболеваний, рака и проявления тревожного/депрессивного поведения и аутизма. Результаты многочисленных исследований кишечной микробиоты при различных заболеваниях человека, в этиологии или прогрессировании которых она задействована, отмечаются выраженные различия между структурой микробиоты у здоровых людей и при метаболических, иммунных, воспалительных заболеваниях (Voigt et al., 2014).
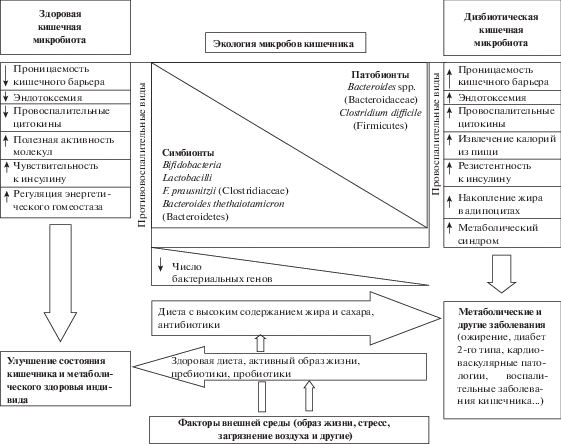
Влияние дисбиотической кишечной микробиоты на кишечник и инициацию функциональных нарушений и здоровья человека представлено на рис. 1. Сдвиг в сторону дисбиоза вызывается уменьшением числа симбионтов и/или увеличением патогенных микробов, что провоцируется влиянием внешних факторов (диеты, стресса, антибиотиков, инфекций). Низкое число генов также ассоциируется с измененными функциями кишечных микробов, дисбиозом и связано с воспалением, с резистентностью к инсулину, ожирением и метаболическим синдромом. Больные с такими характеристиками кишечной микробиоты в большей мере подвержены метаболическим болезням (Le Chatelier et al., 2013).
L. lactis ssp. lactis КАК ПСИХОБИОТИКИ
Симбиотическая микробиота ЖКТ выполняет жизненно важные функции в связи с усвоением труднодоступных компонентов пищи, снабжением организма важными витаминами, кофакторами, нейро- и иммуноактивными соединениями, поддержанием активности иммунной системы и сохранением нормобиоты. Если нормальное функционирование микробиоты есть предпосылка физического и психического здоровья, то ее нарушение (дисбиоз) с угнетением полезной микробиоты угрожает доминированием потенциально болезнетворной микробиоты и развитием как желудочно-кишечных расстройств, так и заболеваний различных систем и органов, включая головной мозг, депрессии и др. (Oleskin, Shenderov, 2019).
Психобиотики – это группа пробиотиков, опосредованных осью кишечник–мозг, которые влияют на центральную нервную систему через иммунные, гуморальные, нервные и метаболические пути для улучшения не только функции ЖКТ, но также действующие как антидепрессанты и обладающие анксиолитической способностью (Cheng et al., 2019).
Физическое и психическое здоровье человека связано с пищевыми привычками и здоровьем мозга. Гипоталамус – это область мозга, которая инициирует реакцию на различные типы стресса. Недавние открытия показали, что еда играет важную роль в регулировании стресса и психического здоровья, в связи с этим пробиотики можно считать полезными микробами, но приносящими пользу для здоровья при употреблении в достаточных количествах (Benton, 2007).
Проведенные исследования показали, что потребление пробиотических продуктов улучшает когнитивные способности in vitro и in vivo, а в доклинических испытаниях на людях-добровольцах было установлено, что улучшаются функции мозга, управления стрессом и принятия решений (Bhagavathi et al., 2019).
Штаммы L. lactis ssp. lactis, часто используемые как заквасочные культуры при приготовлении продуктов функционального назначения, выделяют в среду нейроактивные вещества, такие как дофамин, норадреналин, адреналин и серотонин, влияющие на функции памяти, обучения, формирования эмоций, участвующие в регуляции эндокринной системы (Benton, 2007; Vodolazov et al., 2018).
Данные нейроактивные вещества способны усиливать антимикробную функцию некоторых штаммов L. lactis ssp. lactis и, скорее всего, выполняют функции внутри микробного сообщества организма хозяина, включая ЖКТ. Стресс влияет на моторику кишечника через ось кишечник–мозг, что может изменять профиль кишечной микробиоты, уменьшая количество потенциально полезных МКБ и приводя к значительным изменениям в структуре микробного сообщества в слепой кишке, снижая количество Bacteroides и повышая содержание Clostridium. У пациентов с аутизмом, например, наиболее частым компонентом кишечной микробиоты по сравнению со здоровыми людьми является вид Desulfovibrio (Bhagavathi et al., 2019).
Пробиотические микроорганизмы, которые продуцируют тестируемые биогенные амины, могут использоваться в качестве целевых функциональных продуктов питания в профилактических и терапевтических целях. В нервной системе пептиды преимущественно функционируют как нейромодуляторы: они увеличивают/уменьшают эффективность передачи сигнала по синапсам, работа которых зависит от других нейротрансмиттеров. Например, опиоиды (эндорфины, энкефалины и динофины) связываются с конкретными рецепторами нейронов и блокируют передачу импульсов вдоль аксонов нейронов, в том числе тех, которые участвуют в восприятии боли (Олескин, Шендеров, 2020). Наиболее вероятно, что внутриклеточное накопление нейромедиаторных аминов, ДОФА и продуктов дезаминирования аминов есть результат комбинированного действия двух процессов: 1) внутриклеточного биосинтеза этих соединений и 2) экзогенного потребления (Kitaoka et al., 2014; Oleskin, Shenderov, 2019; Sorokina et al., 2019). Эти вещества используются как сигнальные молекулы внутри микробного консорциума и в то же время влияют на весь организм хозяина, особенно на нервную, эндокринную и иммунную системы.
L. lactis ssp. lactis КАК МЕТАБИОТИКИ
Микробиота кишечника включает в себя разнообразное сообщество бактерий, которые выполняют различные функции, влияя на общее состояние здоровья хозяина. Они включают метаболизм питательных веществ, регуляцию иммунной системы и естественную защиту от инфекции (Clarke et al., 2014). Структурные компоненты пробиотических микроорганизмов и/или их метаболиты, включая антимикробные молекулы (бактериоцины), органические и короткоцепочечные жирные кислоты, биогенные поверхностно-активные вещества, белки, ферменты, витамины, антиоксиданты и другие молекулы с известной химической структурой, которые могут оптимизировать специфические физиологические функции, метаболические реакции, связанные с деятельностью макроорганизма и его микробиоты, объединены общим понятием – метабиотики (Устюгова и др., 2012; Шендеров, 2017). Согласно последним исследованиям, есть все основания полагать, что возможности лактобактерий как продуцентов биологически активных веществ далеко не исчерпаны.
Короткоцепочечные жирные кислоты являются важнейшими регуляторами углеводного, липидного и энергетического метаболизма в ЖКТ, печени и в других органах (Шендеров, 2013).
Высокой антиоксидантной активностью (по уровню супероксиддисмутазы) обладали природный штамм L. lactis ssp. lactis К-205, выделенный из курунги (20.79 ед./мг белка), и рекомбинантный штамм L. lactis ssp. lactis F-116, полученный слиянием протопластов (30 ед./мг белка). Данные микроорганизмы способны снижать уровень свободных радикалов и тем самым могут участвовать в борьбе с преждевременным старением (Virtanen, 2007; Stoyanova et al., 2016). Это обеспечивается действием синтезируемых микроорганизмами органических и короткоцепочечных жирных кислот, а также антибиотикоподобных веществ.
Биологически активные пептиды от 20 до 50 аминокислотных остатков могут обладать антимикробным, антиоксидантным, антитромботическим, антигипертензивным, иммуномодулирующим действием и антипролиферативной активностью, влияя на основные системы организма, а именно сердечно-сосудистую, пищеварительную, эндокринную, иммунную и нервную системы (Erdmann et al., 2008; Hill et al., 2014; Feng et al., 2018). При отмирании бактериоцинпродуцирующих бактерий в ЖКТ накапливаются метаболиты, оказывающие антибиотическое действие, аналогичное действию живых культур. Поэтому сегодня иммунологи рассматривают применение именно бактериальных лизатов как очень перспективное направление повышения антиинфекционного и противовирусного иммунитета и лечения вторичных иммунодефицитов.
Метабиотики в сравнении с пробиотиками имеют более длительный период сохранности, четкие мишени приложения, их лучше дозировать, они лучше метаболизируются, распределяются по организму, тканям и органам, быстрее и в большей степени элиминируются из организма (Sharma, Shukla, 2016). Применение метабиотиков позволяет создать управляемый микробиоценоз кишечника, поскольку метаболические, сигнальные и другие функции представителей эндогенной микробиоты имеют большее значение, чем количественное содержание в биотопе микроорганизмов тех или иных видов. Следовательно, пробиотики и их биологически активные вещества (метабиотики) следует учитывать для контроля эпигенетических явлений, чтобы исключить их возможные побочные эффекты (Шигина, Самоткина, 2018; Benton, 2007).
Хотя лактококки известны и целенаправленно используются уже давно, они все еще обладают большим потенциалом для исследований. Способность к накоплению биологически активных веществ различна и зависит от видовой/штаммовой принадлежности, а также проявляется в определенных условиях культивирования. Это определяет целесообразность конструирования консорциума микроорганизмов, включающих в свой состав бактерии с разным механизмом биологической активности. Определены уникальные свойства лактококков, их ингибирующее действие на бактериях и грибах, отсутствие токсичности и наличие адгезивных свойств. Это позволяет рекомендовать их для применения в составе комплексной антибиотикотерапии в борьбе с полирезистентными штаммами госпитальных инфекций, тем самым способствовать в борьбе с затяжными инфекциями (Стоянова, Габриэлян, 2017).
АЛЬТЕРНАТИВА ВАКЦИНАМ В БОРЬБЕ С ВИРУСАМИ
Вирусные инфекции, передающиеся от животных к людям, могут быть чрезвычайно опасны. В случае таких новых вирусов, как SARS-CoV2, доступные лекарства и вакцины не всегда могут противостоять агрессивности вируса. Поскольку циркулирующие штаммы SARS-CoV-2 продолжают мутировать, и иммунизацию необходимо проводить в течение ограниченного времени, это создает трудности в создании и усовершенствовании эффективных вакцин.
Можно предположить, что первое поколение вакцин COVID-19 должно быть позже заменено новыми вакцинами, позволяющими преодолеть ограничения, связанные с необходимостью генерировать не только гуморальный, но и клеточный иммунитет против SARS-CoV-2 и индуцировать защитный иммунитет на поверхностях слизистых оболочек, где этот вирус инициирует свою репликацию.
В работе Манна с соавт. (Manna et al., 2021) показано, что можно применять пробиотики для профилактики вирусных инфекций. Кроме того, были исследованы липопептиды, полученные из пробиотических микроорганизмов. Среди хорошо охарактеризованных липопептидов, полученных из различных пробиотических штаммов, известен лактококцин из Lactococcus lactis, который был использован в исследовании для демонстрации более высокой склонности связывания S-белка, SARS-CoV-2 и ACE2 человека. Результаты исследования выявили способность липопептидов, обусловленную их амфифильной природой (как и бактериоцина низина, продуцируемого штаммами Lactococcus lactis ssp. lactis (Устюгова и др., 2011)), связывать спайковый белок и рецепторную молекулу, которые могут конкурентно ингибировать обязательное взаимодействие SARS-CoV-2 с рецепторами эпителиальных клеток хозяина при его проникновении в клетку для размножения (Manna et al., 2021).
Доктор Веллс с соавт. (Wells et al., 2011) обнаружили, что иммунизация организма вакциной, содержащей рекомбинантные L. lactis, при нанесении на слизистые оболочки, внутриклеточно продуцирующие пневмококковый поверхностный протеин А (PspA), может стать эффективной альтернативой инъекционной белковой вакцине.
Исследователи интраназально иммунизировали мышей лактококковой вакциной, а контрольные мыши получили соответствующее количество очищенного рекомбинантного Psp. Установлено, что лактококковая вакцина обеспечивала лучшую защиту от респираторной пневмококковой инфекции, чем вакцинация очищенным антигеном. Причем, при внутрибрюшинной модели сепсиса лактококковая назальная вакцина обеспечивала защиту от инфекции наравне с инъекционной вакциной, что подтверждает ее эффективность против различных форм заболеваний, вызванных пневмококками (Villena et al., 2011).
Для модуляции и стимуляции иммунного ответа и уменьшения тяжести симптомов COVID-19 рекомендуется исследовать нутрицевтики (Di Stadio et al., 2020). Нутрицевтики безопасны и могут быть назначены людям любого возраста. Кроме того, комбинация природных противовирусных веществ и иммуностимулирующих молекул, уже успешно протестированных против других инфекций верхних дыхательных путей, могут быть эффективны и против SARS-CoV2. Считается, что эти природные молекулы действительно могут быть союзником против COVID-19.
Важно подчеркнуть возможность использования вакцин на основе молочнокислых бактерий и предложить действенную альтернативу в борьбе с этим заболеванием. МКБ были предложены в качестве векторов доставки и защиты слизистой оболочки ЖКТ еще в 2010 г. против пневмококковых респираторных инфекций. Эти исследования позволили предположить, что использование рекомбинантных вакцин на основе МКБ представляют собой хороший краткосрочный вариант борьбы с пневмококковыми заболеваниями (Medina et al., 2010; Villena et al., 2011).
В последние десятилетия такие рекомбинантные вакцины были испытаны в качестве вакцин на основе вирусных векторов и способности модулировать как врожденные, так и адаптивные иммунные реакции кишечника. В этом смысле Lactococcus lactis и Lactobacillus являются хорошими кандидатами для разработки пероральных вакцин, так как они устойчивы к стрессовым условиям ЖКТ, благотворно модулируют иммунные реакции не только локально (слизистая кишечника), но и в отдаленных от кишечника слизистых оболочках (слизистая дыхательных путей). Показано, что механизмы, участвующие в противовирусной защите слизистых оболочек с помощью штаммов МКБ, способны индуцировать защитные иммунные реакции в кишечнике и в дыхательных путях после их перорального введения, что указывает на возможность их использования при разработке вакцины COVID-19 (Manna et al., 2021).
Пептиды, полученные из пробиотиков и их иммуномодулирующие молекулы, могут играть профилактическую роль против вирусных заболеваний, включая и COVID-19. Молочнокислые бактерии можно использовать как систему доставки пероральных вакцин SARS-CoV-2, и все эти подходы очень актуальны (Di Stadio et al., 2020; Sounik at al., 2021).
Следовательно, в существующей ситуации пандемии применение пробиотиков и использование вакцин на основе МКБ, наряду с другими способами лечения и вакцинацией, может помочь добиться существенного улучшения здоровья пациентов с COVID-19. Кроме того профилактическое использование пробиотиков может способствовать укреплению иммунной защиты у людей, чтобы избежать заражения COVID-19.
ЗАКЛЮЧЕНИЕ
Согласно доктрине продовольственной безопасности РФ, как приоритетной в развитии страны, выделено направление – улучшение состояния здоровья всех возрастных групп населения за счет высокого качества и безопасности потребляемых продуктов питания. В связи с этим необходимо осуществить ряд мер по внедрению прогрессивных технологий и увеличению объемов производства продуктов здорового питания на основе натуральных компонентов (“Доктрина продовольственной безопасности Российской Федерации” № 120 утверждена указом Президента РФ от 30.01.2010 г.). Наука о микробиоме позволяет на современном уровне знаний изучать биологические процессы, состав метаболитов и функционирование организма как в норме, так и при патологии.
Бактериоцинобразующие штаммы L. lactis ssp. lactis перспективны, что позволяет их рекомендовать для использования в качестве пробиотиков (Олескин, Шендеров, 2019; Стоянова и др., 2020).
Литературные данные и результаты предшествующих исследований свидетельствуют о важной роли взаимодействий метаболитов пробиотических культур: продуктов расщепления белков, углеводов, в частности лактозы, бактериоцинов пептидной природы, антиоксидантов, соединений, функционирующих как нейромедиаторы и нейрогормоны, включая биогенные амины и нейроактивные аминокислоты и др. Эти вещества используются как сигнальные молекулы внутри микробного консорциума.
Перспективные МКБ изучены как пробиотические культуры, которые устойчивы к неблагоприятной среде верхних отделов пищеварительного тракта. Это позволяет им достигать толстой кишки, где, в основном, реализуется их полезный эффект. В частности, эти бактерии могут подавлять размножение вредных гнилостных и патогенных бактерий, а также вытеснять патогены – возбудители кишечных и нозокомиальных инфекций, часто полирезистентных к широко используемым антибиотикам (Стоянова, Габриэлян, 2017).
Антибиотики и пробиотики сегодня не должны рассматриваться как несовместимые группы лечебных препаратов или антагонисты. Их совместное рациональное использование создает предпосылку для достижения максимального результата в широком спектре клинических ситуаций.
В заключение отметим, что приведенные обобщения роли пробиотиков для здоровья человека хорошо вписываются в проблему экологии человека, в том числе эндоэкологии. Данная статья привлечет к этому направлению еще большее внимание ученых и клиницистов, что позволит углубить разработку превентивных мероприятий по отношению к дисбиозу кишечной микробиоты, значимость которых для здоровья человека трудно пeреоценить. Подобные исследования расширяют границы понимания феномена здоровья человека в аспекте эндоэкологии и открывают перспективы развития биотерапии. Мировые и отечественные данные свидетельствуют о более высокой смертности пациентов с сопутствующими хроническими заболеваниями и иммунодефицитом вследствие COVID-19.
Следовательно, изучаемые штаммы L. lactis ssp. lactis обладают многофункциональными свойствами, полезными для здоровья человека. Они являются перспективными в комплексной антибиотикотерапии при лечении заболеваний, отличающихся затяжным течением, с иммунодефицитом и для создания про-, пре-, син- и метабиотиков, вакцин, а также профилактических препаратов – биологически активных добавок, необходимых для применения в пищевой промышленности и в медицине. Увеличение числа публикаций по исследованию и разработке биологических консервантов, пробиотиков, вакцин свидетельствуют об актуальности данной научной проблемы и несет большую социальную и экономическую значимость для оздоровления человека.
Список литературы
Воеводкина А.Ю., Хайтович А.Б. Микробиом и его влияние на здоровье человека // Актуальная медицина. 2018. С. 283–289.
ГОСТ Р 57646-2017. Продукция микробиологическая. Добавка пищевая низин. Технические условия. Москва: Стандартинформ, 2017. 18 с.
Доктрина продовольственной безопасности Российской Федерации" от 30.01.2010 №120 // Информационно-правовой портал Гарант.ру: официальный сайт. 2021. URL: http://www.garant.ru/products/ipo/prime/doc/73338425/
Ильин В.К., Суворов А.Н., Кирюхина Н.В. и др. Аутопробиотики как средство профилактики инфекционно-воспалительных заболеваний у человека в искусственной среде обитания // Вестн. РАМН. 2013. № 2. С. 56–62.
Общая микробиология: Прокариоты. Т. 1 / Ред. Й. Ленгелер, Г. Древс, Г. Шлегель. М.: Мир. 2005. 656 с.
Олескин А.В., Шендеров Б.А. Пробиотики, психобиотики и метабиотики: проблемы и перспективы // Физ. реабилитац. мед., мед. реабилитац. 2020. Т. 2. №. 3. С. 233–243.
Осипова И.Г. К вопросу разработки стандартов качества на иммунобиологические лекарственные средства – пробиотики // Вед. НЦ экспертизы средств мед. прим. 2013. № 3. С. 55–57.
Роспотребнадзор. Продвижения идей по повышению качества пищевой продукции, рационального потребления пищевой продукции, как важнейшей составляющей укрепления здоровья. 2020. URL: https://zpp.rospotrebnadzor.ru/info/stat/202831.
Стоянова Л.Г., Габриэлян Н.И. Перспективность использования пробиотических штаммов Lactococcus lactis ssp. lactis при лечении госпитальных инфекций // Журн. инфектол. 2017. Т. 4. № 8. С.18–24.
Стоянова Л.Г., Сультимова Т.Д., Ботина С.Г., Нетрусов А.И. Выделение и идентификация бактериоцинпродуцирующих штаммов Lactococcus lactis subsp. lactis из свежего молока // Прикл. биохим. микробиол. 2006. Т. 42. № 5. С. 560–568.
Стоянова Л.Г., Сорокина Е.В., Дбар С.Д. Скрининг перспективных штаммов Lactococcus lactis subsp. lactis для создания нетоксичных антимикотиков // Пробл. мед. микол. 2020. Т. 12. № 4. С. 25–32.
Стоянова Л.Г., Устюгова Е. А., Нетрусов А. И. Антимикробные метаболиты молочнокислых бактерий: разнообразие и свойства (обзор) // Прикл. биохим. микробиол. 2012. Т. 48. № 3. С. 259–275.
Стоянова Л.Г., Федорова Г.Б., Егоров Н.С. и др. Штамм Lactococcus lactis subsp. lactis F-119 – продуцент антибиотического комплекса LGS и способ получения антибиотического комплекса с его использованием. Патент № 2374320. Бюл. изобретений. Полезные модели. 2009. № 33.
Суворов А.Н. Полезные микробы – кто они? // Природа. 2009. Т. 7. № 1127. С. 21–30.
Устюгова Е.А., Федорова Г.Б., Катруха Г.С., Стоянова Л.Г. Изучение антибиотического комплекса, образуемого Latococcus lactis subsp. lactis 194, вариант-К // Микробиология. 2011. Т. 80. № 5. С. 644–650.
Устюгова Е.А., Тимофеева А.В., Стоянова Л.Г. и др. Характеристика и идентификация бактериоцинов, образуемых Lactococcus lactis subsp. lactis 194-K // Прикл. биохим. микробиол. 2012. Т. 48. № 6. С. 618–625.
Уша Б.В. Основа пищевой и биологической безопасности. Хранение и переработка сельхозсырья // Ветеринария. 2017. № 4. С. 42–44.
Шендеров Б.А., Манвелова М.А., Степанчук Ю.Б., Скиба Н.Э. Пробиотики и функциональное питание // Антибиотики и химиотерапия. 1997. Т. 42. № 7. С. 30–34.
Шендеров Б.А. Мишени и эффекты короткоцепочечных жирных кислот // Соврем. мед. наука. 2013. № 1–2. С. 21–50.
Шендеров Б.А. Метабиотики – новая технология профилактики заболеваний, связанных с микроэкологическим дисбалансом человека // Вестн. восстан. мед. 2017. Т. 4. №. 80. С. 40–49.
Шигина Е.С., Самотокина В.Н. Современные методы микробиологического исследования молочных продуктов // Мат. Междунар. науч.-практ. конф. “Актуальные подходы и направления научных исследований XXI века” / Теоретико-практическая конференция “Актуальные подходы и направления научных исследований XXI века”. Кишинев, 2018. С. 37–43.
Abdullaeva A.M. Blinkova L.P., Usha B.V. et al. Bacteriophages and bactericins as anti-contaminants of chicken meat products // J. Hyg. Engin. Design. Macedonia. 2020. V. 33. P. 28–33.
Albano C., Morandi S., Silvetti T. et al. Lactic acid bacteria with cholesterol-lowering properties for dairy applications: in vitro and in situ activity // J. Dairy Sci. 2018. V. 101 № 12. P. 10807–10818. https://doi.org/10.3168/jds.2018-15096
Benton D., Williams C., Brown A. Impact of consuming a milk drink containing a probiotic on mood and cognition // Eur. J. Clin. Nutr. 2007. V. 61 № 3. P. 355–361.
Bernbom N., Licht T.R., Brogren C.H. et al. Effects of Lactococcus lactis on composition of intestinal microbiota: role of nisin // Appl. Environ. Microbiol. 2006. V. 72 № 1. P. 239–244. https://doi.org/10.1128/AEM.72.1.239-244.2006
Bhagavathi S., Sivamaruthi M.I., Periyanaina K. et al. Probiotics in human mental health and diseases – a minireview // Trop. J. Pharm. Res. 2019. V. 18. № 4. P. 889–895.
Bhatnagar S., Aggarwal R. Lactose intolerance // Br. Med. J. 2007. V. 334. № 7608. P. 1331–1332.
Cheng L.H., Liu Y.W., Wu C.C. et al. Psychobiotics in mental health, neurodegenerative and neurodevelopmental disorders // J. Food Drug Anal. 2019. V. 27. № 3. P. 632–648.
Clarke S.F., Murfy E.F., O’Sullivan O. et al. Exercise and associated dietary extremes impact on gut mirobial diversity // Gut. 2014. V. 63. P. 1913–1920.
Council, European Parliament. Regulation (EC) № 258/97 of the European Parliament and of the Council of 27 Jan. 1997 concerning novel foods and novel food ingredients // Official J. 1997. L43. 14.2.97. P. 1–7.
Crowley J., Ball L., Hiddink G.J. Nutrition in medical education: a systematic review // Lancet Planet Health. 2019. V. 3. № 9. P. e379–e389.https://doi.org/10.1016/S2542-5196(19)30171-8
Di Costanzo M., Berni Canani R. Lactose intolerance: common misunderstandings // Ann. Nutr. Metab. 2018. V. 73. № 4. P. 30–37. https://doi.org/10.1159/000493669
Di Stadio A., Ishai R., Gambacorta V. et al. Nutraceuticals as immune-stimulating therapy to fight COVID-19. Combination of elements to improve the efficacy // Eur. Rev. Med. Pharmacol. Sci. 2020. V. 24 № 17. P. 9182–9187. https://doi.org/10.26355/eurrev_202009_22869
Eckburg P.B., Bik E.M., Bernstein C.N. et al. Diversity of the human intestinal microbial flora // Scince. 2005. V. 308. № 5728. P. 1635–1638.
Erdmann K., Cheung B.W.Y., Schröder H. The possible roles of food-derived bioactive peptides in reducing the risk of cardiovascular disease // J. Nutr. Biochem. 2008. V. 19. P. 643–654.
Feng Q., Chen W.D., Wang Y.D. Gut microbiota: an essential moderator of health and disease // Front Microbiol. 2018. V. 21. № 9. P. 15. https://doi.org/10.3389/fmicb.2018.00151
Hill C., Guarner F., Reid G. et al. Expert consensus document: the International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic // Nat. Rev. Gastroenterol. Hepatol. 2014. V. 11. № 8. P. 506–514. https://doi.org/10.1038/nrgastro.2014.66
Kalliomäki M., Salminen S., Isolauri E. Positive interactions with the microbiota: probiotics // Adv. Exp. Med. Biol. 2008. № 635. P. 57–66. https://doi.org/10.1007/978-0-387-09550-9_5
Kimoto-Nira H., Suzuki C., Kobayashi M. et al. Anti-ageing effect of a lactococcal strain: analysis using senescence-accelerated mice // Br. J. Nutr. 2007. V. 98. № 9. P. 1178–1186.
Kitaoka K., Uchida K., Okamoto N. et al. Fermented ginseng improves the first-night effect in humans // Sleep. 2009. V. 32. № 3. P. 413–421.
Klimko A.I., Cherdyntseva T.A., Brioukhanov A.L. et al. In vitro evaluation of probiotic potential of selected lactic acid bacteria strains // Prob. Antimicrob. Prot. 2020. V. 12. № 3. P. 1139–1148.
Lactic acid bacteria: microbiological and functional aspects. Fourth edition / Eds S. Lahtinen, A. Ouwehand, S. Salminen, A. von Wright. Boca Raton, FL, USA: CRC Press, 2012. 798 p. https://doi.org/10.1201/b11503
Le Chatelier E., Nielsen T., Qin J. et al. Rihness of human gut microbiome correlates with metabolic markers // Nature. 2013. V. 29. № 500. P. 541–546. https://doi.org/10.1038/nature12506
Lilly D.M., Stillwell R.H. Probiotics: growth-promoting factors produced by microorganisms // Science. V. 147. № 3659. 1965. P. 747–748.
Makrgeorgou A., Leonardi-Bee J., Bath-Hextall F.J. et al. Probiotics for treating eczema // Cochrane Database Syst. Rev. 2018. V. 21. № 11. CD006135. https://doi.org/10.1002/14651858
Manna S., Chowdhury T., Chakraborty R., Mandal S.M. Probiotics-derived peptides and their immunomodulatory molecules can play a preventive role against viral diseases including COVID-19 // Prob. Antimicrob. Prot. 2021. V. 13. № 3. P. 611–623. https://doi.org/10.1007/s12602-020-09727-7
Medina M., Vintini E., Villena J. et al. Lactococcus lactis as an adjuvant and delivery vehicle of antigens against pneumococcal respiratory infections // Bioeng. Bugs. 2010. V. 1. № 5. P. 313–325. https://doi.org/10.4161/bbug.1.5.12086
Mohammed A.T., Khattab M., Ahmed A.M. et al. The therapeutic effect of probiotics on rheumatoid arthritis: a systematic review and meta-analysis of randomized control trials // Clin. Rheumatol. 2017. V. 36. № 12. P. 2697–2707. https://doi.org/10.1007/s10067-017-3814-3
News release. WHO publishes list of bacteria for which new antibiotics are urgently needed. GENEVA. 27 February 2017.
Norris V., Molina Gewirtz A.T. Hypothesis: bacteria control host appetites // J. Bateriol. 2013. V. 195. № 3. P. 411–416. https://doi.org/10.1128/JB.01384-12
Oleskin A.V., Shenderov B.A. Probiotics and psychobiotics: the role of microbial neurochemicals // Prob. Antimicrob. Prot. 2019. V. 11. № 4. P. 1071–1085.
Pereg D., Kotliroff A., Gadoth N. et al. Probiotics for patients with compensated liver cirrhosis: a double-blind placebo-controlled study // Nutrition. 2011. V. 27. № 2. P. 177–181. https://doi.org/10.1016/j.nut.2010.01.006
Prakash S., Rodes L., Coussa-Charley M. et al. Gut microbiota: next frontier in understanding human health and development of biotherapeutics // Biologics. 2011. № 5. P. 71–86.
Savaiano D.A. Lactose digestion from yogurt: mechanism and relevance // Am. J. Clin. Nutr. 2014. V. 99. № 5. P. 1251–1255. https://doi.org/10.3945/ajcn.113.073023
Sharma M., Shukla G. Metabiotics: one step ahead of probiotics; an insight into mechanisms involved in anticancerous effect in colorectal cancer // Front. Microbiol. 2016. V. 2. № 7. P. 1940. https://doi.org/10.3389/fmicb.2016.01940
Sorokina E.V., Vodolazov I.R., Oleskin A.V. Stimulatory and toxic effects of neurotransmitters on the lux operon-dependent bioluminescence of Escherichia coli K12 TGI // J. Pharm. Nutr. Sci. 2019. V. 9, № 3. P. 136–143.
Sounik M., Trinath C., Ranadhir C., Santi M. Mandal. Probiotics-derived peptides and their immunomodulatory molecules can play a preventive role against viral diseases including COVID-19 // Prob. Antimicrob. Prot. 2021. V 13. P. 611–623.
Stoyanova L.G., Semenova H.V. Improving training in food microbiology // J. Hyg. Engin. Design. 2021. V. 33. №12. P. 169–175.
Stoyanova L.G., Napalkova M.V., Netrusov A.I. The creating a new biopreservative based on fusant strain Lactococcus lactis ssp. lactis F-116 for food quality and its safety // J. Hyg. Engin. Design. 2016. V. 16. P. 19–27.
Stoyanova L.G., Sultimova T.D., Ustiugova E.A. et al. New antifungal bacteriocin synthesizing strains of Lactococcus lactis ssp. lactis as the perspective biopreservatives for protection of raw smoked sausages // Am. J. Agric. Biol. Sci. 2010. V. 5. № 4. P. 477–485.
Teuber M. The genus Lactococcus // The genera of lactic acid bacteria / Eds B.J.B. Wood, W.H. Holzapfel. Boston, MA: Springer, 1995. V. 2. P. 173–274 https://doi.org/10.1007/978-1-4615-5817-0_6
Trafalska E., Grzybowska K. Probiotics – an alternative for antibiotics? // Wiad. Lek. 2004. V. 57. № 9–10. P. 491–498.
Trush E.A., Poluektova E.A., Beniashvilli A.G. et al. The evolution of human probiotics: challenges and prospects // Prob. Antimicrob. Prot. 2020. V. 12. № 4. P. 1291–1299. https://doi.org/10.1007/s12602-019-09628-4
Villena J., Oliveira M.L., Ferreira P.C. et al. Lactic acid bacteria in the prevention of pneumococcal respiratory infection: future opportunities and challenges // Int. Immunopharmacol. 2011. V. 11. P. 1633–1645.
Virtanen T., Pihlanto A., Akkanen S. et al. Development of antioxidant activity in milk whey during fermentation with lactic acid bacteria // J. Appl. Microbiol. 2007. V. 102. P. 106–115.
Vodolazov I.R., Dbar S.D., Oleskin A.V. et al. Exogenous and endogenous neuroactive biogenic amines // Appl. Biochem. Microbiol. 2018. V. 54. № 6. P. 603–610.
Voigt R.M., Forsyht C.B., Green S.J. et al. Circadian disorganization alters intestinal mirobiota // PLoS One. 2014. V. 9. P. e97500.
Vrese M., Schrezenmeir J. Probiotics, prebiotics, and synbiotics // J. Adv. Biochem. Eng. Biotechnol. 2008. № 111. P. 1–66. https://doi.org/10.1007/10_2008_097
Wells J.M., Rossi O., Meijerink M., van Baarlen P. Epithelial crosstalk at the microbiota – mucosal interface // PNAS USA. 2011. V. 108. (Suppl. 1). P. 4607–4614.
Willey M., van der Donk W. Lantibiotics: peptides of diverse structure and function // Ann. Rev. Microbiol. 2007. V. 61. P. 477–501.
Yoneyama H., Katsumata R. Antibiotic resistance in bacteria and its future for novel antibiotic development // Biosci. Biotechnol. Biochem. 2006. V. 70. № 5. P. 1060–1075. https://doi.org/10.1271/bbb.70.1060
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии