Успехи физиологических наук, 2021, T. 52, № 3, стр. 41-55
Кислородтранспортная функция крови и газотрансмиттер сероводород
В. В. Зинчук *
Гродненский государственный медицинский университет
Гродно, Беларусь
* E-mail: zinchuk@grsmu.by
Поступила в редакцию 20.03.2020
После доработки 03.05.2020
Принята к публикации 30.10.2020
Аннотация
Определяющее значение в формировании кислородтранспортной функции крови принадлежит гемоглобину. Этот аллостерический белок способен осуществлять обратимое связывание с лигандами, обуславливая изменение сродства гемоглобина к кислороду и приспособление организма к меняющимся потребностям тканей в нем. Представлены современные данные о кислородтранспортной функции крови и системе газотрансмиттеров (сероводород и монооксид азота) и их взаимосвязи. Сероводород вносит вклад в модификацию сродства гемоглобина к кислороду, что достигается через различные механизмы: образование сульфгемоглобина, модулирование внутриэритроцитарной системы, L-аргинин-NO системы, а также опосредовано через системные механизмы формирования функциональных свойств гемоглобина. На основе анализа литературных и собственных данных обсуждается значение газотрансмиттера сероводорода в формировании кислородтранспортной функции крови и развитии оксидативных повреждений и гипоксических состояний.
ВВЕДЕНИЕ
Определяющее значение в формировании кислородтранспортной функции крови принадлежит гемоглобину, благодаря которому содержание кислорода в крови становится значительно выше (табл. 1 ). Данный глобин является временным транспортным депо для кислорода и в этом качестве обладает рядом свойств, обеспечивающих как процессы образования HbО2, так и своевременной отдачи О2 [33]. M.F. Perutz подчеркивал, что “гемоглобин – это не статическое здание, а динамический механизм, не кислородное вместилище, а молекулярное легкое, изменяющее свои размеры при присоединении кислорода и его отдаче” (цитируется по [27]).
Присоединение молекулы кислорода к одному гему приводит к изменению его структуры, что обуславливает нелинейную зависимость насыщения гемоглобина кислородом от рО2 и обеспечивает достаточно высокое содержание кислорода в крови даже при значительном снижении рО2, являясь одним из путей компенсации возникающей гипоксии [27].
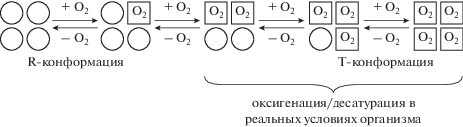
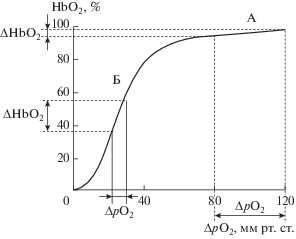
Молекула гемоглобина может существовать в равновесии между оксигенированными и дезоксигенированными формами. Оксигенированную структуру именуют релаксированным (R-) состоянием, а оксигенированную – напряженным (Т-). Субъединицы внутри данного конкретного тетрамера имеют значение сродства к О2, определяемое четвертичной структурой молекулы: R-состояние имеет высокое сродство, а Т- – низкое. Связывание с О2 разрывает электростатические связи, формируя релаксированную R-конформацию, в которой остальные связывающиеся участки молекулы гемоглобина имеют сродство к О2 в 500 раз выше, чем в Т-конформации. Эти изменения ведут к кооперативности между связывающими участками. Связывание одной молекулы О2 с дезокси-гемоглобином повышает сродство к нему остальных участков на той же молекуле (пример, как аллостерический фермент регулирует метаболический путь) [72]. Процесс связывания О2 с одной субъединицей гемоглобина влияет на взаимодействие последующих его молекул с другими субъединицами. Именно этот процесс придает кривой диссоциации оксигемоглобина (КДО) особую S-образную форму (рис. 1 ), что имеет важное физиологическое значение: обеспечивает оптимальные условия для оксигенации крови в капиллярах легкого и деоксигенации в капиллярах большого круга кровообращения. Положение КДО характеризует показатель p50 (рO2, при котором содержание оксигемоглобина равно 50%). Он, как правило, используется для сравнения функциональной способности различных гемоглобинов.
Рис. 1.
Физиологическое значение S-образной формы кривой диссоциации оксигемоглобина: А – оксигенация крови в легких; Б – деоксигенация в капиллярах большого круга кровообращения.
Процесс присоединения кислорода к гемоглобину является ступенчатым. Анализируя физиологическое значение вклада гемоглобина в реализацию кислородтранспортной функции крови (табл. 1) необходимо учитывать, что процессы оксигенации/деоксигенации крови протекают в основном в диапазоне Hb(O2)3 ↔ Hb(O2)4 (рис. 2 ) и соответственно, разница в содержании в артериальной и венозной крови составляет примерно одна треть. Вследствие чего более корректно представлять процессы оксигенации/деоксигенации крови не крайнем диапазоне. Это также является резервом О2 и мобильным механизмом повышения либо ограничения его поступления в ткани, в зависимости от физиологической потребности, что может быть предметом целенаправленного воздействия на кислородтранспортную функцию крови с целью адекватности кислородного обеспечения как отдельных тканей, так и всего организма.
Таблица 1.
Значение гемоглобина в реализации кислородтранспортной функции крови
| Содержание О2 (мл) при концентрации гемоглобина 150 г/л | |
| Артериальная кровь при рО2 = 100 мм рт. ст. и SО2 = 100% содержит 20.7 мл О2 в 100 мл крови |
|
| В плазме | В эритроцитах |
| 0.3 мл О2 (1.55%) | 20.4 мл О2 (98.45%) |
| Венозная кровь при рО2 = 40 мм рт. ст. и SО2 = 70% содержит 14.6 мл О2 в 100 мл крови |
|
| В плазме | В эритроцитах |
| 0.3 мл О2 (2.05%) | 14.3 мл О2 (97.95%) |
МОДУЛЯТОРЫ КИСЛОРОДСВЯЗЫВАЮЩИХ СВОЙСТВ ГЕМОГЛОБИНА
Гемоглобин как аллостерический белок имеет множество участков, способных осуществлять обратимое связывание с первичным лигандом, обуславливающих четвертичные конформационные изменения (гомотропные эффекты), и их модуляция вторичными эффекторами (гетеротропные эффекты) [54, 68]. Гомотропный эффект является фундаментальным свойством гемоглобина, обеспечивающим формирование кислородтранспортной функции крови и физиологические потребности в О2 организмом [45]. Регуляция СГК и, соответственно, изменение положения КДО осуществляется за счет взаимодействия гемоглобина с CO2, H+, органическими фосфатами и некоторыми другими модуляторами, а также факторами, влияющими на его взаимодействие с лигандами [59].
Среди различных факторов, модулирующих положение КДО, не в полной мере определено значение абсолютной температуры и ее градиентов внутри тела, проявление эффекта Бора на уровне капилляра, неоднородность популяции эритроцитов по своим кислородсвязывающим свойствам, взаимодействия гемоглобина и NO, эффекта времени прохождения эритроцитов по капилляру и др. [82]. Кислородсвязывающие свойства гемоглобина отвечают не только на изменения внешней концентрации О2, но и на присутствие в растворе ряда других веществ. Наличие Cl–, CO2, органических фосфатов или Н+ оказывает большое влияние на кислородтранспортную функцию гемоглобина. Большинство гемоглобинов позвоночных изменяет свои кислородсвязывающие свойства в ответ на изменения pH и других аллостерических эффекторных молекул [75].
К ключевым механизмам адаптации структуры и функции гемоглобина преимущественно относят аминокислотные замены на участках, образующих контакты между цепями (по мере сдвига молекулы между дезокси- и окси-состоянием), или сравнительно немногих связывающих участках для эффекторов вроде Н+, Cl– и органических фосфатов [41].
Главными гетеротропными эффекторами гемоглобина являются Н+, СО2 и внутриэритроцитарные органические фосфаты. Физиологическое значение последних было раскрыто в 1967 г. в работах R.E. Benesch, R. Benesch [35], в которых было показано, что 2,3-дифосфоглицерат является мощным модулятором СГК. Увеличение его концентрации приводит к смещению КДО вправо, а снижение вызывает противоположный эффект. В эритроцитах лишь 2,3-дифосфоглицерата и АТФ присутствуют в количествах достаточных, чтобы влиять на положение КДО. На их долю приходится более 90% всего количества органических фосфатов в эритроцитах [80]. Влияние 2,3-дифосфоглицерата на КДО, в сравнении с АТФ, более значительно, что обусловлено его более высокой концентрацией и более выраженным сродством к гемоглобину [40]. Количество этого органического фосфата в эритроцитах превышает содержание АТФ в 4.5 раза и составляет около 60% всех фосфатов клетки. 2,3-дифосфоглицерат является промежуточным продуктом шунта Любиринга–Раппопорта. Его внутриэритроцитарный пул контролируется ферментами 2,3-дифосфоглицерат-мутазой и 2,3-дифосфоглицерат-фосфатазой, активация первого увеличивает образование 2,3-дифосфоглицерата, второго снижает. Этот фактор осуществляет свое влияние на гемоглобин как непосредственно через аллостерический механизм, так и через изменение внутриэритроцитарной концентрации ионов Н+.
Молекулу воды рассматривают также как аллостерический эффектор. Гемоглобин A человека связывает при переходе от Т- к R-состоянию 60 молекул Н2О [92]. Изменение конформации к большему сродству, происходящий при присоединении второй молекулы О2 при высоком pH и уменьшаемый после связывания третьей молекулы при низком pH, связан со стабилизацией Т-состояния протонами.
Таблица 2.
| Свойство | Монооксид азота | Сероводород |
|---|---|---|
| Молярная масса, г/моль | 30.01 | 34.08 |
| Коэффициент диффузии, см2/с–1 °С ×10–5 |
2.07 | 1.75 |
| Растворимость, г/100 г H2O/°C | 0.0062 | 0.40 |
| Синтез | Нейрональная, индуцибельная и эндотелиальная изоформы NO-синтаз |
Цистотионин-β-синтаза,
цистотионин-γ-лиаза, 3-меркаптопируват-сульфуртрансфераза |
| Концентрация в крови | нмоль | нмоль–мкмоль |
| Период полураспада | Секунды | Секунды |
| Механизм действия реализуется при участии | Циклический гуанозинмонофосфат | ${\text{K}}_{{{\text{АТФ}}}}^{ + }$-каналы |
ЭФФЕКТ БОРА
Изменение рН раствора изменяет константу диссоциации и конформацию групп, связанных с кислородом в тетраметре гемоглобина, в результате чего меняется его сродство к О2. Подкисление среды приводит к снижению СГК, подщелачивание – к увеличению. Такая зависимость СГК от рН получила название эффекта Бора. рН среды влияет на взаимодействие атома железа в молекуле гемоглобина с различными лигандами, и прежде всего, с кислородом. Исследования в этом направлении были начаты в лаборатории И.М. Сеченова, а само явление было открыто в 1898 г. Б.Ф. Вериго, белорусом по происхождению, физиологом, работавшим в то время в Одессе в Новороссийском университете и, независимо от него, в 1904 г. датским физиологом Ч. Бором. Данный эффект выражает по существу общую способность протеинов присоединять либо отдавать в среду Н+ и является частным случаем проявления их буферных свойств [22]. В упрощенном виде этот феномен можно представить, как:
Молекулярные механизмы эффекта Бора обусловлены присоединением протонов к остаткам гистидина в α-цепях, образованию солевых мостиков путем протонирования концевых остатков гистидина. Повышение концентрации протонов способствует освобождению кислорода, а повышение концентрации кислорода стимулирует высвобождение протонов [97].
Для гемоглобина человекa в физиологическом диапазоне значений pH во время оксигенации высвобождается примерно 2 протона. Во время оксигенации происходит отщепление от гемоглобина протонов, которые, накапливаясь в эритроците, увеличивают его кислотность, что само по себе приводит к снижению СГК.
Такая зависимость конформации гемоглобина от концентрации протонов имеет место при рН больше 6 (щелочная область эффекта Бора), при меньших значениях pН наблюдается обратная по эффекту взаимосвязь, при которой гемоглобин при отщеплении кислорода отдает протоны (кислотная область эффекта) [97]. Данная область этого эффекта, по-видимому, не имеет самостоятельного физиологического значения в организме. Хотя у некоторых земноводных в условиях анабиоза при значительном снижении рН кислотная область эффекта Бора повышает способность гемоглобина связывать кислород, что в условиях его недостатка может быть более целесообразным. У некоторых гемоглобинов позвоночных (рыбы) наблюдалась иная зависимость между pH и СГК, получавшее название эффект Рута, что имеет значение для увеличения объема плавательного пузыря на глубине и поддержании оксигенации при низком рО2.
Физиологическое значение эффекта Бора заключается в его влиянии на оксигенацию тканей. Сдвиг рН крови в сторону ацидоза за счет образующихся кислых метаболитов и углекислого газа благоприятствует большей десатурации крови в капиллярах [56]. В условиях истощения резервных возможностей других звеньев системы транспорта кислорода данный эффект может стать важным фактором изменения pО2 в крови и тканях [75]. Эффект Бора представляет собой саморегулирующийся механизм доставки кислорода в ткани при гипоксических условиях. Гипоксемия стимулирует вентиляцию, что повышает pО2 и pH крови и снижает p50. Если его значение становится слишком низким, нарушается доставка О2, то возникающий тканевый ацидоз вновь повышает p50 до нормальных значений. Регуляция по принципу обратной связи обеспечивается путем аллостерического контроля СГК через эффект Бора и температуру, а также хеморецепторным контролем вентиляции. Данный эффект вовлечен в развитие алкалоза при гипервентиляции и через изменение рН определяет в эритроцитах уровень органических фосфатов [57]. Этот феномен является примером молекулярной адаптации к различным условиям окружающей среды [50]. При прохождении крови через тканевые капилляры захват СО2 эритроцитами повышает pО2 при данном SO2 через эффект Бора, тем самым облегчая доставку О2 к тканям, что снижает pО2 внутри эритроцитов при данном содержании СО2, в результате чего улучшаются условия для захвата СО2 (эффект Холдейна).
Влияние температуры на процесс связывания О2 с гемоглобином исследован in vitro Дж. Баркрофтом и В. Кингом еще в 1909 г. [1]. Температура выступает как регулятор функций гемоглобина в связи с тем, что оксигенация гемической группы является экзотермической реакцией (СГК уменьшается с ростом температуры), а общая энтальпия оксигенации обусловлена эндотермическим вкладом регуляторных молекул, которые преимущественно связываются с дезоксигемоглобином и модулируют связывание и отщепление О2 [67].
При существенном изменении температуры тела, как при перегревании, лихорадке, так и гипотермии, развиваются специфические изменения кислородсвязывающих свойств крови, направленные на ослабление влияния температурного фактора на СГК [99]. При гипертермии, лихорадке изменения СГК, по-видимому, обусловлены не только влиянием температуры, но и изменением значений 2,3-дифосфоглицерата, рН, рCO2 и константы эффекта Бора [2, 11]. Кроме того, в качестве модулятора температурного эффекта может быть и NO. Введение в организм крыс метилового эфира NG-нитро-L-аргинина сдвигает КДО вправо и значительно снижает устойчивость животных к действию высокой внешней температуры [98]. Однако при относительно небольшом изменении температуры (например, сауна, около 2°С) происходит больший рост значений р50 в расчете на 1°С [14], чем при состоянии выраженного перегревания (более 3.5°С). Очевидно, при относительно умеренной по силе тепловой нагрузке, в отличие от значительного перегревания или лихорадки, механизмы адаптации направлены на усиление транспорта кислорода в ткани (за счет влияния температуры на СГК), что лежит в основе позитивного эффекта контролируемых тепловых воздействий.
В условиях охлаждения организма и существенного снижения температуры тела наблюдается сдвиг КДО влево. У животных, получавших L-аргинин (исходный субстрат синтеза NO) и подвергавшихся гипотермии, отмечается наименьший сдвиг КДО влево и повышение устойчивости организма к действию холода [100]. Холодовое воздействие (снижение температуры тела до 28.4 ± 0.2°С) характеризуется смещением КДО вправо [52]. Данные модуляторы через механизмы обратной связи позволяют оптимизировать процессы транспорта О2 путем соответствующих изменений СГК. Эти факторы образуют систему, которая осуществляет с учетом скоростей биохимических реакций относительно быстрые адаптивные изменения свойств крови в ответ на внешние возмущения.
ЗНАЧЕНИЕ СРОДСТВА ГЕМОГЛОБИНА К КИСЛОРОДУ ДЛЯ ТРАНСПОРТА О2
Согласно классическим представлениям, уменьшение СГК, сдвиг КДО вправо повышает отдачу кровью кислорода тканям. При гемической гипоксии сдвиг КДО вправо, вызванный усилением синтеза 2,3-дифосфоглицерата в эритроцитах (Δp50 – 2.5 мм рт. ст.), увеличивает количество поступающего в ткани кислорода на 15% [7]. В исследованиях на поросятах с применением инозингексафосфата, увеличивавшего p50 на 20%, потребление кислорода возрастает по сравнению с контролем с 4.3 до 6 мл/мин [43]. В опытах на крысах при повышении p50 на 25% наблюдается возрастание тканевого pО2 в среднем на 78% [60]. В хронических экспериментах на собаках увеличение p50 с 31 до 38.8 мм рт. ст. при обработке инозитгексафосфатом не приводит к росту потребления кислорода на фоне снижения сердечного выброса [66]. Наблюдается увеличение рО2 в тканях и потребления О2 у хомячков после 80% замены объема циркулирующей крови искусственным кровезаменителем, содержащим полимеризированный гемоглобин с более высоким значением р50 (54.2 мм рт. ст.) [38]. Пребывание добровольцев в условиях, подобных Эвересту (рО2 – 282 мм рт. ст.) в течение 42 суток увеличивает значение р50станд с 28.2 до 33.1 мм рт.ст., что приводит к уменьшению SO2 в артериальной и венозной крови на 8.4 и 17.4% соответственно, но увеличивает экстракцию О2 на 7.9% [88]. Применение аллостерического регулятора СГК миоинозитол трифосфата, дозазависимо увеличивавшего р50 на 22 и 37% при дозах 1 и 2 г/кг, повышает способность к выполнению физических нагрузок на 57 ± 13 (р = 0.002) у обычных и 63 ± 7% (р = = 0.005) у трансгенных мышей с тяжелой сердечной недостаточностью при максимальном изменении СГК [37].
В то же время есть данные о том, что снижение СГК не всегда обладает явным эффектом по улучшению оксигенации тканей. Использование модификатора СГК, сдвигающего КДО вправо (р50 = = 16.9 ± 3.5 и 40.4 ± 1.7 при температуре 30.0 и 37.5°С соответственно) не уменьшает размеры возникающего инфаркта при ишемии головного мозга крыс при гипотермии [89]. Сдвиг КДО вправо (р50 возрастает с 36.6 ± 0.3 до 48.3 ± 0.6 мм рт.ст.) не приводит к существенному улучшению тканевого метаболизма в условиях глубокой анемии [46]. В тоже время его использование при гипотермической кардиоплегии улучшает восстановление механической и метаболической функции миокарда, снижает проявление окислительного стресса [61]. Снижение СГК до начала моделирования субдуральной гематомы у крыс в нормоксических и гипероксических условиях снижает уровень 2,3-дигидроксибензойной кислоты, образуемой из салицилата после обработки ОН* в сравнении с контролем, но данный эффект не отмечался при модификации СГК в постишемический период [44]. Максимальный подъем p50 не обеспечивает снижение кратковременной очаговой ишемии мозга у крыс [83].
Уменьшение СГК, являющееся наиболее важным фактором компенсации кислородной недостаточности при различных патологических состояниях, лежит в основе процессов адаптации к гипоксии. По-видимому, увеличение p50 выше физиологических значений благоприятствует оптимальному транспорту кислорода к тканям преимущественно в условиях нормоксии или умеренной гипоксии. Трактовка проблемы физиологического значения сдвига КДО влево для оксигенации тканей окончательно не выяснена, несмотря на большое число исследований. Известно, что повышение СГК затрудняет десатурацию крови в микроциркулярном русле.
На изолированной m. gastrocnemius собак in situ, перфузированной нормальной кровью или обработанной цианатом натрия (p50 = 32.1 и 23.2 мм рт. ст. соответственно), наблюдается снижение поступления кислорода в ткань на 17% [53]. У собак с p50 = 23 мм рт. ст. (в контроле 32) при незначительных различиях конвективного транспорта кислорода отмечается значительно меньшее потребление кислорода тканью миокарда [32]. Сдвиг КДО влево вследствие карбоксилирования (уровень карбоксигемоглобина 12%) снижает поступление кислорода в ткани с 70 до 52% [78]. При перфузии изолированной m. gracilis собак высокоаффинной к кислороду кровью в условиях субмаксимальных нагрузок показана меньшая, чем при перфузии нормальной кровью, доставка кислорода в ткани, не компенсируемая усилением кровотока [64]. При перфузии изолированного сердца кролика растворами гемоглобина c значением p50 12 (в контроле 30 мм рт. ст.) потребление кислорода тканями снижается на 36% [70]. Доставка кислорода в ткани из циркулирующей крови при операциях на сердце c p50 31.1 и 20.3 мм рт. ст. уменьшается на 30% [69]. В опытах по моделированию СГК (путем использования инозитолгексофосфата и 5 гидроксиметил-2-фурфурала, изменяющих р50 от 10 до 50 мм рт. ст.) наблюдается несоответствие между тканевым рО2 и его потреблением и доставкой в ткани в условиях острой анемии [38].
Однако сдвиг КДО влево может иметь благоприятный эффект для организма. Так, у бодрствующих хомяков после геморрагического шока использование кровезаменителя с гемоглобином, модифицированным полиэтиленгликолем (р50 = = 5.5 мм рт. ст.) улучшает кровоток и микроциркуляцию [93]. Ишемия головного мозга у низкорезистентных к ней крыс линии Вистар, вызванная окклюзией общих сонных артерий, в острейшем периоде повышает СГК в среднем на 12% относительно нормальных значений, так же, как и эмоциональный стресс, определяя последующее развитие ишемии головного мозга: прирост до 25% обеспечивает его дальнейшее повышение, а свыше 25% – значительное снижение в результате деоксигенации гемоглобина [24]. Трансфузия рекомбинантного полимерного гемоглобина с низким р50 (3 и 18 мм рт. ст.) уменьшает объем поражения при экспериментальном инсульте [63]. Использование гемоглобина, инкапсулированного в липосомы с высоким (р50 = 10 мм рт. ст.) и низким (р50 = 45 мм рт. ст.) СГК оказывает защитный эффект при развитии инсульта, создаваемого у крыс, но действие первого было более выраженным (в большей степени уменьшает размеры инфаркта в коре и базальных ганглиях) [48].
Оценка кислородного снабжения скелетной мышцы на модели Крога показывает, что при увеличении р50 с 26 до 39 мм рт. ст. потребление О2 возрастает на 7 и 1% при рО2 в атмосфере 39 и 53 мм рт. ст. соответственно, а при уменьшении р50 до 20.8 мм рт. ст. в условиях гипоксии (при рО2 = 40 мм рт. ст.) – возрастает на 51% [71]. У хомяков с повышенным СГК (p50=15.7 мм рт. ст.) при значительной гемодилюции (снижение гематокрита на 40%) и гипоксической гипоксии наблюдается менее выраженное нарушение доставки кислорода, чем при нормальном СГК (p50 = = 26.1 мм рт. ст.) [84]. Согласно данным этих исследователей, повышенное СГК не дает очевидных преимуществ для транспорта кислорода на уровне капиллярной сети в поперечно-полосатых мышцах, однако оно может стать очевидным при повышенной скорости метаболизма или более тяжелой гипоксии. У крыс с повышенным СГК (за счет использования NaOCN р50 изменялся с 30 до 24 мм рт. ст.) отмечался более высокий коэффициент экстракции О2 в условиях гипоксии, а в гипероксической среде – меньшая скорость метаболизма, меньшее значение pO2 венозной крови и снижение показателей центральной гемодинамики, что, возможно, обусловлено адаптивными реакциями, развивающимися при длительной тканевой гипоксии [86].
Механизмы транспорта кислорода кровью играют важную роль в развитии кислороддефицитных состояний при сосудистой патологии. У пациентов со стабильной стенокардией напряжения СГК снижается: показатель p50станд увеличивается на 9.7% при II функциональном классе, но было на 14.1% (p < 0.001) ниже, чем при – I классе [13], что следует расценивать как компенсаторную реакцию на гипоксию в тканях, возникшую из-за недостаточности коронарного кровотока. Происходящий сдвиг КДО вправо способствует лучшей деоксигенации крови и, очевидно, оптимизации кислородного режима тканей. У пациентов с артериальной гипертензией. под влиянием небиволола (препарата, изменяющего состояние L-аргинин-NO системы) р50реал увеличивается на 9.2% (р < 0.05), р50станд – на 8.3% (р < 0.05), т.е. отмечается нормализующее влияние данного препарата на СГК [79]. При стабильной стенокардии напряжения III функционального класса, протекавшей с артериальной гипертензией, СГК снижается, тесно коррелируя с эндотелийзависимой вазодилатацией [31].
В этом плане заслуживают внимания данные о использовании ряда фармакологических средств для коррекции КТФ крови. Их действие реализуется через автономную внутриэритроцитарную систему регуляции кислородсвязывающих свойств крови, которые выступают в качестве важного модификатора функциональных свойств гемоглобина. Так, использование эритропоэтина, мелатонина перед холодовым воздействием и последующим отогреванием приводит к улучшению транспорта кислорода в ткани, степень снижения КДО вправо уменьшается [52]. Выявлено, что лозартан в концентрации 250 нг/мл достоверно повышает СГК (р50 снижается с 30.2 ± 0.5 в контроле до 27.8 ± 0.7 мм рт. ст.) [4]. В опытах in vitro небиволол увеличивал значения р50 при реальных значениях рН и рСО2 на 4.3 ± 0.8 (p < 0.05) мм рт. ст. при самой низкой концентрации, а последующее 2-х и 3-х кратное увеличение его концентрации повышает его величину на 7.5 ± 1.1 (p < 0.01) и 10.6 ± 0.7 (p < < 0.01) мм рт. ст. соответственно, что отражает дозозависимый характер его действия [15].
Смещение КДО влево при выраженной гипоксической гипоксии улучшает транспорт кислорода в ткани организма. Данный сдвиг следует рассматривать как адаптивную реакцию организма к физическим нагрузкам в условиях кислородной недостаточности. Такая значимость изменения СГК отражает необходимость организма приспосабливаться к постоянно меняющимся потребностям тканей в кислороде, степенью развивающейся гипоксии и выраженностью реакции адаптации к ней.
Однако в ряде случаев этот подход механистически переносят на условия целостного организма. В организме в условиях гипоксии доставка О2 в ткани осуществляется путем изменения тонких механизмов регуляции СГК, даже малые сдвиги которого способны максимально увеличить артериовенозную разницу по О2 и оптимизировать его транспорт в ткани, поддерживая относительно низкую нагрузку на гемодинамику [82]. Выявлен определенный физиологический диапазон, в рамках которого СГК играет адаптационную антиоксидантную роль при острой ишемии головного мозга, границы последнего зависят от индивидуальной резистентности (выход за верхнюю границу этого диапазона является одним из патогенетических факторов развития осложнений после перенесенного эмоционального или другого стресса, ведущих к летальности от ишемии мозга) [24]. Показана эффективность основанных на гемоглобине носителей кислорода со сниженным р50 (повышенным сродством к О2) как средств направленной доставки О2 в ишемизированную ткань, что дает основание для разработки и оптимизации носителей О2, и предполагает возможное использование гемоглобина для коррекций различных гипоксий [81].
Сдвиг КДО вправо при снижении рO2 в крови можно расценивать как попытку организма компенсировать кислородную недостаточность, но в условиях окислительного стресса, когда нарушена утилизация кислорода тканями и значительная его часть используется в оксигеназных реакциях, ведущих к образованию активных форм кислорода, это приводит к активации процессов свободнорадикального окисления [21]. Увеличение p50 способствует росту потока кислорода в ткани в условиях нормоксии или умеренной гипоксии, в тоже время его уменьшение может иметь благоприятное значение, обладая антиоксидантным эффектом в условиях нарушенной утилизации кислорода тканями.
ГАЗОТРАНСМИТТЕРЫ
Проблема формирования кислородсвязывающих свойств крови в последние годы приобрела новый аспект, а именно вклада в этот процесс различных газотрансмиттеров. Наши представления о роли этих веществ в формировании кислородсвязывающих свойств крови, в развитии оксидативных повреждений пока еще достаточно фрагментарны. Приходится констатировать, что до сих пор не сложилось целостного представления о механизмах, при участии которых газотрансмиттеры оказывают регулирующее влияние на отдельные компоненты различных функциональных систем, и в частности кислородтранспортной функции крови в обычных условиях жизнедеятельности организма и при развитии оксидативных повреждений.
Газообразные газотрансмиттеры представляют собой особую группу газообразных молекул, осуществляющих межклеточную и внутриклеточную регуляцию организации различных функций организма [30, 73]. К данным газотрансмиттерам относят монооксид азота, сероводород и монооксид углерода. Сравнительная характеристика монооксид азота и сероводорода представлена в табл. 2 . В отличии от классических мессенджеров, передающих сигнал по каскадному принципу, газотрансмиттеры осуществляют модификацию внутриклеточных протеинов. Их физиологическое значение не ограничивается регуляцией функций сердечно-сосудистой системы, желудочно-кишечного тракта, но и распространяется также на другие системы, образуя единый комплекс газовых посредников, легко проникающих через мембрану и регулирующих многочисленные процессы клетки [26].
Ранее нами было показано участие моноксида азота (NO) в регуляции кислородсвязывающих свойств крови в сосудистом компартменте [9, 12]. Предполагается, что NO транспортируется кровью в качестве третьего дыхательного газа и вызывает вазодилатацию по взаимосвязанному с кислородом (аллостерически) механизму [51]. В результате взаимодействия NO и гемоглобина происходит образование его различных форм, которые играют роль своеобразного аллостерического регулятора функциональной активности данного протеина на уровне отдельных его тетрамеров. Инкубация крови с нитрозоцистеином в условиях оксигенации приводит к левостороннему сдвигу КДО [85]. Инкубирование венозной крови с пероксинитритом повышает СГК, отмечается снижение величины р50реал на 4.5 ± ± 1.6 мм рт. ст. (р < 0.05) [18], что может иметь значение для формирования функциональных свойств гемоглобина, формирования потока О2 в ткани и поддержания прооксидантно-антиоксидантного равновесия в организме. В ходе одного цикла движения эритроцита в сосудистой системе происходят последовательные реакции гемоглобина с NO, модулирующие его структурные переходы из R- в Т-состояние [10], что на уровне капилляров малого круга кровообращения может быть дополнительным механизмом, способствующим оксигенации крови, а на уровне микроциркуляции большого круга – оптимизирующим десатурацию крови, и, соответственно, доставку кислорода в ткани.
Газотрансмиттеры (монооксид азота наряду с сероводородом и монооксидом углерода) обладают уникальными физико-химическими свойствами и проявляют свою активность посредством механизмов, отличающихся от других сигнальных молекул. Знание молекулярных мишеней действия газотрансмиттеров, структуры центров их связывания и особенностей взаимодействия может иметь существенное значение при разработке способов регуляции этих сигнальных систем при помощи фармакологических средств [6]. Представляется целесообразным проанализировать вклад такого газотрансмиттера, как H2S в формирование кислородсвязывающих свойств крови.
СЕРОВОДОРОД
В организме H2S синтезируется из L-цистеина через ферментативный и неферментативный пути. Первый осуществляется за счет специальных цитозольных пиридоксаль-5'-фосфат-зависимых ферментов (цистотионин-β-синтазы и цистотионин-γ-лиазы), а также – зависимого от Zn2+ фермента 3-меркаптопируват-сульфуртрансферазы, локализованного как в цитоплазме, так и в митохондриях [55]. Эти ферменты выявлены в клетках печени, почки, поджелудочной железы. В клетках нервной системы обнаружен только фермент цистотионин-β-синтаза, а в кровеносных сосудах синтез H2S осуществляет преимущественно цистотионин-γ-лиаза [90].
H2S является представителем несинаптического способа межклеточной коммуникации, основанного на диффузии молекул неорганических соединений по межклеточному пространству во всех направлениях и действии на отдаленные от места их образования несинаптические рецепторы [23]. В физиологическом диапазоне рН Н2S существует в виде НS– (70–80%), S2– и самой малой фракции, растворимой в плазме в форме газа [42]. Его содержание в различных тканях колеблется в диапазоне 20–200 мкмоль, а в крови, в частности, 10–50 мкмоль [58].
Эта субстанция обладает широким спектром физиологических эффектов на различные системы организма: ЦНС, дыхание, кровообращение, пищеварение и т.д. Сероводород играет важную роль в процессах внутриклеточного метаболизма и осуществлении контроля над фундаментальными клеточными процессами: регуляции нервной (процессы нейронной передачи сигнала), сердечно-сосудистой (расслабление гладких мышц), иммунной (противовоспалительный и цитопротекторный агент), сенсорной, пищеварительной систем, а также в метаболизме различных органов [23]. Газовые трансмиттеры модулируют образование генов белков-регуляторов апоптоза семейства Bcl-2, снижая экспрессию антиапоптических молекул [25]. Сероводород обеспечивает значительную защиту от апоптоза кардиомиоцитов путем подавления активации каспазы-3 и повышения экспрессии гликоген-синтазы киназы-3β. Он участвует в механизмах гемостаза, обладая антикоагулянтным эффектом, в отличии от СО, который может быть, как коагулянтом, так и прокоагулянтом [76].
АТФ-зависимые калиевые каналы являются основной мишенью H2S в клетке. Эта молекула путем открытия данных каналов в гладкомышечных клетках кровеносных сосудов вызывает их дилатацию. Активация ${\text{К}}_{{{\text{АТФ}}}}^{ + }$-каналов и инактивация потенциалзависимых Са2+-каналов L-типа, обуславливает снижение концентрации внутриклеточного Са2+ с развитием гиперполяризации мембраны гладкомышечных клеток сосудов и их релаксацию [34]. Также возможна эндотелийзависимая H2S-индуцированная вазорелаксация, непосредственно не связанная с механизмом ${\text{К}}_{{{\text{АТФ}}}}^{ + }$-каналов [74]. Сероводород является важной регуляторной молекулой, которая модулирует функцию гладкомышечных клеток, оказывая не только релаксирующее действие, но и констрикторное действие, обусловленное активацией малыми концентрациями H2S трансмембранного ионного обменника Nа+, К+, 2Сl–-котранспорта, который тесно связан с объем-зависимыми механизмами регуляции сократительной активности [28]. Исследование взаимодействия газотрансмиттеров может помочь в понимании интегральных механизмов регуляции сосудистого тонуса и других процессов организма [6].
МОНООКСИД АЗОТА И СЕРОВОДОРОД
Неоднозначно мнение о роли внутриклеточных сигнальных каскадов в механизмах действия NO и H2S. Взаимодействие NO и Н2S-опосредованных сигнальных систем может происходить через нитрозилирование свободных SH-групп в составе цистотионин-γ-лиазы, а также через активацию протеин-киназы G [6]. Взаимодействие NO и H2S реализуется через различные механизмы, а именно NO увеличивает: экспрессию фермента цистотионин-γ-лиазы, но ингибирует его активность, клеточное высвобождение цистеина, ведет к образованию новых молекул S-нитрозотиолов, а также H2S при ацидозе индуцирует образование NO из нитритов и других NO-дериватов [91].
Взаимодействие NO и H2S имеет значение для развития окислительного стресса. Как известно, H2S уменьшает окислительные повреждения при дисфункции эндотелия, выступая как “ловушка” супероксид аниона и снижая его продукцию НАДФН-оксидазой [74]. В регуляции нитрозативных повреждений ДНК, индуцирующих активацию регулона SoxRS, молекулы NO и H2S могут функционировать согласованно, взаимодополняя друг друга [3]. Н2S как газообразная молекула достаточно легко диффундирует через клеточную мембрану. Она реагирует с пероксинитритом с образованием HSNO и сульфинилнитритом [HS(0)NO], за счет чего снижаются негативные эффекты пероксинитрита и достигается цитопротективный эффект при различных видах окислительного стресса [47]. H2S уменьшает уровень свободных радикалов через усиление механизмов антиоксидантной защиты, а также действует как их ловушка [91]. Этот газотрансмиттер регулирует активность ряда антиоксидантных ферментов (каталаза, СОД, глутатион пероксидаза, глутатион трансфераза). Однократная инфузия донора H2S (гидросульфида натрия) за 5 мин до реперфузии печени снижает уровень конечных продуктов процессов перекисного окисления липидов и повышает уровень ряда антиоксидантов печени, активность трансаминаз крови в конце реперфузионного периода [29]. При геморрагическом шоке введение донора H2S (гидросульфид натрия) в условиях ишемии–реперфузии обладает благоприятным эффектом, обусловленным снижением продукции супероксид аниона и NO (за счет уменьшения экспрессии индуцибельной изоформы NO-синтазы) [49].
Отдельного внимания заслуживает вопрос взаимодействия NO- и Н2S-зависимых сигнальных путей между собой и детальное изучение их механизмов взаимодействия, определение “точек пересечения”, порядок их последовательности взаимодействия друг с другом, что позволит более глубоко понять механизмы регуляции функции органов и систем [6]. Данные газомодуляторы, взаимодействуя между собой, образуют сложную систему, управляющую интеграционными процессами организма. Многие физиологические эффекты H2S обусловлены его взаимодействием с другими газообразными посредниками (NO, CО), осуществляемым как на уровне регуляции ферментов синтеза, так и мишеней их действия, поэтому предлагается рассматривать газомедиаторы не по отдельности, а как союз молекул, регулирующих клеточные процессы.
СЕРОВОДОРОД И КИСЛОРОДСВЯЗЫВАЮЩИЕ СВОЙСТВА КРОВИ
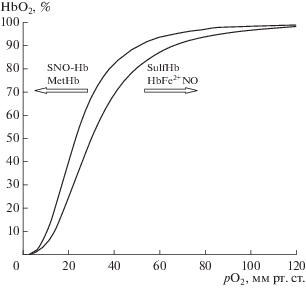
Катаболизм сероводорода достаточно сложен. Время полураспада невелико (составляет секунды). Он окисляется дисульфидными группами липидов до сульфата и тиосульфата. В физиологических условиях сероводород быстро утилизируется в организме через путь митохондриального окисления (основной путь элиминации) с образованием сульфатов или через путь цитозольного метилирования с участием фермента S-метилтрансферазы [62]. Данная субстанция может непосредственно связываться с метгемоглобином, образуя сульфгемоглобин. В обычных условиях содержание сульфгемоглобина относительно невелико, но при некоторых патологических состояниях, при лечении препаратами фенацетин, метоклопрамид и другие, его значение существенно растет и при концентрации 60 и более % ведет к тканевой гипоксии и летальному исходу. Предполагается, что гемоглобин участвует в поддержании уровня H2S в сосудистой системе [36]. Гемоглобин играет важную роль в факультативном окислении H2S, в результате чего образуется тиосульфат и гидросульфид [87]. Также возможно окисление H2S при участии метгемоглобина [65]. Совместно с NO-производными гемоглобина, сульфгемоглобин может изменять положение КДО (рис. 3 ). Meтгемоглобин и нитрозогемоглобин повышают СГК, а нитрозилгемоглобин и сульфгемоглобин его снижают, соответственно первые смещают КДО влево, а последние – вправо. Взаимодействие NO и H2S может иметь значение для формирования кислородного обеспечения организма. Одной из мишеней данных газообразных посредников является гемоглобин.
Рис. 3.
Эффект газотрансмиттеров на положение кривой диссоциации оксигемогобина: MetHb – метгемоглобин, SNO-Hb – нитрозогемоглобин; HbFe2+NO – нитрозилгемоглобин, SulfHb – сульфгемоглобин.
Установлено повышение продукции Н2S в эритроцитах при синкопальных состояниях у детей (32.9 ± 12.5 в сравнении с контролем 15.0 ± ± 4.0 нмоль/мин/108 эр, р < 0.018), линейно коррелирующее с величиной эндотелийзависимой вазодилатации [95]. Выявлено повышенное содержание Н2S в эритроцитах при синдроме постуральной ортостатической тахикардии, концентрация которого может быть предиктором эффективности проводимой терапии [94]. Для постуральной ортостатической тахикардии и синкопа характерно повышенное содержание Н2S в плазме (109.3 ± 2.1 и 95.3 ± 3.8 нмоль/мин/108 эр в сравнении со здоровыми), что предлагается использовать для дифференциального диагноза этой патологии [96]. Хотя следует понимать, что его содержание не является специфическим критерием для постановки диагноза при патологиях, сопровождающихся ростом его содержания.
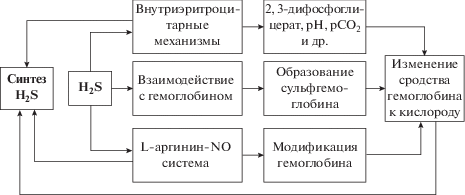
Метаболизм сероводорода является частью кислородсенсорного механизма: в обычных условиях Н2S окисляется в митохондриях до сульфита, при гипоксии его утилизация уменьшается, в связи с чем возрастает вклад в гипоксический ответ [77]. Очевидно, модификация гемоглобина за счет взаимодействия с молекулой H2S участвует в формировании оптимального кислородного режима. Среди различных факторов внутриэритроцитарной системы регуляции кислородсвязывающих свойств крови, наряду с рН, 2,3-дифосфоглицератом, модуляторами свойств гемоглобина являются система газотрансмиттеров, и в частности H2S (рис. 4 ).
Рис. 4.
Вклад газотрансмиттерово в внутриэритроцитарную систему регуляции сродства гемоглобина к кислороду.
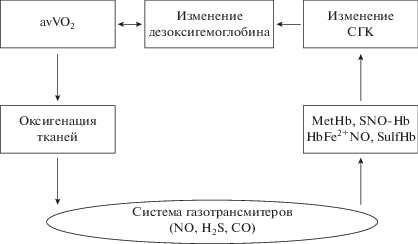
В наших исследованиях показано, что L-аргинин-NO система оказывает модулирующее действие на кислородтранспортную функцию крови при различных состояниях, сопровождающихся развитием гипоксии. Введение L-аргинина и нитроглицерина при действии магнитного поля приводит к уменьшению СГК, которое отсутствует при введении неселективного ингибитора фермента NO-синтазы (N-нитро-L-аргинин метилэфира) и сопровождается повышением концентрации нитрат/нитритов и сероводорода [16]. Облучение магнитным полем хвостовой артерии крыс и введение гидросульфида натрия или аминокислоты L-аргинин в течение 10 сут обуславливает уменьшению СГК и сопровождается повышением содержания газотрансмиттеров (нитрат/нитритов и сероводорода) в крови, а при введении ингибиторов синтеза NO (N-нитро-L-аргинин метилэфир) и синтеза Н2S (цистатионин-γ-лиазы D,L-пропаргилглицина) эффект магнитного поля на СГК не проявляется [17]. Показан эффект газотрансмиттеров на кислоросвязывающие свойства крови и редокс-статус при введении липополисахарида [19]. Мелатонин, уменьшая дисбаланс в функционировании системы газотрансмиттеров, способствует адаптивным изменениям КТФ крови и уменьшению окислительного стресса [20].
Эти эффекты реализуется через различные кратко- и долгосрочные уровни регуляции эритроцитарных и системных механизмов. В их обеспечении также участвуют и Н2S-продуцирующие структуры. Пересечение на тех или иных уровнях NO- и Н2S-зависимых сигнальных каскадов может приводить как к взаимному активированию, так и к ингибированию этих сигнальных систем, в результате чего может быть вариативность физиологических реакций со стороны отдельных клеток, органов и систем [6]. Модулирующее действие газообразных посредников, участвующих в обмене классических медиаторов, обеспечивает многообразные функции – от управления локальной регуляцией интенсивности местного кровотока до сложных каскадных процессов формирования функциональных свойств гемопротеидов. Эффекты данных эндогенных газов-посредников на систему транспорта кислорода реализуются не только через регулирование гемодинамического компонента данной системы, но и через формирование кислородтранспортной функции крови.
Газотрансмиттеры вовлечены во внутри- и межклеточную коммуникацию с высокой специфичностью во многих клетках, тканях и органах, так как они хорошо растворимы в липидах, легко проходят через клеточные и субклеточные мембраны [6]. В системе кровообращения эндотелий является основным источником NО и СО (связываемых в гладких мышечных элементах сосудов с гемосодержащей группой растворимой гуанилатциклазы, в результате чего происходит активация этого фермента, накопление цГМФ, расслабление сосудов), а H2S продуцируется в основном в гладких мышцах сосудов, в адипоцитах и эритроцитах [74]. Эти посредники играют важную роль в центральных и периферических механизмах регуляции процессов транспорта кислорода, образуя единую систему, синергически взаимодополняя друг друга, обеспечивая в конечном итоге достижение положительного приспособительного результата.
Взаимодействие NO с гемоглобином вносит свой вклад в развитие адаптивных и дезадаптивных реакций при стрессе, снижение биоактивности NO и гипоксии. Это в определенной степени относится и к другим газотрансмиттерам, в частности, сероводороду. В исследованиях при дисфункции эндотелия различного генеза отмечалось изменение кислородтранспортной функции крови и содержание таких газотрансмиттеров, как NO, H2S. При хронической обструктивной болезни легких сдвиг КДО вправо сопровождается однонаправленным ростом содержания нитрат/нитритов и уровня сероводорода [8]. Ее сдвиг вправо также отмечался у пациентов с инфарктом миокарда в сочетании с метаболическим синдромом, сахарным диабетом 2-го типа в период 25–60-е сутки, степень выраженности которого коррелирует с содержанием этих газотрансмиттеров, отражая степень дисфункции эндотелия при этой патологии [5].
Несомненно, газотрансмиттер сероводород участвует в модификации СГК, что достигается через различные механизмы: образование различных дериватов гемоглобина (сульфгемоглобин), модулирование внутриэритроцитарной системы формирования кислородсвязывающих свойств крови, L-аргинин-NO системы, а также опосредовано через системные механизмы формирования функциональных свойств гемоглобина (рис. 5 ). Нарушения кислородтранспортной функции крови может способствовать потери согласованности функционирования антиоксидантной системы, вызывая прооксидантно-антиоксидантный дисбаланс и развитие окислительного стресса.
ЗАКЛЮЧЕНИЕ
Анализ литературных данных, собственных экспериментальных и клинических результатов исследований указывают, что не только монооксид азота, но и сероводород выполняют роль аллостерических эффекторов в отношении гемоглобина, изменяя его сродство к кислороду и определяя состояние кислородтранспортной функции крови. Предполагается участие газотрансмиттера сероводорода в формировании функциональных свойств гемоглобина путем модификации его сродства к кислороду через системные и регионарные, внутриэритроцитарные механизмы регуляции, что имеет значение в патогенезе гипоксических состояний, дисфункции эндотелия, окислительного стресса организма и особенно для их коррекции.
Эффективность работы системы транспорта кислорода определяется функциональным состоянием крови, ее способностью связывать необходимое количество кислорода в легких и отдавать его в тканевых капиллярах. Вследствие развития гипоксии происходят сложные изменения на всех этапах процессов транспорта кислорода. Механизмы транспорта кислорода кровью являются важнейшими мишенью эффектов NО и H2S. Нарушение газотрансмиттеробразующей функции приводят к снижению адекватного обеспечения кровотоком тканевых потребностей в кислороде, развитию оксидативных повреждений и гипоксических состояний.
Список литературы
Баркрофт Дж. Основные черты архитектуры физиологических функций. М., Л.: Биомедизд, 1937. 240 с.
Борисюк М.В., Зинчук В.В. Состояние кислородтранспортной функции крови при гипертермии у кроликов // Бюлл. эксперим. биол. и мед. 1989. Т. CV11. № 6. С. 652.
Васильева С.В., Стрельцова Д.А. Взаимодействие мессенджеров – “газотрансмиттеров” NO и H2S в сигнальных и регуляторных процессах бактериальной клетки // Докл. Акад. наук. 2015. Т. 461. № 5. С. 599.
Гацура С.В., Зинчук Д.В. Влияние эналаприла и лозартана на размеры экспериментального инфаркта миокарда, сродство гемоглобина к кислороду и некоторые показатели перекисного окисления липидов // Эксп. и клин. фарм. 2004. Т. 67. № 1. С. 19.
Глуткина Н.В., Пырочкин В.М. Газотрансмиттеры и механизмы транспорта кислорода кровью при инфаркте миокарда и сахарном диабете 2-го типа // Кислород и свободные радикалы: сборник материалов Международной научно-практической конференции. Гродно: ГрГМУ. 2016. С. 28.
Гусакова С.В., Смаглий Л.В., Бирулина Ю.Г. и др. Молекулярные механизмы действия газотрансмиттеров NO, СО и НS в гладкомышечных клетках и влияние NO-генерирующих соединений (нитратов и нитритов) на среднюю продолжительность жизни // Усп. физиол. наук. 2017. Т. 48. № 1. С. 24.
Дмитриева М.Г., Карпова И.В., Пивник А.В. и др. Роль гемоглобина в адаптации к гипоксии больных железодефицитной анемией // Гематол. и трансфузиол. 1994. Т. 39. № 1. С. 13.
Добродей М.А., Зинчук В.В., Глуткина Н.В., Шейфер Ю.А. Кислородтранспортная функция крови, уровень газотрансмиттеров и прооксидантно-антиоксидантное состояние при хронической обструктивной болезни легких // Журн. ГрГМУ. 2016. № 2. С. 5.
Зинчук В.В. Участие оксида азота в формировании кислород-связывающих свойств гемоглобина // Усп. физиол. наук. 2003. Т. 34. № 2. С. 33.
Зинчук В.В. Дисфункция эндотелия и кислородсвязывающие свойства гемоглобина // Кардиология. 2009. Т. 49. № 7–8. С. 81.
Зинчук В.В., Борисюк М.В. Эффект ингибирования NO-синтазы на кислородтранспортную функцию крови при лихорадке у кроликов // Росс. физиол. ж. им. И.М. Сеченова. 1997. Т. 83. № 4. С. 111.
Зинчук В.В., Глуткина Н.В. Кислородсвязывающие свойства крови и монооксид азота // Росс. физиол. журн. им. И.М. Сеченова. 2013. Т. 99. № 5. С. 537.
Зинчук В.В., Добродей М.А., Лис М.А. Особенности кислородтранспортной функции крови у больных стенокардией в условиях коррекции L-аргинин-NO системы // Физиол. человека. 2008. Т. 34. № 2. С. 136.
Зинчук В.Вю, Жадько Д.Д. Эффект сауны на кислородтранспортную функцию крови и прооксидантно-антиоксидантный баланс у нетренированных лиц // Физиол. человека. 2012. Т. 38. № 5. С. 112.
Зинчук В.В. Зинчук Н.В. Влияние небиволола на кислородтранспортную функцию крови // Эксперим. и клин. фарм. 2007. Т. 70. № 1. С. 44.
Зинчук В.В., Лепеев В.О., Гуляй И.Э. Участие газотрансмиттеров в модификации кислородтранспортной функции крови при действии магнитного поля // Росс. физиол. журн. им. И.М. Сеченова. 2016. Т. 102. № 10. С. 1176.
Зинчук В.В., Лепеев В.О. Влияние магнитного поля на кислородтранспортную функцию крови при введении донора сероводорода // Фiзiол. журнал. 2017. Т. 63. № 4. С. 30.
Зинчук В.В., Степуро Т.Л. Эффект пероксинитрита на сродство гемоглобина к кислороду in vitro // Биофизика. 2006. Т. 131. № 1. С. 32-38.
Зинчук В.В., Фираго М.Э., Гуляй И.Э. Эффект газотрансмиттеров на кислоросвязывающие свойства крови и редокс-статус при введении липополисахарида // Росс. физиол. журн. им. И.М. Сеченова. 2017. Т. 99. № 8. С. 890.
Зинчук В.В., Фираго М.Э. Участие мелатонина в регуляции кислородтранспортной функции крови при окислительном стрессе, вызванном введением липополисахарида // Биомед. хим. 2017. Т. 63. № 6. С. 89.
Зинчук В.В., Ходосовский М.Н. Участие кислородзависимых процессов в патогенезе реперфузионных повреждений печени // Усп. физиол. наук. 2006. Т. 34. № 4. С.45.
Иржак Л.И. Гемоглобины и их свойства. М.: Наука, 1975. 240 с.
Колесников С.И., Власов Б.Я., Колесникова Л.И. Сероводород как третья эссенциальная газовая молекула живых тканей // Вестник РАМН. 2015. Т. 70. № 2. С. 237.
Конорова И.Л., Новиков В.Э., Ганнушкина И.В. Влияние эмационального стресса на сродство гемоглобина к кислороду у низкорезистентных к нему животных в норме и при ишемии головного мозга // Бюлл. эксперим. биол. и медицины. 2007. Т. 144. № 10. С. 376.
Новицкий В.В., Рязанцева Н.В., Старикова Е.Г., Таширева Л.А. Регуляция апоптоза клеток с использованием газовых трансмиттеров) оксида азота, монооксида углевода и сульфид водорода) // Вестник науки Сибири. 2011. Т. 1. № 1. С. 635.
Реутов В.П., Охотин В.Е., Шуклин А.В. и др. Оксид азота и цикл NO в миокарде: молекулярные, биохимические и физиологические аспекты // Усп. физиол. наук. 2007. Т. 38. № 4. С. 39.
Рябов Г.А. Гипоксия критических состояний. М.: Медицина, 1988. 232 с.
Смаглий Л.В., Гусакова С.В., Бирулина Ю.Г., Ковалев И.В., Орлов С.Н. Роль сероводорода в объем-зависимых механизмах регуляции сократительной активности гладкомышечных клеток сосудов // Росс. физиол. журн. им. И.М. Сеченова. 2015. Т. 101. № 4. С. 441.
Ходосовский М.Н., Зинчук В.В., Гуляй И.Э. Влияние донора сероводорода на параметры прооксидантно-антиоксидантного баланса при ишемии-реперфузии печени у крыс // Эксп. и клин. фарм. 2017. Т. 80. № 5. С. 22.
Черток В.М., Коцюба А.Е. Регуляция функций яичников: участие газовых трансмиттеров NO, CO, H2S // Усп. физиол. наук. 2015. Т. 46. № 4. С. 74.
Янковская Л.В., Зинчук В.В., Лис М.А. Кислородтранспортная функция крови и дисфункция эндотелия у больных со стенокардией и артериальной гипертензией // Кардиология. 2007. Т. 47. № 4. С. 22.
Baer R.W. Increased oxyhemoglobin affinity by carbamylation: coronary autoregulation and O2 transport // Am. J. Physiol. 1992. V. 263. № 3. Pt. 2. H691.
Balaban D.Y., Duffin J., Preiss D. et al. The in vivo oxyhaemoglobin dissociation curve at sea level and high altitude // Respir. Physiol. Neurobiol. 2013. V. 186. № 1. P. 45.
Barr L.A., Calvert J.W. Discoveries of Hydrogen Sulfide as a Novel Cardiovascular Therapeutic // Circ. J. 2014. V. 78. P. 2111.
Benesch R.E., Benesch R. The effect of organic phosphates from the human erythrocytes on the allosteric properties of hemoglobin // Biochem. Biophys. Res. Commun. 1967. V. 26. P. 162.
Bilska-Wilkosz A., Iciek M., Girny M., Kowalczyk-Pachel D. The Role of Hemoproteins: Hemoglobin, Myoglobin and Neuroglobin in Endogenous Thiosulfate Production Processes // Int. J. Mol. Sci. 2017. V. 18. № 6. P. 1315.
Biolo A., Greferath R., Siwik D.A. et al. Enhanced exercise capacity in mice with severe heart failure treated with an allosteric effector of hemoglobin, myo-inositol trispyrophosphate // Proc. Natl. Acad. Sci. USA. 2009. V. 106. № 6. P. 1926.
Cabrales P., Tsai A.G., Intaglietta M. Increased tissue PO2 and decreased O2 delivery and consumption after 80% exchange transfusion with polymerized hemoglobin // Am. J. Physiol. Heart. Circ. Physiol. 2004. V. 287. H2825.
Cabrales P., Tsai A.G., Intaglietta M. Isovolemic exchange transfusion with increasing concentrations of low oxygen affinity hemoglobin solution limits oxygen delivery due to vasoconstriction // Am. J. Physiol. Heart. Circ. Physiol. 2008. V. 295. № 5. H2212.
Chowdhury A., Dasgupta R. Effects of acute hypoxic exposure on oxygen affinity of human red blood cells // Appl. Opt. 2017. V. 56. № 3. P. 439-445.
Clerbaux T., Detry B., Geubel A. et al. The oxyhemoglobin dissociation curve in liver cirrhosis // Chest. 2006. V. 129. № 2. P. 438.
Cortese-Krott M.M., Fernandez B.O., Kelm M., Butler A.R. On the chemical biology of the nitrite/sulfide interaction // Nitric Oxide. 2015. V. 46. P. 14.
Deleuze P.H., Bailleul C., Shiiya N. et al. Enhanced O2 transportation during cardiopulmonary bypass in piglets by the use of inositol hexaphosphate loaded red blood cells // Int. J. Artif. Organs. 1992. V. 15. № 4. P. 239.
Doppenberg E.M., Rice M.R., Alessandri B. et al. Reducing hemoglobin oxygen affinity does not increase hydroxyl radicals after acute subdural hematoma in the rat // J. Neurotrauma. 1999. V. 16. № 2. P.123.
Dufu K., Yalcin O., Ao-Ieong E.S. et al. GBT1118, a potent allosteric modifier of hemoglobin oxygen affinity increases tolerance to severe hypoxia in mice // Am. J. Physiol. Heart. Circ. Physiol. 2017. https://doi.org/10.1152/ajpheart.00772.2016
Eichelbronner O., D’Almeida M., Sielenkamper A. et al. Increasig p50 does not improve ${\text{D}}{{{\text{o}}}_{{{\text{2crit}}}}}$ or systemic Vo2 in severe anemia // Am J. Physiol. Heart. Circ. Physiol. 2002. V. 283. H92.
Filipovic M.R., Miljkovic J., Allgäuer A. et al. Biochemical insight into physiological effects of H2S: reaction with peroxynitrite and formation of a new nitric oxide donor, sulfinyl nitrite // Biochem. J. 2012. V. 441. № 2. P. 609.
Fukumoto D., Kawaguchi A.T., Haida M. et al. Liposome-encapsulated hemoglobin reduces the size of cerebral infarction in rats: effect of oxygen affinity // Artif. Organs. 2009. V. 33. № 2. P. 159.
Ganster F., Burban M., de la Bourdonnaye M. et al. Effects of hydrogen sulfide on hemodynamics, inflammatory response and oxidative stress during resuscitated hemorrhagic shock in rats // Crit. Care. 2010. V. 14. № 5. R165.
Giardina B., Mosca D., De Rosa M.C. The Bohr effect of haemoglobin in vertebrates: an example of molecular adaptation to different physiological requirements // Acta. Physiol. Scand. 2004. V. 182. № 3. P. 229.
Gow A.J., Luchsinger B.P., Pawloski J.R. et al. The oxyhemoglobin reaction of nitric oxide // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 16. P. 9027.
Hlutkin S., Zinchuk V. Effect of melatonin on the blood oxygen transport during hypothermia and rewarming in rats // Adv. Med. Sci. 2008. V. 53. № 2. P. 234.
Hogan M.C., Bebout D.E., Wagner P.D. Effect of increased Hb-O2 affinity on VO2max at constant O2 delivery in dog muscle in situ // J. Appl. Physiol. 1991. V. 70. № 6. P. 2656.
Hsia C.C.W. Mechanisms of disease: Respiratory function of hemoglobin // New England Journal of Medicine. 1998. V. 338. № 4. P. 239.
Huang B., Chen C.T., Chen C.S. et al. Laminar shear flow increases hydrogen sulfide and activates a nitric oxide producing signaling cascade in endothelial cells // Biochem. Biophys. Res. Commun. 2015. V. 464. № 4. P. 1254.
Jensen B., Storz J.F., Fago A. Bohr effect and temperature sensitivity of hemoglobins from highland and lowland deer mice // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 2016. V. 195. P. 10.
Jensen F.B. Red blood cell pH, the Bohr effect, and other oxygenation-linked phenomena in blood O2 and CO2 transport // Acta. Physiol. Scand. 2004. V. 182. № 3. P. 215.
Kajimura M., Fukuda R., Bateman R.M. et al. Interactions of multiple gas-transducing systems: hallmarks and uncertainties of CO, NO, and H2S gas biology // Antioxid. Redox. Signal. 2010. V. 13. № 2. P. 157.
Kassa T.W., Zhang N., Palmer A.F., Matthews J.S. Design, synthesis, and activity of 2,3-diphosphoglycerate analogs as allosteric modulators of hemoglobin O2 affinity // Artif. Cells. Nanomed. Biotechnol. 2013. V. 41. № 2. P. 109.
Khandelwal S.R., Randad R.S., Lin P.S. et al. Enhanced oxygenation in vivo by allosteric inhibitors of hemoglobin saturation // Am. J. Physiol. 1993. V. 265. № 4. Pt. 2. P. H1450.
Kilgore K.S., Shwartz C.F., Gallagher M.A. et al. RSR13, a synthetic allosteric modifier of hemoglobin, improves myocardial recovery following hypothermic cardiopulmonary bypass // Circulation. 1999. V. 100. № 19. P.II351.
Kimura H. Metabolic turnover of hydrogen sulfide // Frontiers in Physiology. 2012 https://doi.org/10.3389/fphys.2012.00101
Koehler R.C., Fronticelli C., Bucci E. Insensitivity of cerebral oxygen transport to oxygen affinity of hemoglobin-based oxygen carriers // Biochim. Biophys. Acta. 2008. V. 1784. № 10. P. 1387.
Kohzuki H., Enoki Y., Sakata S. et al. High affinity of blood for oxygen reduces oxygen uptake in contracting canine gracilis muscle // Exp. Physiol. 1994. V. 79. № 1. P.71.
Kolluru G.K., Prasai P.K., Kaskas A.M. et al. Oxygen tension, H2S, and NO bioavailability: is there an interaction? // J. Appl. Physiol. 2016. V. 120. № 2. P. 263.
Liard J.F., Kunert M.P. Hemodinamic changes induced by low blood oxygen affinity in dogs // Am. J. Physiol. 1993. V. 264. № 2. P. 396.
Lilly L.E., Bonaventura J., Lipnick M.S., Block B.A. Effect of temperature acclimation on red blood cell oxygen affinity in Pacific bluefin tuna (Thunnus orientalis) and yellowfin tuna (Thunnus albacares) // Comp. Biochem. Physiol. A Mol. Integr. Physiol. 2015. V. 181. P. 36.
Mairbaurl H., Weber Roy E. Oxygen Transport by Hemoglobin // Physiological. Society. Compr. Physiol. 2012. V. 2. P. 1463.
Matsuzaki K., Takano H., Tokunaga K. et al. Clinical application of phosphoenolpyruvate to autologous transfusion of patients with open heart surgery // Fukuoka Igaku Zasshi. 1993. V. 84. № 1. P. 7.
McDonald V.W., Winslow R.M. Oxygen delivery and myocardial function in rabbit hearts perfused with cell-free hemoglobin // J. Appl. Physiol. 1992. V. 72. № 2. P. 476.
McGuire B.J., Secomb T.W. Theoretical predictions of maximal oxygen consumption in hypoxia: effects of transport limitations // Respir. Physiol. Neurobiol. 2004. V. 143. № 1. P. 87.
Miele A.E., Bellelli A., Brunori M. Hemoglobin allostery: new views on old players // J. Mol. Biol. 2013. V. 425. № 9. P. 1515.
Mistry R.K., Brewer A.C. Redox regulation of gasotransmission in the vascular system: A focus on angiogenesis // Free. Radic. Biol. Med. 2017. V. 108. P. 500.
Nagpure B.V., Bian J.S. Interaction of Hydrogen Sulfide with Nitric Oxide in the Cardiovascular System // Oxid. Med. Cell. Longev. 2016. 6904327. https://doi.org/10.1155/2016/6904327
Okonjo K.O. Bohr effect of native and chemically modified hemoglobins: Quantitative analyses based on the Wyman equation // Biophys. Chem. 2017. V. 226. P. 34.
Olas B. Gasomediators (NO, CO, and H2S) and their role in hemostasis and thrombosis // Clin. Chim. Acta. 2015. V. 445. P. 115.
Olson K.R. Hydrogen sulfide and oxygen sensing: implications in cardiorespiratory control // J. Exp. Biol. 2008. V. 211. P. 2727.
Overgaard J., Nielsen J.E., Grau C. Effect of carboxyhemoglobin on tumor oxygen unloading capacity in patients with squamous cell carcinoma of the head and neck // Int. J. Radiat. Oncol. Biol. Phys. 1992. V. 22. № 3. P. 407.
Pronko T.P., Zinchuk V.V. Effect of nebivolol on blood oxygen transport indices and endothelial dysfunction in patients with arterial hypertension // Clin. Physiol. Funct. Imaging. 2009. V. 29. № 3. P. 170.
Revsbech I.G., Malte H., Frbert O. et al. Decrease in the red cell cofactor 2,3-diphosphoglycerate increases hemoglobin oxygen affinity in the hibernating brown bear Ursus arctos // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013. V. 304. № 1. R43.
Sakai H., Cabrales P., Tsai A.G. et al. Oxygen release from low and normal p50 Hb vesicles in transiently occluded artetioles of the hamster window model // Am. J. Physiol. Heart. Circ. Physiol. 2005. V. 288. H2897.
Samaja M., Crespi N., Guazzi M., Vandegriff K.D. Oxygen transport in blood at high altitude: role of the hemoglobin-qxygen affinity and impract of the phenomena related to hemoglobin allosterism and red cell function // Eur. J. Appl. Physiol. 2003. V. 90. P. 351.
Sarraf-Yazdi S., Sheng H., Grocott H.P. et al. Effects of RSR13, a synthetic allosteric modifier of hemoglobin, alone and in combination with dizocilpine, on outcome from transient focal cerebral ischemia in the rat // Brain. Res. 1999. V. 826. № 2. P.172.
Stein J.C., Ellsworth M.L. Capillary oxygen transport during severe hypoxia: role of hemoglobin oxygen affinity // J. Appl. Physiol. 1993. V. 75. № 4. P. 1601.
Stepuro T.L., Zinchuk V.V. Nitric oxide effect on the hemoglobin-oxygen affinity // Journal Physiol. & Pharmacol. 2006. V. 57. № 1. P. 29.
Taki J, Masuda Y, Hayashi F, Fukuda Y. Increased cardiovascular and metabolic tolerance to acute hypoxia in the rat with increased hemoglobin-O2 affinity induced by Na-cyanate treatment // Jpn. J. Physiol. 1999. V. 49. № 3. P. 257.
Vitvitsky V., Yadav P.K., Kurthen A., Banerjee R. Sulfide oxidation by a noncanonical pathway in red blood cells generates thiosulfate and polysulfides // J. Biol. Chem. 2015. V. 290. № 13. P. 8310.
Wagner P.D., Wagner H.E., Groves B.M. et al. Hemoglobin p50 during a simulated ascent of Mt. Everest, Operation Everest II // High. Alt. Med. Biol. 2007. V. 8. № 1. P. 32.
Wainwright M.S., Sheng H., Sato Y. et al. Pharmacological correction of hypothermic p50 shift does not alter outcome from focal cerebral ischemia in rats // Am J. Physiol. Heart. Circ. Physiol. 2002. V. 282. H1863.
Wallace J.L., Ianaro A., Flannigan K.L., Cirino G. Gaseous mediators in resolution of inflammation // Semin. Immunol. 2015. V. 27. № 3. P. 227.
Wang R., Szabo C., Ichinose F. et al. The role of H2S bioavailability in endothelial dysfunction // Trends. Pharmacol. Sci. 2015. V. 36. № 9. P. 568.
Weber R.E., Fago A. Functional adaptation and its molecular basis in vertebrate hemoglobins, neuroglobins and cytoglobins // Respir. Physiol. Neurobiol. 2004. V. 144. № (2–3). P. 141.
Wettstein R., Tsai A.G., Winslow R.M., Intaglietta M. Resuscitation with polyethylene glycol-modified human hemoglobin improves microcirculatory blood flow and tissue oxygenation after hemorrhagic shock in awake hamsters // Crit. Care. Med. 2003. V. 31. № 6. P. 1824.
Yang J., Li H., Ochs T., Zhao J. et al. Erythrocytic hydrogen sulfide production is increased in children with vasovagal syncope // J. Pediatr. 2015. V. 166. № 4. P. 965.
Yang J., Zhao J., Du S. et al. Postural orthostatic tachycardia syndrome with increased erythrocytic hydrogen sulfide and response to midodrine hydrochloride // J. Pediatr. 2013. V. 163. № 4. P. 1169.
Zhang F., Li X., Stella C. et al. Plasma hydrogen sulfide in differential diagnosis between vasovagal syncope and postural orthostatic tachycardia syndrome in children // J. Pediatr. 2012. V. 160. № 2. P. 227.
Zheng G., Schaefer M., Karplus M. Hemoglobin Bohr effects: atomic origin of the histidine residue contributions // Biochemistry. 2013. V. 52. № 47. P. 8539.
Zinchuk V., Borisiuk V. The effect of NO synthase inhibition on blood oxygen-carrying function during hyperthermia in rats // Respiration Physiology. 1998. V. 113. № 1. P. 39.
Zinchuk V. Effect of NO-synthase inhibition on hemoglobin-oxygen affinity and lipid peroxidation in rabbits during fever // Respiration. 1999. V. 66. № 5. P. 448.
Zinchuk V.V., Dorokhina L.V. Blood oxygen transport in rats under hypothermia combined with modification of the L-arginine-NO pathway // Nitric Oxide. 2002. V. 6. № 1. P. 29.
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук