Успехи физиологических наук, 2023, T. 54, № 1, стр. 70-90
Социальная ангедония: (ф)МРТ исследования
М. Е. Мельников *
Федеральный исследовательский центр фундаментальной и трансляционной медицины.
Институт молекулярной биологии и биофизики
630117 Новосибирск, Россия
* E-mail: mikhail-melnikov@mail.ru
Поступила в редакцию 04.09.2022
После доработки 16.09.2022
Принята к публикации 25.09.2022
- EDN: GXYMZD
- DOI: 10.31857/S030117982301006X
Аннотация
Ангедония, и в частности социальная ангедония – важный психопатологический симптом, играющий ключевую роль в развитии депрессий и шизофрении. У здоровых людей уровень социальной ангедонии ассоциирован с изменением структуры, активации и функциональных связей различных участков префронтальной коры, височной и височно-теменной областей, а также базальных ядер. Для пациентов с шизофренией ключевые фМРТ-корреляты социальной ангедонии локализуются в височной доле. В отношении лиц с депрессией и другими психическими расстройствами полученные результаты недостаточны для обобщения. В отличие от физической ангедонии, социальная не демонстрирует специфичной ассоциации с объемом и активацией прилежащего ядра.
ВВЕДЕНИЕ
Социальная ангедония проявляется в сниженной способности испытывать удовольствие от социальных вознаграждений и при восприятии нормативно позитивных социальных стимулов. У здоровых людей эта черта нарушает способность к детальному воображению социальных ситуаций и снижает ожидания сильных и приятных эмоций от общения [145].
Ангедония в целом – распространенный симптом, принадлежащий к RDoC-домену систем позитивной валентности [98] и связанный с дефицитарностью метакогнитивных функций [119]. Ангедония, и в частности социальная ангедония, наиболее значима для аффективных расстройств и шизофрении, однако отмечается и при некоторых других психопатологических состояниях. Субклиническая депрессивная симптоматика связана с низкой мотивацией к социальным контактам и с неуверенностью в получении социальных вознаграждений [40], а группы риска депрессии характеризуются недостатком реакции на социальные подкрепления [71]. В курсе развития депрессии ангедония обычно возникает раньше большинства других симптомов, и ее сила является предиктором большей тяжести депрессии [34]. Уровень ангедонии опосредует связь между депрессией в анамнезе и внутричерепным распределением лобной асимметрии альфа-ритма, предположительно важным показателем эмоциональной регуляции [114]. Выраженность ангедонии связана с силой нарушений настроения [127] и характеризует один из крупных подтипов депрессивного синдрома [133]. Изменение уровня ангедонии после лечения коррелирует с облегчением других симптомов депрессии [10, 127], а исходные показатели ангедонии ассоциированы с ростом мотивации, связанной с вознаграждением, по завершении курса психотерапии [10].
При шизофрении, как правило, выше показатели и физической, и социальной ангедонии [64], связанные с относительно негативным впечатлением от нормативно приятных стимулов [17] при сохранном распознавании эмоций других людей [101]. У пациентов с шизофренией сглажена реакция увеличения удовольствия при переходе от ожидания приятного видеоролика к его просмотру [17]. Для лиц с шизофренией характерны сниженные показатели в логическом тесте, если за правильными ответами следует финансовое вознаграждение [29, 93, 121]. На этом основана гипотеза, что ангедония при шизофрении является нарушением когнитивных, а не эмоциональных процессов. Однако показано, что качество усвоения закономерностей в таких тестах не зависит от уровня ангедонии [29].
Зачастую развитие ангедонии запускается психологической травмой [13, 38], и у женщин с посттравматическим стрессовым расстройством (ПТСР) показатели ангедонии повышены. Кроме того, пациенты с ПТСР демонстрируют возникновение парадоксальных негативных реакций на конвенционально положительные стимулы [38].
Ангедония имеет ряд биологических коррелятов, например, реактивность периферической иммунной системы в целом [18] и повышенный уровень периферических провоспалительных цитокинов [34]. Продемонстрирована наследуемость ангедонии по полигенному принципу [149] и ее генетические связи с большим депрессивным и биполярным аффективным расстройством (БАР), а также с шизофренией, но не с обсессивно-компульсивным расстройством и болезнью Паркинсона [135]. Обширный корпус биологических исследований ангедонии сфокусирован на ее нейроструктурных и нейрофункциональных коррелятах. Известно, что у крыс гиперактивация медиальной префронтальной коры снижает возбудимость нейронов стриатума и подавляет поведение, направленное на получение вознаграждений [37].
Несмотря на дискутабельность моноаминовой и, более глобально, нейромедиаторных теорий депрессии, для которой ангедония является ключевым симптомом, ангедония зачастую соотносится с патологией активности одной или нескольких нейромедиаторных систем. В частности, речь о дофаминэргической системе [5, 34, 37, 115]. Полиморфизм гена рецептора серотонина HTR2A связан с большей способности чувствовать “разделенную радость” [87]. Экспериментальное истощение серотонина и, в меньшей степени, дофамина снижает эффективность научения с социальным контекстом и подавляет активность префронтальной коры при ожидании социального вознаграждения [39]. Существуют данные в пользу вовлеченности ГАМК-эргической системы в развитие ангедонии [34, 42, 43], однако авторы тематического обзора полагают, что ангедония ассоциирована с аномалиями не собственно ГАМК-трансмиссии, а тесно взаимосвязанной с ней глутаминэргической [16]. Также в ряде исследований не подтверждена гипотеза о связи концентраций ГАМК, глутамина или глутамата с ангедонией [7, 24, 137]. Полиморфизм гена канабиноидного рецептора CNR1 rs1049353, ассоциированный с развитием резистентности к антидепрессантам, связан и с менее выраженным ответом миндалины и базальных ядер на маскированное предъявление радостных портретов [26].
В разрезе активности классических сетей покоя ангедония наиболее тесно сопряжена с работой сети когнитивного контроля и сети вознаграждения [47]. Тематический обзор связывает эту черту при депрессиях с гиперактивностью сети выделения релевантных стимулов в покое и при восприятии негативных стимулов и гипоактивностью при восприятии позитивных стимулов [98]. Интересно, что при шизофрении особенности системной организации мозга связаны с уровнем ангедонии по собственной оценке пациента, но не по мнению психиатра [8].
В диагностически гетерогенной группе на основании (ф)МРТ-данных, а также личностных тестов удалось предсказать уровень физической ангедонии при r2 = 0.65, а социальной – при r2 = 0.8, причем данные структурной МРТ играли для успеха предсказания минимальную роль [88]. Обзоры и мета-аналитические работы предшественников выделяют МРТ- и фМРТ-маркеры ангедонии и дефицита социальных эмоций при определенных психических расстройствах. Так, у депрессивных пациентов с ангедонией снижена фракционная анизотропия в поясном пучке [6]. Важным фактором развития депрессии в молодом возрасте считается недостаточная активность стриатума во время предвкушения и получения вознаграждения [71]. Пробы для изучения эмоциональной оценки вознаграждения и мотивации к его получению показали недостаток активации стриатума и орбитофротнальной коры и гиперактивацию медиальной и дорсолатеральной префронтальной коры, коры островка и передней поясной извилины при моделировании высокой ангедонии. При обучении, связанном с вознаграждениями, отмечается более выраженный фронтостриарный ответ на вознаграждения, но не на наказания [5].
Мета-анализ указывает на то, что неспособность ощущать удовлетворение ассоциирована с гипоактивацией стриатума и бледного шара. При этом нарушение предвкушения удовольствия, помимо базальных ядер, связано с патологией других регионов фронтостриарной системы: передней поясной извилины, средней и медиальной лобной извилин. Эти результаты воспроизводятся у пациентов с депрессией и шизофренией. Однако искажение переживания приятных впечатлений было ассоциировано с гипоактивацией правых бледного шара, скорлупы и нижней лобной извилины, левой передней поясной извилины и миндалины билатерально при гиперактивации средней затылочной и веретенообразной извилин только для депрессий [143].
Согласно мета-анализу свыше 100 публикаций, паттерн фМРТ-ответа на предъявление портретов с эмоциональной мимикой включает участки зрительной и лимбической систем, височно-теменной и префронтальной областей, мозжечка, а также скорлупы. Реакции миндалины и островка в наибольшей степени различаются в зависимости от эмоции на портретах [41]. Еще один мета-анализ [20] показал, что при большом депрессивном расстройстве (БДР) ослабевает активность и коннективность дорсолатеральной префронтальной коры и дорсальной передней поясной извилины в ответ на предъявление фотопортретов. Систематически отмечается большая активность миндалин в ответ на негативную мимику, значительно реже – сниженная в ответ на позитивную. При БАР эти изменения воспроизводятся вне зависимости от фазы. В отдельных случаях фиксируется гиперактивность субгенуальной передней поясной извилины при наблюдении эмоциональных портретов. При ремиссии депрессии отмечается частичная редукция этих нарушений, однако коморбидности, вероятно, не являются значимым фактором. Для БАР, напротив, ремиссия не влияет на характеристики церебрального ответа, а коморбидные состояния оказывают на него определенное воздействие [20].
Несмотря на то, что активность мозга, связанная с обработкой социальных стимулов, хорошо исследована как в норме, так и при различных формах патологии, и то же можно сказать о мотивации вознаграждения и в частности об ангедонии, более узкая область социальной ангедонии изучена значительно слабее. Цель этого обзора – обобщить современные данные о структурных и функциональных МРТ-коррелятах социальной ангедонии, в особенности при психических расстройствах, попутно рассмотрев связанные с ней темы общей ангедонии и реакции на эмоциональную мимику.
В рассмотренных ниже публикациях ангедония концептуализируется преимущественно как устойчивая черта характера и оценивается психометрически. Основными методиками, применяемыми для характеристики уровня ангедонии, являются специализированные шкалы: Snaith-Hamilton Pleasure Scale (SHAPS), Chapman’s Physical/Social Anhedonia Scale (CPAS и CSAS) в оригинальной и пересмотренной версии и Temporal Experience of Pleasure Scale (TEPS). Вторая из этих методик позволяет дифференцировать физическую и социальную ангедонию, а третья – ангедонию в отношении предвкушения и удовлетворения. Также могут использоваться подшкалы и отдельные пункты опросников, предназначенных для исследования родственных феноменов, например, депрессии, и обобщенные оценки субъективной приятности различных стандартных стимулов. В редких случаях в качестве индикатора ангедонии рассматриваются собственно нейрофизиологические показатели, включая низкую амплитуду вызванного потенциала, связанного с вознаграждением [103], или недостаток фМРТ-ответа мотивационных структур мозга в релевантных функциональных пробах [9, 13, 17, 52, 81, 110].
Для идентификации регионов, активность которых ассоциирована с показателями ангедонии, используются пробы, предполагающие получение подкрепления. Сама когнитивная задача обычно является простой (например, оценка длительности временного отрезка [46, 89]), и ее содержание рассматривается как вторичное. При этом принципиальное значение имеет раздельный учет попыток с возможностью вознаграждения и наказания как релевантных и нерелевантных исследованию ангедонии; полезным также может быть разделение периодов ожидания и собственно получения награды. В работах, посвященных общей ангедонии, наиболее распространено финансовое подкрепление, реже используются конвенционально приятные стимулы (изображения [91], аудиодорожки [63]) или напоминания о приятных автобиографических событиях [61].
Для исследования социальной ангедонии моделируются социальные подкрепления. Несмотря на то, что формально таковыми могут считаться изображения лиц людей с эмоционально позитивной мимикой, в ряде исследований приняты более сложные варианты [12, 59, 100, 105, 116]. Например, подкреплением может служить высокая оценка внешности или записанного выступления испытуемого другим “участником”. Для предъявления социальных вознаграждений больше подходит аватар, ранее получивший высокий балл от самого испытуемого, что моделирует “взаимную симпатию” [59]. Сравнительно часто для изучения социальной ангедонии применяется проба Cyberball [12, 51, 86, 95], в которой от 3 аватаров передают друг другу мяч. Сюжет игры предполагает возможность социального отвержения (в какой-то момент аватар испытуемого перестает получать мяч) и социального включения как частных случаев социального наказания и вознаграждения. Ниже будут рассмотрены связи показателей ангедонии в целом и социальной ангедонии в частности с индикаторами структурных особенностей и выраженности функционального ответа различных регионов головного мозга здоровых испытуемых и пациентов с различными психопатологическими состояниями.
РЕАКЦИЯ НА СОЦИАЛЬНЫЕ СТИМУЛЫ ПРИ АФФЕКТИВНЫХ И ТРЕВОЖНЫХ РАССТРОЙСТВАХ
У взрослых пациентов с БДР, в сравнении со здоровыми людьми, при просмотре видеозаписей с выраженной жестикуляцией повышена активность в левой веретенообразной извилине и снижена – в правой скорлупе [117]. Также при БДР не выявляется характерного для здоровых людей усиления ответа веретенообразных извилин и правой скорлупы при приближении мимики на портретах к экспрессии счастья. Вместо этого формируется аналогичная система для печали, включающая левые парагиппокампальную извилину, миндалину и скорлупу и правую веретенообразную извилину. Сила ответа правой веретенообразной извилины на портреты со счастливой мимикой негативно связана с тяжестью депрессии [118]. Испытуемые с депрессией, не получающие антидепрессантов, отличаются более выраженной реакцией миндалины на целевые (требующие определения вида эмоциональной мимики) грустные портреты и менее – на целевые и отвлекающие радостные. Кроме того, у пациентов ослаблен ответ медиальной и левой вентролатеральной префронтальной коры на отвлекающие грустные портреты [50]. Участники с историей депрессии и суицидального поведения излишне активируют дорсальную префронтальную и орбитофронтальную кору в айовском игровом тесте при некоторых сочетаниях фазы теста, степени рискованности выбора и эмоций на демонстрируемых портретах [3].
У здоровых женщин, родивших ребенка 1.5–2.5 года назад, тяжесть субклинической депрессии связана с недостатком активации правой нижней лобной извилины при попытке определить эмоции взрослых людей (но не детей) по изображению зоны глаз [113]. Испытуемые с БДР чаще, чем их здоровые сверстники, избегают взаимодействия с аватаром в специальном тесте. Как при приближении, так и при избегании контакта пациенты сильнее активируют центральный и шпорный регионы коры и слабее – червь мозжечка, шпорный регион, язычную, веретенообразную, верхнюю и среднюю лобные извилины [22].
У здоровых детей 6–8 лет с высоким семейным риском депрессии, в сравнении с детьми без такого риска, снижен ответ дорсального стриатума при наблюдении радостных портретов. Уровень активации дорсального стриатума и дорсолатеральной префронтальной коры в этой группе связан с меньшей склонностью к поиску вознаграждений [92]. Если взрослых пациентов с депрессией согласно традиции китайской медицины разделить на подгруппы избытка (тревожности) и недостатка (утомляемости), участники группы избытка отличаются большей активностью в ответ на грустные лица в островках, нижней и средней лобной извилинах, верхней височной и надкраевой извилинах билатерально, а также левой нижнетеменной дольке [134].
В гетерогенной выборке, включающей здоровых людей, пациентов с большой депрессией, генерализованным тревожным расстройством и социофобией, уровень депрессивной симптоматики был отрицательно связан с силой активации дорсолатеральной префронтальной коры при предъявлении портретов с мимикой гнева [84]. Испытуемые с социальной фобией (в особенности при наличии коморбидной депрессии), пытаясь определить вид эмоциональной мимики, активировали правую вентролатеральную префронтальную кору, а также, в противоположность здоровым людям, миндалину. При этом нормальные реципрокные функциональные отношения вентролатеральной префронтальной коры и миндалины при социофобии сменяются положительной связью [11]. Среди пациентов с шизофренией участники с выраженной коморбидной депрессией отличаются большей активацией левого таламуса и базальных ядер, коры островка, средней и нижней лобных извилин и парацентральной дольки исключительно при наблюдении испуганных фотопортретов [73].
Пациенты с БДР в состоянии ремиссии, в сравнении с симптоматичными пациентами и здоровыми людьми, выше оценивали уровень боли, испытанный людьми на стимульных видео. По данным фМРТ, представители этой группы демонстрировали отстраненный стиль эмпатии – большую активность затылочной коры, правого височно-теменного соединения, верхнетеменной дольки, прецентральной и левой верхневисочной извилины и меньшую в регионе задней верхневисочной и веретенообразной борозд, клина, миндалин и правой средней лобной извилины [102]. У пациентов с шизофренией активность гиппокампа при просмотре нейтральных видеофрагментов и ответ средней височной извилины на видео с нейтральной просодией выше, чем в норме и при депрессии. Испытуемые с депрессией характеризуются усиленным ответом левой дополнительной моторной области в эмоционально окрашенных фрагментах. Для полностью нейтральных видео депрессивные пациенты продемонстрировали сниженную активность височно-теменного соединения, а для полностью эмоциональных – повышенную в задней поясной извилине [101].
При просмотре изображений с социальным контекстом участники с депрессией в меньшей степени активируют систему, включающую верхнюю, среднюю и нижнюю лобные извилины. В случае, если изображалось взаимодействие нескольких людей, в эту систему также входили подкорковые области: скорлупа, хвостатое ядро, вентролатеральное ядро таламуса. Курс лечения венлафаксином позволял нивелировать эти изменения [106]. Высокий семейный риск развития депрессии был ассоциирован с более тесными функциональными связями вентромедиальной префронтальной коры и правой VII дольки и Crus I мозжечка, а также коры островка, левой скорлупы и лобного полюса в задании на понимание социальных взаимодействий. Также в попытках, действительно содержащих схематически изображенные социальные взаимодействия, у участников из группы риска усиление связей вентролатеральной префронтальной коры и прилежащего ядра было более выраженным, чем у лиц без риска депрессии или у участников, имеющих большой депрессивный эпизод в анамнезе [122].
По некоторым данным, у взрослых женщин с БДР повышена активность передней коры островка как в ситуации получения социального вознаграждения (сообщения о симпатии со стороны другого человека), так и при социальном отвержении [105]. У участников с пограничным личностным расстройством и коморбидной депрессией при принятии их в игру в парадигме Cyberball наблюдалась более выраженная активация правых дорсомедиальной префронтальной коры, височно-теменного соединения, задней поясной извилины и левого предклинья в сравнении как со здоровыми людьми, так и с пациентами с БДР [86].
В парадигме Cyberball взрослые пациенты с депрессией, не предпринимавшие в недавнее время суицидальных попыток, во время их включения в игру демонстрируют более высокий уровень активации в верхней части правой передней коры островка, чем здоровые люди и чем испытуемые с депрессией, совершившие суицидальную попытку. Ответ этой структуры в обоих полушариях положительно связан с тяжестью депрессии [12]. Депрессивные пациенты с несуицидальной аутоагрессией (в сравнении с пациентами, не склонными к самоповреждению) демонстрировали более выраженный ответ медиальной и вентролатеральной префронтальной коры на отвержение в парадигме Cyberball [51]. Также эти пациенты переоценивали частоту отвержения другими аватарами и сильнее расстраивались из-за отвержения, однако не отличались по силе позитивных эмоций при получении позитивных оценок от других аватаров. Распределение фМРТ-ответа, в особенности в дорсомедиальной префронтальной коре и дорсальной передней поясной извилине, при получении обратной связи позволяло классифицировать испытуемых по склонности к самоповреждению [95].
В группе здоровых людей с высоким уровнем депрессивной симптоматики ослаблены реакции на социальное подкрепление в правом островке и в верхнетеменной дольке и предклинье [40]. В другом исследовании группы взрослых здоровых людей и пациентов с униполярной и биполярной депресией не отличались друг от друга по показателям фМРТ-ответа на социальное вознаграждение. Однако отрицательная корреляция активации вентрального стриатума и левой орбитальной коры с тяжестью симптоматики была отмечена только в группе БАР [112].
У здоровых подростков риск депрессии связан с ослабленными позитивными эмоциями в ситуации, когда другие положительно оценивали их рассказ о собственных достижениях. Также риск депрессии сопряжен с более интенсивным ответом средней и задней поясной извилины, прецентральной и постцентральной извилин, средней и нижней височных извилин, а также хвостатого ядра на высокие и низкие оценки. Специфично для негативной социальной обратной связи упомянутая связь выявляется для верхней височной, верхней и средней лобных извилин, а также клина [116]. Большая активность левого вентрального стриатума в момент, когда испытуемые правильно угадывают, кто из “товарищей” дал им негативную обратную связь, коррелирует с высоким уровнем тревожности и низким – депрессии [100].
Интересно, что дети в возрасте 10–12 лет, отвергаемые сверстниками, в сравнении с принимаемыми сверстниками, демонструют большую активность орбитофронтальной и вентролатеральной префронтальной коры билатерально, а также левых веретенообразной извилины, средней затылочной извилины, задней поясной извилины и мозжечка в ответ на негативную социальную обратную связь и большую активность затылочных областей 17/18 при получении позитивной социальной обратной связи [75]. В смешанной группе гетеросексуальных и гомосексуальных подростков фМРТ-ответ височно-теменного соединения на социальное подкрепление негативно связан с выраженностью межличностных симптомов депрессии [32].
У подростков, прошедших поведенческую терапию для коррекции депрессивной и тревожной симптоматики, уровень активации правой средней лобной извилины в тесте с социальным подкреплением отрицательно коррелирует с выраженностью улучшений. Уровень ослабления симптомов связан со снижением силы функциональных связей вентрального стриатума с язычной извилиной, предклиньем, угловой извилиной и нижней теменной долькой в пробе с социальными вознаграждениями. Напротив, коннективность вентрального и дорсального стриатума позитивно связана с выраженностью клинического прогресса [109].
Интересные данные получены для сложных социальных эмоций. У пациентов с БДР в состоянии ремиссии усилены реакции миндалины и задней коры островка при переживании стыда (как ожидания отношения других людей) в сравнении с виной (самоотношением) [99]. При решении дилеммы заключенного в “асимметричных” попытках (один из участников “сотрудничал со следствием”, а другой – нет) пациенты с депрессией показывают меньшую активность дорсолатеральной префронтальной коры, уровень сигнала которой негативно коррелирует с выраженностью чувства вины [49]. Среди людей, ожидающих, что им придется публично выступать, участники с депрессией меньше активировали регион медиальной префронтальной коры при подготовке речи. Тем не менее, социальная тревожность не влияла на активность этой области [136].
Когда взрослых испытуемых просили определить причину гипотетических социальных событий в своей жизни, у участников с депрессией не наблюдалось склонности к самооправданию, свойственной здоровым людям. На нейрофизиологическом уровне этим различиям соответствовала активность в нижней лобной и средней височной извилине [56]. В еще одном исследовании с аналогичными поведенческими результатами активация дорсомедиальной и вентролатеральной префронтальной коры, левых височного пояса и средней поясной извилины была связана с самооправданием у депрессивных пациентов и сбалансированными реакциями атрибуции у здоровых людей [111].
Упражнение в написании благодарственных писем увеличивает эффективность лечения депрессии у молодежи. Влияние степени благодарности за “получение” денежного подарка в специальном тесте связано с активностью левой верхнетеменной дольки, верхней и нижней лобных извилин и правой средней затылочной извилины. В подгруппе пациентов, писавших письма, в сравнении с неписавшими, сильнее связь выраженности благодарности и ответа кластера в прегенуальной передней поясной извилине. Желание помочь и чувство вины не влияли на нервную активность испытуемых в этой задаче [66].
В целом, у пациентов с депрессией в состоянии покоя выстраиваются иные, в сравнении со здоровыми людьми, отношения между структурами социоэмоциональной сети. В частности, усилены функциональные связи передняя поясная извилина–предклинье, левая миндалина–предклинье, подколенный участник поясной извилины–передняя поясная извилина, подколенный участник поясной извилины–предклинье, передняя поясная извилина–левая миндалина [108]. Семейный риск БДР связан с меньшим средним влиянием узла внутри сети социальных навыков, включающей ряд височных и лобных регионов, а также области предклинья и задней поясной извилины. Низкое значение среднего влияния узла этой сети на фМРТ покоя предсказывало утяжеление симптомов в течение 8 лет [2].
ОБЩАЯ АНГЕДОНИЯ
Здоровые люди
У условно здоровых людей выраженность физической ангедонии отрицательно связана с толщиной верхней лобной извилины и перешейка правой поясной извилины [129], объемом серого вещества в центральной части левой орбитофронтальной коры [144] и фракционной анизотропией в поясе и малых щипцах [139]. Также в выборке молодежи ангедония выше, если ростральные и каудальные медиальная и латеральная борозды орбитофронтальной коры сообщаются (не разделены) [144]. Физическая ангедония положительно связана с объемом серого вещества в левом предклинье и правой задней поясной извилине [78], с размером левого бледного шара, а на уровне тренда – скорлупы [129], отрицательно – с объемом прилежащего ядра [125]. Для хвостатого ядра данные неоднозначны [58, 129].
В британской национально репрезентативной выборке ангедония оказалась связанной с диффузным сокращением серого вещества и увеличением объема белого вещества мозга при нарушении целостности ряда трактов, меньшим объемом таламуса и прилежащего ядра, меньшей толщиной коры в центральной области, лобной покрышке, островке и ростральной части передней поясной извилины. Оценка генетического риска ангедонии также связана со снижением объема серого вещества и целостности трактов белого вещества при его большем объеме, однако ключевые регионы снижения плотности коры располагаются в височной области: в парагиппокампальной и верхней височной извилине и коре островка [149].
Что касается функциональных данных, уровень физической ангедонии позитивно связан с силой активации вентромедиальной префронтальной коры в ответ на эмоционально позитивные стимулы [58]. Интересно, что активность вентромедиальной префронтальной коры в ответ на позитивные стимулы может модерироваться тем, ассоциированы ли они с членами референтной группы испытуемого [65]. Сила ангедонии отрицательно коррелирует с активацией прилежащего ядра, гипоталамуса, передней коры островка и базальной поверхности лобной доли, включая орбитофронтальную кору, при прослушивании музыкальных отрывков, а также с их субъективной оценкой [63].
Показатель ангедонии обратно связан с фМРТ-ответом прилежащего ядра в ситуации вознаграждения [125]. У студентов потеря удовольствия от предвкушения сопряжена с активацией миндалин, передней коры островка и дорсальной передней поясной извилины во время угашения ранее сформированной реакции страха [141]. Также выраженность ангедонии (после учета уровня депрессивной симптоматики) формирует положительные ассоциации с ответом субгенуальной части передней поясной извилины и отрицательные – с активностью ростральной в пробе, в которой требуется оценивать временные отрезки, а обратная связь об успешности попыток дается путем предъявления радостных или испуганных лиц [89].
Студенты с высоким уровнем суммарной (физической и социальной) ангедонии в задаче на определение знака эмоций отличаются меньшим уровнем активации в медиальной префронтальной коре и в миндалине билатерально в ответ на нейтральные портреты и в левой миндалине – на испуганные [130]. Показатель физической ангедонии положительно связан с интенсивностью активации средней височной извилины при построении теорий сознания [132].
Также сила ангедонии отрицательно связана с увеличением эффективной коннективности мезолимбической мотивационной системы с левой премоторной и орбитофронтальной корой, островком и покрышкой островка и с правой нижнетеменной долькой, верхневисочной корой, вторичной слуховой корой при прослушивании обычной музыки островком и латеральной затылочной корой, по сравнению со спектрально аналогичными искаженными звуковыми дорожками. Для эффективных связей правого прилежащего ядра аналогичных корреляций не выявлено [63]. У участников с выраженной ангедонией снижена сила функциональных связей правой миндалины с дорсальной поверхностью передней поясной извилины (при наблюдении счастливой мимики) и с медиальной лобной извилиной (для испуганной мимики) и повышена – между правой корой островка и левой верхней лобной извилиной [130].
Транскраниальная магнитная стимуляция ростромедиальной префронтальной коры, тесно связанной с вентральным стриатумом, тета-вспышками увеличивает амплитуду позитивности вознаграждения (около 300 мс). При этом резидуализированная фМРТ-активность правого стриатума положительно связана с амплитудой позитивности вознаграждения. Сила эффекта ассоциирована с функциональной связанностью медиальной префронтальной коры и вентрального стриатума [103].
В еще одном исследовании здоровым аспирантам были проведены по два сеанса регуляции активности прилежащего ядра с помощью предвкушения позитивных событий в близком будущем. Большинство испытуемых экспериментальной группы успешно справились с этой задачей, а также снизили силу функциональных связей прилежащих ядер и вентромедиальной префронтальной коры в обоих полушариях и улучшили свои показатели в тестах, вовлекающих мотивацию. У представителей плацебо-группы не наблюдалось подобных эффектов [81].
Депрессии и тревожные расстройства
Были продемонстрированы нейроанатомические корреляты ангедонии при различных аффективных расстройствах. В мультицентровом исследовании на 200 взрослых пациентах с БДР выделен кластер симптомов “тревоги и страдания”, включающий ангедонию. Выраженность этой группы симптомов была негативно связана с толщиной коры и с объемом подкорковых областей: средней и задней поясной извилины, верхней, средней и нижней лобных извилин, лобного полюса, гиппокампа, парагиппокампальной извилины, энторинальной коры, предклинья, центральной покрышки, а также миндалины [142]. Неспособность испытывать удовлетворение негативно связано с толщиной коры в левой ростральной передней поясной извилине и левой латеральной орбитофронтальной коре [83]. Интересно, что в разновозрастной группе взрослых пациентов показатель ангедонии после учета влияния пола и возраста положительно коррелировал с правосторонней асимметрией толщины медиальной орбитофронтальной коры, но не с асимметрией поясной извилины [27]. При депрессиях старшего возраста сокращение объема головного мозга и толщина коры не зависят от типа депрессии и, следовательно, от силы ангедонии [1].
При депрессиях показана негативная связь ангедонии с фракционной анизотропией в поясном пучке [62] и положительная – с фракционной анизотропией и радиальной диффузией в правом переднем таламическом излучении и малых щипцах [97]. Для пациентов с первым депрессивным эпизодом, не получавших фармакотерапии, неспособность к получению удовольствия от предвкушения коррелирует с радиальной диффузией в переднем таламическом излучении, поясе, нижнем лобно-затылочном пучке, верхнем продольном пучке и кортикоспинальный тракте [139]. У взрослых пациентов с БАР и их родственников подгруппа с ангедонией отличается меньшей фракционной анизотропией крючковидного пучка, правого височного и теменных окончаний верхнего продольного пучка [23].
У взрослых пациентов с БДР с показателем ангедонии были ассоциированы большие значения ковариации пропорции серого вещества в прилежащем ядре с представленностью серого вещества в миндалине, хвостатом ядре, передней коре островка, передней поясной извилине. При БАР выраженность ангедонии ассоциирована со связанностью доли серого вещества в прилежащем ядре и стриатуме, а также префронтальной коре [55].
Показано, что у молодых пациентов с депрессией снижено отношение сигнала ГАМК к сигналу воды в передней поясной извилине. Уровень ГАМК негативно коррелирует с выраженностью ангедонии [43]. В более поздней работе недостаток ГАМК в передней поясной извилине выявлен только у подгруппы пациентов с выраженной ангедонией. Из оцененных клинических показателей с концентрацией ГАМК ассоциирована исключительно ангедония [42].
Однако в еще одном исследовании уровень ангедонии не коррелировал с уровнями ГАМК и глутамата/глутамина в передней поясной извилине и в стриатуме в группе подростков c БДР [7]. Также стартовые уровни глутамина/глутамата и увеличение уровня ГАМК после курса ТМС левой дорсолатеральной префронтальной коры тета-вспышками при БАР не были связаны с показателями ангедонии [24]. Наконец, в гетерогенной выборке пациентов с депрессией выраженность ангедонии не демонстрировала связи с содержанием глутамата в медиальной префронтальной коре [137].
При объединении взрослых пациентов с униполярной и биполярной депрессией и здоровых лиц с семейным риском депрессии и без такового в одну группу уровень ангедонии позитивно коррелировал с силой реакции правой передней поясной извилины на размер денежного приза и ответом вентрального стриатума при ошибке прогнозирования исхода. Способность ощущать удовлетворение демонстрировала негативную связь с активностью правой передней поясной извилины, лобного полюса, вентрального стриатума в контексте размера ожидаемого вознаграждения [85]. В еще одном исследовании фМРТ-активация ключевых структур системы вознаграждения в мотивационной пробе не различалась между группами здоровых людей и пациентов с БДР, а также не изменялась после курса лечения антидепрессантами [9].
У здоровых людей уровень генетического риска депрессии был предиктором особенностей церебрального ответа, связанных с ангедонией: большего стресс-индуцированного снижения ответа прилежащего ядра и скорлупы при ошибке прогнозирования вознаграждений [52]. При этом в группах пациентов с БДР без медикаментозной нагрузки [72] и с различными формами депрессии [137] не отмечено связей между ангедонией и активностью в стриатуме, связанной с ошибками в предсказании финансового вознаграждения. Депрессивные пациенты в ремиссии отличались от здоровых людей повышенной активностью вентральной покрышки, связанной с опосредованным вознаграждением обучением определению временных отрезков. Однако у пациентов выраженность этой активности была негативно связана с уровнем ангедонии, а у здоровых людей – позитивно [46]. У лиц с БДР, в отличие от здоровых людей, слабее связь между размером вознаграждения и активностью стриатума, уровнем приложенных усилий и скоростью реакции [120].
В пилотном исследовании показано, что в группе лиц с высоким уровнем ангедонии, по сравнению с пациентами с рекуррентным депрессивным расстройством, выше оценки валентности позитивных изображений, однако средний показатель валентности не был связан с выраженностью ангедонии. Также в группе ангедонии выше активация в правых прецентральной и нижнетеменной извилинах, левой средней лобной извилине, предклинье и язычной извилине. Однако у этих испытуемых ниже ответ правой нижней лобной извилины, левых верхней и средней височных извилин, передней и задней поясных извилин, левой коры островка, а также таламуса [91]. У пациентов с БДР ответ вентромедиальной префронтальной коры на позитивные стимулы (напоминания о событиях из жизни испытуемых и портреты с эмоционально позитивной экспрессией) положительно, а миндалины и вентрального стриатума – отрицательно связан с уровнем ангедонии [61].
В социальной oddball-пробе у взрослых пациентов с БДР и их здоровых сверстников показана слабая отрицательная корреляция ответа левой миндалины и показателя ангедонии [68]. Для выборки пациентов с депрессией, не получающих лечения, недостаток увеличения активности прилежащего ядра в ответ на возрастание справедливости предложения партнера в игре “Ультиматум” коррелировал с выраженностью ангедонии [48].
Что касается данных фМРТ покоя, ангедония в отношении предвкушения при БДР ассоциирована с повышенной амплитудой флуктуаций сигнала левой дорсальной передней поясной извилины [83]. Для обсессивно-компульсивного расстройства неспособность испытывать удовлетворение связана с высокой амплитудой флуктуаций сигнала в правой веретенообразной извилине и низкой – в правой скорлупе [30].
Для взрослых пациентов с БДР, в отличие от здоровых людей, коннективность оболочки правого прилежащего ядра с субгенуальной и прегенуальной частью передней поясной извилины и центральной части прилежащего ядра с предклиньем положительно связана со способностью чувствовать удовлетворенность [82]. В динамике депрессивные пациенты, в отличие от здоровых людей, на записях с разницей в один год демонстрируют усиление связей левого вентрального хвостатого ядра с параллельным ослаблением ангедонии [138]. У подростков с депрессивными нарушениями функциональная коннективность дорсомедиальной префронтальной коры с предклиньем в состоянии покоя отрицательно связана с выраженностью депрессивной симптоматики, и в частности ангедонии, как неспособности предвкушать приятные события. Функциональная сопряженность дорсомедиальной префронтальной коры с передней поясной извилиной и парацингулярной областью также положительно связана с уровнем ангедонии [104].
В нескольких исследованиях рассмотрены сетевые аспекты ангедонии при депрессиях. В выборке лиц с различными уровнями тревоги и депрессии сила ангедонии ассоциирована со снижением интенсивности внешних функциональных связей сети пассивного режима работы мозга, сети обнаружения релевантного стимула, дорсальной сети внимания, соматомоторной и зрительной сетей. Также с выраженностью ангедонии связан рост синхронизации внутри зрительной сети и больший объем эмпирических компонент, репрезентирующих зрительную сеть, дорсальную сеть внимания и сеть пассивного режима работы мозга [44]. По другим данным, уровень ангедонии ассоциирован с увеличенной силой связей внутри сети когнитивного контроля и уменьшенной – внутри сети вознаграждения исключительно у пациентов с БДР [47]. В еще одной работе показано, что пациенты с депрессией с преобладанием ангедонического компонента характеризуются гипоконнективностью подкорковой сети и дорсальной сети внимания [133].
Взаимосвязи между интенсивностью ангедонии и фМРТ-ответом определенных структур можно наблюдать в динамике в ходе различных форм терапии. Прием антагониста K-опиодных рецепторов позволяет снизить уровень ангедонии, в основном, относящейся к удовлетворению (но не предвкушению) при аффективных и тревожных расстройствах. Параллельно увеличивается интенсивность ответа вентрального стриатума на предвкушение денежного вознаграждения и денежных штрафов [70]. Способность подростков к получению удовольствия тесно связана с облегчением симптомов депрессии после лечения кетамином. Изменения в активации правого прилежащего ядра в контрастах эмоционального Струп-теста связаны с соответствующими изменениями выраженности ангедонии [123]. Сравнительно низкая связанность левой средней лобной извилины и правой височно-теменной области у пациентов с БДР является предиктором большего снижения ангедонии после прохождения активирующей поведенческой терапии [128].
Транскраниальная стимуляция левой дорсолатеральной префронтальной коры тета-вспышками (в сравнении с плацебо-ТМС) снижает активность хвостатого ядра и скорлупы в ответ на подкрепления у участников со сравнительно слабой ангедонией, у которых эта активность исходно выше, и увеличивает – у испытуемых с выраженной ангедонией [31]. У пациентов с депрессией редукция ангедонии после курса электросудорожной терапии ассоциирована со снижением амплитуды низкочастотных флуктуаций в дорсомедиальной префронтальной коре и с изменением связанности медиального и латерального доменов дорсальной префронтальной коры. Также отмечена позитивная корреляция изменения ангедонии и центральности дорсомедиальной префронтальной, правой дорсолатеральной префронтальной, орбитофронтальной и средней лобной коры [146]. Модификация ключевых симптомов депрессии, включая ангедонию, у пациентов, получавших электросудорожную терапию, ассоциирована с показателями МР-волюметрии в левой постцентральной извилине, правой извилине Гешля и ростральной части правой средней лобной извилины [126].
ШИЗОФРЕНИЯ
У здоровых людей с выраженными шизотипическими чертами личности отмечена связь уровня ангедонии и сниженного объема прилежащего ядра. Апатия, включающая ангедонию как составной симптом, ассоциирована с меньшим объемом скорлупы и правого прилежащего ядра [67]. Пациенты с шизофренией продемонстрировали тренд к отрицательной связи физической ангедонии и объема серого вещества в левом предклинье и правой задней поясной извилине [78]. Также при шизофрении интенсивность ангедонии была ассоциирована с фракционной анизотропией в левом переднем таламическом излучении, зрительном излучении, поясе, нижнем и верхнем (I и II) продольных пучках и валике мозолистого тела [76].
Несколько исследовательских групп рассмотрели связи показателей ангедонии и церебрального ответа пациентов с шизофренией в пробах, предполагающих возможность вознаграждения. Сила реакции ростро-вентральной передней поясной извилины на переход пробы в фазу, в которой испытуемые могли выиграть деньги, положительно коррелирует со значениями шкал социальной амотивации и ангедонии [93]. Как у пациентов с шизофренией, получающих фармакотерапию, так и у здоровых людей выраженность физической ангедонии связана с меньшей активацией вентрального стриатума и вентромедиальной префронтальной коры при наблюдении стимула, предвосхищающего получение денежного вознаграждения (в сравнении с подсказкой о том, что вознаграждения не последует) [28] (рис. 1). В смешанной группе пациентов с шизофренией и шизоаффективным расстройством и здоровых людей активность левого хвостатого ядра и билатеральной дорсолатеральной префронтальной коры в ситуации получения вознаграждения негативно коррелировала с уровнем ангедонии и абулии [29].
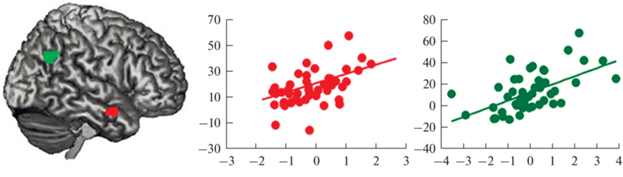
Рис. 1.
Связь уровня физической ангедонии и фМРТ-ответа мозга в пробах с финансовым вознаграждением. Верхняя часть: кластеры деактивации в контрасте “ожидание вознаграждения”/“ожидание отсутствия вознаграждения” (p < < 0.01) и скатерограмма уровня контраста в отмеченном кластере (вентральный стриатум и вентромедиальная префронтальная кора) и показателя физической ангедонии. Нижняя часть: кластеры активации в контрасте “получение вознаграждения”/“неполучение вознаграждения” (p < 0.003) и скатерограмма уровня контраста в отмеченном кластере и показателя физической ангедонии. Z-координаты срезов даны для MNI-пространства. Адаптировано из [28].

У взрослых пациентов уровень активности передней поясной извилины в ответ на стимул, скомбинированный из фотографии лица участника и эмоционально нейтрального слова, был ассоциирован с выраженностью физической, но не социальной ангедонии [77]. При шизофрении, в отличие от нормы, наблюдается большее вовлечение передней поясной извилины и хвостатого ядра при переходе от предвкушения приятного видео к его просмотру [17].
В группе молодежи, включавшей испытуемых с выраженным риском развития психотических расстройств и без такового, уровень общей и физической (но не социальной) ангедонии отрицательно коррелировал с оценками кровотока билатеральной орбитофронтальной коры в покое [19]. У пациентов с шизофренией субъективная выраженность ангедонии была положительно связана с функциональной коннективностью между хвостатым ядром и независимыми компонентами, отражающими центральную сеть исполнительных функций (билатерально) и каудальный домен сети пассивного режима работы мозга. Также сила ангедонии ассоциирована с коннективностью между вентральным стриатумом и левополушарной частью сети исполнительных функций [8].
ПТСР
Значительный корпус исследований посвящен ангедонии в контексте ПТСР. Уровень фракционной анизотропии в крючковидном пучке в момент психологической травмы отрицательно связан с перспективой развития посттравматической ангедонии [36, 57]. Увеличение фракционной анизотропии свода и объема серого вещества в вентромедиальной префронтальной коре и предклинье после травмы также является протективным фактором против развития ангедонии [57].
У взрослых пациентов с ПТСР вследствие угрожающих жизни ситуаций после учета тяжести расстройства выявлялась значимая отрицательная связь активности в веретенообразной извилине в ответ на позитивные изображения и выраженности ангедонии [124]. У женщин с ПТСР уровень ангедонии отрицательно связан с активностью орбитофронтальной и медиальной префронтальной коры, а также части мозжечка при воображении позитивных социальных событий в соответствии с предложенным сценарием [38].
Среди испытуемых, переживших землетрясение (около половины – с установленным диагнозом ПТСР), в подгруппе с более выраженной посттравматической ангедонией отмечены ослабленные функциональные связи левого вентрального бледного шара и региона в предклинье и задней поясной извилине билатерально в состоянии покоя [79]. У пациенток с ПТСР коннективность левого прилежащего ядра с левыми хвостатым ядром и таламусом обратно связана с уровнем ангедонии, в том числе при учете тяжести ПТСР и депрессии в качестве ковариат [96].
Травмирующий опыт, пережитый девочками к 12 годам, влиял на активность их мозга в момент ожидания вознаграждения в 16 лет. Реакции медиальной префронтальной коры и стриатума опосредовали связь между событиями раннего подросткового возраста и последующим развитием депрессии. Также социальный стресс был фактором снижения активности в медиальной префронтальной коре [13]. У подростков, переживших психотравму, скорость реакции на стимулы, связанные с денежным вознаграждением, а также уровень сигнала в левом бледном шаре были связаны с меньшим риском развития депрессивной симптоматики [21].
Гетерогенные выборки
Что касается трансдиагностических исследований, в смешанной группе здоровых людей, пациентов с зависимостями, депрессией, пограничным личностным расстройством, шизофренией и неопределенными психотическими эпизодами уровень ангедонии отрицательно коррелировал с объемом скорлупы и мозжечка. Подгруппы, выделенные по диагностическому признаку, отличались объемом правого прилежащего ядра, однако он не был связан с уровнем ангедонии [107]. Генетический риск ангедонии в гетерогенной выборке ассоциирован с меньшей целостностью белого вещества и объемом серого вещества в областях, связанных с обработкой информации о подкреплениях, но абсолютная сила корреляций для конкретных регионов невелика [135].
При выполнении мотивационной задачи взрослые пациенты с шизофренией, расстройствами аутистического спектра и БАР характеризуются ослабленной активацией в правом стриатуме (рис. 2), а для расстройств аутистического спектра и БАР – также в левом стриатуме. Также лица с БАР отличаются подавленным ответом левой и правой нижнетеменной дольки, правой латеральной лобной области и левой веретенообразной извилины. А для пациентов с шизофренией характерны сниженные значения ответа в правом мозжечке и правой нижнетеменной дольке [110].
Рис. 2.
ФМРТ-ответ мозга при антиципации вознаграждения в различных клинических группах. В левой части картирован фМРТ-ответ кластера, включающего правый вентральный стриатум, в ситуации ожидания вознаграждения, по сравнению с ожиданием отсутствия вознаграждения, цветовая шкала для значения F-критерия. В правой части – величина контраста для показанного кластера в различных группах: Зд – здоровые; Шиз, БАР, БДР и РАС – пациенты с шизофренией, БАР, БДР и расстройствами аутистического спектра соответственно. Адаптировано из [110].

У молодых пациентов, обратившихся в психиатрическую клинику, сила активации вентрального стриатума при несоответствии ожиданий и реального вознаграждения была предиктором снижения уровня ангедонии через 6 месяцев вне зависимости от характеристик полученного пациентами лечения. Снижение ангедонии выступало в качестве медиатора связи между активацией стриатума и улучшением качества жизни пациентов [33].
В гетерогенной выборке пациентов краткосрочная активирующая поведенческая терапия и терапия, основанная на осознанности, показали сопоставимый эффект в снижении уровня ангедонии. Параллельно у испытуемых снижалась сила функциональных связей регионов сети пассивного режима работы мозга и лобно-теменной сети. В особенности ослабевали ассоциации сети пассивного режима работы мозга с левой лобной и затылочной корой, с областью предклинья и задней поясной извилины [14].
СОЦИАЛЬНАЯ АНГЕДОНИЯ
Условно здоровые
Исследования церебральных коррелятов социальной ангедонии у условно здоровых людей отличаются высоким разнообразием используемых типов нервных маркеров и подходов к установлению их ассоциаций с показателем ангедонии. С нейроанатомической точки зрения, показатели социальной ангедонии положительно связаны с толщиной верхней лобной, постцентральной и нижнетеменной извилин, а также с объемом бледного шара [129] и серого вещества в хвостатом ядре [35]. При этом у молодых людей выраженность социальной ангедонии не связана ни с типом морфологии орбитофронтальной коры, ни с объемом серого вещества в каком-либо из ее отделов [144].
У взрослых людей при высокой социальной ангедонии сильнее ответ красного ядра (только при учете уровня социальной тревожности) и таламуса на тахистоскопически предъявляемые грустные фотопортреты [54]. При этом, слабее контраст между определением эмоций на портретах и контрольными условиями в передней медиальной префронтальной области, правой верхней височной извилине и левой соматосенсорной коре [45]. Также при выраженной социальной ангедонии сглаживался контраст в вентролатеральной префронтальной коре между ответом на счастливую и нейтральную мимику [60]. Примечательно то, что не показано значимых результатов для регионов интереса, в которых теоретически ожидался наибольший контраст: миндалины и прилежащего ядра [54].
Молодые люди с повышенным показателем социальной ангедонии в специальной парадигме в большей степени активировали медиальную префронтальную кору в ситуации, моделирующей взаимную симпатию [59]. Выраженность ангедонии у студентов была положительно связана с силой вовлечения височно-теменного сочленения и средней височной извилины при построении теорий сознания и средней височной извилины и клина в пробе на эмпатию [132]. Бледный шар, напротив, в аналогичной пробе больше активен у людей, легко испытывающих радость за другого. В тесте, моделирующем социальную ангедонию, активность дорсолатеральной префронтальной коры ассоциирована с показателями выполнения теста, а активность прилежащего ядра – с выраженностью радости за кого-то другого [90]. Показана связь социальной ангедонии с меньшей активацией отдельного небольшого участка в правой височной области, ассоциированного с построением теорий сознания, в пробе для исследования феномена разделенной радости [87] (рис. 3).
Рис. 3.
Связь степени влияния социального контекста на переживание радости и фМРТ-ответа мозга. В левой части отмечены кластеры, активация которых связана с разностью оценок радости между наличием и отсутствием в воображаемой ситуации друга. Значение этой разности может рассматриваться как противоположное социальной ангедонии. Красным выделены результаты для воображения нейтральных, зеленым – негативных ситуаций. В середине и справа скатерограммы для обоих этих условий. Адаптировано из [87].
Интересно, что после курса тренировки оперативной памяти у испытуемых с высоким уровнем социальной ангедонии увеличилась активность предклинья, передней поясной извилины и дорсального стриатума при ожидании эмоциональных подкреплений и верхней лобной и надкраевой извилин для предвкушения финансового вознаграждения. Однако аналогичные изменения произошли и у лиц с низким уровнем социальной ангедонии, проходивших такой же курс [80].
У молодых людей с высоким уровнем социальной ангедонии усилены функциональные связи ретроспленальной коры с правой веретенообразной извилиной [140], ретроспленальной коры с корой островка в обоих полушариях и со средней лобной извилиной и парагиппокампальной области со средней лобной извилиной [145], прилежащего ядра со средней лобной извилиной, вентрального хвостатого ядра с островковой корой и передней дорсальной скорлупы с верхней лобной извилиной [131] в состоянии покоя. Однако у них слабее функциональные связи гиппокампа с парагиппокампальной корой [145] и прилежащего ядра с задней поясной извилиной [131]. У здоровых людей с социальной ангедонией сеть социальных функций более дифференцирована; усилены ассоциации веретенообразных извилин, миндалин, левого предклинья, правой нижней орбитофронтальной коры и отдельных областей мозжечка [148]. Часть этих изменений, несмотря на то, что они были выявлены на фМРТ покоя, коррелировали с эмоциональной оценкой социальных событий, воображаемых испытуемыми согласно стандартному скрипту [145], с детализацией прогнозируемого испытуемыми исхода социальных событий [140] и с характеристиками социальных отношений людей в реальной жизни [148].
В группе студентов с выраженной социальной ангедонией оценки удовольствия от предвкушения и удовлетворения были позитивно связаны с функциональной сопряженностью островка и правого вентрального хвостатого ядра. У участников с низким уровнем социальной ангедонии степень удовольствия от предвкушения отрицательно коррелировала со связанностью средней лобной извилины и прилежащего ядра билатерально [131]. Также повышенной социальной ангедонии соответствовала большая функциональная коннективность прилежащего ядра и медиальной префронтальной коры в момент, когда симулировалась взаимная симпатия [59].
При интеграции различных типов фМРТ-маркеров у здоровых студентов в момент построения ими теорий сознания наиболее важными предикторами социальной ангедонии были уровень активации височно-теменного сочленения и временная динамика сети, включавшей дорсолатеральную префронтальную и моторную кору, а также поясную извилину [69]. Интересно, что ключевые идентификаторы особенностей социальных отношений испытуемых зависят от уровня их социальной ангедонии. При высоких показателях важнейшим предиктором является топография социальной сети мозга, при низких – система функциональных связей внутри этой сети. Наиболее важными для предсказания социального поведения человека являются связи правой нижней орбитофронтальной коры [147].
Шизофрения
Высокий уровень социальной ангедонии характерен для пациентов с шизофренией [143]. При дебюте шизофрении и при риске развития психоза снижено метилирование ДНК гена рецептора окситоцина, которое отрицательно связано с тяжестью социальной ангедонии специфично в этих клинических группах [4]. Даже среди здоровых людей субъективное переживание социальной ангедонии и сниженная сила ответа вентролатеральной префронтальной коры на позитивную мимику указывают на субклиническую шизофреноподобную (в особенности параноидную) симптоматику [60]. Шизофрению и выраженную социальную ангедонию у здоровых людей роднят нарушения связей в средневисочном блоке сети пассивного режима работы мозга в состоянии покоя, однако конкретные измененные ассоциации при этих состояниях различны [140].
У пациентов с шизофренией показана позитивная корреляция объема серого вещества в миндалинах обоих полушарий с социальной вовлеченностью (сложная метрика, включающая социальную ангедонию) [53]. При шизофрении, в отличие от нормы, социальная ангедония не связана с показателем малого мира на структурных данных в правой 9-й дольке мозжечка. Также социальная ангедония у пациентов с шизофренией более негативно коррелирует с показателем малого мира в левой передней поясной извилине и правом хвостатом ядре и более позитивно – с этим же показателем в левом гиппокампе [64].
В парадигме для изучения теории сознания взрослые пациенты с шизофренией в меньшей степени вовлекают медиальную префронтальную кору. Сила этой активности опосредует связь уровня социальной ангедонии и тяжести других нарушений социальной сферы [25].
В гетерогенной группе, включающей пациентов с шизофренией, сила функциональных связей сети стриатума и сети миндалины в покое позитивно коррелирует с тяжестью ангедонии, однако только у женщин [4]. Церебральная сеть социальных функций, сконструированная на основании мета-анализа релевантных публикаций, у пациентов с шизофренией менее дифференцирована и характеризуется ослабленными функциональными связями веретенообразных извилин, средних височных извилин, левых надкраевой извилины и височного полюса и правой миндалины [148].
Однако до дебюта шизофрении нейрофизиологические различия могут не проявляться. Так, подростки с высоким и обычным риском развития психотического эпизода не отличались по оценкам активности и силы функциональных связей стриатума и вентромедиальной префронтальной коры при получении позитивной социальной обратной связи [94].
Прочие расстройства
Что касается других психопатологических состояний, им посвящены единичные исследования, объединенные в этом разделе. В частности, показано, что расстройства аутистического спектра могут быть предсказаны на основании фМРТ-данных, записанных при выполнении двух социоэмоциональных проб. Ключевыми для классификации были недостаток активации веретенообразной извилины и затылочной области распознавания лиц, задней верхней височной борозды и височно-теменного сочленения. Присвоенные классификатором значения демонстрировали позитивную связь с интенсивностью социальной ангедонии в группе пациентов [15]. В гетерогенной группе удалось достичь достаточно точного предсказания уровня социальной ангедонии, в основном, на основании данных о функциональных связях регионов мозга на фМРТ покоя. Наиболее значимыми предикторами были изменения коннективности узлов сети пассивного режима работы мозга с узлами зрительной сети, лобно-теменной сети контроля, в меньшей степени – подкорковой сети [88].
Несколько работ посвящены роли хвостатого ядра как субстрата социальной ангедонии при психических нарушениях. Так, у пациентов с БДР выявлена связь интенсивности социальной ангедонии и объема серого вещества хвостатого ядра, сохранявшаяся после учета пола испытуемых, тяжести депрессии, получаемого лечения и числа госпитализаций [35]. У женщин с пограничным личностным расстройством более выражена активация в хвостатом ядре в ответ на эмоциональные портреты, не связанная, тем не менее, с показателями принятия эмоций [74].
ЗАКЛЮЧЕНИЕ
1. Ангедония, и в частности социальная ангедония, – важный симптом для развития аффективных расстройств, шизофрении и посттравматического стрессового расстройства. Социальная ангедония как отдельный феномен наиболее изучена при шизофрении; при других психопатологических состояниях ее, скорее, стоит рассматривать как проявление общей ангедонии в социальной сфере.
2. На уровне нейромедиаторных систем проявления ангедонии предсказуемо связываются с патологией дофаминэргической трансмиссии. Данные относительно вовлеченности ГАМК-эргической системы противоречивы.
3. При аффективных и тревожных расстройствах наблюдаются изменения фМРТ-ответа префронтальной коры, височно-теменной области, островка, базальных ядер и миндалины в социальном контексте. Однако результаты приблизительно в равной доле включают гипер- и гипоактивацию и не локализуются в каком-либо ограниченном анатомическом регионе.
4. Уровень общей ангедонии связан с меньшим объемом прилежащего ядра (рис. 4). Также интенсивность ангедонии ассоциирована с большим показателем фракционной анизотропии и радиальной диффузии в переднем таламическом излучении.
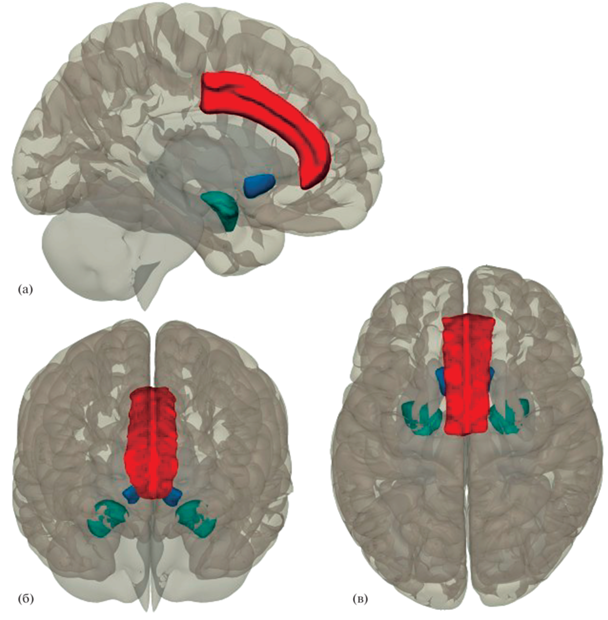
Рис. 4.
Основные регионы мозга, ассоциированные с ангедонией. Регионы выделены на фоне полупрозрачного мозга на: а – вид изнутри, б – вид спереди и в – вид сверху. Синим изображены прилежащие ядра, сниженный объем и активация (в особенности в выборках пациентов с депрессиями) которых связаны с физической ангедонией. Бирюзовым выделены миндалины, активация которых отрицательно связана с физической ангедонией. Красным изображена передняя поясная извилина, относительно которой данные противоречивы; тем не менее, в когорте пациентов с шизофренией большая активация региона ассоциирована с выраженной физической ангедонией.
5. В различных когортах, в особенности у пациентов с депрессией воспроизводится отрицательная связь общей ангедонии и активации вентрального стриатума (прилежащего ядра) в различных мотивационных задачах. Также ангедония может быть ассоциирована с ослаблением ответа миндалин и усилением реакции передней поясной извилины в ситуациях, предполагающих возможность того или иного вознаграждения (рис. 4). Значения ангедонии коррелируют с показателями внешних функциональных связей стриатума, а также префронтальной коры.
6. Церебральные корреляты социальной ангедонии не повторяют таковые для общей ангедонии. Результаты крайне разнородны, однако наиболее часто социальная ангедония ассоциирована с гипер- и гипоактивацией участков префронтальной коры и различных височных и теменно-височных областей.
Работа поддержана грантом № 21-15-00209 Российского научного фонда.
Список литературы
Аведисова А.С., Захарова К.В., Гаскин В.В. и др. Клинические и нейровизуализационные характеристики апатической депрессии // Журн. неврологии и психиатрии. 2017. Т. 117. № 8. С. 11–17. https://doi.org/10.17116/jnevro20171178111-17
Abraham E., Wang Y., Svob C. et al. Organization of the social cognition network predicts future depression and interpersonal impairment: a prospective family-based study // Neuropsychopharmacology. 2022. V. 47. № 2. P. 531–542. https://doi.org/10.1038/s41386-021-01065-8
Alacreu-Crespo A., Olié E., Le Bars E. et al. Prefrontal activation in suicide attempters during decision making with emotional feedback // Translational Psychiatry. 2020. V. 10. № 1. e313. https://doi.org/10.1038/s41398-020-00995-z
Bang M., Kang J.I., Kim S.J. et al. Reduced DNA Methylation of the Oxytocin Receptor Gene Is Associated With Anhedonia-Asociality in Women With Recent-Onset Schizophrenia and Ultra-high Risk for Psychosis // Schizophrenia Bulletin. 2019. V. 45. № 6. P. 1279–1290. https://doi.org/10.1093/schbul/sbz016
Borsini A., Wallis A.J., Zunszain P. et al. Characterizing anhedonia: A systematic review of neuroimaging across the subtypes of reward processing deficits in depression // Cognitive, Affective, & Behavioral Neuroscience. 2020. V. 20. № 4. P. 816–841. https://doi.org/10.3758/s13415-020-00804-6
Bracht T., Linden D., Keedwell P. A review of white matter microstructure alterations of pathways of the reward circuit in depression // J. Affective Disorders. 2015. V. 187. P. 45–53. https://doi.org/10.1016/j.jad.2015.06.041
Bradley K.A., Alonso C.M., Mehra L.M. et al. Elevated striatal γ-aminobutyric acid in youth with major depressive disorder // Progress in Neuro-Psychopharmacology & Biological Psychiatry. 2018. V. 86. P. 203–210. https://doi.org/10.1016/j.pnpbp.2018.06.004
Brakowski J., Manoliu A., Homan P. et al. Aberrant striatal coupling with default mode and central executive network relates to self-reported avolition and anhedonia in schizophrenia // J. Psychiatric Research. 2022. V. 145. P. 263–275. https://doi.org/10.1016/j.jpsychires.2020.10.047
Brandt I.M., Köhler-Forsberg K., Ganz M. et al. Reward processing in major depressive disorder and prediction of treatment response – Neuropharm study // European Neuropsychopharmacology. 2021. V. 44. P. 23–33. https://doi.org/10.1016/j.euroneuro.2020.12.010
Brown V.M., Zhu L., Solway A. et al. Reinforcement Learning Disruptions in Individuals With Depression and Sensitivity to Symptom Change Following Cognitive Behavioral Therapy // JAMA Psychiatry. 2021. V. 78. № 10. P. 1113–1122. https://doi.org/10.1001/jamapsychiatry.2021.1844
Burklund L.J., Craske M.G., Taylor S.E., Lieberman M.D. Altered emotion regulation capacity in social phobia as a function of comorbidity // Social Cognitive & Affective Neuroscience. 2015. V. 10. № 2. P. 199–208. https://doi.org/10.1093/scan/nsu058
Cáceda R., James G.A., Stowe Z.N. et al. The neural correlates of low social integration as a risk factor for suicide // European Archives of Psychiatry and Clinical Neuroscience. 2020. V. 270. № 5. P. 619–631. https://doi.org/10.1007/s00406-019-00990-6
Casement M.D., Guyer A.E., Hipwell A.E. et al. Girls’ challenging social experiences in early adolescence predict neural response to rewards and depressive symptoms // Developmental Cognitive Neuroscience. 2014. V. 8. P. 18–27. https://doi.org/10.1016/j.dcn.2013.12.003
Cernasov P., Walsh E.C., Kinard J.L. et al. Multilevel growth curve analyses of behavioral activation for anhedonia (BATA) and mindfulness-based cognitive therapy effects on anhedonia and resting-state functional connectivity: Interim results of a randomized trial // Journal of Affective Disorders. 2021. V. 292. P. 161–171. https://doi.org/10.1016/j.jad.2021.05.054
Chanel G., Pichon S., Conty L. et al. Classification of autistic individuals and controls using cross-task characterization of fMRI activity // Neuroimage: Clinical. 2015. V. 10. P. 78–88. https://doi.org/10.1016/j.nicl.2015.11.010
Chiapponi C., Piras F., Piras F. et al. GABA System in Schizophrenia and Mood Disorders: A Mini Review on Third-Generation Imaging Studies // Frontiers in Psychiatry. 2016. V. 7. e61. https://doi.org/10.3389/fpsyt.2016.00061
Choi S.-H., Lee H., Ku J. et al. Neural basis of anhedonia as a failure to predict pleasantness in schizophrenia // World J. Biological Psychiatry. 2014. V. 15. № 7. P. 525–533. https://doi.org/10.3109/15622975.2013.819121
Costi S., Morris L.S., Collins A. et al. Peripheral immune cell reactivity and neural response to reward in patients with depression and anhedonia // Translational Psychiatry. 2021. V. 11. № 1. e565. https://doi.org/10.1038/s41398-021-01668-1
Cressman V.L., Schobel S.A., Steinfeld S. et al. Anhedonia in the psychosis risk syndrome: associations with social impairment and basal orbitofrontal cortical activity // NPJ Schizophrenia. 2015. V. 1. e15020. https://doi.org/10.1038/npjschz.2015.20
Cusi A.M., Nazarov A., Holshausen K. et al. Systematic review of the neural basis of social cognition in patients with mood disorders // J. Psychiatry & Neuroscience. 2012. V. 37. № 3. P. 154–169. https://doi.org/10.1503/jpn.100179
Dennison M.J., Sheridan M.A., Busso D.S. et al. Neurobehavioral markers of resilience to depression amongst adolescents exposed to child abuse // J. Abnormal Psychology. 2016. V. 125. № 8. P. 1201–1212. https://doi.org/10.1037/abn0000215
Derntl B., Seidel E.-M., Eickhoff S.B. et al. Neural correlates of social approach and withdrawal in patients with major depression // Social Neuroscience. 2011. V. 6. № 5–6. P. 482–501. https://doi.org/10.1080/17470919.2011.579800
Diaz A.P., Fernandes B.S., Teixeira A.L. et al. White matter microstructure associated with anhedonia among individuals with bipolar disorders and high-risk for bipolar disorders // J. Affective Disorders. 2022. V. 300. P. 91–98. https://doi.org/10.1016/j.jad.2021.12.037
Diederichs C., DeMayo M.M., Cole J. et al. Intermittent Theta-Burst Stimulation Transcranial Magnetic Stimulation Increases GABA in the Medial Prefrontal Cortex: A Preliminary Sham-Controlled Magnetic Resonance Spectroscopy Study in Acute Bipolar Depression // Frontiers in Psychiatry. 2021. V. 12. e665402. https://doi.org/10.3389/fpsyt.2021.665402
Dodell-Feder D., Tully L.M., Lincoln S.H., Hooker C.I. The neural basis of theory of mind and its relationship to social functioning and social anhedonia in individuals with schizophrenia // Neuroimage: Clinical. 2013. V. 4. P. 154–163. https://doi.org/10.1016/j.nicl.2013.11.006
Domschke K., Dannlowski U., Ohrmann P. et al. Cannabinoid receptor 1 (CNR1) gene: impact on antidepressant treatment response and emotion processing in major depression // European Neuropsychopharmacology. 2008. V. 18. № 10. P. 751–759. https://doi.org/10.1016/j.euroneuro.2008.05.003
Dotson V.M., Taiwo Z., Minto L.R. et al. Orbitofrontal and Cingulate Thickness Asymmetry Associated with Depressive Symptom Dimensions // Cognitive, Affective, & Behavioral Neuroscience. 2021. V. 21. № 6. P. 1297–1305. https://doi.org/10.3758/s13415-021-00923-8
Dowd E.C., Barch D.M. Pavlovian reward prediction and receipt in schizophrenia: relationship to anhedonia // PLoS One. 2012. V. 7. № 5. e35622. https://doi.org/10.1371/journal.pone.0035622
Dowd E.C., Frank M.J., Collins A. et al. Probabilistic Reinforcement Learning in Patients With Schizophrenia: Relationships to Anhedonia and Avolition // Biological Psychiatry: Cognitive Neuroscience & Neuroimaging. 2016. V. 1. № 5. P. 460–473. https://doi.org/10.1016/j.bpsc.2016.05.005
Du H., Xia J., Fan J. et al. Spontaneous neural activity in the right fusiform gyrus and putamen is associated with consummatory anhedonia in obsessive compulsive disorder // Brain Imaging & Behavior. In print. https://doi.org/10.1007/s11682-021-00619-0
Duprat R., Wu G.-R., De Raedt R., Baeken C. Accelerated iTBS treatment in depressed patients differentially modulates reward system activity based on anhedonia // World Journal of Biological Psychiatry. 2018. V. 19. № 7. P. 497–508. https://doi.org/10.1080/15622975.2017.1355472
Eckstrand K.L., Flores Jr. L.E., Cross M. et al. Social and Non-social Reward Processing and Depressive Symptoms Among Sexual Minority Adolescents // Frontiers in Behavioral Neuroscience. 2019. V. 13. e209. https://doi.org/10.3389/fnbeh.2019.00209
Eckstrand K.L., Forbes E.E., Bertocci M.A. et al. Anhedonia Reduction and the Association Between Left Ventral Striatal Reward Response and 6-Month Improvement in Life Satisfaction Among Young Adults // JAMA Psychiatry. 2019. V. 76. № 9. P. 958–965. https://doi.org/10.1001/jamapsychiatry.2019.0864
Ely B.A., Nguyen T.N.B., Tobe R.H. et al. Multimodal Investigations of Reward Circuitry and Anhedonia in Adolescent Depression // Frontiers in Psychiatry. 2021. V. 12. e678709. https://doi.org/10.3389/fpsyt.2021.678709
Enneking V., Krüssel P., Zaremba D. et al. Social anhedonia in major depressive disorder: a symptom-specific neuroimaging approach // Neuropsychopharmacology. 2019. V. 44. № 5. P. 883–889. https://doi.org/10.1038/s41386-018-0283-6
Fani N., Michopoulos V., van Rooij S.J.H. et al. Structural connectivity and risk for anhedonia after trauma: A prospective study and replication // Journal of Psychiatric Research. 2019. V. 116. P. 34–41. https://doi.org/10.1016/j.jpsychires.2019.05.009
Ferenczi E.A., Zalocusky K.A., Liston C. et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior // Science. 2016. V. 351. № 6268. aac9698. https://doi.org/10.1126/science.aac9698
Frewen P.A., Dozois D.J.A., Lanius R.A. Assessment of anhedonia in psychological trauma: psychometric and neuroimaging perspectives // European J. Psychotraumatology. 2012. e3. https://doi.org/10.3402/ejpt.v3i0.8587
Frey A.-L., McCabe C. Effects of serotonin and dopamine depletion on neural prediction computations during social learning // Neuropsychopharmacology. 2020. V. 45. № 9. P. 1431–1437. https://doi.org/10.1038/s41386-020-0678-z
Frey A.-L., McCabe C. Impaired social learning predicts reduced real-life motivation in individuals with depression: A computational fMRI study // J. Affective Disorders. 2020. V. 263. P. 698–706. https://doi.org/10.1016/j.jad.2019.11.049
Fusar-Poli P., Placentino A., Carletti F. et al. Functional atlas of emotional faces processing: a voxel-based meta-analysis of 105 functional magnetic resonance imaging studies // J. Psychiatry & Neuroscience. 2009. V. 34. № 6. P. 418–432.
Gabbay V., Bradley K.A., Mao X. et al. Anterior cingulate cortex γ-aminobutyric acid deficits in youth with depression // Translational Psychiatry. 2017. V. 7. № 8. e1216. https://doi.org/10.1038/tp.2017.187
Gabbay V., Mao X., Klein R.G. et al. Anterior cingulate cortex γ-aminobutyric acid in depressed adolescents: relationship to anhedonia // Archives of General Psychiatry. 2012. V. 69. № 2. P. 139–149. https://doi.org/10.1001/archgenpsychiatry.2011.131
Geller W.N., Liu K., Warren S.L. Specificity of anhedonic alterations in resting-state network connectivity and structure: A transdiagnostic approach // Psychiatry Research: Neuroimaging. 2021. V. 317. e111349. https://doi.org/10.1016/j.pscychresns.2021.111349
Germine L.T., Garrido L., Bruce L., Hooker C. Social anhedonia is associated with neural abnormalities during face emotion processing // Neuroimage. 2011. V. 58. № 3. P. 935–945. https://doi.org/10.1016/j.neuroimage.2011.06.059
Geugies H., Mocking R.J.T., Figueroa C.A. et al. Impaired reward-related learning signals in remitted unmedicated patients with recurrent depression // Brain. 2019. V. 142. № 8. P. 2510–2522. https://doi.org/10.1093/brain/awz167
Gong L., He C., Zhang H. et al. Disrupted reward and cognitive control networks contribute to anhedonia in depression // J. Psychiatric Research. 2018. V. 103. P. 61–68. https://doi.org/10.1016/j.jpsychires.2018.05.010
Gradin V.B., Pérez A., MacFarlane J.A. et al. Abnormal brain responses to social fairness in depression: an fMRI study using the Ultimatum Game // Psychological Medicine. 2015. V. 45. № 6. P. 1241–1251. https://doi.org/10.1017/S0033291714002347
Gradin V.B., Pérez A., MacFarlane J.A. et al. Neural correlates of social exchanges during the Prisoner’s Dilemma game in depression // Psychological Medicine. 2016. V. 46. № 6. P. 1289–1300. https://doi.org/10.1017/S0033291715002834
Greening S.G., Osuch E.A., Williamson P.C., Mitchell D.G.V. Emotion-related brain activity to conflicting socio-emotional cues in unmedicated depression // Journal of Affective Disorders. 2013. V. 150. № 3. P. 1136–1141. https://doi.org/10.1016/j.jad.2013.05.053
Groschwitz R.C., Plener P.L., Groen G. et al. Differential neural processing of social exclusion in adolescents with non-suicidal self-injury: An fMRI study // Psychiatry Research: Neuroimaging. 2016. V. 255. P. 43–49. https://doi.org/10.1016/j.pscychresns.2016.08.001
Guffanti G., Kumar P., Admon R. et al. Depression genetic risk score is associated with anhedonia-related markers across units of analysis // Translational Psychiatry. 2019. V. 9. № 1. e236. https://doi.org/10.1038/s41398-019-0566-7
Günther V., Lindner C., Dannlowski U. et al. Amygdalar Gray Matter Volume and Social Relating in Schizophrenia // Neuropsychobiology. 2016. V. 74. № 3. P. 139–143. https://doi.org/10.1159/000458528
Günther V., Zimmer J., Kersting A. et al. Automatic processing of emotional facial expressions as a function of social anhedonia // Psychiatry Research: Neuroimaging. 2017. V. 270. P. 46–53. https://doi.org/10.1016/j.pscychresns.2017.10.002
Han S., Cui Q., Wang X. et al. The anhedonia is differently modulated by structural covariance network of NAc in bipolar disorder and major depressive disorder // Progress in Neuropsychopharmacology & Biological Psychiatry. 2020. V. 99. e109865. https://doi.org/10.1016/j.pnpbp.2020.109865
Hao L., Yang J., Wang Y. et al. Neural correlates of causal attribution in negative events of depressed patients: Evidence from an fMRI study // Clinical Neurophysiology. 2015. V. 126. № 7. P. 1331–1337. https://doi.org/10.1016/j.clinph.2014.10.146
Harnett N.G., Stevens J.S., van Rooij S.J.H. et al. Multimodal structural neuroimaging markers of risk and recovery from posttrauma anhedonia: A prospective investigation // Depression & Anxiety. 2021. V. 38. № 1. P. 79–88. https://doi.org/10.1002/da.23104
Harvey P.-O., Pruessner J., Czechowska Y., Lepage M. Individual differences in trait anhedonia: a structural and functional magnetic resonance imaging study in non-clinical subjects // Molecular Psychiatry. 2007. V. 12. № 8. P. 767–775. https://doi.org/10.1038/sj.mp.4002021
Healey K.L., Morgan J., Musselman S.C. et al. Social anhedonia and medial prefrontal response to mutual liking in late adolescents // Brain & Cognition. 2014. V. 89. P. 39–50. https://doi.org/10.1016/j.bandc.2013.12.004
Hooker C.I., Benson T.L., Gyurak A. et al. Neural activity to positive expressions predicts daily experience of schizophrenia-spectrum symptoms in adults with high social anhedonia // J. Abnormal Psychology. 2014. V. 123. № 1. P. 190–204. https://doi.org/10.1037/a0035223
Keedwell P.A., Andrew C., Williams S.C.R. et al. The neural correlates of anhedonia in major depressive disorder // Biological Psychiatry. 2005. V. 58. № 11. P. 843–853. https://doi.org/10.1016/j.biopsych.2005.05.019
Keedwell P.A., Chapman R., Christiansen K. et al. Cingulum white matter in young women at risk of depression: the effect of family history and anhedonia // Biological Psychiatry. 2012. V. 72. P. 296–302. https://doi.org/10.1016/j.biopsych.2012.01.022
Keller J., Young C.B., Kelley E. et al. Trait anhedonia is associated with reduced reactivity and connectivity of mesolimbic and paralimbic reward pathways // J. Psychiatric Research. 2013. V. 47. № 10. P. 1319–1328. https://doi.org/10.1016/j.jpsychires.2013.05.015
Kim B.-H., Kim H.E., Lee J.S., Kim J.-J. Anhedonia Relates to the Altered Global and Local Grey Matter Network Properties in Schizophrenia // J. Clinical Medicine. 2021. V. 10. № 7. e1395. https://doi.org/10.3390/jcm10071395
Kim K., Johnson M.K. Activity in ventromedial prefrontal cortex during self-related processing: positive subjective value or personal significance? // Social Cognitive & Affective Neuroscience. 2015. V. 10. № 4. P. 494–500. https://doi.org/10.1093/scan/nsu078
Kini P., Wong J., McInnis S. et al. The effects of gratitude expression on neural activity // Neuroimage. 2016. V. 128. P. 1–10. https://doi.org/10.1016/j.neuroimage.2015.12.040
Kirschner M., Schmidt A., Hodzic-Santor B. et al. Orbitofrontal-Striatal Structural Alterations Linked to Negative Symptoms at Different Stages of the Schizophrenia Spectrum // Schizophrenia Bulletin. 2021. V. 47. № 3. P. 849–863. https://doi.org/10.1093/schbul/sbaa169
Koeppel C.J., Herrmann T., Weidner K. et al. Same salience, different consequences: Disturbed inter-network connectivity during a social oddball paradigm in major depressive disorder // Neuroimage: Clinical. 2021. V. 31. e102731. https://doi.org/10.1016/j.nicl.2021.102731
Krohne L.G., Wang Y., Hinrich J.L. et al. Classification of social anhedonia using temporal and spatial network features from a social cognition fMRI task // Human Brain Mapping. 2019. V. 40. № 17. P. 4965–4981. https://doi.org/10.1002/hbm.24751
Krystal A.D., Pizzagalli D.A., Smoski M. et al. A randomized proof-of-mechanism trial applying the 'fast-fail' approach to evaluating κ-opioid antagonism as a treatment for anhedonia // Nature Medicine. 2020. V. 26. № 5. P. 760–768. https://doi.org/10.1038/s41591-020-0806-7
Kujawa A., Burkhouse K.L. Vulnerability to Depression in Youth: Advances from Affective Neuroscience // Biological Psychiatry: Cognitive Neuroscience & Neuroimaging. 2017. V. 2. № 1. P. 28–37. https://doi.org/10.1016/j.bpsc.2016.09.006
Kumar P., Goer F., Murray L. et al. Impaired reward prediction error encoding and striatal-midbrain connectivity in depression // Neuropsychopharmacology. 2018. V. 43. № 7. P. 1581–1588. https://doi.org/10.1038/s41386-018-0032-x
Kumari V., Peters E., Guinn A. et al. Mapping Depression in Schizophrenia: A Functional Magnetic Resonance Imaging Study // Schizophrenia Bulletin. 2016. V. 42. № 3. P. 802–813. https://doi.org/10.1093/schbul/sbv186
Lamers A., Toepper M., Fernando S.C. et al. Caudate hyperactivation during the processing of happy faces in borderline personality disorder // Neuropsychologia. 2021. V. 163. e108086. https://doi.org/10.1016/j.neuropsychologia.2021.108086
Lee H.-S., Lee J.-E., Lee K.-U., Kim Y.-H. Neural changes associated with emotion processing in children experiencing peer rejection: a functional MRI study // J. Korean Medical Science. 2014. V. 29. № 9. P. 1293–1300. https://doi.org/10.3346/jkms.2014.29.9.1293
Lee J.S., Han K., Lee S.-K. et al. Altered structural connectivity and trait anhedonia in patients with schizophrenia // Neuroscience Letters. 2014. V. 579. P. 7–11. https://doi.org/10.1016/j.neulet.2014.07.001
Lee J.S., Kim E.S., Kim E.J. et al. The relationship between self-referential processing-related brain activity and anhedonia in patients with schizophrenia // Psychiatry Research: Neuroimaging. 2016. V. 254. P. 112–118. https://doi.org/10.1016/j.pscychresns.2016.06.010
Lee J.S., Park H.-J., Chun J.W. et al. Neuroanatomical correlates of trait anhedonia in patients with schizophrenia: a voxel-based morphometric study // Neuroscience Letters. 2011. V. 489. № 2. P. 110–114. https://doi.org/10.1016/j.neulet.2010.11.076
Li G., Cao C., Fang R. et al. Neural correlates of posttraumatic anhedonia symptoms: Decreased functional connectivity between ventral pallidum and default mode network regions // J. Psychiatric Research. 2021. V. 140. P. 30–34. https://doi.org/10.1016/j.jpsychires.2021.05.061
Li X., Li Z., Li K. et al. The neural transfer effect of working memory training to enhance hedonic processing in individuals with social anhedonia // Scientific Reports. 2016. V. 6. e35481. https://doi.org/10.1038/srep35481
Li Z., Zhang C.-Y., Huang J. et al. Improving motivation through real-time fMRI-based self-regulation of the nucleus accumbens // Neuropsychology. 2018. V. 32. № 6. P. 764–776. https://doi.org/10.1037/neu0000425
Liu R., Wang Y., Chen X. et al. Anhedonia correlates with functional connectivity of the nucleus accumbens subregions in patients with major depressive disorder // Neuroimage: Clinical. 2021. V. 30. e102599. https://doi.org/10.1016/j.nicl.2021.102599
Liu X., Li L., Li M. et al. Characterizing the subtype of anhedonia in major depressive disorder: A symptom-specific multimodal MRI study // Psychiatry Research: Neuroimaging. 2021. V. 308. e111239. https://doi.org/10.1016/j.pscychresns.2020.111239
MacNamara A., Klumpp H., Kennedy A.E. et al. Transdiagnostic neural correlates of affective face processing in anxiety and depression // Depression & Anxiety. 2017. V. 34. № 7. P. 621–631. https://doi.org/10.1002/da.22631
Macoveanu J., Meluken I., Chase H.W. et al. Reduced frontostriatal response to expected value and reward prediction error in remitted monozygotic twins with mood disorders and their unaffected high-risk co-twins // Psychological Medicine. 2021. V. 51. № 10. P. 1637–1646. https://doi.org/10.1017/S0033291720000367
Malejko K., Neff D., Brown R. et al. Neural Correlates of Social Inclusion in Borderline Personality Disorder // Frontiers in Psychiatry. 2018. V. 9. e653. https://doi.org/10.3389/fpsyt.2018.00653
Matsunaga M., Kawamichi H., Umemura T. et al. Neural and Genetic Correlates of the Social Sharing of Happiness // Frontiers in Neuroscience. 2017. V. 11. e718. https://doi.org/10.3389/fnins.2017.00718
Mellem M.S., Liu Y., Gonzalez H. et al. Machine Learning Models Identify Multimodal Measurements Highly Predictive of Transdiagnostic Symptom Severity for Mood, Anhedonia, and Anxiety // Biological Psychiatry: Cognitive Neuroscience & Neuroimaging. 2020. V. 5. № 1. P. 56–67. https://doi.org/10.1016/j.bpsc.2019.07.007
Mies G.W., Van den Berg I., Franken I.H.A. et al. Neurophysiological correlates of anhedonia in feedback processing // Frontiers in Human Neuroscience. 2013. V. 7. e96. https://doi.org/10.3389/fnhum.2013.00096
Mirabito G., Taiwo Z., Bezdek M., Light S.N. Fronto-striatal activity predicts anhedonia and positive empathy subtypes // Brain Imaging & Behavior. 2019. V. 13. № 6. P. 1554–1565. https://doi.org/10.1007/s11682-019-00081-z
Mitterschiffthaler M.T., Kumari V., Malhi G.S. et al. Neural response to pleasant stimuli in anhedonia: an fMRI study // Neuroreport. 2003. V. 14. № 2. P. 177–182. https://doi.org/10.1097/00001756-200302100-00003
Morgan J.K., Silk J.S., Woods B.K., Forbes E.E. Differential neural responding to affective stimuli in 6- to 8-year old children at high familial risk for depression: Associations with behavioral reward seeking // J. Affective Disorders. 2019. V. 257. P. 445–453. https://doi.org/10.1016/j.jad.2019.06.058
Park I.H., Chun J.W., Park H.-J. et al. Altered cingulo-striatal function underlies reward drive deficits in schizophrenia // Schizophrenia Research. 2015. V. 161. № 2–3. P. 229–236. https://doi.org/10.1016/j.schres.2014.11.005
Pelletier-Baldelli A., Orr J.M., Bernard J.A., Mittal V.A. Social reward processing: A biomarker for predicting psychosis risk? // Schizophrenia Research. 2020. V. 226. P. 129–137. https://doi.org/10.1016/j.schres.2018.07.042
Perini I., Gustafsson P.A., Hamilton J.P. et al. Brain-based Classification of Negative Social Bias in Adolescents With Nonsuicidal Self-injury: Findings From Simulated Online Social Interaction // EClinicalMedicine. 2019. V. 13. P. 81–90. https://doi.org/10.1016/j.eclinm.2019.06.016
Pessin S., Philippi C.L., Reyna L. et al. Influence of anhedonic symptom severity on reward circuit connectivity in PTSD // Behavioral Brain Research. 2021. V. 407. e113258. https://doi.org/10.1016/j.bbr.2021.113258
Pfarr J.-K., Brosch K., Meller T. et al. Brain structural connectivity, anhedonia, and phenotypes of major depressive disorder: A structural equation model approach // Human Brain Mapping. 2021. V. 42. № 15. P. 5063–5074. https://doi.org/10.1002/hbm.25600
Pisoni A., Davis S.W., Smoski M. Neural signatures of saliency-mapping in anhedonia: A narrative review // Psychiatry Research. 2021. V. 304. e114123. https://doi.org/10.1016/j.psychres.2021.114123
Pulcu E., Lythe K., Elliott R. et al. Increased amygdala response to shame in remitted major depressive disorder // PLoS One. 2014. V. 9. № 1. e86900. .https://doi.org/10.1371/journal.pone.0086900
Quarmley M.E., Nelson B.D., Clarkson T. et al. I Knew You Weren’t Going to Like Me! Neural Response to Accurately Predicting Rejection Is Associated With Anxiety and Depression // Frontiers in Behavioral Neuroscience. 2019. V. 13. e219. https://doi.org/10.3389/fnbeh.2019.00219
Regenbogen C., Kellermann T., Seubert J. et al. Neural responses to dynamic multimodal stimuli and pathology-specific impairments of social cognition in schizophrenia and depression // British J. Psychiatry. 2015. V. 206. № 3. P. 198–205. https://doi.org/10.1192/bjp.bp.113.143040
Rütgen M., Pfabigan D.M., Tik M. et al. Detached empathic experience of others' pain in remitted states of depression – An fMRI study // Neuroimage: Clinical. 2021. V. 31. e102699. https://doi.org/10.1016/j.nicl.2021.102699
Ryan J., Pouliot J.J., Hajcak G., Nee D.E. Manipulating Reward Sensitivity Using Reward Circuit-Targeted Transcranial Magnetic Stimulation // Biological Psychiatry: Cognitive Neuroscience & Neuroimaging. 2022. S2451-9022(22)00050-7. https://doi.org/10.1016/j.bpsc.2022.02.011
Rzepa E., McCabe C. Anhedonia and depression severity dissociated by dmPFC resting-state functional connectivity in adolescents // J. Psychopharmacology. 2018. V. 32. № 10. P. 1067–1074. https://doi.org/10.1177/0269881118799935
Sankar A., Yttredahl A.A., Fourcade E.W. et al. Dissociable Neural Responses to Monetary and Social Gain and Loss in Women With Major Depressive Disorder // Frontiers in Behavioral Neuroscience. 2019. V. 13. e149. https://doi.org/10.3389/fnbeh.2019.00149
Schaefer H.S., Putnam K.M., Benca R.M., Davidson R.J. Event-related functional magnetic resonance imaging measures of neural activity to positive social stimuli in pre- and post-treatment depression // Biological Psychiatry. 2006. V. 60. № 9. P. 974–986. https://doi.org/10.1016/j.biopsych.2006.03.024
Schaub A.-C., Kirschner M., Schweinfurth N. et al. Neural mapping of anhedonia across psychiatric diagnoses: A transdiagnostic neuroimaging analysis // Neuroimage: Clinical. 2021. V. 32. e102825. https://doi.org/10.1016/j.nicl.2021.102825
Schilbach L., Müller V.I., Hoffstaedter F. et al. Meta-analytically informed network analysis of resting state FMRI reveals hyperconnectivity in an introspective socio-affective network in depression // PLoS One. 2014. V. 9. № 4. e94973. https://doi.org/10.1371/journal.pone.0094973
Schwartz K.T.G., Kryza–Lacombe M., Liuzzi M.T. et al. Social and Non-social Reward: A Preliminary Examination of Clinical Improvement and Neural Reactivity in Adolescents Treated With Behavioral Therapy for Anxiety and Depression // Frontiers in Behavioral Neuroscience. 2019. V. 13. e177. https://doi.org/10.3389/fnbeh.2019.00177
Schwarz K., Moessnang C., Schweiger J.I. et al. Transdiagnostic Prediction of Affective, Cognitive, and Social Function Through Brain Reward Anticipation in Schizophrenia, Bipolar Disorder, Major Depression, and Autism Spectrum Diagnoses // Schizophrenia Bulletin. 2020. V. 46. № 3. P. 592–602. https://doi.org/10.1093/schbul/sbz075
Seidel E.-M., Satterthwaite T.D., Eickhoff S.B. et al. Neural correlates of depressive realism – an fMRI study on causal attribution in depression // J. Affective Disorders. 2012. V. 138. № 3. P. 268–276. https://doi.org/10.1016/j.jad.2012.01.041
Sharma A., Satterthwaite T.D., Vandekar L. et al. Divergent relationship of depression severity to social reward responses among patients with bipolar versus unipolar depression // Psychiatry Research: Neuroimaging. 2016. V. 254. P. 18–25. https://doi.org/10.1016/j.pscychresns.2016.06.003
Shimada K., Kasaba R., Fujisawa T.X. et al. Subclinical maternal depressive symptoms modulate right inferior frontal response to inferring affective mental states of adults but not of infants // J. Affective Disorders. 2018. V. 229. P. 32–40. https://doi.org/10.1016/j.jad.2017.12.031
Smith E.E., Cavanagh J.F., Allen J.J.B. Intracranial source activity (eLORETA) related to scalp-level asymmetry scores and depression status // Psychophysiology. 2018. V. 55. № 1. . https://doi.org/10.1111/psyp.13019
Stein D.J. Depression, anhedonia, and psychomotor symptoms: the role of dopaminergic neurocircuitry // CNS Spectrum. 2008. V. 13. № 7. P. 561–565. https://doi.org/10.1017/s1092852900016837
Stretton J., Walsh N.D., Mobbs D. et al. How biopsychosocial depressive risk shapes behavioral and neural responses to social evaluation in adolescence // Brain & Behavior. 2021. V. 11. № 5. e02005. https://doi.org/10.1002/brb3.2005
Suffel A., Nagels A., Steines M. et al. Feeling addressed! The neural processing of social communicative cues in patients with major depression // Human Brain Mapping. 2020. V. 41. № 13. P. 3541–3554. https://doi.org/10.1002/hbm.25027
Surguladze S., Brammer M.J., Keedwell P. et al. A differential pattern of neural response toward sad versus happy facial expressions in major depressive disorder // Biological Psychiatry. 2005. V. 57. № 3. P. 201–209. https://doi.org/10.1016/j.biopsych.2004.10.028
Szczepanik J.E., Brycz H., Kleka P. et al. Metacognition and emotion – How accurate perception of own biases relates to positive feelings and hedonic capacity // Conscious & Cognition. 2020. V. 82. e102936. https://doi.org/10.1016/j.concog.2020.102936
Takamura M., Okamoto Y., Okada G. et al. Patients with major depressive disorder exhibit reduced reward size coding in the striatum // Progress in Neuropsychopharmacology & Biological Psychiatry. 2017. V. 79. (Pt. B). P. 317–323. https://doi.org/10.1016/j.pnpbp.2017.07.006
Taylor N., Hollis J.P., Corcoran S. et al. Impaired reward responsiveness in schizophrenia // Schizophrenia Research. 2018. V. 199. P. 46–52. https://doi.org/10.1016/j.schres.2018.02.057
Tepfer L.J., Alloy L.B., Smith D.V. Family history of depression is associated with alterations in task-dependent connectivity between the cerebellum and ventromedial prefrontal cortex // Depression & Anxiety. 2021. V. 38. № 5. P. 508–520. https://doi.org/10.1002/da.23143
Thai M., Başgöze Z., Klimes–Dougan B. et al. Neural and Behavioral Correlates of Clinical Improvement to Ketamine in Adolescents With Treatment Resistant Depression // Frontiers in Psychiatry. 2020. V. 11. e820. https://doi.org/10.3389/fpsyt.2020.00820
Uldall S.W., Madsen K.H., Siebner H.R. et al. Processing of Positive Visual Stimuli Before and After Symptoms Provocation in Posttraumatic Stress Disorder – A Functional Magnetic Resonance Imaging Study of Trauma-Affected Male Refugees // Chronic Stress. 2020. V. 4. e2470547020917623. https://doi.org/10.1177/2470547020917623
Wacker J., Dillon D.G., Pizzagalli D.A. The role of the nucleus accumbens and rostral anterior cingulate cortex in anhedonia: integration of resting EEG, fMRI, and volumetric techniques // Neuroimage. 2009. V. 46. № 1. P. 327–337. https://doi.org/10.1016/j.neuroimage.2009.01.058
Wade B.S.C., Hellemann G., Espinoza R.T. et al. Accounting for symptom heterogeneity can improve neuroimaging models of antidepressant response after electroconvulsive therapy // Human Brain Mapping. 2021. V. 42. № 16. P. 5322–5333. https://doi.org/10.1002/hbm.25620
Wade B.S.C., Hellemann G., Espinoza R.T. et al. Depressive Symptom Dimensions in Treatment-Resistant Major Depression and Their Modulation With Electroconvulsive Therapy // J. ECT. 2020. V. 36(2). P. 123–129. https://doi.org/10.1097/YCT.0000000000000623
Walsh E.C., Eisenlohr-Moul T.A., Minkel J. et al. Pretreatment brain connectivity during positive emotion upregulation predicts decreased anhedonia following behavioral activation therapy for depression // J. Affective Disorders. 2019. V. 243. P. 188–192. https://doi.org/10.1016/j.jad.2018.09.065
Wang Y., Deng Y., Fung G. et al. Distinct structural neural patterns of trait physical and social anhedonia: evidence from cortical thickness, subcortical volumes and inter-regional correlations // Psychiatry Research. 2014. V. 224. № 3. P. 184–191. https://doi.org/10.1016/j.pscychresns.2014.09.005
Wang Y., Li Z., Liu W.-H. et al. Negative Schizotypy and Altered Functional Connectivity During Facial Emotion Processing // Schizophrenia Bulletin. 2018. V. 44. (S. 2). P. S491–S500. https://doi.org/10.1093/schbul/sby036
Wang Y., Liu W.-H., Li Z. et al. Altered corticostriatal functional connectivity in individuals with high social anhedonia // Psychological Medicine. 2016. V. 46. № 1. P. 125–135. https://doi.org/10.1017/S0033291715001592
Wang Y., Liu W.-H., Li Z. et al. Dimensional schizotypy and social cognition: an fMRI imaging study // Frontiers in Behavioral Neuroscience. 2015. V. 9. e133. https://doi.org/10.3389/fnbeh.2015.00133
Wang Y., Tang S., Zhang L. et al. Data-driven clustering differentiates subtypes of major depressive disorder with distinct brain connectivity and symptom features // British J. Psychiatry. 2021. V. 219. № 5. P. 606–613. https://doi.org/10.1192/bjp.2021.103
Wang Y.-Z., Han Y., Zhao J.-J. et al. Brain activity in patients with deficiency versus excess patterns of major depression: A task fMRI study // Complementary Therapies in Medicine. 2019. V. 42. P. 292–297. https://doi.org/10.1016/j.ctim.2018.12.006
Ward J., Lyall L.M., Bethlehem R.A.I. et al. Novel genome-wide associations for anhedonia, genetic correlation with psychiatric disorders, and polygenic association with brain structure // Translational Psychiatry. 2019. V. 9. № 1. e327. https://doi.org/10.1038/s41398-019-0635-y
Waugh C.E., Hamilton J.P., Chen M.C. et al. Neural temporal dynamics of stress in comorbid major depressive disorder and social anxiety disorder // Biology of Mood & Anxiety Disorders. 2012. V. 2. e11. https://doi.org/10.1186/2045-5380-2-11
Whitton A.E., Kumar P., Treadway M.T. et al. Mapping Disease Course Across the Mood Disorder Spectrum Through a Research Domain Criteria Framework // Biological Psychiatry: Cognitive Neuroscience & Neuroimaging. 2021. V. 6. № 7. P. 706–715. https://doi.org/10.1016/j.bpsc.2021.01.004
Yang X., Huang J., Roser M.E., Xie G. Anhedonia reduction correlates with increased ventral caudate connectivity with superior frontal gyrus in depression // Journal of Psychiatric Research. 2022. V. 151. P. 286–290. https://doi.org/10.1016/j.jpsychires.2022.04.030
Yang X.-H., Wang Y., Wang D.F. et al. White matter microstructural abnormalities and their association with anticipatory anhedonia in depression // Psychiatry Research: Neuroimaging. 2017. V. 264. P. 29–34. https://doi.org/10.1016/j.pscychresns.2017.04.005
Yang Z.-Y., Zhang R.-T., Li Y. et al. Functional connectivity of the default mode network is associated with prospection in schizophrenia patients and individuals with social anhedonia // Progress in Neuropsychopharmacology & Biological Psychiatry. 2019. V. 92. P. 412–420. https://doi.org/10.1016/j.pnpbp.2019.02.008
Young K.S., Bookheimer S.Y., Nusslock R. et al. Dysregulation of threat neurociruitry during fear extinction: the role of anhedonia // Neuropsychopharmacology. 2021. V. 46. № 9. P. 1650–1657. https://doi.org/10.1038/s41386-021-01003-8
Yu M., Cullen N., Linn K.A. et al. Structural brain measures linked to clinical phenotypes in major depression replicate across clinical centres // Molecular Psychiatry. 2021. V. 26. № 7. P. 2764–2775. https://doi.org/10.1038/s41380-021-01039-8
Zhang B., Lin P., Shi H. et al. Mapping anhedonia-specific dysfunction in a transdiagnostic approach: an ALE meta-analysis // Brain Imaging & Behavior. 2016. V. 10. № 3. P. 920–939. https://doi.org/10.1007/s11682-015-9457-6
Zhang H., Harris L., Split M. et al. Anhedonia and individual differences in orbitofrontal cortex sulcogyral morphology // Human Brain Mapping. 2016. V. 37. № 11. P. 3873–3881. https://doi.org/10.1002/hbm.23282
Zhang R.-T., Yang Z.-Y., Wang Y.M. et al. Affective forecasting in individuals with social anhedonia: The role of social components in anticipated emotion, prospection and neural activation // Schizophrenia Research. 2020. V. 215. P. 322–329. https://doi.org/10.1016/j.schres.2019.10.006
Zhang T., He K., Bai T. et al. Altered neural activity in the reward-related circuit and executive control network associated with amelioration of anhedonia in major depressive disorder by electroconvulsive therapy // Progress in Neuropsychopharmacology & Biological Psychiatry. 2021. V. 109. e110193. https://doi.org/10.1016/j.pnpbp.2020.110193
Zhang Y.-J., Cai X.-L., Hu H.-X. et al. Social brain network predicts real-world social network in individuals with social anhedonia // Psychiatry Research: Neuroimaging. 2021. V. 317. e111390. https://doi.org/10.1016/j.pscychresns.2021.111390
Zhang Y.-J., Pu C.-C., Wang Y.-M. et al. Social brain network correlates with real-life social network in individuals with schizophrenia and social anhedonia // Schizophrenia Research. 2021. V. 232. P. 77–84. https://doi.org/10.1016/j.schres.2021.05.016
Zhu X., Ward J., Cullen B. et al. Phenotypic and genetic associations between anhedonia and brain structure in UK Biobank // Translational Psychiatry. 2021. V. 11. № 1. e395. https://doi.org/10.1038/s41398-021-01522-4
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


