Успехи физиологических наук, 2023, T. 54, № 2, стр. 56-68
Каналы-рецепторы TRPV1 в патогенезе воспалительных заболеваний кишечника
К. А. Дворникова a, *, О. Н. Платонова a, Е. Ю. Быстрова a
a Лаборатория интероцепции, ФГБУН Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: 691442@gmail.com
Поступила в редакцию 01.11.2022
После доработки 23.01.2023
Принята к публикации 25.01.2023
- EDN: PLCCMZ
- DOI: 10.31857/S0301179823020042
Аннотация
Воспалительные заболевания кишечника (Inflammatory Bowel Disease, IBD), включая язвенный колит (Ulcerative colitis, UC) и болезнь Крона (Crohn’s disease, CD), представляют собой группу хронических иммуноопосредованных заболеваний желудочно-кишечного тракта со сложной патофизиологией и патогенезом. Хотя точные патофизиологические и молекулярные механизмы, ассоциированные с IBD, изучены недостаточно, в последние годы получены данные об активации и изменении функций ноцицепторов и их сигнальных путей при воспалительном процессе и гипералгезии, в частности одна из ключевых ролей отводится каналу транзиторного рецепторного ванилоидного потенциала 1 (TRPV1). Наибольший уровень экспрессии TRPV1 характерен для сенсорных нейронов, однако он способен экспрессироваться и другими типами клеток, включая эпителиальные клетки кишки и мочевого пузыря, иммунореактивные клетки, такие как лимфоциты, тучные и дендритные клетки, клетки эндотелия сосудов и др. Все большее число исследований на различных экспериментальных моделях, включая человека, демонстрирует, что активация каналов суперсемейства TRP, к которому относится и TRPV1, может существенно усиливать висцеральную гиперчувствительность, опосредовать развитие воспаления и боли. Обзор обобщает представленные в литературе данные, раскрывающие структуру, функции и потенциальную роль в патогенезе IBD канала-рецептора TRPV1. Большое внимание уделено обсуждению сигнальных путей, лежащих в основе модуляции TRPV1. Можно надеяться, что дальнейшие исследования в данной области будут способствовать лучшему пониманию общих механизмов формирования воспалительной и болевой реакции и выявлению новых терапевтических мишеней для лечения IBD.
ВВЕДЕНИЕ
Воспалительные заболевания кишечника (IBD), включающие два основных типа расстройств: язвенный колит (UC) и болезнь Крона (CD), представляют собой группу хронических иммуноопосредованных заболеваний желудочно-кишечного тракта (ЖКТ) со сложной патофизиологией и патогенезом [47]. Однако этиология IBD в настоящее время до конца неизвестна. В большинстве случаев воспалительные заболевания кишечника сопровождаются воспалительным и болевым синдромами, которые, согласно современным представлениям, по-видимому, взаимосвязаны и могут иметь общие механизмы. Так, предполагается, что воспаление создает предпосылки для формирования острой и хронической висцеральной боли при активных формах IBD [8, 18].
За последние годы были получены данные, свидетельствующие о важной роли канала транзиторного рецепторного потенциала 1 (Transient receptor potential vanilloid 1, TRPV1) в развитии воспаления при IBD и ассоциированной с ним висцеральной гиперчувствительности [7, 12, 57]. TRPV1 представляет собой неселективный катионный канал, экспрессирующийся у млекопитающих, который может быть активирован алкалоидом капсаицином (ванилиламид 8-метил-6-ноненовой кислоты) или другими ванилоидами растительного происхождения, включая камфору и ультрамощный аналог капсаицина из Euphorbia resinifera – резинифератоксин, а также температурой (t > 43°C), низким pH (<6.0) или эндогенными лигандами, такими как анандамид (N-арахидоноил-этаноламин, AEA) [38]. Отмечается роль TRPV1 в модулировании активации и дифференцировки Т-клеток, а также защитные эффекты TRPV1 при воспалительных заболеваниях, опосредованных Т-клетками [35, 57]. Было установлено, что TRPV1 участвует в регуляции активации дендритных клеток слизистой оболочки толстой кишки и в поддержании иммунных ответов Т-хелперов 17 (T helper 17, Th17) на воспалительные стимулы [16]. Кроме того, сообщается о возможности сенсибилизации TRPV1 различными медиаторами воспаления, что, в свою очередь, приводит к возникновению абдоминальной боли [33]. При этом, несмотря на относительную изученность каналов TRPV1, до сих пор отсутствует четкое понимание их роли в патогенезе IBD.
Данный обзор посвящен обсуждению результатов исследований по изучению возможного влияния ионных каналов-рецепторов TRPV1, экспрессируемых внутренними сенсорными нейронами энтеральной нервной системы (intrinsic enteric nervous system, ENS) толстой кишки, на течение и прогрессирование IBD.
СТРУКТУРА КАНАЛА-РЕЦЕПТОРА TRPV1
Структура TRPV1 за последние годы была определена с помощью криоэлектронной микроскопии с высоким разрешением (3.4 Å), что позволило значительно расширить знания о строении и функциях канала [37]. TRPV1 Homo sapiens кодирует белок с молекулярной массой 95 кДа и состоит из 839 аминокислот, шести внутриклеточных N-концевых анкириновых повторов (ankyrin repeats, AR), шести трансмембранных сегментов (transmembrane segments, TM) S1–S6 с промежуточной порообразующей гидрофобной группой – поровой петлей и спиралью (Pore-loop, Pore-helix) между S5 и S6, и консервативной C-концевой последовательности TRP-бокса, ориентированной в сторону линкера S4–S5, что предполагает его важную роль в аллостерической модуляции канала TRPV1 (рис. 1) [9, 60]. TRPV1 представляет собой тетрамер, при этом шесть доменов AR, расположенных в области N-концевого участка, позволяют связывать кальмодулин (CaM) и АТФ, тем самым модулируя активацию TRPV1. С-конец содержит домен TRP и сайты связывания CaM и фосфатидилинозитол 4,5-бисфосфата (phosphatidylinositol 4,5-bisphosphate, PIP2), который предположительно также может ингибировать канал TRPV1 [49]. В структуре TRPV1 помимо сайтов связывания капсаицина присутствует несколько сайтов фосфорилирования, через которые его активность может регулироваться различными киназами, включая протеинкиназы A и С (PKA и PKC), Ca2+/кальмодулин-зависимую киназу II (CaMKII), Src-киназу (C-terminal Src kinase) и Са2+/кальмодулин-зависимую протеин фосфатазу РР2В (кальциневрин). Во внеклеточном петлевом домене аминокислотные остатки могут регулировать активацию TRPV1 протонами, обеспечивая чувствительность к pH [57]. После активации TRPV1 внеклеточный Са2+ поступает в клетки, а внутриклеточный пул Са2+ высвобождается, тем самым увеличивая концентрацию внутриклеточного Са2+, который впоследствии опосредует основную активность многих клеток, вызывая такие эффекты, как сокращение мышц, изменение активности нейронов, высвобождение медиаторов, пролиферацию клеток и апоптоз, а также регуляцию температуры тела и боль [30].
Рис. 1.
Структура канала TRPV1. PKA – протеинкиназа А; PKC – протеинкиназа C; ATP – аденозинтрифосфат (АТФ); PIP2 – фосфатидилинозитол 4,5-бисфосфат; Ca2+M binding – Ca2+/кальмодулин-связывающий домен; PIP2 binding – PIP2-связывающий домен; AR – анкириновые повторы; PS – сайт фосфорилирования; CaM – кальмодулин; Pore-loop – поровая петля; Pore-helix – поровая спираль. Пунктирная линия означает предполагаемое воздействие.
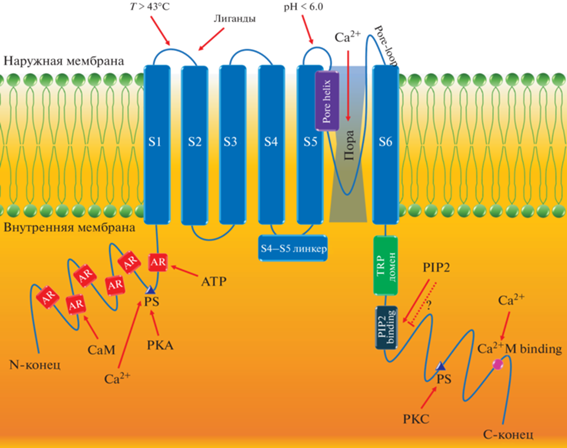
Согласно имеющимся данным, TRPV1 также может олигомеризоваться с другими субъединицами некоторых представителей семейства TRP, включая TRPV3 и TRPA1 [40]. При этом в ЖКТ TRPV1 часто коэкспрессируется с TRPA1 на капсаицин-чувствительных нейронах [14].
Структурной детерминантой десенсибилизации TRPV1 является связывание CaM с сайтами, расположенными на N- и C-концах.
В результате проведенных биоинформатических исследований, направленных на изучение первичной последовательности мембранных белков TRPV1 для прогнозирования потенциальных отличительных признаков функциональной и структурной последовательности, было выявлено эволюционное давление на белковые домены TRPV1 млекопитающих, свидетельствующее об отрицательном отборе и важности функций этих мембранных белков [15]. Примечательно, что существуют структурные различия между белками TRPV1 птиц и млекопитающих [58]. Эти различия приводят к разным реакциям на капсаицин. Так, капсаициновый карман представляет собой гидрофобную полость, образованную остатками Y512, S513, T551 и E571 в последовательности TRPV1 Homo sapiens. Первые два остатка сохраняются у разных видов, а T551 отличается у кролика и курицы, двух видов, нечувствительных к капсаицину. Соответственно, структурные различия между ортологами TRPV1 приводят к экспрессии каналов с различной чувствительностью к капсаицину у разных видов.
ЛОКАЛИЗАЦИЯ И ФУНКЦИИ TRPV1
Более 60 лет назад венгерский фармаколог Nikolaus Jancsó обнаружил, что жгучая боль, которую вызывает капсаицин, индуцирована стимуляцией ноцицептивных афферентных нейронов, положив начало для дальнейшего изучения TRPV1. Szolcsányi и Jancsó-Gábor в 1975 г. предположили, что капсаицин стимулирует афферентные нейроны через определенные ванилоидные рецепторы в результате исследования взаимосвязи между структурой и активностью конгенеров капсаицина. Создание антагониста капсаицина – капсазепина и открытие специфических сайтов связывания резинифератоксина в дальнейшем предоставили доказательства этой теории [23]. В 1997 г. TRPV1 был идентифицирован как сенсор капсаицина на генетическом и функциональном уровне, впервые была признана роль каналов TRP в восприятии ряда химических веществ (куминовый альдегид, α-фелландрен (α-PHE), коричный альдегид, камфора, пиперин, эвгенол, гингерол и др.). Затем были идентифицированы другие каналы TRP с особыми характеристиками трансдукции для хемо-, термо- и механочувствительности, а также восприятия сладкого, горького, кислого, соленого вкусов и умами. Помимо этого, данные молекулярные сенсоры поддерживают химестезис (химическая чувствительность, отличная от вкуса и запаха), поскольку они способны распознавать определенные химические вещества, включая ряд токсинов (этанол, резинифератоксин, VaTx1–3 (токсин пауков)) [22]. Способность TRPV1 активироваться не только капсаицином, но и такими стимулами как повышение температуры, ацидоз и болевые раздражители, привела к повышенному интересу и его интенсивным исследованиям в физиологии, медицине и фармакологии.
TRPV1 экспрессируется субпопуляцией периферических и центральных нейронов, например, в C- и Aδ-волокнах нейронов ганглиев задних корешков (dorsal root ganglia, DRG), где он опосредует сенсорное восприятие, в частности ноцицепцию [44]. Также экспрессия TRPV1 характерна и для других типов клеток и тканей, включая почки, поджелудочную железу, матку, селезенку, желудок, тонкую кишку, легкие, печень, некоторые иммунные клетки. Активация TRPV1 приводит к повышению уровня кальция и последующему высвобождению сенсорных нейропептидов – кальцитонин ген-родственного пептида (Calcitonin Gene-Related Peptide, CGRP) и вещества P (substance P, SP), а также основных провоспалительных цитокинов, связанных с Т-хелперами 2 (T helper 2, Th2), таких как фактор некроза опухоли-α (Tumor necrosis factor alpha, TNF-α), интерлейкин-4 (IL-4), интерлейкин-6 (IL-6). Многие провоспалительные факторы, включая SР, фактор роста нервов (nerve growth factor, NGF), брадикинин, простагландины, могут усиливать и повышать чувствительность TRPV1 [42].
При активации желудочной кислотой чувствительные к капсаицину нейроны высвобождают CGRP, который, в свою очередь, вызывает высвобождение соматостатина, ингибирующего дальнейшую секрецию кислоты. Капсазепин, блокатор TRPV1, ингибирует эффекты капсаицина на секрецию ионов бикарбоната эпителиальными клетками двенадцатиперстной кишки, уменьшает гиперемию слизистой оболочки желудка, индуцированную TRPV1. Капсазепин также уменьшает количество желудочной слизи, выделяемой в результате стимуляции протеазоактивируемого рецептора-2 (PAR-2) в желудке, что указывает на связь между PAR-2 и TRPV1. Капсазепин, с другой стороны, не влияет на склонность слизистой оболочки желудка к гиперемии при воздействии кислоты, но подавляет склонность двенадцатиперстной кишки к расширению сосудов. TRPV1 опосредует реакции, которые поддерживают гомеостаз слизистой оболочки передней кишки, но способствуют воспалению и повреждению тканей поджелудочной железы, подвздошной кишки и толстой кишки. Капсазепин, например, значительно уменьшает симптомы экспериментального панкреатита, вызванного церулином, илеита, вызванного токсином А Clostridium difficile, и колита, вызванного декстран сульфатом натрия (Dextran sulfate sodium, DSS) [23].
Сложные механизмы терморегуляции развились в процессе эволюции и включают в себя один из важных элементов – определение окружающей и внутренней температуры. Благодаря клонированию TRPV1, был исследован молекулярный механизм термосенсибилизации (t > 43°C). Однако роль TRPV1 в устойчивом тепловом ответе на сегодняшний день далека от однозначного понимания, поскольку быстрая термоиндуцированная десенсибилизация (rapid heat-induced desensitization, Dh) следует за термоиндуцированной активацией (heat-induced activation, Ah) TRPV1 [39]. Так, было проведено сравнительное исследование каналов TRPV1 у мышей и утконоса, у которого отсутствует Dh. Взаимодействие между N- и C-концевыми доменами мышей, но не утконоса, вызывало конформационную перестройку в поре, ведущую к Dh. Мыши с нокаутом гена TRPV1 нормально ощущали тепло, но в жаркой среде страдали от ожогов. Функциональное продление процесса Ah in vivo у нокаутированных мышей показало, что десенсибилизация TRPV1 служит важным защитным механизмом против воздействия повышенных температур у млекопитающих.
Появляющиеся в последние годы данные указывают на существенную роль TRPV1 в процессах нормального функционирования кишки и реализации ее защитных механизмов. TRPV1 экспрессируется внутренними и внешними нейронами в межмышечном и подслизистом сплетениях толстой кишки, а также в DRG, иннервирующих двенадцатиперстную кишку [62]. При этом, TRPV1 является важной мишенью для эндогенных лигандов – эндоканнабиноидов, воздействие которых определяет течение воспалительного процесса в кишке [36]. Известно, что кишка является богатым источником эндоканнабиноидов и ферментов, участвующих в их синтезе и метаболизме. Установлено, что реципрокные изменения в эндованилоидной системе на основе TRPV1 могут индуцировать гипералгезию и состояния, сопровождающиеся абдоминальной болью [20].
Имеющиеся данные также позволяют предполагать, что TRPV1 является геном-супрессором опухолей. В частности, показано, что нормальный или повышенный уровень экспрессии TRPV1 может обеспечивать защиту от развития колоректального рака, индуцированного колитом, а дефицит TRPV1, наоборот, усугубляет течение заболевания, увеличивая рост опухолей в дистальном отделе толстой кишки, и снижает экспрессию противовоспалительных нейропептидов [53]. Кроме того, сообщается, что сверхэкспрессия TRPV1 подавляет пролиферацию эпителиальных клеток (intestinal epithelial cells, IEC) при раке кишечника и поджелудочной железы [35]. Дополнительно установлено, что капсаицин демонстрирует противораковую активность и его действие на клетки глиомы и уротелиального рака вызывает опосредованный TRPV1 Ca2+-зависимый апоптоз [13]. В то же время, имеются данные, позволяющие предположить, что TRPV1 является прометастазным фактором [11]. При этом уточняется, что роль TRPV1 в метастазировании может зависеть от типа раковых клеток, что подразумевает канцеро- или тканеспецифические функции TRPV1. Следует отметить, что на сегодняшний день неизвестны точные механизмы прометастазного влияния TRPV1. Необходимо проведение дальнейших исследований с использованием комбинированных подходов сайленсинга или нокаута генов.
Несмотря на большое количество данных, подтверждающих участие TRPV1 и ассоциированных с ним сигнальных путей в ряде физиологических процессов, до сих пор нет однозначного понимания его роли в патогенезе воспалительных заболеваний кишечника, сопровождающихся воспалением, острой и/или хронической болью.
РОЛЬ И МОЛЕКУЛЯРНЫЕ ПУТИ TRPV1 В ПАТОГЕНЕЗЕ IBD
Течение IBD представляет собой хронический воспалительный иммуноопосредованный процесс с высоким риском развития заболевания у генетически предрасположенных людей [5]. При этом, факторы окружающей среды и комменсальная микробиота также способны оказывать значительное влияние на течение IBD [45].
Изучение Т-клеточного ответа в патогенезе IBD играет ключевую роль при рассмотрении иммунных процессов в слизистых оболочках кишки в течение продолжительного времени. Комплекс проведенных исследований продемонстрировал значимость Т-клеток при формировании аберрантного воспаления при IBD. Так, были сформированы представления о двух типах воспаления: UC и CD. При UC происходит увеличение продукции основных провоспалительных цитокинов, связанных с Th2 – интерлейкина-1 (IL-1), интерлейкина-6 (IL-6), интерлейкина-8 (IL-8) и TNF-α. CD развивается в результате избыточного ответа Т-хелперов 1 (T helper 1, Th1) и Th17 на интерлейкин-12 (IL-12), интерлейкин-18 (IL-18) и интерлейкин-23 (IL-23), продуцируемые антигенпрезентирующими клетками (antigen-presenting cell, APC) и макрофагами [52]. Центральная роль в регуляции ранних ответов на патогены отводится IL-23, продуцируемому в циклах врожденного и адаптивного ответа. Также было показано, что IL-23 индуцирует продукцию цитокинов Th17 врожденными лимфоидными клетками (ILC), что поддерживает дифференцировку в сторону популяции ILC3, сходной по фенотипу с клетками-индукторами лимфоидной ткани [64]. Отдельно отмечается важное значение гена IL23R в патогенезе CD, поскольку продукт гена участвует в дифференцировке Th17 и приводит к дисрегуляции продукции цитокинов. В целом можно заключить, что IL-23 является важной воспалительной молекулой при CD.
Установлено, что при IBD происходит выраженная инфильтрация APC и Т-клетками очагов воспаления [16]. При этом среди APC важную роль в инициации и регуляции иммунитета слизистой оболочки играют дендритные клетки [28]. Распознавание патогена паттерн-распознающими рецепторами (Pattern recognition receptors, PRRs) дендритных клеток приводит к активации костимуляторных молекул и главного комплекса гистосовместимости класса II (major histocompatibility complex II, MHC II). Впоследствии высвобождаемые цитокины контролируют дифференцировку наивных CD4+ T-клеток в эффекторные линии [16].
В исследовании на мышах, имеющих мутацию Trpv1G564S+/+ c конститутивно активным каналом TRPV1, было изучено влияние усиления/снижения функции TRPV1 на течение и восприимчивость к колиту. Экспрессия провоспалительных цитокинов IL-1β, IL-6, интерлейкина-7 (IL-7), IL-12, IL-23, TNF-α и интерферона гамма (IFN-γ) в тканях толстой кишки у мышей с мутацией Trpv1G564S+/+ оказалась выше, чем у контроля, что свидетельствует об усилении функции TRPV1 и повышении восприимчивости мышей к колиту, вызванному декстрансульфатом натрия (Dextran sulfate sodium, DSS). Дополнительно было установлено, что усиление функции TRPV1 влияет на гомеостаз CD4+ T-клеток толстой кишки при DSS-индуцированном колите. Уровни экспрессии IL-10, IL-17, IFN-γ и ключевого фактора транскрипции Rorc (RAR-related orphan receptor C), управляющих поляризацией Th17, были значительно повышены в CD4+ T-клетках мышей Trpv1G564S+/+ по сравнению с контролем. По-видимому, гомеостаз Т-клеток может способствовать дифференцировке Th17 и, следовательно, усугублять течение колита. В другом исследовании было показано, что для мышей с нокаутом TRPV1 (Trpv1–/–) не характерно развитие поствоспалительной висцеральной гиперчувствительности и поведение, ассоциированное с болью, что также указывает на важную регуляторную роль TRPV1 при остром колите [33].
Согласно современным представлениям, воспаление при IBD создает предпосылки для формирования острой или хронической висцеральной боли. Первичные афферентные ноцицепторы на периферии передают сигналы вторичным нейронам в дорсальных рогах спинного мозга, а оттуда в головной мозг, вызывая ощущение острого дискомфорта или боли. Помимо этого, уникальность ноцицепторов заключается в возможности передавать антидромные сигналы путем высвобождения сигнальных молекул из стимулированных периферических окончаний. Взаимодействие и последующая продукция сигнальных молекул приводит к нейрогенному воспалению и сенсибилизации. Это явление представляет собой ключевой периферический механизм, посредством которого повреждение тканей способствует повышенной чувствительности к боли [31]. Болевые стимулы воспринимаются первичными афферентными сенсорными нейронами, в частности TRPV1-позитивными сенсорными нейронами кишки. При этом, несмотря на уже имеющиеся данные о том, что TRPV1 активируется и сенсибилизируется при воспалительных процессах, до сих пор отсутствует четкое понимание его роли в патогенезе IBD [25].
Активация TRPV1 в кишечнике приводит к увеличению секреторной активности, усилению кровотока и пролиферации IEC толстой кишки [18]. С другой стороны, TRPV1 также участвует в гипералгезии, которая опосредуется либо изменениями уровней экспрессии TRPV1, либо степенью его активации. TRPV1 в сенсорных нейронах толстой кишки активируется липидами, включая AEA, а снижение температурного порога, опосредованного воспалением, способствует активации рецептора при изменении температуры тела. В свою очередь, стимуляция капсаицином и родственными ванилоидными соединениями вызывает ощущение острой жгучей боли, сопровождающееся локальной вазодилатацией и воспалением [50]. Кроме того, активность TRPV1 модулируется при активации/ингибировании определенных сигнальных путей, сопровождаясь прямой сенсибилизацией или десенсибилизацией канала.
TRPV1 способен распознавать сигналы, ассоциированные с активацией фосфолипазы С (PLC), при этом некоторые подтипы реагируют на продукты липидного метаболизма, а другие – на инозитол-трифосфат (IP3)-опосредованное высвобождение Ca2+. Ввиду этого, активация PLC нейротрансмиттерами или гормонами, как следствие, может приводить к активации и сенсибилизации TRPV1 [30]. Кроме того, TRPV1 может опосредовать сигналы рецепторов, связанных с G-белком (G-protein-coupled receptors, GPCR), на основе сайтов фосфорилирования на N-конце для PKA и PKC. Помимо этого, TRPV1 вовлечен в перекрестную нейроиммунную передачу и сигналинг, ассоциированные с высвобождением нейропептидов. Наиболее часто встречается для TRPV1-иммунопозитивных нервных волокон коэкспрессия с CGRP и SP [12]. CGRP образуется в результате альтернативного процессинга РНК гена кальцитонина, играет защитную роль при воспалении и подавляет активность иммунных клеток [51]. Так, CGRP может ограничивать способность дендритных клеток и макрофагов к презентации антигенов и секреции провоспалительных цитокинов (например, TNF-α), а также индуцирует активацию IL-10 и сохраняет целостность слизистой оболочки [24]. Установлено, что введение мышам CGRP приводит к активации TGF-β-экспрессирующих CD4+Tim4+ макрофагов в толстой кишке, что может иметь терапевтический эффект для лечения воспаления [55]. Также имеются сведения о роли CGRP в провоспалительном процессе. В частности, CGRP может стимулировать миграцию Т-клеток и высвобождение IFN-γ и IL-2 из Т-хелперов [34]. SP, нейропептид, состоящий из 11 аминокислот, подобно CGRP служит мощным сосудорасширяющим средством, при этом индуцированная им вазодилатация зависит от высвобождения оксида азота (NO). SP модулирует иммунный ответ на микробную инфекцию и способствует активации тучных клеток, индуцируя высвобождение множества провоспалительных цитокинов и хемокинов [19]. Установлено, что в биоптатах тканей толстой и прямой кишки у пациентов с IBD наблюдается повышенный уровень SP, что, в свою очередь, может указывать на потенциальную провоспалительную роль SP [17]. При этом в другом исследовании сообщается о противовоспалительном терапевтическом действии SP на течение колита. Так, на модели DSS-индуцированного колита у мышей SP способствовал подавлению воспаления за счет активации экспрессии IL-10 макрофагами типа M2, связанными с иммунной регуляцией, и регуляторными Treg-клетками, и ингибирования секреции TNF-α/IL-17, что в конечном счете приводило к регенерации тканей при хронических повреждениях [27, 63]. Такие противоречивые наблюдения в отношении свойств CGRP и SP предположительно могут свидетельствовать о возможных двунаправленных функциях нейропептидов в норме и при патологических состояниях. Кроме того, существующие противоречия могут объясняться недостаточной изученностью эффектов CGRP и SP на воспалительный процесс. Необходимо проведение дальнейших исследований, в том числе для выяснения общих молекулярных механизмов, вовлекающих и TRPV1.
Повышенное количество TRPV1-позитивных нервных волокон у пациентов с IBD в толстой кишке коррелирует со степенью выраженности абдоминальной боли [16]. Следует отметить, что при экспериментальном DSS-индуцированном колите у мышей регистрировали увеличение TRPV1- и 5-HT3-иммунопозитивных нервных волокон. При этом дополнительно экспрессию мРНК TRPV1 регистрировали и в IEC, эндотелии сосудов и иммунных клетках. Повышенная экспрессия приводила к значительному уменьшению количества рецепторов 5-гидрокситриптамина 4 подтипа (5-HT4). Имеются данные, свидетельствующие о том, что NGF и глиальный нейротрофический фактор (GDNF) участвуют в сверхэкспрессии рецепторов TRPV1 и 5-HT3. Указанные данные позволяют рассматривать нейротрофины в качестве потенциальных кандидатов, управляющих экспрессией этих рецепторов [41].
TRPV1 экспрессируется рядом иммунореактивных клеток (лимфоцитами, тучными клетками и дендритными клетками), продуцирующих целый спектр провоспалительных и противовоспалительных молекул, среди которых особый интерес представляет TNF-α. Было высказано предположение, что TNF-α играет определенную роль в патогенезе IBD, отвечая на воспалительные стимулы [12]. При этом иммунные клетки, продуцирующие этот и другие цитокины, прямо или опосредованно, вовлекая различные сигнальные пути, активируют сенсорные нейроны. Таким образом, мы полагаем, что будущие исследования, вероятно, будут сосредоточены на выяснении роли каналов-рецепторов TRPV1, экспрессирующихся не только на нейронах, но и на других типах клеток, в процессах, ассоциированных с развитием воспаления при IBD, а также на изучении их взаимодействия с различными элементами иммунной системы и участия в нейроиммунных взаимодействиях.
Также на сегодняшний день представляет интерес рассмотрение роли TRPV1 в развитии воспалительного ответа при инфекционных воздействиях, обусловленных проникновением в организм различных патогенов, поскольку согласно существующим представлениям в некоторых случаях дебют IBD может быть ассоциирован с бактериальной или вирусной инфекцией; кроме того, течение заболевания может сопровождаться дисбиозом кишечника, избыточным ростом условно-патогенной микробиоты [26, 43, 48].
Возникновение сильной боли при развитии инфекционного процесса может быть следствием не только непрямой активации ноцицепторов провоспалительными и противовоспалительными компонентами иммунного ответа на инфекционный агент, но и результатом прямой активации ноцицепторов бактериальными или вирусными антигенами. Косвенно это подтверждается данными, полученными на модели колита у мышей при введении тринитробензенсульфоната (2,4,6-trinitrobenzenesulfonic acid, TNBS). Полученные данные демонстрируют возможность функционального взаимодействия между рецепторами врожденного иммунитета, такими как Toll-подобный рецептор 4 (Toll-like receptor, TLR4), и ванилоидными рецепторами TRPV1 [56]. Так, было показано, что активация TLR4 оказывает двойное влияние на передачу сигналов TRPV1 в периферических сенсорных нейронах, обеспечивая прямую сенсибилизацию TRPV1 и активацию экспрессии TRPV1. При этом активация или инактивация TLR4 предположительно может влиять на передачу сигналов TRPV1 посредством увеличения или уменьшения продукции провоспалительных цитокинов IFN-α, TNF-α, IL-1 и IL-6.
Ранее, в наших собственных экспериментах была исследована коэкспрессия рецепторов TLR4 и TRPV1 на уровне одиночного нейрона в межмышечном и подслизистом сплетениях двенадцатиперстной, тощей и ободочной кишки крысы. Проведенный анализ характера распределения нейронов в ганглиях кишки выявил, что TRPV1 экспрессируются преимущественно нейронами межмышечного сплетения, а TLR4 в основном нейронами подслизистого сплетения. Подобная разница может быть связана с функциональными особенностями экспрессирующих эти рецепторы нейронов. Присутствие TLR4 и TRPV1 в межмышечном и подслизистом сплетениях свидетельствует о возможности функционального взаимодействия между ними при бактериальной инвазии и воспалительных заболеваниях инфекционной природы. Также было установлено, что TLR4 в некоторых случаях экспрессируется TRPV1-позитивными нейронами, на что указывает совместная локализация рецепторов TLR4 и TRPV1 [2, 3]. В другом исследовании было показано, что капсаицин увеличивает число TLR4-позитивных нейронов в межмышечном сплетении ободочной кишки крысы. Кроме того, введение специфического ингибитора рецептора TLR4 – 2-ацетамидопиранозида (2-Acetamidopyranoside, C34) приводило к достоверному уменьшению числа TRPV1-позитивных нейронов в межмышечном и подслизистом сплетениях ободочной кишки как у интактных крыс, так и у животных с острым TNBS-индуцированным колитом. Полученные данные позволили выдвинуть предположение о том, что одним из возможных механизмов возникновения висцеральной боли при бактериальной инвазии и IBD может быть стимуляция ноцицепторов посредством прямой активации TLR4, экспрессируемого на сенсорных нейронах. В свою очередь, TLR4 активируют TRPV1 путем внутриклеточной сигнализации, приводя к высвобождению CGRP [4].
Также нами было выдвинуто предположение о возможности модуляции экспрессии TLR4 гистамином и сенсибилизации TRPV1 через H1R-рецепторный путь [1]. Согласно имеющимся данным, гистамин может выступать в роли сенсибилизирующего агента, модулирующего ноцицептивные сигналы, в частности опосредованно через канал-рецептор TRPV1 [54]. Гистамин-индуцированная активация TRPV1 предположительно осуществляется через сигнальный путь PLC/PKC, приводящий к фосфорилированию и сенсибилизации TRPV1 на сенсорных нейронах, а TLR4 способен регулировать паттерн экспрессии TRPV1, в том числе через сигнальные пути, ассоциированные с гистамином и его рецепторами. Сенсибилизация TRPV1 гистамином через H1R-рецепторный путь может обусловливать развитие висцеральной гиперчувствительности и соответствующих симптомов при IBD. Однако необходимо проведение дальнейших исследований для однозначного понимания указанных взаимосвязей.
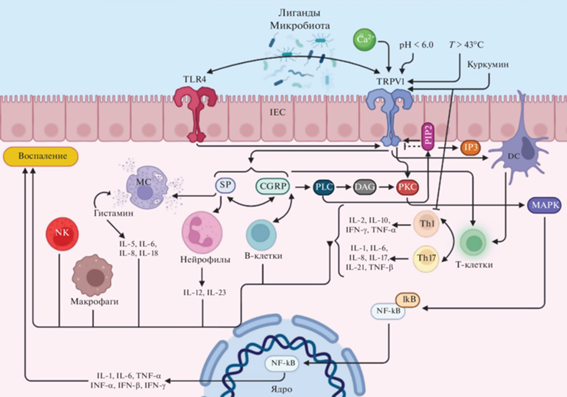
Таким образом, значимость роли каналов-рецепторов TRPV1 при воспалительных процессах в кишечнике, ассоциированных с IBD, не вызывает сомнения (рис. 2). При этом, несмотря на тот факт, что исследования последних лет в существенной степени приблизили нас к раскрытию молекулярных механизмов и сигнальных путей, задействующих, в том числе, TRPV1, в настоящее время все еще недостаточно данных для полного и однозначного понимания всех взаимосвязей, лежащих в основе воспаления и висцеральной гиперчувствительности при IBD.
Рис. 2.
Основные молекулярные пути TRPV1 при воспалении. IEC – кишечные эпителиальные клетки; IFN-α – интерферон альфа; IFN-β – интерферон бета; IFN-γ – интерферон гамма; TNF-α – фактор некроза опухоли-α; TNF-β – фактор некроза опухоли-β; Th1 – Т-хелперы 1; Th17 – Т-хелперы 17; IL-1 – интерлейкин-1; IL-2 – интерлейкин-2; IL-5 – интерлейкин-5; IL-6 – интерлейкин-6; IL-8 – интерлейкин-8; IL-10 – интерлейкин-10; IL-12 – интерлейкин-12; IL-18 – интерлейкин-18; IL-23 – интерлейкин-23; CGRP – кальцитонин ген-родственный пептид; SP – вещество P; NK – естественные клетки-киллеры; MC – тучные клетки; PIP2 – фосфатидилинозитол 4,5-бисфосфат; IP3 – инозитол-трифосфат; PLC – фосфолипаза; DAG – диацилглицерол; PKC – протеинкиназа С; MAPK – митоген-активируемая протеинкиназа; NF-κB – транскрипционный ядерный фактор “каппа-би”; IκB – киназа IκB (IKK). Пунктирная линия означает предполагаемое воздействие. Создано с помощью BioRender.com.
НЕКОТОРЫЕ НОВЫЕ ПОДХОДЫ К ТЕРАПИИ IBD
В связи с увеличением заболеваемости IBD во всем мире, ростом частоты случаев у молодых пациентов, в настоящее время существует острая необходимость в разработке новых усовершенствованных подходов для лечения воспалительных заболеваний кишечника. Уже существующие способы терапии направлены, главным образом, на замедление прогрессирования заболевания, предотвращение его осложнений, уменьшение частоты рецидивов, выход в клиническую ремиссию. Так, например, терапия IBD может включать пероральное или местное применение 5-аминосалициловой кислоты (5-АСК), кортикостероидов, иммунодепрессантов, генно-инженерных биологических препаратов (анти-TNF-α терапия). При этом следует учитывать, что указанные группы препаратов в ряде случаев не приводят к желаемому клиническому ответу, кроме того, их применение может сопровождаться тяжелыми побочными эффектами. В свете вышесказанного, разработка новых методов терапии IBD остается весьма актуальной задачей. В частности, изучение молекулярных путей, ассоциированных с IBD, поиск новых молекулярных мишеней позволит создавать инновационные “таргетные” препараты, обладающие точечным действием на тот или иной компонент сигнального пути, высокой эффективностью и безопасностью.
Среди новых разрабатываемых подходов к лечению IBD большой интерес вызывает возможность применения агонистов/антагонистов TRPV1. Так, отмечается, что антагонисты TRPV1 могут стать потенциальной терапевтической мишенью для лечения боли, т.к. они снижают чувствительность к ней [29]. Однако их клиническое применение ограничено рядом побочных эффектов, в частности таких как гипертермия. Тем не менее, современные препараты, нацеленные на TRPV1, могут быстро стать доступными в качестве анальгетиков следующего поколения для широкого спектра болевых состояний, включая болевой синдром, ассоциированный с IBD.
На модели экспериментального колита у мышей было показано, что введение антагониста TRPV1 – BCTC (4-(3-хлор-2-пиридинил)-N-[4-(1,1-диметилэтил) фенил]-1-пиперазинкарбоксамид) сопровождается ослаблением симптомов [10]. При этом TRPV1 функционально экспрессировался в CD4+ Т-клетках и способствовал индуцированному Т-клеточным антигенным рецептором (TCR) притоку Ca2+, передаче сигналов TCR и активации Т-клеток. В то же время введение BCTC снижало высвобождение цитокинов из CD4+ Т-клеток, тем самым сдерживая провоспалительные Т-клеточные ответы. Следует отметить, что аналогичный эффект наблюдался и при наличии генетической делеции (в частности у мышей с фенотипом Trpv1–/–).
Поскольку TRPV1 обладает консенсусными сайтами фосфорилирования для PKA и PKC, фосфорилирование делает канал чувствительным также и к агонистам, введение которых способно предотвращать его быструю десенсибилизацию [64]. При этом пероральное введение агонистов TRPV1, например, таких как капсаицин или полный адъювант Фрейнда (Complete Freund’s Adjuvant, CFA), потенциально может приводить к уменьшению боли и гипералгезии, в том числе ассоциированных с IBD [21]. Однако, по-видимому, данный эффект является дозозависимым.
В последние годы было показано, что гепоксилин (HxA3 и HxB3, продукт метаболизма арахидоновой кислоты) и 12S-гидро-пероксиэйкозатетраеновая кислота (12(S)-HPETE) обладают способностью запускать мобилизацию Ca2+ в гетерологичной системе экспрессии (клеточная линия HEK), обусловливающей экспрессию каналов TRPV1 сенсорными нейронами [9]. В HEK TRPV1 активируется 9- и 13-гидрокси-октадекадиеновой кислотой (9- и 13-hydroxy-10E,12Z-octadecadienoic acid, 9- и 13-HODE), а также окисленными формами 9- и 13-оксо-октадекадиеновой кислоты (9- и 13-oxo-10E,12Z-octadecadienoic acid, 9- и 13-oxoODE), вызывая механическую аллодинию, тепловую сенсибилизацию и воспалительную гипералгезию [6]. Предполагается, что длинноцепочечные ненасыщенные N-ациламиды – простые липиды со структурой, состоящей из жирной кислоты (ацильной группы), также могут активировать TRPV1 [46]. Однако не определены механизмы, с помощью которых эти молекулы модулируют активацию/функционирование TRPV1. Также установлено, что другой агонист – лизофосфатидная кислота (lysophosphatidic acid, LPA), которая характеризуется повышенными уровнями продукции при воспалительных процессах и заболеваниях, связывается с С-концом TRPV1 и индуцирует одноканальную проводимость, приводящую к большим макроскопическим токам [9]. Одноканальная проводимость может быть физиологически значимой, поскольку позволяет нейронам, экспрессирующим данный канал, деполяризоваться более эффективно при патологических состояниях. Перечисленные выше соединения в перспективе могут найти применение для лечения/ослабления симптомов IBD, однако необходимы дальнейшие исследования с целью оценки их клинической эффективности и безопасности.
Еще одним потенциальным терапевтическим средством является куркумин (диферулоилметан, (1E,6E)-1,7-бис(4-гидрокси-3-метоксифенил)-1,6-гептадиен-3,5-дион), который способен подавлять экспрессию Th1 и продукцию оксида азота (NO), контролируя активацию макрофагов [32]. Подавление воспаления происходит посредством избирательной блокировки рецепторов циклооксигеназы (cyclooxygenase-2, COX-2). Снижение активности Th1 также способствует подавлению перекрестного окисления липидов, и, как следствие, снижается повреждение тканей. Установлено, что ингибирование куркумином активности транскрипционного фактора NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells, NF-κB), связанного с продукцией воспалительных цитокинов и хемокинов, может представлять потенциальные терапевтические перспективы в качестве подхода для лечения IBD [61]. Ингибирующее действие куркумина на экспрессию NF-κB модулирует путь NF-κB/IκB (киназа IκB (IKK)). В свою очередь, куркумин предотвращает деградацию IκB, и, как следствие, блокирует активирующую передачу сигналов киназы. Ингибиторные свойства куркумина также были показаны в отношении передачи сигналов IFN-γ в IEC толстой кишки [32]. Установлено, что пероральное введение куркумина ослабляет висцеральную гипералгезию, связанную с DSS-индуцированным колитом у крыс, путем ингибирования экспрессии TRPV1 в воспаленной толстой кишке и афферентных нейронах DRG. Кроме того, данные in vitro показали, что куркумин может ингибировать фосфорилирование и последующую мембранную транслокацию TRPV1, что предположительно подтверждает гипотезу о том, что куркумин имеет терапевтическое значение при висцеральной гипералгезии за счет ингибирования фосфорилирования TRPV1 [59].
Таким образом, в ближайшем будущем не исключено появление новых методов эффективной терапии IBD с использованием подходов, основанных на понимании молекулярных механизмов функционирования TRPV1 и ассоциированных с ним сигнальных путей.
ЗАКЛЮЧЕНИЕ
Проведенный анализ исследований, посвященных изучению роли TRPV1 и ассоциированных с ним сигнальных путей при воспалительном ответе и гипералгезии, позволяет рассматривать данный канал-рецептор в качестве одного из ключевых участников патофизиологических процессов, лежащих в основе IBD. При этом тот факт, что TRPV1 экспрессируется не только нейронами, но и другими типами клеток, в том числе клетками иммунной системы, по-видимому, указывает на его прямую или косвенную роль в нейроиммунных взаимодействиях, обеспечивающих нормальное функционирование кишки и реализацию ее защитных механизмов. Тем не менее, реальные молекулярные механизмы, лежащие в основе нейроиммунных взаимодействий с участием TRPV1 и его сигнальных путей, обусловливающих формирование воспалительной и болевой реакций при IBD, достаточно сложны, неоднозначны и требуют дальнейшего изучения.
Отдельного внимания заслуживает рассмотрение роли TRPV1 в развитии воспалительного ответа при инфекционных воздействиях, обусловленных проникновением в организм различных патогенов, выступающих в роли триггеров, которые индуцируют или ухудшают течение IBD. Имеющиеся на сегодняшний день данные позволяют предположить, что рецепторы врожденного иммунитета TLRs, являющиеся первой линией защиты организма от инфекционных агентов, способны модулировать паттерн экспрессии TRPV1, прямо или опосредованно, тем самым индуцируя развитие висцеральной гиперчувствительности и соответствующих симптомов, ассоциированных с IBD.
Можно надеяться, что дальнейшие исследования в данной области позволят получить новые сведения о роли каналов-рецепторов TRPV1 в этиологии и патогенезе IBD, в перспективе обеспечив разработку инновационных терапевтических подходов в лечении указанной группы заболеваний, например, на основе агонистов/антагонистов TRPV1 или компонентов ассоциированных с ним сигнальных путей.
Работа выполнена при поддержке Госпрограммы ГП-47 “Научно-технологическое развитие Российской Федерации” (2019–2030), тема 0134-2019-0001.
Список литературы
Быстрова Е.Ю., Дворникова К.А., Платонова О.Н., Ноздрачев А.Д. Модулирующая роль гистамина в нейроиммунных взаимодействиях // Молекулярная медицина. 2021. Т. 19. № 3. С. 17. https://doi.org/10.29296/24999490-2021-03-03
Филиппова Л.В. и др. Особенности локализации паттерн-распознающих и ванилоидных рецепторов в нервных сплетениях кишки крысы // Докл. Академии наук. Федеральное государственное бюджетное учреждение “Российская академия наук”. 2013. Т. 452. №. 3. С. 342. https://doi.org/10.1134/S0012496613050074
Филиппова Л.В., Быстрова Е.Ю., Малышев Ф.С. и др. Экспрессия паттерн-распознающих рецепторов ноцицептивными метасимпатическими нейронами // Бюллетень экспериментальной биологии и медицины. 2015. Т. 159. № 2. С. 209. https://doi.org/10.1007/s10517-015-2934-5
Филиппова Л.В., Федорова А.В., Ноздрачев А.Д. Механизм активации энтеральных ноцицептивных нейронов посредством взаимодействия рецепторов TLR4 и TRPV1 // Докл. Академии наук. Федеральное государственное бюджетное учреждение “Российская академия наук”, 2018. Т. 479. №. 1. С. 99. https://doi.org/10.7868/S0869565218010243
Agrawal M. et al. Multiomics to elucidate inflammatory bowel disease risk factors and pathways // Nature Reviews Gastroenterology & Hepatology. 2022. T. 19. № 6. P. 399. https://doi.org/10.1038/s41575-022-00593-y
Alsalem M. et al. The contribution of the endogenous TRPV1 ligands 9-HODE and 13-HODE to nociceptive processing and their role in peripheral inflammatory pain mechanisms // Brit. J. Pharmacol. 2013. V. 168. № 8. P. 1961. https://doi.org/10.1111/bph.12092
Balemans D., Boeckxstaens G.E., Talavera K., Wouters M.M. Transient receptor potential ion channel function in sensory transduction and cellular signaling cascades underlying visceral hypersensitivity // American J. Physiology-Gastrointestinal and Liver Physiology. 2017. V. 312. № 6. P. G635. https://doi.org/10.1152/ajpgi.00401.2016
Beckers A.B. et al. Review article: transient receptor potential channels as possible therapeutic targets in irritable bowel syndrome // Alimentary Pharmacology & Therapeutics. 2017. V. 46. №. 10. P. 938. https://doi.org/10.1111/apt.14294
Benítez-Angeles M., Morales-Lázaro S.L., Juárez-González E., Rosenbaum T. TRPV1: structure, endogenous agonists, and mechanisms // International J. Molecular Sciences. 2020. V. 21. № 10. P. 3421. https://doi.org/10.3390/ijms21103421
Bertin S. et al. The ion channel TRPV1 regulates the activation and proinflammatory properties of CD4+ T cells // Nature Immunology. 2014. V. 15. № 11. P. 1055. https://doi.org/10.1038/ni.3009
Bujak J.K. et al. Inflammation, cancer and immunity—implication of TRPV1 channel // Front. Oncol. 2019. V. 9. P. 1087. https://doi.org/10.3389/fonc.2019.01087
Chen Y. et al. Transient receptor potential channels and inflammatory bowel disease // Front. Immunol. 2020. V. 11. P. 180. https://doi.org/10.3389/fimmu.2020.00180
Clark R., Lee S.H. Anticancer properties of capsaicin against human cancer // Anticancer Research. 2016. V. 36. № 3. P. 837.
Csekő K., Beckers B., Keszthelyi D., Helyes Z. Role of TRPV1 and TRPA1 ion channels in inflammatory bowel diseases: potential therapeutic targets? // Pharmaceuticals. 2019. V. 12. №. 2. P. 48. https://doi.org/10.3390/ph12020048
Donate-Macian P., Peralvarez-Marin A. Dissecting domain-specific evolutionary pressure profiles of transient receptor potential vanilloid subfamily members 1 to 4 // PLoS One. 2014. V. 9. № 10. P. e110715. https://doi.org/10.1371/journal.pone.0110715
Duo L. et al. Gain of function of ion channel TRPV1 exacerbates experimental colitis by promoting dendritic cell activation // Molecular Therapy-Nucleic Acids. 2020. V. 22. P. 924. https://doi.org/10.1016/j.omtn.2020.10.006
El-Salhy M. et al. Gastrointestinal neuroendocrine peptides/amines in inflammatory bowel disease // World J. Gastroenterol. 2017. V. 23. № 28. P. 5068. https://doi.org/10.3748/wjg.v23.i28.5068
Flynn S., Eisenstein S. Inflammatory bowel disease presentation and diagnosis // Surgical Clinics. 2019. V. 99. № 6. P. 1051. https://doi.org/10.1016/j.suc.2019.08.001
Green D.P. et al. A mast-cell-specific receptor mediates neurogenic inflammation and pain // Neuron. 2019. V. 101. № 3. P. 412. https://doi.org/10.1016/j.neuron.2019.01.012
Hasenoehrl C., Taschler U., Storr M., Schicho R. The gastrointestinal tract–a central organ of cannabinoid signaling in health and disease // Neurogastroenterology & Motility. 2016. V. 28. № 12. P. 1765. https://doi.org/10.1111/nmo.12931
Ho K.W., Ward N.J., Calkins D.J. TRPV1: a stress response protein in the central nervous system // Amer. J. Neurodegen. Dis. 2012. V. 1. № 1. P. 1.
Holzer P. Transient receptor potential (TRP) channels as drug targets for diseases of the digestive system // Pharmacology & Therapeutics. 2011. V. 131. № 1. P. 142. https://doi.org/10.1016/j.pharmthera.2011.03.006
Holzer P. TRPV1 and the gut: from a tasty receptor for a painful vanilloid to a key player in hyperalgesia // Europ. J. Pharmacol. 2004. V. 500. № 1(3). P. 231. https://doi.org/10.1016/j.ejphar.2004.07.028
Holzmann B. Antiinflammatory activities of CGRP modulating innate immune responses in health and disease // Current Protein & Peptide Science. 2013. V. 14. № 4. P. 268. https://doi.org/10.2174/13892037113149990046
Horie S., Tashima K., Matsumoto K. Gastrointestinal spice sensors and their functions // Yakugaku Zasshi: J. Pharmaceutical Society of Japan. 2018. V. 138. № 8. P. 1003. https://doi.org/10.1248/yakushi.17-00048-1
Hubbard V.M., Cadwell K. Viruses, autophagy genes, and Crohn’s disease // Viruses. 2011. V. 3. № 7. P. 1281. https://doi.org/10.3390/v3071281
Hwang D.Y., Kim S., Hong H.S. Substance-P ameliorates dextran sodium sulfate-induced intestinal damage by preserving tissue barrier function // Tissue Engineering and Regenerative Medicine. 2018. V. 15. № 1. P. 63. https://doi.org/10.1007/s13770-017-0085-7
Iacomino G. et al. IBD: Role of intestinal compartments in the mucosal immune response // Immunobiology. 2020. V. 225. № 1. P. 151849. https://doi.org/10.1016/j.imbio.2019.09.008
Iftinca M., Defaye M., Altier C. TRPV1-targeted drugs in development for human pain conditions // Drugs. 2021. V. 81. № 1. P. 7. https://doi.org/10.1007/s40265-020-01429-2
Jeong K.Y., Seong J. Neonatal capsaicin treatment in rats affects TRPV1-related noxious heat sensation and circadian body temperature rhythm // J. Neurological Sciences. 2014. V. 341. № 1–2. P. 58. https://doi.org/10.1016/j.jns.2014.03.054
Julius D. TRP channels and pain // Ann. Rev. Cell Develop. Biol. 2013. V. 29. P. 355. https://doi.org/10.1146/annurev-cellbio-101011-155833
Karthikeyan A. et al. Curcumin and its modified formulations on inflammatory bowel disease (IBD): The story so far and future outlook // Pharmaceutics. 2021. V. 13. № 4. P. 484. https://doi.org/10.3390/pharmaceutics13040484
Lapointe T.K. et al. TRPV1 sensitization mediates postinflammatory visceral pain following acute colitis // American J. Physiology-Gastrointestinal and Liver Physiology. 2015. V. 309. №. 2. P. G87. https://doi.org/10.1152/ajpgi.00421.2014
Li F.J. et al. Calcitonin gene-related peptide is a promising marker in ulcerative colitis // Digestive Dis. Scienc. 2013. V. 58. № 3. P. 686. https://doi.org/10.1007/s10620-012-2406-y
Li L. et al. The impact of TRPV1 on cancer pathogenesis and therapy: a systematic review // Int. J. Biol. Scienc. 2021. V. 17. № 8. P. 2034. https://doi.org/10.7150/ijbs.59918
Li Y. et al. Endocannabinoid activation of the TRPV1 ion channel is distinct from activation by capsaicin // J. Biol. Chem. 2021. V. 297. № 3. P. 1. https://doi.org/10.1016/j.jbc.2021.101022
Liao M., Cao E., Julius D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy // Nature. 2013. V. 504. № 7478. P. 107. https://doi.org/10.1038/nature12822
Luo C. et al. Upregulation of the transient receptor potential vanilloid 1 in colonic epithelium of patients with active inflammatory bowel disease // Int. J. Clin. Exp. Pathol. 2017. V. 10. № 11. P. 11335.
Luo L. et al. Molecular basis for heat desensitization of TRPV1 ion channels // Nature Comm. 2019. V. 10. № 1. P. 1. https://doi.org/10.1038/s41467-019-09965-6
Martinez G.Q., Gordon S.E. Multimerization of Homo sapiens TRPA1 ion channel cytoplasmic domains // PloS One. 2019. V. 14. № 2. P. e0207835. https://doi.org/10.1371/journal.pone.0207835
Matsumoto K. et al. Experimental colitis alters expression of 5-HT receptors and transient receptor potential vanilloid 1 leading to visceral hypersensitivity in mice // Laboratory Investigation. 2012. V. 92. № 5. P. 769. https://doi.org/10.1038/labinvest.2012.14
Melnick C., Kaviany M. Thermal actuation in TRPV1: Role of embedded lipids and intracellular domains // J. Theor. Biol. 2018. V. 444. P. 38. https://doi.org/10.1016/j.jtbi.2018.02.004
Mirsepasi-Lauridsen H.C. et al. Disease-specific enteric microbiome dysbiosis in inflammatory bowel disease // Front. Med. 2018. V. 5. P. 304. https://doi.org/10.3389/fmed.2018.00304
Palkar R., Lippoldt E.K., McKemy D.D. The molecular and cellular basis of thermosensation in mammals // Curr. Opin. Neurobiol. 2015. V. 34. P. 14. https://doi.org/10.1016/j.conb.2015.01.010
Quraishi M.N., Shaheen W., Oo Y.H., Iqbal T.H. Immunological mechanisms underpinning faecal microbiota transplantation for the treatment of inflammatory bowel disease // Clinical & Experimental Immunology. 2020. V. 199. № 1. P. 24. https://doi.org/10.1111/cei.13397
Raboune S. et al. Novel endogenous N-acyl amides activate TRPV1-4 receptors, BV-2 microglia, and are regulated in brain in an acute model of inflammation // Front. Cell. Neurosci. 2014. V. 8. P. 195. https://doi.org/10.3389/fncel.2014.00195
Roda G. et al. Crohn’s disease // Nature Reviews Disease Primers. 2020. V. 6. № 1. P. 1. https://doi.org/10.1038/s41572-020-0156-2
Rowan C. et al. Severe symptomatic primary CMV infection in inflammatory bowel disease patients with low population seroprevalence // Gastroenterology Research and Practice. 2018. V. 2018. № 1029401. P. 1 https://doi.org/10.1155/2018/1029401
Senning E.N. et al. Regulation of TRPV1 ion channel by phosphoinositide (4, 5)-bisphosphate: the role of membrane asymmetry // J. Biol. Chem. 2014. V. 289. № 16. P. 10999. https://doi.org/10.1074/jbc.M114.553180
Shuba Y.M. Beyond neuronal heat sensing: diversity of TRPV1 heat-capsaicin receptor-channel functions // Front. Cell. Neurosci. 2021. V. 14. P. 612480. https://doi.org/10.3389/fncel.2020.612480
Sousa-Valente J., Brain S.D. A historical perspective on the role of sensory nerves in neurogenic inflammation // Seminars in Immunopathology. 2018. V. 40. № 3. P. 229. Springer Berlin Heidelberg. https://doi.org/10.1007/s00281-018-0673-1
Uhlig H.H., Powrie F. Translating immunology into therapeutic concepts for inflammatory bowel disease // Ann. Rev. Immunol. 2018. V. 36. P. 755. https://doi.org/10.1146/annurev-immunol-042617-053055
Vinuesa A.G. et al. Vanilloid Receptor-1 Regulates Neurogenic Inflammation in Colon and Protects Mice from Colon CancerTRPV-1 Protects from Colitis-Associated Cancer // Cancer Research. 2012. V. 72. № 7. P. 1705. https://doi.org/10.1158/0008-5472.CAN-11-3693
Wouters M.M. et al. Histamine receptor H1–mediated sensitization of TRPV1 mediates visceral hypersensitivity and symptoms in patients with irritable bowel syndrome // Gastroenterology. 2016. V. 150. № 4. P. 875. https://doi.org/10.1053/j.gastro.2015.12.034
Wu W. et al. The CGRP/macrophage axis signal facilitates inflammation recovery in the intestine // Clinical Immunology. 2022. P. 109154. https://doi.org/10.1016/j.clim.2022.109154
Wu Y. et al. TLR4 mediates upregulation and sensitization of TRPV1 in primary afferent neurons in 2, 4, 6-trinitrobenzene sulfate-induced colitis // Molecular Pain. 2019. V. 15. P. 1744806919830018. https://doi.org/10.1177/1744806919830018
Xiao T., Sun M., Kang J., Zhao C. Transient Receptor Potential Vanilloid1 (TRPV1) Channel Opens Sesame of T Cell Responses and T Cell-Mediated Inflammatory Diseases // Front. Immunol. 2022. P. 2205. https://doi.org/10.3389/fimmu.2022.870952
Yang F. et al. Structural mechanism underlying capsaicin binding and activation of the TRPV1 ion channel // Nat. Chem. Biol. 2015. V. 11. №. 7. P. 518. https://doi.org/10.1038/nchembio.1835
Yang M. et al. Oral administration of curcumin attenuates visceral hyperalgesia through inhibiting phosphorylation of TRPV1 in rat model of ulcerative colitis // Molecular Pain. 2017. V. 13. P. 1744806917726416. https://doi.org/10.1177/1744806917726416
Yue W.W.S. et al. TRPV1 drugs alter core body temperature via central projections of primary afferent sensory neurons // Elife. 2022. V. 11. P. e80139. https://doi.org/10.7554/eLife.80139
Zhang T. et al. NF-κB signaling in inflammation and cancer // MedComm. 2021. V. 2. №. 4. P. 618. https://doi.org/10.1002/mco2.104
Zhang Y.Z., Li Y.Y. Inflammatory bowel disease: pathogenesis // World J. Gastroenterology: WJG. 2014. V. 20. № 1. P. 91. https://doi.org/10.3748/wjg.v20.i1.91
Zhuang H. et al. Tiliroside ameliorates ulcerative colitis by restoring the M1/M2 macrophage balance via the HIF-1α/glycolysis pathway // Front. Immunol. 2021. V. 12. P. 649463. https://doi.org/10.3389/fimmu.2021.649463
Zielińska M. et al. Role of transient receptor potential channels in intestinal inflammation and visceral pain: novel targets in inflammatory bowel diseases // Inflammatory Bowel Diseases. 2015. V. 21. № 2. P. 419. https://doi.org/10.1097/MIB.0000000000000234
Дополнительные материалы отсутствуют.
Инструменты
Успехи физиологических наук


