Вестник РАН, 2021, T. 91, № 6, стр. 541-549
ЯДЕРНАЯ МЕДИЦИНА
А. Д. Каприн *, В. П. Смирнов b, **
a Национальный медицинский исследовательский центр радиологии Минздрава России
Москва, Россия
b АО “НИИ технической физики и автоматизации” ГК “Росатом”
Москва, Россия
* E-mail: kaprin@mail.ru
** E-mail: vpsmirnov@ropsatom.ru
Поступила в редакцию 19.01.2021
После доработки 19.01.2021
Принята к публикации 25.01.2021
Аннотация
Статья посвящена истории становления и развития радиационной медицины, которая сейчас приобретает всё более широкое распространение. Лечение радиацией различных доброкачественных и злокачественных новообразований с помощью контактного применения источников ионизирующего излучения получило название брахитерапии. К настоящему времени клиническая брахитерапия разделилась на три направления: высокодозная/высокомощностная, низкодозная/низкомощностная и электронная.
Основанное в начале 1980-х годов отделение радионуклидной терапии в МРНЦ им. А.Ф. Цыба – филиале НМИЦ радиологии Минздрава России (г. Обнинск) – первое и крупнейшее в России медицинское учреждение, где осуществляется терапевтическое применение радионуклидов. Авторы завершают обзор, вычленяя основные тенденции в мировой ядерной медицине будущего.
История радиологии в России началась с открытий трёх выдающихся личностей – Антуана Анри Беккереля, обнаружившего в 1896 г. явление радиоактивности урановой руды, а также Пьера и Марии Кюри, выделивших из развалов урановой руды новые элементы – полоний и радий [1]. С этих пор многие открытия в области ядерных технологий стали толчком к разработке и развитию новых методов лечения: как говорил великий И.В. Курчатов, “атом должен быть рабочим, а не солдатом” [2].
В 1903 г., в одной из своих зарубежных поездок, В.М. Зыков, выдающийся хирург-онколог, доктор медицины, познакомился с Марией Кюри, которая передала ему на нужды развития науки в России бесценный подарок – несколько миллиграммов изотопа радия-226. Это были первые источники ионизирующего излучения в нашей стране [3].
В ходе экспериментов в начале ХХ в. врачи выяснили, что радиацией можно лечить различные доброкачественные и злокачественные новообразования с помощью контактного применения источников ионизирующего излучения. В 1903 г. началось проведение внутритканевой радиотерапии путём имплантации трубочек с радием-226 и радием-228 (мезоторием) в опухолевую ткань. Впоследствии этот метод лечения получил название “брахитерапия” [4].
К настоящему времени клиническая брахитерапия разделилась на три направления: высокодозная/высокомощностная (капсулы с кобальтом-60, цезием-137 и иридием-192), низкодозная/низкомощностная (капсулы с йодом-125, палладием-103 или цезием-131) и электронная. В России активное внедрение брахитерапии началось с 2000 г. с использованием микроисточников зарубежного производства. В качестве источника ионизирующего излучения для высокодозной брахитерапии применялись капсулы с радиоизотопом иридий-192, а в качестве источника излучения для низкодозной брахитерапии – капсулы с йодом-125.
НМИЦ радиологии Минздрава России принимал активное участие в создании и регистрации отечественных микроисточников на базе ГНЦ РФ “Физико-энергетический институт им. А.И. Лейпунского” (г. Обнинск), и в 2016 г. в России появились отечественные микроисточники с йодом-125 для низкодозной брахитерапии, которые сейчас применяются во многих медицинских центрах страны. Электронная брахитерапия, представляющая собой миниатюрный рентгеновский источник излучения, работающий при низких энергиях от сети, активно завоёвывает терапевтическую нишу за рубежом, но у нас пока не используется [5].
С 1922 г. внук известного революционера-демократа А.И. Герцена и сын крупнейшего физиолога Европы А.А. Герцена П.А. Герцен кардинально изменил характер онкологической деятельности в нашей стране. Он стал идеологом комбинированного метода лечения, учения о метастазировании, заложил основы современной организации онкологической службы и разработал конкретные методы лечения злокачественных опухолей основных локализаций, в том числе с использованием ионизирующего излучения [3].
В это же самое время в мире стала бурно развиваться коммерческая деятельность по использованию радиоизотопов радия (радий-226 и радий-228) в разных сферах деятельности – от косметической (светящиеся румяна, тени и пудра), до медицинской – в США и Европе был разрешён к медицинскому применению радиевый тоник, который, по мнению врачей, ослаблял боли при переломах [6]. В 1923 г. в СССР раствор хлорида радия-224 был официально разрешён в качестве радиофармпрепарата для облегчения болей в костях.
На протяжении следующих десятилетий радиофармпрепараты с радиоактивными изотопами фосфора-32, стронция-89, рения-186 и самария-153 успешно использовались в паллиативном лечении костных метастазов для облегчения болевого синдрома и улучшения качества жизни пациентов. Все радиофармацевтические лекарственные препараты (РФЛП) с этими изотопами имеют как свои преимущества, так и недостатки. Последние в основном обусловлены переоблучением красного костного мозга и связанными с этим фактом побочными эффектами, проявляющимися в виде анемии, нейтропении и миелосупрессии.
Наконец, в 2018 г. в США, Европе, а затем и в России был зарегистрирован новый радиофармпрепарат на основе радия-223, который предназначен не только для паллиативного лечения, но и повышения уровня выживаемости пациентов [7]. Так радий вернулся в ядерную медицину, но уже в качестве радиофармпрепарата, обладающего самым высоким терапевтическим эффектом.
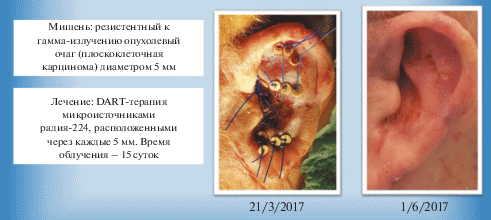
Однако не забыт в наше время и радий-224. Сегодня в Израиле разработаны и успешно прошли клинические испытания в нескольких центрах по брахитерапии ряда злокачественных солидных новообразований альфа-излучающие микроисточники с радием-224. В испытаниях участвовал и НМИЦ радиологии Минздрава России.
Помимо радионуклидной терапии костных метастазов и брахитерапии, в мире активно развивается направление по радионуклидному лечению воспалительных заболеваний суставов, основанное на внутрисуставном введении РФЛП, меченого β-излучающими радионуклидами для разрушения гипертрофированной синовиальной оболочки (радиосиновектомия – РСО). В клиническом руководстве Европейской ассоциации по ядерной медицине (EANM) процедура РСО показана при ряде воспалительных заболеваний, таких как:
• ревматоидный артрит и артриты иной природы;
• болезнь Бехчета и рецидивирующие внутрисуставные выпоты;
• гемартроз при гемофилии;
• остеоартроз и другие заболевания суставов.
За рубежом применяют целую линейку РФЛП для радиосиновектомии (табл. 1) [8].
Таблица 1.
Характеристики разрешённых к применению в Европе РФЛП для радиосиновектомии
| Радионуклид (частица) | Объём (мл) | Размер частиц (мкм) | Период полураспада (дни) | Максимальная энергия β-излучения (МэВ) | Глубина проникновения β-излучения в мягкой ткани (мм) | Гамма-излучение (КэВ) | Суставы |
|---|---|---|---|---|---|---|---|
| Иттрий-90 (цитрат) | <2 | 3–6 | 2.7 | 2.2 | 3.8–11/<8.5 | – | Колено |
| Рений (коллоид/сульфит) | <1 | 5–10 | 3.7 | 1.07 | 1.2–3.7/<3.1 | 140 | Плечо |
| Эрбий (цитрат) | <0.2 | 3–8 | 9.4 | 0.34 | 0.3–1.0/<0.7 | – | Все |
| Золото | 2.7 | 0.96 | 1.2–3.6 | 411 | Колено | ||
| Фосфор (метахром) | 10–20 | 14 | 1.7 | 2.6–7.9 | – | Колено | |
| 166Но макроагрегаты | 5–10 | 1.2 | 1.8 | 2.2–8.7 | 81 | Колено | |
| 165Dy макроагрегаты | 3–10 | 0.09 | 1.3 | 1.4–5.6 | 95 | Колено |
Сегодня в России нет зарегистрированных РФЛП для РСО. Однако недавно разработаны и успешно прошли доклинические исследования два отечественных РФЛП с радиоизотопом рений-188 для процедуры радиосиновектомии: синорен, 188Re – разработка ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России, и микросферы альбумина 5–10 мкм, 188Re – разработка НМИЦ радиологии Минздрава России [9, 10].
Радионуклидная эмболизация (РЭ) применяется для терапии неоперабельного первичного и метастатического рака печени, когда через внутрипечёночную артерию в сосуды, кровоснабжающие опухолевый очаг, подводят радиоактивное вещество, одновременно перекрывая кровоснабжение опухолевых клеток в этой области. Синергия воздействия ионизирующего излучения и кислородного голодания эффективно убивает опухолевые клетки и позволяет превратить неоперабельную опухоль в операбельную или даёт время пациенту на дожитие до трансплантации печени.
В настоящее время в мире доступны три коммерческих препарата для РЭ: стеклянные и полимерные микросферы с радионуклидом иттрий-90 и полимерные микросферы с радионуклидом гольмий-166. В России зарегистрирован отечественный препарат для РЭ – стеклянные микросферы с иттрием-90 производства ООО “Бебиг”. В НМИЦ радиологии Минздрава России радионуклидную эмболизацию этими микросферами успешно провели 8 пациентам. Однако у этого препарата имеется один, но весьма существенный недостаток: для активации микросфер необходимо высокопоточное нейтронное излучение ядерного реактора. Этот факт определяет логистическую схему поставки препарата и его стоимость.
Для устранения этого недостатка в НМИЦ радиологии Минздрава России были разработаны и успешно прошли доклинические исследования микросферы альбумина крови человека диаметром 20–40 мкм, меченные радионуклидом рений-188. Среди достоинств таких радиофармпрепаратов следует отметить:
• микросферы имеют чёткую сферическую форму и узкий размерный ряд: >95% микросфер находятся в диапазоне размеров 5–10 мкм;
• микросферы альбумина биоразлагаемы и биосовместимы, они подвергаются протеолизу после внутрисуставной инъекции;
• генераторный радионуклид рений-188 удобен в использовании;
• высокая локальная терапевтическая доза РФЛП обусловлена высокой энергией β-излучения рения-188;
• сопутствующее гамма-излучение рения-188 (155 кэВ) позволяет контролировать биораспределение РФЛП с помощью гамма-камеры;
• радионуклид получают из генератора 188W/188Re, установленного в клинике, и РФЛП готовят на месте, непосредственно перед введением пациенту.
Ядерные испытания позволили получить разнообразную информацию, в том числе и о радиоизотопах йода, которые выделяются из продуктов деления ядер урана, плутония, тория и являются одним из основных загрязнителей природной среды [11]. Радиоизотопы йода представляют большую радиационную опасность для человека и животных в связи со способностью накапливаться в щитовидной железе, замещая природный йод.
В 1950 г. Советский Союз одним из первых в мире взял курс на использование энергии атома в мирных целях. Большой победой на этом пути стал пуск первой в мире атомной электростанции мощностью 5 МВт в Обнинске 26 июня 1954 г. [11]. Из отработавшего ядерного топлива атомной станции началось выделение йода-131 для медицинского применения при заболеваниях щитовидной железы (ЩЖ).
Радиойодтерапия основана на способности щитовидной железы селективно накапливать йод. При многих заболевания ЩЖ накопление йода многократно увеличивается. Способностью селективно накапливать йод обладают и метастазы ЩЖ. Это свойство стало основой радиойодлечения (радиойодабляция) метастазов ЩЖ.
Основанное в начале 1980-х годов отделение радионуклидной терапии (РНТ) в МРНЦ им. А.Ф. Цыба – филиале НМИЦ радиологии Минздрава России (г. Обнинск) – первое и крупнейшее в России медицинское учреждение, где осуществляется терапевтическое применение радионуклидов. Здесь лечатся более 40% всех пациентов страны, получающих РНТ, потребляется более половины отечественных терапевтических РФЛП. В МРНЦ проводят 30% от всей радиойодтерапии в России.
За последние 10 лет в нашей стране наметился прогресс в развитии РНТ. Если в 2009 г. у нас было всего две клиники, где проводили РНТ, и 50 активных коек для радиойодтерапии, то к 2020 г. количество активных коек увеличилось до 125, а число центров возросло до девяти. Центры РНТ равномерно расположены по всей населённой территории России.
С изобретением приборов визуализации распределения радиоактивности в организме пациентов стала активно развиваться радионуклидная диагностика. А это важно, ведь ранняя диагностика заболевания является залогом успешного лечения.
Первый прототип ПЭТ-сканера появился в 1952 г. в Массачусетском госпитале, однако проводившиеся на нём исследования ещё нельзя было назвать томографическими, так как в итоге врачи получали только одно двумерное изображение, а не их последовательность. В 1958 г. американский биофизик и инженер Холл Ангер изобрёл гамма-камеру. В клиническую практику ПЭТ-сканеры и гамма-камеры вошли уже в конце 70-х годов [12].
В России одним из ведущих центров в данном направлении является НИЦ “Курчатовский институт”, где расположены установки, позволяющие производить широкий спектр радионуклидов, на основе которых синтезируются диагностические РФЛП: это реакторные радионуклиды, циклотронные, а также радионуклиды, которые получаются методом лазерной селекции. В НИЦ “Курчатовский институт” накоплен максимальный в стране опыт исследований и разработок в области позитронно-эмиссионной томографии, в том числе с использованием таких методов лучевой диагностики, как магнитно-резонансная томография и рентгеновская компьютерная томография.
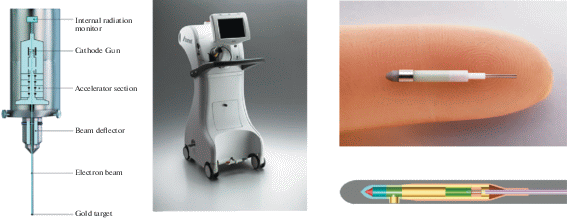
9 сентября 1960 г. произошло важное событие в мировой физике – циклотрон У‑300, установленный в лаборатории ядерных реакций Объединённого института ядерных исследований в Дубне, дал первый пучок ускоренных ядер азота до 10 МэВ/н [11]. На протяжении 17 последующих лет У‑300 оставался самым мощным и самым лучшим среди действующих ускорителей тяжёлых ионов в мире, как по интенсивности пучков, так и по разнообразию ускоряемых ионов. Развитие протонной лучевой терапии в нашей стране началось практически одновременно с ведущими странами мира. Первый в СССР протонный пучок с необходимыми для лучевой терапии параметрами был получен в 1967 г. в упомянутой лаборатории ОИЯИ по предложению члена-корреспондента АН СССР В.П. Джелепова на 680 МэВ фазотроне [11].
В 2016 г. был введён в действие первый протонный синхротрон “Прометеус” для внутриклинического размещения, созданный в ФТЦ ФИАН членом-корреспондентом РАН В.Е. Балакиным [13]. В настоящее время терапевтический комплекс располагается в Обнинске на базе НМИЦ радиологии Минздрава России, специалисты центра специализируются на лечении опухолей головы и шеи. За время работы установки в Обнинске эффективное лечение прошли более 300 человек, у которых наблюдается положительная посттерапевтическая динамика онкологического заболевания.
Крайне интересной и перспективной для мирового научного сообщества является тематика терапии радиорезистентных (в том числе и к протонной терапии) опухолей тяжёлыми ионами углерода. По наиболее консервативным оценкам, не менее 10% больных, нуждающихся в лучевом лечении, получат существенный выигрыш от использования ионной терапии – в России это примерно 26 тыс. человек. Исторически, с 1992 г., наибольшим опытом создания подобных комплексов для клинического использования обладают японские инженеры [14]. Сейчас число комплексов терапии тяжёлыми ионами углерода достигло в мире 13. Новые комплексы создаются в Китае и Южной Корее. К сожалению, в настоящий момент Россия не располагает клиническими центрами ионной терапии, хотя работа в этом направлении ведётся.
НМИЦ радиологии Минздрава России поддерживает научные контакты с крупнейшими центрами ионной терапии Японии и Германии. Коллектив центра участвовал в физических исследованиях и математическом моделировании в этой области. Проведя серию биологических исследований пучка ионов углерода 12С на клеточных культурах опухолей и лабораторных животных, сотрудники центра получили уникальный, единственный на территории России опыт доклинического применения пучка ионов углерода 12С. Кроме того, НМИЦ радиологии совместно с НИИ технической физики и автоматизации ГК “Росатом” ведёт работу по созданию отечественного комплекса лучевой терапии (КЛТ-6) на основе ускорителя электронов с энергией 6 МэВ, а совместно с ВНИИ автоматики им. Н.Л. Духова Росатома и НИИТФА создаётся медицинская установка для нейтронной терапии на базе малогабаритного нейтронного генератора НГ-24.
Технологический, научный и производственный потенциал ВНИИА и НИИТФА позволяют с минимальными затратами создать серийное производство компактных и недорогих установок для нейтронной терапии и кардинально расширить применение высокотехнологичной медицины в лечении онкологических больных в России. В 2021 г. планируется начало клинических испытаний.
В конце ХХ – начале XXI в. во главу угла в ядерной медицине встала не физика, а радиофармацевтика. Возникло новое направление – тераностика, от слов ТЕРАпия и диагНОСТИКА.
Среди основных задач тераностики можно выделить:
• молекулярную визуализацию и точную молекулярно-метаболическую оценку биологических процессов, в том числе на ранних стадиях, когда это недоступно другим видам исследования;
• высокоинтенсивное прицельное адресное лучевое воздействие на молекулярно-клеточном уровне непосредственно на клетки и органы-мишени без повреждения здоровых тканей;
• одновременное воздействие на все патологические очаги с возможностью их визуализации;
• посттерапевтический мониторинг состояния организма и патологических очагов.
В мире основные работы стали проводиться не по поиску новых радионуклидов, а по синтезу новых транспортных молекул, благодаря которым, в зависимости от свойств конъюгированных с ними радионуклидов, будут создаваться либо диагностические радиофармацевтические лекарственные препараты, либо РФЛП для терапии.
Так, в НМИЦ радиологии Минздрава России были разработаны и прошли первую фазу клинических испытаний два отечественных РФЛП с рением-188 на основе фосфоновой и золедроновой кислот для радионуклидной терапии костных метастазов. РФЛП показали превосходное накопление в патологических костных структурах с минимальной лучевой нагрузкой на организм в целом. Сейчас делается всё возможное для скорейшей регистрации этих РФЛП для клинического применения их в России.
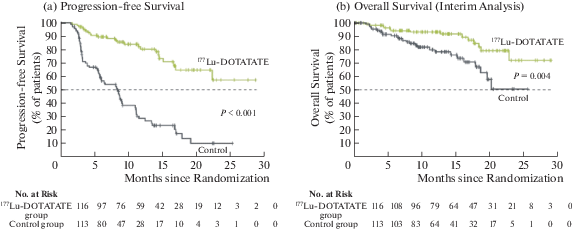
В 2018 г. в Европе и США был разрешён для клинического применения инновационный зарубежный РФЛП лютатерра, 177Lu для пептид-рецепторной радионуклидной терапии нейроэндокринных злокачественных новообразований (НЭО). Препарат показал высокую терапевтическую эффективность: в группе пациентов с НЭО, принимающих лютатерру, 177Lu, общая выживаемость за период наблюдения, равный 30 месяцам после терапии, была выше на 45% в сравнении с контрольной группой. В России этот препарат ещё не появился, однако в НМИЦ радиологии Минздрава России совместно с партнёрами ведутся работы по синтезу отечественного аналога этого РФЛП.
Специалистами МРНЦ им. А.Ф. Цыба – филиала НМИЦ радиологии Минздрава России разработана технология получения инновационного отечественного диагностического РФЛП на основе моноклональных антител, чувствительных к простат специфическому мембранному антигену (ПСМА), меченных генераторным радионуклидом технеций-99м для однофотонной эмиссионной компьютерной томографии (ОФЭКТ) метастатического кастрат-резистентного рака предстательной железы (мКРРПЖ) и лютецием-177 для радиолигандной терапии этого же заболевания. ПСМА обладает высокой экспрессией на поверхности клеток рака предстательной железы. Единственный шанс на успешное лечение мКРРПЖ – его ранняя диагностика. В мире применяются несколько РФЛП для диаг-ностики мКРРПЖ: для позитронно-эмиссионной томографии – 68Ga-ПСМА-11, 18F-ПСМА1007, для ОФЭКТ – 99мТс-ПСМА-I&S, 99mTc-MIP-1404, и два РФЛП для радиолигандной терапии мКРРПЖ: 177Lu-ПСМА-617 и 225Ас-ПСМА-617. Эти препараты пока нигде в мире не зарегистрированы, однако уже более 10 лет активно и эффективно применяются за рубежом (страны Евросоюза, США, Канада, Китай, Япония, Австралия и др.).
В настоящее время специалистами МРНЦ им. А.Ф. Цыба проводятся работы по созданию инновационных РФЛП на базе фрагментов моноклональных антител (мАт), специфичных к GD2 ганглиозиду, меченных радионуклидами галлия-68, технеция-99м, актиния-225 и рения-188 для диагностики и лечения злокачественных новообразований. Партнёрами выступают компания ООО “Реал-Таргет” – разработчик анти-GD2 моноклональных антител и их фрагментов, и АО “ГНЦ РФ – ФЭИ” – единственный отечественный производитель сорбционных генераторов рения-188 и раствора актиния-225 медицинского качества.
Инициатива НМИЦ радиологии о возможности изготавливать в клиниках РФЛП, которые успешно применяются за рубежом, но не зарегистрированы в России, была поддержана Минздравом России. В 2019–2020 гг. была проведена и ведётся до сих пор большая работа по изменению нормативного законодательства в этой сфере. Приказом Министерства здравоохранения РФ от 31 июля 2020 г. № 780н “Об утверждении видов аптечных организаций” (вступил в силу с 1 января 2021 г.) введён новый вид аптеки как структурного подразделения медицинской организации – производственная аптека с правом изготовления радиофармацевтических лекарственных препаратов. Готовится к выпуску ещё один приказ Минздрава России о порядке изготовления РФЛП в медицинских организациях, где более подробно прописаны правила изготовления РФЛП. Этот документ заменит действующий приказ № 211н от 27 апреля 2015 г. Основными отличиями устанавливаемого новым приказом порядка являются: уточнение требований, предъявляемых к помещениям, оборудованию, системе документации, персоналу, контролю качества при изготовлении радиофармацевтических лекарственных препаратов, системе обеспечения качества в медицинской организации с учётом норм радиационной безопасности, требований санитарно-эпидемиологических правил и гигиенических нормативов, установленных законодательством Российской Федерации.
Подводя итоги, можно вычленить основные тенденции в мировой ядерной медицине будущего:
• чёткое разделение компаний, специализирующихся на диагностике, и компаний, развивающих то или иное направление терапии;
• диагностика останется в сфере компетенций радиофармацевтических компаний, тогда как традиционные фармацевтические компании сосредоточат внимание на терапевтических РФЛП;
• тераностика станет приоритетным направлением развития в радиофармацевтике.
Поэтому в качестве первоочередных задач отечественной ядерной медицины следует определить:
• создание собственных образцов тяжёлой техники для лучевой диагностики и терапии;
• организацию полного цикла производства препаратов в стране – от сырья до вывода на рынок новых РФЛП;
• развитие кадрового потенциала по конструированию, производству, испытанию, введению в серию РФЛП и аппаратуры для ядерной медицины;
• усовершенствование законодательной базы по производству и оказанию медицинских услуг в этой области;
• финансирование, контроль и выполнение НИОКРов по развитию ядерной медицины междисциплинарными коллективами.
Рис. 2.
Вехи в развитии радионуклидной терапии костных метастазов: сцинтиграфия скелета после введения РФЛП с различными радиоизотопами
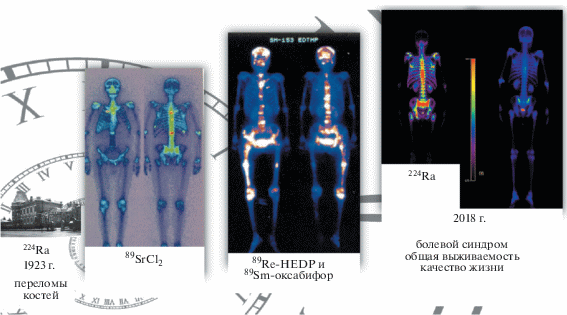
Рис. 4.
Сравнение размеров и однородности распределения микрочастиц коллоида и микросфер альбумина крови человека
а – микросферы альбумина 5–10 нм; б – коллоид сульфида рения

Список литературы
Trombetta M. Madame Maria Sklodowska-Curie – brilliant scientist, humanitarian, humble hero: Poland’s gift to the World // J. Contemp. Brachytherapy. 2014 Oct. 6(3): 297-9.
Орлова Г. Что такое мирный атом // arzamas.academy, 2020. https://arzamas.academy/materials/2199 (дата обращения 17.12.2020).
Каприн А.Д., Чиссов В.И., Дрошнева И.В. Стpаницы истоpии МНИОИ имени П.А. Геpцена // МНИОИ им. П.А. Герцена – филиал ФГБУ “НМИЦ радиологии” Минздрава России, 2020. https://www.mnioi.nmicr.ru/about/history.php (дата обращения 17.12.2020).
Rivard M.J., Venselaar J.L., Beaulieu L. The evolution of brachytherapy treatment planning // Med Phys. 2009 Jun. 36(6): 2136-53.
Eaton D. Electronic brachytherapy – current status and future directions // British Journal of Radiology. 2015. March.
Medicine: Radium Drinks // TIME USA. 1932. 11 apr. http://content.time.com/time/subscriber/article/0,33009,743525,00.html (дата обращения 17.12.2020).
Hoskin P., Sartor O., O’Sullivan J.M. et al. Efficacy and safety of radium-223 dichloride in patients with castration-resistant prostate cancer and symptomatic bone metastases, with or without previous docetaxel use: a prespecified subgroup analysis from the randomised, double-blind, phase 3 ALSYMPCA trial // Lancet Oncol. 2014 Nov. 15(12):1397-406.
Dash A., Farahati J., Giammarile F., Jalilian A. Production, Quality Control and Clinical Applications of Radiosynovectomy agents // IAEA Technical Reports Series. August 2019.
Кодина Г.Е., Малышева А.О., Клементьева О.Е. и др. Синорен 188Re – потенциальный радиофармацевтическиий лекарственный препарат для радиосиновэктомии // Радиация и риск. 2018. Т. 27. № 4.
Радиофармацевтическая композиция для терапии воспалительных заболеваний суставов на основе радионуклида 188Re и микросфер альбумина крови человека, а также состав и способ её получения: пат. 2698101. Заявители: Дороватовский С.А., Петриев В.М., Зверев А.В., Скворцов В.Г., Каприн А.Д., Антонюк А.В., Лесковец Е.Ю. Заявл. 25.05.2018; регистр. 22.08.2019.
75 лет Атомной промышленности. Опережая время. Государственная корпорация по атомной энергии “Росатом”, 2020. https://www.atom75.ru/#history (дата обращения 17.12.2020).
History of PET and MRI. U.S. Department of Energy. Molecular Nuclear Medicine Legacy, 2009 Sept. https://medicalsciences.energy.gov/historypetmri.shtml (дата обращения 17.12.2020).
Первый опыт клинического использования терапевтического протонного комплекса “Прометеус”// Тезисы докладов 2-го Всероссийского съезда по радиохирургии и стереотаксической радиотерапии. СПб., 2016.
Malouff T.D., Mahajan A., Krishnan S. et al. Carbon Ion Therapy: A Modern Review of an Emerging Technology // Front Oncol. 2020;10:82. Published 2020 Feb 4.
Дополнительные материалы отсутствуют.