Высокомолекулярные соединения (серия А), 2019, T. 61, № 3, стр. 209-221
РАСТВОРИМЫЕ ПОЛИМЕРНЫЕ КОМПЛЕКСЫ ЦЕФТРИАКСОНА И ЦЕФОТАКСИМА С СОЛЕВЫМИ ФОРМАМИ СУЛЬФАТА АЦЕТАТА ЦЕЛЛЮЛОЗЫ И ИХ АДСОРБЦИЯ НА УГОЛЬНЫХ СОРБЕНТАХ
Т. А. Савицкая a, *, Е. А. Шахно b, Д. Д. Гриншпан b, О. А. Ивашкевич a
a Белорусский государственный университет
220030 Минск, ул. Ленинградская, 14, Республика Беларусь
b Учреждение Белорусского государственного университета
“Научно-исследовательский институт физико-химических проблем”
220030 Минск, ул. Ленинградская, 14, Республика Беларусь
* E-mail: savitskayaTA@bsu.by
Поступила в редакцию 05.12.2018
После доработки 28.12.2018
Принята к публикации 09.01.2019
Аннотация
Изучено влияние природы противоиона солевых форм сульфата ацетата целлюлозы на состав, гидродинамические характеристики, поверхностную активность и размеры надмолекулярных образований водорастворимых комплексов с цефтриаксоном и цефотаксимом. Установлена взаимосвязь между положением противоиона в лиотропном ряду катионов щелочных металлов и свойствами комплексов. Показано, что количество связываемого антибиотика уменьшается в ряду K+–Na+–Li+. Аналогично изменяются и размеры мицеллоподобных надмолекулярных образований в растворе и в твердой фазе (пленке, полученной из раствора). Формирование таких структур возможно вследствие гидрофобизации макромолекулярной цепи полиэлектролита. Найдено, что адсорбция полимерных комплексов цефтриаксона и цефотаксима на различных угольных сорбентах зависит от поровой структуры активированного угля и позволяет обеспечить перенос антибиотика в тонкий кишечник в неизменном виде. Это открывает возможность создания новой таблетированной лекарственной формы цефалоспориновых антибиотиков при полном сохранении их фармакологической активности.
ВВЕДЕНИЕ
Цефтриаксон (ЦЕФТР) и цефотаксим (ЦЕФОТ) являются полусинтетическими антибиотиками, которые по химической классификации относятся к иминоцефалоспоринам, а по фармакологической – к цефалоспоринам третьего поколения. Оба антибиотика отличаются активностью в отношении грамотрицательных бактерий и не инактивируются большинством β-лактамаз, продуцируемых этими бактериями. Механизм их биодействия заключается в ингибировании транспептидазы, участвующей в синтезе белковой оболочки патогенной бактерии. ЦЕФТР и ЦЕФОТ в настоящее время остаются одними из самых распространенных в клинической практике цефалоспориновых антибиотиков несмотря на существенное неудобство для лечения: отсутствие пероральной лекарственной формы [1].
Применяемый сегодня парентеральный путь приема данных антибиотиков имеет ряд существенных недостатков: необходимость наличия квалифицированного медицинского персонала для стационарного ведения больного, риск постинъекционных осложнений, возможность анафилактического шока при введении антибиотиков из-за неконтролируемого быстрого нарастания плазменной концентрации лекарства, болезненность и психологический дискомфорт, связанный с необходимостью принятия многочисленных инъекций, особенно при длительном лечении и т.п.
Попытки перейти от инъекционной формы к таблетированной или суспензионной привели к потере лекарственной активности цефалоспоринов, так как они оказались нестабильными в кислой среде желудка [2] и практически не проникали через мембрану слизистой оболочки кишечника. Последнее обусловлено тем, что в этих физиологических условиях они присутствуют в ионизованной форме [3]. Традиционно в качестве возможного пути повышения биодоступности цефалоспориновых антибиотиков предлагается их модификация высокомолекулярными соединениями, которые выполняют роль либо кислотонерастворимой внешней оболочки (капсулы), либо комплексообразователя (для уменьшения степени ионизации) [4]. Однако до сих пор для ЦЕФТР и ЦЕФОТ не был найден полимер, сохраняющий их лекарственную активность и поэтому пригодный для промышленного выпуска таблетированной или иной непарентеральной лекарственной формы.
Цель настоящей работы – синтез и изучение физико-химических свойств новых полимерных комплексов ЦЕФТР и ЦЕФОТ с водорастворимым анионным полиэлектролитом – сульфатом ацетатом целлюлозы (САЦ) в форме литиевой (Li-САЦ), натриевой (Na-САЦ) и калиевой (K-САЦ) солей в растворе и после их иммобилизации на активированном угле.
В последнем случае активированный уголь мы рассматривали как носитель комплексов антибиотик–полимер при создании твердых лекарственных форм. Ранее нами было показано на примере L-аргинина [5], что такая композиция действительно не только позволяет сохранить эффективность терапевтического действия лекарственного вещества, но и повысить его.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Натриевую, калиевую и литиевую соли сложного смешанного эфира целлюлозы – сульфата ацетата (поли-(1β → 4)-(2-O-ацетил-6-сульфо-D-глюкопиранозы) синтезировали в соответствии с методикой [6]. Характеристики полимеров представлены в табл. 1. Ниже приведено составное повторяющееся звено САЦ
Таблица 1.
Характеристики полимеров
| Полимер | $\left\langle {{{M}_{\eta }}} \right\rangle $ × 10–3 | рН 1%-ного водного раствора | Содержание сульфатных групп, % | Содержание ацетатных групп, % |
|---|---|---|---|---|
| Na-САЦ | 36 | 6.7 ± 0.1 | 32.0 ± 0.1 | 14.4 ± 0.1 |
| K-САЦ | 42 | 6.2 ± 0.1 | 34.1 ± 0.1 | 17.3 ± 0.1 |
| Li-САЦ | 45 | 6.0 ± 0.1 | 31.5 ± 0.1 | 19.8 ± 0.1 |
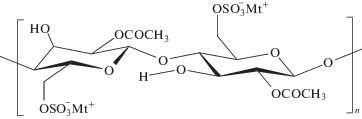
(Мt+ – K+, Na+ или Li+).
ЦЕФТР и ЦЕФОТ использовали в форме соответственно ди- и мононатриевой соли (“Harbin Pharmaceutica Group”, КНР) с содержанием основного вещества 99.9 и 99.8 мас. % соответственно
Полимерные комплексы лекарственных субстанций получали смешением растворов исходных компонентов в деионизованной воде (рН 5.6), водном растворе 0.1М HCl (рН 1.0) и 0.2 М фосфатном буферном растворе (рН 7.5). Суммарную концентрацию растворов варьировали от 1 до 10 мас. % при отношениях полимер : антибиотик от 1:10 до 10:1 моль-звено полимера/моль антибиотика. В качестве моль-звена САЦ рассматривали целлобиозное звено. Состав комплексов определяли методом изомолярных серий Остромысленского–Жоба [7] на спектрофотометре UV/VIS SP8001 (“Metertech”, Тайвань). Поверхностное натяжение водных растворов антибиотиков, САЦ и их комплексов измеряли полустатическим методом отрыва кольца на приборе “Процессор-тензиометр K100 MK2” (“Kruss”, Германия) и сталагмометрическим методом. Удельную электропроводность λ растворов определяли на кондуктометре МАРК-603 (Общество с ограниченной ответственностью “ВЗОР”, Россия) в сверхчистой воде (λ = 0.055 мкСм/см), полученной с помощью системы “SG-Wasser Ultra Clear” (“Siemens”, Германия).
Для определения рН растворов в методе потенциометрического титрования использовали рН-метр “PerpHecT® Meter Thermo Orion 310” (“ThermoScientific”, США). Калибровку проводили по буферным растворам с рН 7.01 и 4.01.
Характеристическую вязкость растворов индивидуальных полимеров и комплексов находили с помощью вискозиметра Уббелоде (d = 0.54 мм) в 0.2 моль/дм3 солевых растворах, соответственно LiCl, NaCl и KCl (для подавления эффекта полиэлектролитного набухания).
Размер частиц в растворах солевых форм САЦ и их комплексов с антибиотиками определяли с помощью метода лазерной дифракции на приборе “Zetasizer Nano ZS” (“Malvern”, Великобритания) при 298 K. Концентрация полимера составляла 3.0 и 4.0 г/100 см3 в случае K-САЦ, 0.6 и 2.5 г/100 см3 для Na-САЦ, 0.6 и 2.5 г/100 см3 для Li-САЦ.
Размер частиц в водных растворах Na-САЦ и его комплекса с ЦЕФТР оценивали также методом анализа траектории движения наночастиц на мультипараметрическом анализаторе наночастиц “Nanosight LM0” (“Nanosight Ltd”, Великобритания) в конфигурации HS-BF (высокочувствительная видеокамера “Andor Luca”, полупроводниковый лазер с длиной волны 405 нм и мощностью 45 мВт).
Морфологию поверхности пленок, полученных из растворов путем испарения воды, исследовали методом сканирующей электронной микроскопии на СЭМ LEO 1420 (“Сarl Zeiss”, Германия) при увеличениях от 500 до 20 000.
ИК-фурье-спектры в режиме МНПВО (на кристалле селенида цинка с фиксированным углом падения 45°) регистрировали на спектрометре “Nicolet IS10 FT-IR” (“ThermoScientific”, США) при 40-кратном сканировании и разрешении 2 см–1 при температуре окружающей среды.
В качестве носителя для иммобилизации полимерных комплексов цефалоспоринов использовали активированные угли АУТ-МИ (Открытое акционерное общество “СветлогорскХимволокно”, Беларусь); ОУ-А (“Сорбент”, Россия); TH-90G (“Silicarbon”, Германия). Адсорбцию антибиотиков и их полимерных комплексов с Na-САЦ на активированных углях оценивали методом переменных концентраций в статических условиях при 298 K. Для обработки результатов использовали уравнения Фрейндлиха и Ленгмюра. Таблетки получали на лабораторной установке тритурационным методом. Размеры частиц дисперсий, образуемых таблетками в дистиллированной воде, изучали методом лазерной дифракции на приборе “Mastersizer 3000” (“Malvern”, Великобритания), снабженном блоком для мокрого диспергирования с объемом измерительного сосуда 120 см3 при скорости вращения мешалки 1500 об/мин.
Кинетику выделения лекарственной субстанции и устойчивость новой лекарственной формы ЦЕФТР в модельных средах оценивали методом ВЭЖХ на жидкостном хроматографе “LC-20 Prominence” с диодно-матричным детектором SPD-M20A (“Shimadzu”, Япония).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
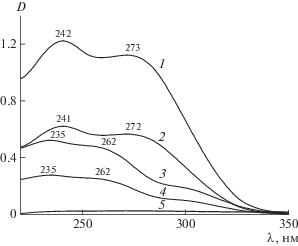
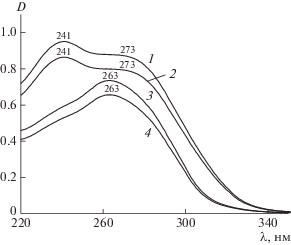
Основу молекул цефалоспориновых антибиотиков составляет цефем-группа, которая определяет их антимикробную активность и представляет собой соединенные бета-лактамный и дигидротиазиновый циклы. В водной среде при различных значениях рН ЦЕФТР и ЦЕФОТ взаимодействуют со всеми исследованными солевыми формами САЦ с образованием новых растворимых продуктов. При исследованных значениях рН в УФ-спектрах ЦЕФТР и ЦЕФОТ в присутствии Na-САЦ сохраняются присущие им полосы поглощения. Однако по сравнению со спектрами индивидуальных антибиотиков они характеризуются большей интенсивностью, т.е. имеет место гиперхромный эффект, что указывает на взаимодействие антибиотика с полимером, поскольку cам полимер в этой области не поглощает (рис. 1, кривая 5) [8], а антибиотик, связанный в комплекс, поглощает в УФ-области значительно сильнее.
Рис. 1.
УФ-спектры растворов при рН 7.5: 1 – комплекс Na-САЦ с ЦЕФТР, 2 – ЦЕФТР, 3 – комплекс Na-САЦ с ЦЕФОТ, 4 – ЦЕФОТ, 5 – Na-САЦ.
Изменение УФ-спектра комплекса в средах с различным рН соответствует изменению спектра самого антибиотика. Так, в кислой среде (рис. 2, кривые 3, 4) в спектрах ЦЕФТР и его комплекса с Na-САЦ присутствует только один пик при 263 нм, который, по литературным данным, соответствует поглощению протонированной аминотиазольной группы [9]. Действительно, согласно определенным в работе [10] константам ионных равновесий при рН 1.2 ЦЕФТР существует преимущественно в катионной форме H3ЦЕФТР+, протонированная аминотиазольная группа которой способна электростатически взаимодействовать с сульфогруппами Na-САЦ с образованием полимерной соли антибиотика. На их взаимодействие указывает также увеличение интенсивности полос в спектре антибиотика, включенного в комплекс. В нейтральной и щелочной средах (рис. 1 и 2, кривые 1, 2) в спектрах проявляются поглощения двух групп – аминотиазольной и анионного фрагмента 7-аминодезацетоксицефалоспорановой (ЦЕФТР) и 7-аминоцефалоспорановой (ЦЕФОТ) кислот, что указывает на существование антибиотиков при этих значениях рН в цвиттерионной форме H3ЦЕФТР±.
Рис. 2.
УФ-спектры водных растворов: 1 – комплекс Na-САЦ с ЦЕФТР (рН 5.6), 2 – ЦЕФТР (рН 5.6), 3 – комплекс Na-САЦ с ЦЕФТР (рН 1.2), 4 – ЦЕФТР (рН 1.2).
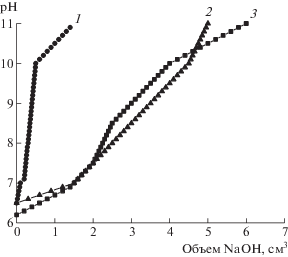
Данные рис. 3 позволяют заключить, что карбоксильные группы антибиотика во взаимодействии с полимером не участвуют, поскольку ход кривых титрования NaOH практически совпадает для индивидуального и соединенного с полимером антибиотика (кривые 2, 3). В то же время сульфатные группы, принадлежащие САЦ, не проявляются на кривой потенциометрического титрования комплекса, что указывает на их преимущественное участие во взаимодействии с антибиотиком (кривые 1 и 2).
Рис. 3.
Кривые потенциометрического титрования 0.1 М раствором NaOH при 298 K водных растворов: 1 – Na-САЦ, 2 – комплекс ЦЕФТР с Na-САЦ, 3 – ЦЕФТР.
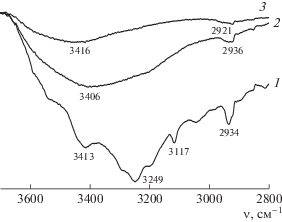
Участие сульфатной группы полимера в образовании комплекса полимер–антибиотик четко подтверждается данными ИК-фурье-спектроскопии. В спектрах комплексов наблюдается смещение полосы ее асимметричных валентных колебаний относительно положения полос в спектрах индивидуальных полимеров. Так, в спектре комплекса Li-САЦ с ЦЕФТР имеет место сдвиг 1205 → 1217 см–1, с ЦЕФОТ – 1205 → 1225 см–1. Для комплекса Na-САЦ с ЦЕФТР смещение составляет 1219 → 1228 см–1 и 1219 → 1241 см–1 в случае комплекса с ЦЕФОТ. Для комплексов K-САЦ с ЦЕФОТ также зафиксировано смещение 1220 → → 1225 см–1. Наблюдающиеся батохромные сдвиги вызваны заменой катиона щелочного металла на катион антибиотика. Для всех солевых форм электростатическое взаимодействие дополняется образованием водородных связей с участием гидроксильных групп полимера и амидной группы O=CNH–антибиотика, что иллюстрируют изменения в спектре комплекса Na-САЦ с ЦЕФТР в области 3100–3600 см–1 по сравнению со спектрами индивидуальных компонентов (рис. 4).
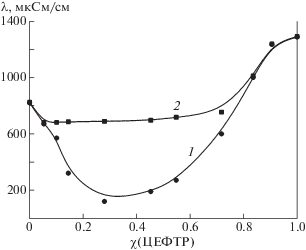
Электростатический характер взаимодействия компонентов проявляется в уменьшении электропроводности растворов, как полимера, так и антибиотика при их смешении в определенных пропорциях (рис. 5). При этом для комплекса характерна минимальная электропроводность. Молярное отношение Na-CАЦ:ЦЕФТР, составило 2.1 : 1. Более низкие экспериментальные значения электропроводности по сравнению с рассчитанными путем сложения парциальных величин, свидетельствуют о нейтрализации заряда молекул компонентов в результате их взаимодействия.
Рис. 5.
Удельная электропроводность λ водных растворов Na-CАЦ : ЦЕФТР при различном молярном отношении компонентов.: 1 и 2 – экспериментальная и рассчитанная зависимости соответственно.
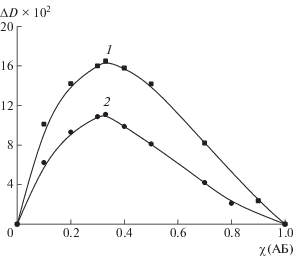
Найденное по данным электропроводности соотношение компонентов в комплексе Na-CАЦ с ЦЕФТР практически совпало с определенным по методу Остромысленского–Жоба (рис. 6, кривая 1). Аналогичный состав (2.0 : 1.0 моль-звено/моль) был установлен и для комплекса Na-CАЦ с ЦЕФОТ (рис. 6, кривая 2). Для остальных солевых форм целлюлозного полиэлектролита состав комплексов соответствует молярным отношениям Li-CАЦ : ЦЕФТР = 2.5 : 1.0; K-CАЦ : : ЦЕФТР = 1.5 : 1.0; Li-CАЦ : ЦЕФОТ = 2.5 : 1.0; K-CАЦ : ЦЕФОТ = 1.5 : 1.0 моль-звено/моль. Нестехиометричность составов свидетельствует о наличии не вовлеченных в процесс комплексообразования высокогидрофильных групп –OSO$_{3}^{ - }$, присутствие которых обусловливает заряд свободных от антибиотика участков цепи полиэлектролита и, как следствие, водорастворимость полученных комплексов [11].
Рис. 6.
Кривые Остромысленского–Жоба для определения молярного состава комплексов Na–САЦ с ЦЕФТР (1) и Na–САЦ с ЦЕФОТ (2).
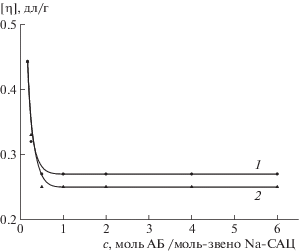
Состав комплексов, установленный этим методом, подтвержден результатами вискозиметрического исследования. Оказалось, что зависимость характеристической вязкости водных растворов комплексов от молярного отношения антибиотик : полимер выходит на плато при молярном отношении, соответствующем составу комплекса (рис. 7) [12].
Рис. 7.
Зависимость характеристической вязкости растворов комплексов от количества антибиотика с в расчете на моль-звено Na-CАЦ в 0.2 М NaCl при 298 К. 1 – ЦЕФТР, 2 – ЦЕФОТ.
Для объяснения различия в составе комплексов, образованных солевыми формами целлюлозного полиэлектролита, следует принять во внимание предложенную в работе [13] модель, где гидродинамический объем, занимаемый макромолекулой полиэлектролита, в соответствии с представлением о двойном электрическом слое условно разделен на объем, занимаемый собственно макромолекулой и прочно связанной с ней частью противоионов, и на внешний объем, в котором присутствуют только противоионы, участвующие в тепловом движении и образующие диффузный слой.
Чем слабее связаны противоионы с функциональными группами полимера, тем их больше переходит во внешний объем и тем больше некомпенсированный заряд макромолекулярной цепи. Соответственно лиотропному ряду ионов щелочных металлов, в котором с ростом радиуса иона должна уменьшаться степень его гидратации, наибольший эффективный заряд цепи, а, значит, и наибольшие размеры макромолекулярного клубка должна иметь литиевая соль САЦ, поскольку ион Li+ гидратирован в наибольшей степени и слабее взаимодействует с сульфатными группами, определяющими плотность заряда цепи макромолекулы САЦ. Это подтверждают приведенные в табл. 2 значения характеристической вязкости, которые пропорциональны размерам цепи полимера и уменьшаются от литиевой к натриевой соли. Значения cкр, отвечающие концентрации начала перекрывания полимерных клубков в объеме раствора, также закономерно растут. Как следует из данных табл. 2, по влиянию на эти характеристики ионы калия и натрия должны быть переставлены в ряду, соответствующем увеличению их размера. Перестановка ионов калия и натрия обусловлена в данном случае особым типом гидратации ионов калия (отрицательная гидратация) [14, 15].
Таблица 2.
Влияние природы противоиона на гидродинамические характеристики и параметр термодинамической жесткости солевых форм макромолекул САЦ и их комплексов с цефалоспоринами
| Проти-воион | [η], 100 см3/г | kH | cкр, г/100 см3 | [η]kHcкр | A, Å |
|---|---|---|---|---|---|
| Li+ | 0.70 | 0.26 | 1.72 | 0.31 | 214 |
| ЦЕФТР | 0.65 | 0.24 | 1.32 | 0.21 | 280 |
| ЦЕФОТ | 0.64 | 0.24 | 1.32 | 0.20 | 251 |
| Na+ | 0.44 | 0.66 | 1.70 | 0.49 | 267 |
| ЦЕФТР | 0.32 | 0.48 | 1.64 | 0.25 | 284 |
| ЦЕФОТ | 0.30 | 0.45 | 1.64 | 0.22 | 252 |
| K+ | 0.62 | 0.52 | 3.12 | 1.01 | 191 |
| ЦЕФТР | 0.55 | 0.46 | 2.81 | 0.71 | 208 |
| ЦЕФОТ | 0.53 | 0.44 | 2.81 | 0.66 | 187 |
Представленные в табл. 2 гидродинамические характеристики полимерных солей исследованных цефалоспориновых антибиотиков такие, как константа Хаггинса kH, концентрация кроссовера cкр и величина сегмента Куна А не демонстрируют зависимости от природы противоиона, характерной для лиотропного ряда. Единственным критерием, позволяющим учесть это влияние, оказалось произведение трех величин [η] kHcкр, которое было предложено нами ранее [6] как учитывающее все основные типы взаимодействий в системах полимер–полимер, полимер–растворитель, полимер–антибиотик и степень заполнения единицы объема раствора макромолекулами полимера.
С увеличением заряда цепи производного целлюлозы должно уменьшаться количество связанных с ней молекул антибиотика; последние в той области значений рН, для которой был определен состав комплексов, присутствуют в цвитер-ионной форме [10]. Наличие одноименных зарядов на полимерной цепи и в молекуле антибиотика затрудняет его диффузию в объем макромолекулярного клубка для образования солевых связей в фиксированных точках макромолекулы за счет взаимодействия сульфатных групп САЦ и протонированной аминотиазольной группы антибиотика. Действительно, на целлобиозное звено Li-САЦ приходится 0.4 моля антибиотика, а на звено K-САЦ – 0.6 моля.
Электростатическое взаимодействие с молекулами цефалоспоринов придает гидрофобность отдельным участкам макромолекул целлюлозного полиэлектролита, на что указывают результаты оценки поверхностного натяжения их водных растворов. Как видно на рис. 8, комплексы обоих антибиотиков обладают поверхностной активностью (6.11 $\frac{{{\text{Н /}}{{{\text{м }}}^{{ - 1}}}}}{{{\text{к м о л ь /}}{{{\text{м }}}^{3}}}}$ для Na-САЦ : ЦЕФТР и 12.9 $\frac{{{\text{Н /}}{{{\text{м }}}^{{ - 1}}}}}{{{\text{к м о л ь /}}{{{\text{м }}}^{3}}}}$ для Na-САЦ : ЦЕФОТ), тогда как полимер поверхностно-инактивен, а антибиотики поверхностно-индифферентны. При этом, как следует из табл. 3, химическая индивидуальность противоиона слабо влияет на величину поверхностного натяжения. Различные солевые формы САЦ практически одинаково повышают поверхностное натяжение на границе вода – воздух (рис. 8, кривая 3; табл. 3), а их комплексы с антибиотиками снижают его (рис. 8, кривые 1, 4; табл. 3).
Рис. 8.
Изотермы поверхностного натяжения водных растворов при 298 K: 1 – комплекс ЦЕФТР с Na-САЦ; 2 – ЦЕФТР, ЦЕФОТ; 3 –Na-САЦ; 4 – комплекс ЦЕФОТ с Na-САЦ.
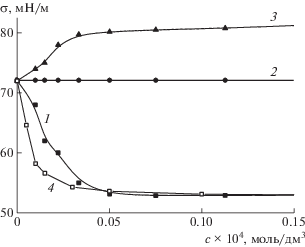
Таблица 3.
Значения поверхностного натяжения водных растворов солевых форм САЦ и их комплексов с цефалоспоринами при различных концентрациях полимера при 298 K
| Солевые формы САЦ и их комплексы с АБ | σ (мН/м) при концентрации, моль/дм3 | ||
|---|---|---|---|
| 0.01 × 10–4 | 0.03 × 10–4 | 0.25 × 10–4 | |
| Na-САЦ | 75.1 | 79 | 81.8 |
| K-САЦ | 73.2 | 79.1 | 81.8 |
| Li-САЦ | 74.9 | 78.3 | 82.4 |
| Na-САЦ : ЦЕФТР | 62.3 | 55.4 | 53.0 |
| K-САЦ : ЦЕФТР | 62.1 | 54.6 | 54.0 |
| Li-САЦ : ЦЕФТР | 59.5 | 52 | 51.5 |
| Na-САЦ : ЦЕФОТ | 58.2 | 54.3 | 52.7 |
| K-САЦ : ЦЕФОТ | 61.2 | 55.4 | 52.0 |
| Li-САЦ : ЦЕФОТ | 62.5 | 58 | 52.2 |
В то же время природа противоиона существенно влияет на характер надмолекулярных образований, формирующихся в растворах солевых форм САЦ и их комплексов. Агрегаты макромолекул полиэлектролитов в литературе обозначают как кластеры или домены [16]. На рис. 9 видно, что при переходе от литиевой к калиевой соли имеет место переход от фибриллярной к глобулярной структурам.
Рис. 9.
СЭМ образцов пленок, полученных из водных растворов с концентрацией ниже скр. а – Li-САЦ, б – Na-САЦ, в – K-САЦ.

Сферическая форма надмолекулярных структур в пленках комплексов полиэлектролита с обоими антибиотиками позволяет предположить, что в растворенном состоянии эти комплексы имеют вид мицеллоподобных агрегатов с гидрофобным ядром, образованным фрагментами полиэлектролитных цепей, в которых часть функциональных групп САЦ электростатически связана с ионизованными молекулами антибиотиков, а гидрофильная корона состоит из участков цепей со свободными сульфатными группами. Ниже показана возможная схема мицеллоподобных образований в растворах комплексов цефалоспориновых антибиотиков с солевыми формами САЦ.
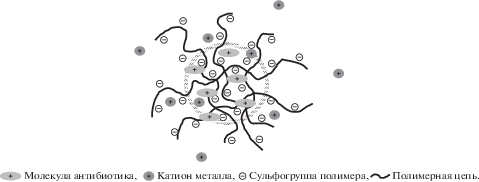
Увеличение концентрации полимера выше критической приводит к росту мицелл и формированию непосредственных контактов между ними (рис. 10). При этом размеры надмолекулярных образований больше в случае комплекса антибиотика с Li-САЦ по сравнению с его комплексом с K-САЦ (рис. 11).
Рис. 10.
СЭМ образцов пленок комплексов Na-САЦ–ЦЕФТР (а, б) и Li-САЦ–ЦЕФТР (в, г), полученных из водного раствора с концентрацией ниже (а, в) и выше (б, г) cкр.

Рис. 11.
СЭМ образцов пленок комплексов K-САЦ–ЦЕФОТ (а) и Li-САЦ–ЦЕФОТ (б), полученных из водных растворов с концентрацией выше cкр.

Действительно, как следует из рис. 12–14, средний размер рассеивающих частиц в растворах солевых форм САЦ и их комплексов с антибиотиками, определенный с помощью метода лазерной дифракции, уменьшается в ряду противоионов Li+– K+–Na+ как для самих полимеров, так и для их комплексов с обоими антибиотиками. Размер частиц в растворах комплексов меньше, чем в растворах полимеров при концентрациях как больше, так и меньше cкр.
Рис. 12.
Дифференциальные кривые распределения частиц по размерам в водных растворах Li-САЦ (1), K-САЦ (2), Na-САЦ (3) с концентрацией меньше cкр, полученные методом лазерной дифракции.
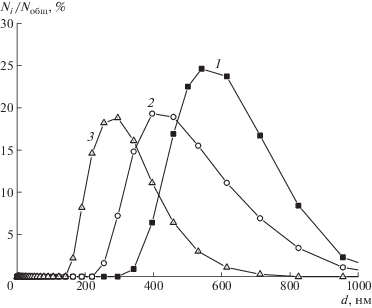
Рис. 13.
Дифференциальные кривые распределения частиц по размерам в водных растворах комплексов Li-САЦ (1), K-САЦ (2), Na-САЦ (3) с ЦЕФТР при концентрацией меньше cкр, полученные методом лазерной дифракции.
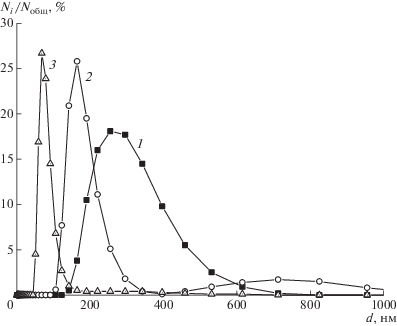
Рис. 14.
Дифференциальные кривые распределения частиц по размерам в водных растворах K-САЦ (1), K-САЦ–ЦЕФТР (2) с концентрациями меньше cкр и K-САЦ (3), K-САЦ–ЦЕФТР (4) с концентрацией выше cкр, полученные методом лазерной дифракции.
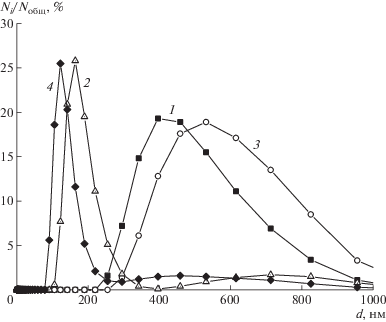
Нами было установлено, что по мере разбавления от 4 до 0.01 г/100 см3 размер частиц уменьшается в растворах индивидуальных полимеров и их комплексов с антибиотиками. Для наименьшей из исследованных концентраций, равной 0.01 г/100 см3, диаметр D50 (размер, который имеют 50% частиц), определенный методом анализа траектории движения наночастиц, составил соответственно 140 нм (коэффициент полидисперсности 1.04) для Na-САЦ и 117 нм (коэффициент полидсперсности 1.38) для Na-САЦ-ЦЕФТР (рис. 15).
Рис. 15.
Гистограммы распределения частиц по размерам в водных растворах Na-САЦ (а) и Na-САЦ–ЦЕФТР (б), полученные методом анализа траектории наночастиц.
Для иммобилизации комплексов с целью получения пероральной лекарственной формы исследованных антибиотиков был выбран не растворимый в воде носитель – активированный уголь. В табл. 4 и 5 представлены результаты математической обработки полученных изотерм адсорбции на различных активированных углях с помощью уравнений Ленгмюра и Фрейндлиха. Значения величин адсорбции антибиотиков на всех углях в случае их полимерных комплексов несколько выше, чем индивидуальных антибиотиков за счет дополнительного вклада в адсорбцию полимера, которая составляет 0.07 г/г для Na-САЦ на АУТ-МИ.
Таблица 4.
Результаты математической обработки изотерм адсорбции АБ и комплексов на угольных адсорбентах при 298 К с использованием уравнения Ленгмюра
| Адсорбат | Угольный адсорбент | R2 | КL, дм3/г | Г∞, г/г |
|---|---|---|---|---|
| ЦЕФТР | ОУ-А | 0.9969 | 22.4 ± 0.5 | 0.19 ± 0.01 |
| TH-90G | 0.9952 | 58.3 ± 5.6 | 0.09 ± 0.01 | |
| АУТ-МИ | 0.9876 | 27.6 ± 1.8 | 0.07 ±0.01 | |
| ЦЕФТР-Na-САЦ | ОУ-А | 0.9950 | 20.5 ± 03 | 0.21 ± 0.01 |
| TH-90G | 0.9880 | 59.3 ± 7.2 | 0.11 ± 0.01 | |
| АУТ-МИ | 0.9853 | 24.2 ± 1.7 | 0.08 ± 0.01 | |
| ЦЕФОТ | ОУ-А | 0.9933 | 18.8 ± 0.7 | 0.18 ± 0.01 |
| TH-90G | 0.9912 | 75.2 ± 5.2 | 0.09 ± 0.01 | |
| АУТ-МИ | 0.9985 | 22.3 ± 0.4 | 0.09 ±0.01 | |
| ЦЕФОТ- Na-САЦ | ОУ-А | 0.9945 | 23.1 ± 0.8 | 0.23 ± 0.01 |
| TH-90G | 0.9906 | 63.9 ± 7.1 | 0.11 ± 0.01 | |
| АУТ-МИ | 0.9958 | 30.1 ± 0.9 | 0.06 ± 0.01 |
Таблица 5.
Термодинамические характеристики адсорбции антибиотиков на угольных адсорбентах при 298 К
| Активированный уголь | Адсорбат | Кads | ΔG$_{{ads}}^{0}$, кДж/моль |
|---|---|---|---|
| ОУ-А | ЦЕФТР | 2.48 ± 0.19 | –2.25 ± 0.18 |
| ЦЕФТР–Na-САЦ | 2.68 ± 0.09 | –2.44 ± 0.08 | |
| ЦЕФОТ | 2.68 ± 0.10 | –2.44 ± 0.09 | |
| ЦЕФОТ–Na-САЦ | 2.81 ± 0.29 | –2.56 ± 0.25 | |
| TH-90G | ЦЕФТР | 2.78 ± 0.07 | –2.53 ± 0.06 |
| ЦЕФТР–Na-САЦ | 3.89 ± 0.29 | –3.37 ± 0.18 | |
| ЦЕФОТ | 6.59 ± 0.01 | –4.67 ± 0.01 | |
| ЦЕФОТ–Na-САЦ | 6.87 ± 0.05 | –4.78 ± 0.02 | |
| АУТ-МИ | ЦЕФТР | 1.11 ± 0.08 | –0.25 ± 0.02 |
| ЦЕФТР–Na-САЦ | 1.18 ± 0.01 | –0.42 ± 0.02 | |
| ЦЕФОТ | 2.79 ± 0.46 | –2.54 ± 0.38 | |
| ЦЕФОТ–Na-САЦ | 1.94 ± 0.28 | –1.65 ± 0.33 |
В ряду активированных углей ОУ-А–TH-90G–АУТ-МИ величина удельной гиббсовской адсорбции уменьшается, что может быть связано с сокращением в этом ряду суммарного объема мезопор, соответственно 0.31, 0.25 и 0.18 см3/г [17], поскольку размер молекул ЦЕФОТ и ЦЕФТР равен 1.4–2.0 нм, что соизмеримо с размерами мезопор (2–50 нм по классификации ИЮПАК). В то же время константа уравнения Ленгмюра, которая характеризует отношение констант адсорбции и десорбции, является наибольшей для угля TH-90G, для которого характерна и наибольшая суммарная площадь удельной поверхности мезо- и макропор: 370 м2/г для TH-90G , 290 м2/г для ОУ-А и 180 м2/г для АУТ-МИ. Для TH-90G наибольшие значения имеет и стандартная энергия Гиббса адсорбции, а также константа адсорбционного равновесия (табл. 5).
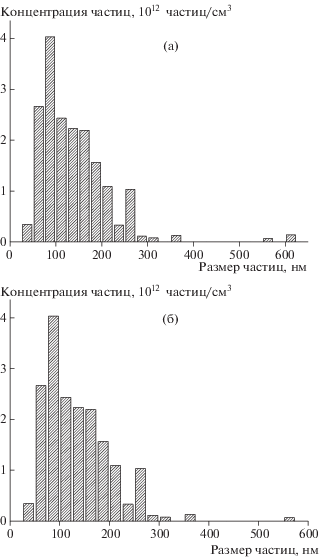
Иммобилизация антибиотиков и их полимерных комплексов на активированных углях приводит к изменению распределения по размерам частиц угольных суспензий в воде. Из рис. 16 следует, что к увеличению содержания в суспензии более мелких частиц приводит адсорбция и полимера, и его комплексов с антибиотиком, причем в последнем случае достигается наибольшее содержание частиц субмикронного размера. В то же время практически аналогичный эффект оказывают и индивидуальные антибиотики, адсорбция которых на поверхности угольных частиц способствует дезагрегированию последних. При разработке таблетированной лекарственной формы этих антибиотиков данное свойство должно обеспечить хорошую распадаемость таблеток в водной среде и более высокую эффективность их терапевтического действия.
Рис. 16.
Распределение частиц по размерам: 1 – ОУ-А, 2 – ОУ-А+ Na-САЦ; 3 – ОУ-А+комплекс Na-САЦ–ЦЕФТР; 4 – ОУ-А+комплекс Na-САЦ–ЦЕФОТ; 5 – ОУ-А+ЦЕФТР; 6 – ОУ-А+ЦЕФОТ. Размер частиц 0.1–1.0 (а), 1–10 (б) и 10–1000 (в).
Для моделирования релиза АБ из таблетированной лекарственной формы в организме человека методом ВЭЖХ была проведена оценка концентрации выделившегося количества ЦЕФТР после пребывания таблетки в кислой среде (0.1 М HCl) с последующим ее перемещением в буфер с рН 7.5, что соответствует пути, который таблетка проходит в желудочно-кишечном тракте. При этом было установлено, что в кислой среде (желудок) выделяется всего 22.3 мас. % антибиотика, а затем основное содержание антибиотика (67 мас. %) высвобождается уже при рН 7.5 (кишечник). При этом, как следует из вида хроматограмм, лекарственная субстанция выделяется в эти среды в неизменном виде, как и в случае инъекционного введения АБ [12] (рис. 17).
Рис. 17.
Хроматограммы инъекционной субстанции ЦЕФТР (а) и фильтрата суспензии таблеток ОУ-А–Na-CАЦ–ЦЕФТР (б) в среде буфера с рН 7.5.
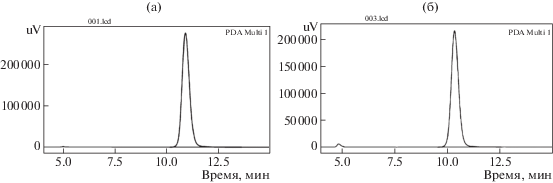
На основании приведенных данных можно сделать вывод, что комплексообразование и иммобилизация на угле позволяют доставить основную часть антибиотика (83 мас. %) в желудочно-кишечный тракт в неизменном виде.
О сохранении антибактериальной активности таблетированной лекарственной формы ЦЕФТР свидетельствуют и проведенные in vitro испытания методом серийных разведений в бульоне. Тестирование проводили в щелочной среде, имитирующей среду кишечника. Было установлено, что новая комбинированная лекарственная форма на основе ЦЕФТР, Na-CАЦ и ОУ-А активна в отношении музейных культур E.Coli, ProteusMirabilis, S. Aureus, являющихся возбудителями основных бактериальных инфекций. Таблетированная лекарственная форма (1 таблетка) массой 0.22 г, в которой содержится 0.075 г ЦЕФТР, оказалась более активной и действовала эквивалентно инъекционной форме, в которой содержится на 0.025 г больше антибиотика (0.1 г).
ЗАКЛЮЧЕНИЕ
Установлено, что антибиотики цефалоспоринового ряда третьего поколения ЦЕФТР и ЦЕФОТ взаимодействуют в водной среде с литиевой, натриевой и калиевой формами CАЦ с образованием полностью водорастворимых комплексов нестехиометрического состава, в которых на целлобиозное звено, приходится 0.4, 0.5 и 0.6 моля антибиотика соответственно. Увеличение содержания антибиотика в комплексе отвечает уменьшению плотности заряда цепи целлюлозного полиэлектролита в результате уменьшения гидратируемости конденсируемого на ней противоиона. Иммобилизацией комплексов на активированных углях получена новая активная пероральная форма антибиотиков, которую можно рекомендовать для доклинических и клинических испытаний.
Список литературы
Balant L., Dayer P., Auckenthaler R. // Clin. Pharmacokinet. 1985. V. 10. № 2. P. 101.
DeBrouse D.L. Pat. 11938638 USA. 2007.
Choi S., Lee J. Pat. 6248360B1 USA. 2000.
Patel N., Lalwani D., Gollmer S., Injeti E., Sari Y., Nessamony J. // Prog. Biomater. 2016. V. 5. № 2. P. 117.
Shakhno E.A., Savitskaya T.A., Grinshpan D.D., Pokrovskaya T.G., Yakushev V.I., Pokrovskii M.V. // Pharm. Chem. J. 2018. V. 51. № 11. P. 970.
Grinshpan D.D., Savitskaya T.A., Tsygankova N.G., Makarevich S.E., Tretsiakova S.M., Nevar T.N. // Int. J. Polym. Sci. 2010. Art. ID 831658.
Костромина Л.А., Скумок В.Н., Скорик Н.А. Химия координационных соединений. М.: Химия, 1990.
Аввакумова Н.И., Бударина Н.А., Дивгун С.М., Заикин А.Е., Кузнецов Е.В., Куренков В.Ф. Практикум по химии и физике полимеров / Под ред. В.Ф. Куренкова. М.: Химия, 1990.
Fabre H., Eddine N.H., Berge M.D. // J. Pharm. Sci. 1985. V. 74. № 1. P. 85.
Alekseev V.G., Vorob’ev N.V., Yakubovich Yu.Ya. // Russ. J. of Phys. Chem. 2006. V. 80. № 9. P. 1615.
Kabanov V.A., Zezin A.B. // Russ. Chem. Rev. 1982. V. 52. № 9. P. 833.
Савицкая Т.А., Шахно Е.А., Фираго Е.С., Гриншпан Д.Д., Ивашкевич О.А. // Докл. НАН Беларуси. 2017. Т. 61. № 3. С. 58.
Krotova M.K., Vasilevskaya V.V., Leclercq L., Boustta M., Vert M., Khokhlov A.R. // Macromolecules. 2009. V. 42. № 19. P. 7495.
Нефедов В.Г., Атапин А.Г., Головко Д.А. // Вост.-Европ. журн. перед. техн. 2017. Т. 78. № 6. С. 17.
Бутырская Е.В., Шапошник В.А., Бутырский А.М. // Вестн. ВГУ. Серия: Химия. Биология. Фармация. 2004. Т. 2. С. 25.
Zhang Y., Douglas J.F., Ermi B.D., Amis E.J. // J. Chem. Phys. 2001. V. 114. № 7. P. 3299.
Савицкая Т.А., Невар Т.Н., Цыганкова Н.Г., Кривова М.Г., Резников И.В., Шахно Е.А., Везенцев А.И., Гриншпан Д.Д. // Свиридовские чтения: Сб. ст. 2015. Вып. 10. С. 132.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)