Высокомолекулярные соединения (серия А), 2019, T. 61, № 3, стр. 244-253
Влияние катионного полилизина на высвобождение инкапсулированного вещества из pН-чувствительных анионных липосом
А. В. Сыбачин a, *, А. Ю. Локова a, В. В. Спиридонов a, О. А. Новоскольцева a, Э. В. Штыкова b, c, В. В. Самошин d, В. А. Мигулин e, А. А. Ярославов a
a Московский государственный университет имени М.В. Ломоносова. Химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
b Московский государственный университет имени М.В. Ломоносова. Физический факультет
119991 Москва, Ленинские горы, 1, стр. 2, Россия
c Институт кристаллографии им. А.В. Шубникова Российской академии наук
119333 Москва, Ленинский пр., 59, Россия
d Department of Chemistry, University of the Pacific
3601 Pacific Avenue
Stockton, USA
e Институт органической химии им. Н.Д. Зелинского Российской академии наук
119991 Москва, Ленинский пр., 47, Россия
* E-mail: sybatchin@mail.ru
Поступила в редакцию 14.11.2018
После доработки 17.12.2018
Принята к публикации 29.12.2018
Аннотация
Исследовано формирование комплексов из анионных липосом со встроенным в мембрану рН-чувствительным “молекулярным переключателем” (флипидом) и катионного полипептида (полилизина) со степенью полимеризации 90, 660 и 1360. Липосомы в составе комплекса сохраняют свою целостность в буферном растворе с рН 7; полученные комплексы устойчивы к диссоциации в физиологическом растворе, содержащем 0.15 М NaCl. Понижение рН раствора до 5 вызывает формирование дефектов в липидном бислое за счет изменения конформации флипида, что приводит к выходу инкапсулированного вещества из липосом в окружающий раствор. При этом комплексообразование увеличивает как скорость высвобождения инкапсулированного вещества, так и количество вещества, переходящего из липосом во внешний раствор. Полученные результаты представляют интерес для инкапсулирования и контролируемой доставки лекарственных веществ.
ВВЕДЕНИЕ
Бислойные липидные везикулы (липосомы) активно используются для инкапсулирования, доставки и контролируемого высвобождения биологически активных веществ, что обусловлено в том числе их биосовместимостью и биодеградируемостью [1–7]. Модификация поверхности липосом гидрофильными полимерами придает им стабильность в биологическом окружении [1–6, 8]. Для получения липосом разработаны простые и эффективные способы, позволяющие контролировать размер, заряд и липидный состав частиц [1–6, 8]. Особый интерес представляют липосомы, реагирующие на изменение рН окружающего раствора [4, 9–12], которые способны инкапсулировать водорастворимые лекарственные вещества во внутренней водной полости и высвобождать содержимое при попадании в слабо кислую среду, характерную для воспаленных тканей и опухолей [13, 14]. Важно отметить, что высвобождение лекарства происходит без дополнительного внешнего воздействия: света, тепла или магнитного поля [15–17]. Таким образом, изменение рН является привлекательным стимулом для запуска выхода лекарства из липосомального контейнера.
рН-Чувствительность может быть обеспечена путем встраивания в липосомальную мембрану липидоподобного соединения – флипида [18–26]. Последний способен протонироваться и приобретать положительный заряд при понижении рН раствора, что сопровождается изменением конформации флипида, нарушением упаковки липидного бислоя и повышением его проницаемости по отношению к лекарству [19, 20].
Увеличить скорость выхода лекарства из липосом можно, повышая содержание флипида в липосомальной мембране [19], что будет одновременно вызывать рост (цито)токсичности липосомального контейнера [27]. Для понижения доли флипида в мембране и сохранения высокой скорости высвобождения инкапсулированного вещества мы использовали описанный ранее подход – модификацию поверхности анионных липосом катионным полимером. Такая модификация сопровождается кластеризацией анионных липидных молекул, что вызывает дестабилизацию бислоя и влияет на проницаемость липосомальной мембраны [28]. Существенной особенностью комплекса липосома–поликатион является его низкая цитотоксичность, сопоставимая с цитотоксичностью исходных (без поликатиона) анионных липосом [29].
В настоящей работе описаны получение и свойства липосомального контейнера, сформированного путем электростатического связывания катионного полипептида (полилизина – ПЛ)
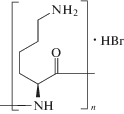
с разной степенью полимеризации с тройными липосомами, состоящими из анионного и цвиттер-ионного липидов и рН-чувствительного флипида. Особое внимание уделено скорости высвобождения инкапсулированного вещества из липосом, связанных в комплекс, при понижении рН внешнего раствора в сравнении со свободными рН-чувствительными липосомами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
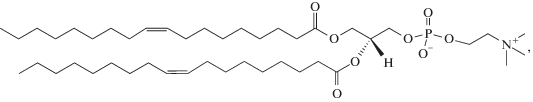
Три образца полилизина1 гидробромида со средней степенью полимеризации 90 (ПЛ-1), 660 (ПЛ-2) и 1360 (ПЛ-3) производства компании “Sigma-Aldrich” использовали без дополнительной очистки. Цвиттер-ионный 1,2-диолеоил-sn-глицеро-3-фосфохолин (ДОФХ)1
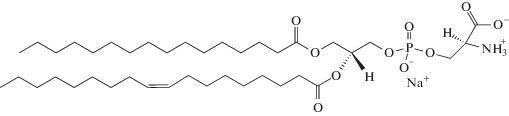
анионный 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфо-L-серин (ПОФС1–)
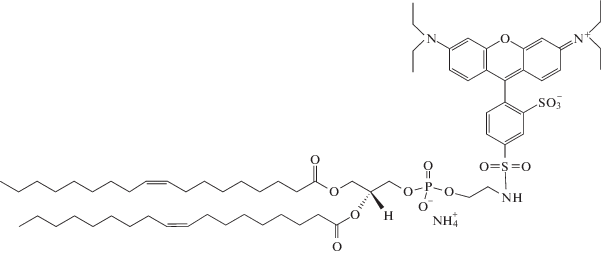
и флуоресцентно меченный липид 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-(лиссамин-родамин B-сульфонил) (ДОФЭ*)
производства компании “Avanti” применяли без дополнительной очистки. Флипид транс-4,5-дидодецилаксикарбонил-2-морфолиноциклогексанол (ДЦГ)
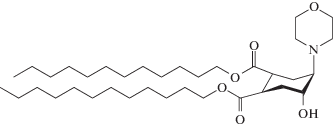
синтезировали по описанной ранее методике [18, 25, 26].
Малые моноламелярные липосомы получали по стандартной методике ультразвуковым диспергированием липидной пленки в буферном растворе [8]. Смесь ДОФХ, ПОФС1– и ДЦГ растворяли в хлороформе, органический растворитель упаривали в вакууме. Полученную пленку диспергировали в буферном растворе с pH 7, суспензию обрабатывали ультразвуком в течение двух циклов по 300 с и центрифугировали в течение 5 мин при 11 000 об/мин для отделения титановой пыли. Таким образом приготавливали суспензию тройных липосом ДОФХ/ПОФС1–/ДЦГ с мольным соотношением компонентов 1 : 6 : 3. Гидродинамический размер липосом менялся от образца к образцу, но всегда находился в интервале 60–80 нм.
Флуоресцентно меченные липосомы получали по описанной выше методике с той разницей, что к раствору липида и флипида добавляли 0.5 мас. % ДОФЭ*.
Липосомы, нагруженные раствором соли, приготавливали диспергированием смешанной липидной пленки в буферном растворе с рН 7, дополнительно содержавшем 1 М NaCl, с последующим диализом липосомальной суспензии против буфера с рН 7.0 в течение 1.5 ч. Внешний буферный раствор меняли каждые 30 мин. Проводимость полученной суспензии липосом составляла 63.5 ± 0.4 мкСм/см. Добавление к суспензии 10-кратного избытка неионогенного ПАВ Тритон Х-100 по отношению к суммарному количеству липидов приводит к разрушению липосом [22], выходу соли в окружающий раствор и повышению проводимости суспензии до значения 155.0 ± 4.0 мкСм/см.
Средний гидродинамический диаметр липосом и их комплексов с ПЛ находили методом динамического рассеяния света при фиксированном угле рассеяния (90°) в термостатической ячейке на приборе “Brookhaven Zeta Plus” (США). Использовали усредненное значение трех измерений средних гидродинамических диаметров образцов, полученных путем обработки корреляционной функции по методу кумулянтов программным обеспечением Brookhaven.
Электрофоретическую подвижность (ЭФП) липосом и их комплексов с ПЛ определяли лазерным микроэлектрофорезом в термостатической ячейке с помощью прибора “Brookhaven Zeta Plus” (США). Усредняли данные десяти измерений ЭФП образцов, полученные обработкой значений допплеровского сдвига частоты света лазера, проходящего сквозь ячейку с образцом.
Интенсивность флуоресценции суспензий меченых липосом измеряли при λem = 571 нм (λex = = 557 нм) с использованием флуоресцентного спектрофлуориметра “F-4000 Hitachi”.
Высвобождение NaCl из липосом контролировали, определяя проводимость липосомальных суспензий с помощью кондуктометра CDM83 (“Radiometer”).
Структуру липосом исследовали с помощью малоуглового рассеяния синхротронного излучения на синхротроне “Petra III” (DESY, Гамбург) на линии P12. Линия P12 оснащена оборудованием для автоматической смены образцов и двумерным детектором Pilatus 2M (фирма “DECTRIS”, Швейцария). Интенсивность рассеяния I(s) измеряли в области значений волновых векторов 0.08 < s < 4.5 нм–1, где s = (4πsinθ)/λ, 2θ – модуль вектора рассеяния, и длина волны λ = 0.124 нм [30]. Первичную обработку данных проводили с помощью программы РRIMUS [31]. Максимальный размер Dmax и функцию распределению по расстояниям p(r) определяли с помощью интерактивной программы GNOM [32], используя уравнение
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
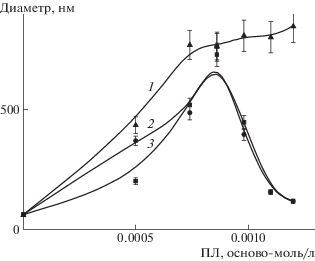
Связывание поликатионов полилизина разной степени полимеризации с тройными липосомами ДОФХ/ПОФС1–/ДЦГ контролировали по изменению размеров частиц в системе. Данный метод традиционно используется для исследования взаимодействия коллоидных частиц (включая липосомы) с полимерами [22, 28, 29, 33–36]. Результаты представлены на рис. 1 в координатах размер частиц–осново-мольная концентрация ПЛ. Видно, что добавление раствора ПЛ к суспензии липосом сопровождается увеличением размера частиц в системе, который затем достигает своего максимального значения и либо не изменяется при дальнейшем повышении концентрации полимера (кривая 1 для ПЛ-1), либо уменьшается до размера, близкого к размеру исходных липосом (кривая 2 для ПЛ-2 и кривая 3 для ПЛ-3). Такая картина характерна для поведения заряженных лиофильных коллоидов в присутствии противоположно заряженных полиэлектролитов, а движущей силой стабилизации/агрегации частиц является нейтрализация их заряда адсорбированным полиэлектролитом [8, 33–37].
Рис. 1.
Зависимость среднего диаметра частиц комплекса от концентрации добавленного ПЛ-1 (1), ПЛ-2 (2) и ПЛ-3 (3). Концентрация липосом ДОФХ/ПОФС1–/ДЦГ составляет 1 мг/мл, 10–3 М Трис буфер (рН 7).
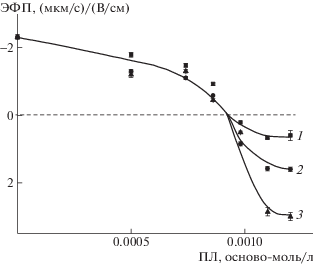
Эффективный заряд частиц комплекса липосома–ПЛ можно оценить, измеряя их электрофоретическую подвижность методом лазерного микроэлектрофореза. Величина ЭФП тройных липосом в буферном растворе с pH 7 составляет –2.0 (мкм/с)/(В/см), что указывает на преобладающую роль анионного липида ПОФС1– в формировании заряда липосом в этих условиях. Данный результат согласуется с литературными данными о кислотности морфолиновой группы в составе ДЦГ (pKa ~ 8.4 [38]), что позволяет сделать вывод о несущественном вкладе протонированных морфолиновых групп в суммарный заряд липосом при рН 7. При добавлении раствора ПЛ к суспензии тройных липосом значение ЭФП липосом снижается до нуля и становится положительным в избытке поликатионов (рис. 2), что подтверждает формирование комплексов липосом с поликатионами. Концентрация ПЛ, соответствующая точке полной нейтрализации заряда липосом (ЭФП равна нулю), одинаковая для всех трех ПЛ, т.е. с большой вероятностью можно считать, что все аминогруппы трех поликатионов количественно участвуют в формировании комплекса с тройными липосомами. Вместе с тем увеличение степени полимеризации полилизина приводит к последовательному повышению максимального заряда комплекса в избытке ПЛ. Как следует из данных рис. 2, предельное положительное значение ЭФП равно 0.6 для комплекса с ПЛ-1 (кривая 1), 1.6 с ПЛ-2 (кривая 2) и 3.0 (мкм/с)/(В/см) с ПЛ-3 (кривая 3). Такая тенденция, скорее всего, отражает различные конформации адсорбированных поликатионов [39]. Короткий ПЛ-1 (гидродинамический радиус 90 нм) адсорбируется как жесткий стержень, что приводит к формированию на поверхности липосом лишь незначительного по величине положительного заряда (кривая 1), который не может обеспечить агрегативную стабильность комплекса в избытке поликатиона (ср. с кривой 1 на рис. 1). Напротив, более длинные ПЛ-2 и ПЛ-3 (гидродинамический диаметр 215 нм и 190 нм соответственно) образуют петли и хвосты, экспонированные в окружающий водный раствор, где концентрируется нескомпенсированный положительный заряд, приводящий к ощутимой перезарядке поверхности и стабилизации частиц комплекса в избытке поликатионов (кривые 2 и 3).
Рис. 2.
Зависимость величины ЭФП частиц комплексов от концентрации добавленного ПЛ-1 (1), ПЛ-2 (2), ПЛ-3 (3). Концентрация липосом ДОФХ/ПОФС1–/ДЦГ составляет 1 мг/мл, 10–3 М Трис буфер (рН 7).
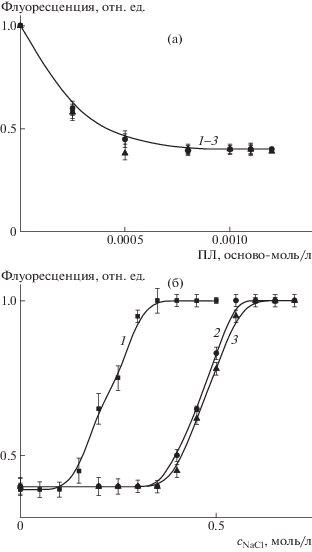
Стабильность комплексов липосома–ПЛ к диссоциации в водно-солевых средах была исследована методом флуориметрии. Известно, что катионные полимеры являются эффективными тушителями флуоресценции. Связывание поликатионов с мечеными противоположно заряженными полимерами и коллоидами сопровождается тушением флуоресценции, а последующая диссоциация комплексов на составляющие компоненты – ее восстановлением [40]. В соответствии с этой схемой были приготовлены тройные липосомы ДОФХ/ПОФС1–/ДЦГ, дополнительно содержавшие флуоресцентно меченый ДОФЭ*. Формирование комплексов всех поликатионов с мечеными липосомами в растворе с рН 7 приводит к уменьшению интенсивности флуоресценции метки (рис. 3а). Последующее добавление раствора NaCl повышает флуоресценцию до исходного уровня (рис. 3б), что обусловлено количественной диссоциацией комплексов в результате экранирования зарядов липосом и ПЛ зарядами малых противоионов – Na+ и Cl–. Однако конечный результат зависит от степени полимеризации поликатионов. Так, комплекс липосома–ПЛ-1 полностью диссоциировал на составляющие компоненты при [NaCl] = 0.35 моль/л (кривая 1 на рис. 3б); два других комплекса с ПЛ-2 и ПЛ-3 – при [NaCl] = 0.55 моль/л (кривая 2 на рис. 3б). Таким образом, все три комплекса остаются стабильными в буферном растворе с рН 7 и 0.15 М NaCl.
Рис. 3.
Зависимость относительной флуоресценции комплексов липосом ДОФХ/ПОФС1–/ДОФЭ*/ДЦГ с полилизином от концентрации добавленных ПЛ-1 (1), ПЛ-2 (2), ПЛ-3 (3) (а) и NaCl (б). Концентрация липосом ДОФХ/ПОФС1–/ДОФЭ*/ДЦГ составляет 1 мг/мл, 10–3 М Трис буфер (рН 7).
В буферном растворе с рН 7 свободная (непротонированная) аминогруппа и гидроксигруппа в молекуле ДЦГ не взаимодействуют друг с другом (слева). Протонирование аминогруппы инициирует образование внутримолекулярной водородной связи, что вызывает изменение конформации циклогексанового кольца и пространственной ориентации ацильных радикалов (справа).
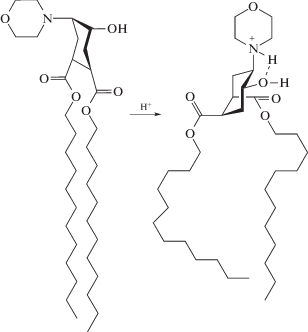
Этот эффект сохраняется после встраивания ДЦГ в липосомальную мембрану, что делает липосомы, содержащие ДЦГ, чувствительными к рН окружающего раствора. Описанные конформационные перестройки нарушают упаковку липидов в мембране и индуцируют высвобождение содержимого липосом в окружающий раствор [18–23].
Для контроля за вытеканием водорастворимого содержимого из липосом при уменьшении рН раствора использовали липосомы ДОФХ/ПОФС1–/ДЦГ, заполненные раствором NaCl. Вытекание соли приводит к повышению проводимости суспензии, которое регистрировали кондуктометрически. Исходная суспензия содержала липосомы, заполненные 1 М раствором NaCl в буфере с рН 7; внешний раствор представляет собой буфер с рН 7. Проводимость такой суспензии не изменялась в течение 1 ч.
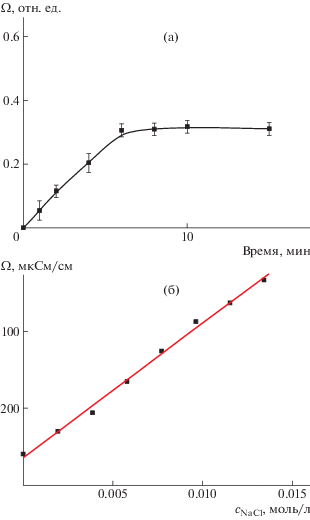
При перенесении липосом в буфер с рН 5 наблюдается вытекание соли из липосом во внешний раствор. На рис. 4а представлена кинетическая зависимость относительной проводимости суспензии липосом, которая описывается уравнением
Рис. 4.
Относительная электропроводность липосом ДОФХ/ПОФС1–/ДЦГ концентрации 1 мг/мл в 3 × 10–3 М ацетатном буфере при рН 5 (а), а также зависимость абсолютной электропроводности ацетатного буфера от концентрации добавленного NaCl (б).
Высвобождение хлорида натрия может происходить как за счет формирования дефектов в мембране липосомы, так и в результате ее полного разрушения [29, 41]. Чтобы оценить, какой из процессов развивается преимущественно для липосом, заполненных 1 М солью, исследуемого состава, были получены кривые малоуглового рассеяния рентгеновских лучей липосом при различных рН (рис. 5). На рис. 5а приведена кривая рассеяния для липосом при рН 7. Наблюдается широкий максимум в интервале волновых векторов s = 0.35–2.9 нм–1, характерный для моноламелярных липосом [42]. На рис. 5б приведена кривая малоуглового рассеяния для липосом при рН 5, которые предварительно были выдержаны при данном рН в течение 1 ч (при этом все перестройки, происходившие в липосомальной мембране заведомо завершились). Можно отметить небольшое уменьшение среднего радиуса инерции Rg для липосом в кислой среде по сравнению с нейтральным раствором – 24.3 ± 0.1 нм и 21.8 ± ± 0.2 нм соответственно. Кроме того, максимальные размеры Dmax липосом, определенные с помощью программы GNOM по полным кривым рассеяния, варьировались от 75 нм для липосом при рН 7 до 65 нм для липосом при рН 5. Эти значения являются заниженными, поскольку угловой диапазон, используемый в малоугловом эксперименте, не позволяет определять структуры большего размера.
Рис. 5.
Экспериментальные кривые малоуглового рентгеновского рассеяния (кривые 1) и функции распределения по размерам p(r) (вставки) для липосом ДОФХ/ПОФС1–/ДЦГ при рН 7 (а) и 5 (б).
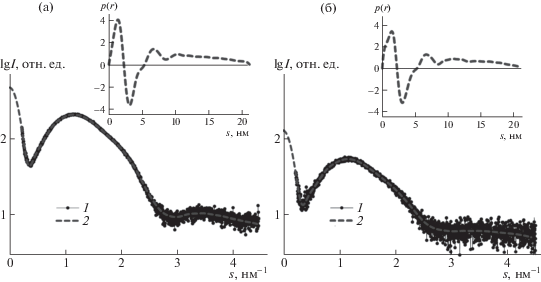
Возможные изменения структуры строения липосомального бислоя можно проанализировать, используя функции распределения по размерам p(r). Для лучшей визуализации функции p(r) были рассчитаны по кривым малоуглового рассеяния с отсеченным участком в области самых малых углов (рис. 5), чтобы уменьшить влияние таких крупных рассеивающих объектов, как целые липосомы. Показанные на вставках рис. 5 функции распределения по размерам p(r) имеют ярко выраженную область отрицательных значений, что соответствует отрицательной по отношению к водным растворам величине электронной плотности гидрофобных хвостов липосом. Толщина гидрофобного слоя отсюда может быть оценена в пределах 3.5–4.0 нм. Профили функций распределения по размерам p(r) для обоих образцов отличаются незначительно, хотя можно заметить некоторое искажение функции p(r) для образца в кислой среде, которое, вероятно, можно отнести к реорганизации структуры бислоя при рН 5 по отношению к структуре бислоя при рН 7 за счет изменившего конформацию ДЦГ.
В целом при уменьшении рН не происходит глобального разрушения моноламелярной структуры липосом, а вытекание соли может быть обусловлено образованием локальных дефектов, вызванных конформационной перестройкой молекул ДЦГ. Такие дефекты могут представлять собой временные нарушения ламелярной структуры липосом в рамках монослоев и бислоя. Исчезновение дефектов со временем подтверждается выходом кривой на рис. 4а на плато, что соответствует прекращению вытекания соли из внутреннего объема липосом во внешний раствор.
После этого были получены суспензии комплексов липосома–ПЛ, которые готовили смешением 0.0015 осново-моль/л раствора ПЛ и 1 мг/мл суспензии липосом. В указанной смеси мольное отношение катионных звеньев ПЛ и анионных групп ПОФС1–Z = [ПЛ] : [ПОФС1–] = 0.75. Для оценки состава комплексов в такой смеси мы использовали полученные ранее результаты по взаимодействию анионных липосом, не содержавших флипида, с полилизином [43]. Такой подход представляется вполне правомерным, поскольку выше мы показали, что ДЦГ не принимает участия в электростатическом связывании тройных липосом с ПЛ в буферном растворе при рН 7. Связывание ПЛ с анионными липосомами продолжается вплоть до значения Z = 0.55, при этом весь добавленный полилизин оказывается адсорбированным на поверхности липосом [42]. Иными словами, соотношение компонентов в смеси Z = 0.75 обеспечивает формирование насыщенного комплекса липосома–ПЛ с максимальным содержанием поликатиона. При большем содержании ПЛ начинает накапливаться в суспензии в свободном (не связанном с липосомами) виде. Такой результат позволяет сделать следующий вывод о составе приготовленной нами смеси: основная часть ПЛ (около 75%) связана в насыщенный комплекс с липосомами, остальные 25% представляют собой свободный ПЛ. Существенно, что данный состав смеси обеспечивает агрегативную устойчивость комплексов тройных липосом с ПЛ-2 и ПЛ-3. Как следует из данных рис. 2, размер частиц в суспензиях липосома–ПЛ-2 и липосома–ПЛ-3 при Z > 0.6 близок к размеру исходных тройных липосом.
При том же соотношении компонентов Z = = 0.75 были приготовлены комплексы, содержавшие ПЛ-2 (или ПЛ-3) и тройные липосомы, заполненные 1 М раствором NaCl. Проводимость полученных суспензий остается неизменной в течение 1 ч. Таким образом, липосомы как свободные, так и в комплексе с ПЛ-2 и ПЛ-3 сохраняют целостность в буферном растворе с рН 7.
Иная картина наблюдается после того как комплексы были перенесены в буфер с рН 5. Во всех случаях уменьшение рН раствора приводит к заметному увеличению проводимости суспензий. На рис. 6 показаны кинетические кривые возрастания относительной проводимости суспензий. Сравнение результатов для исходных липосом (рис. 4а) с результатами для их комплексов с полилизином (рис. 6) приводит к таким заключениям. Во-первых, комплексообразование липосом с поликатионом увеличивает скорость высвобождения NaCl. Количественно эффект ПЛ на скорость выхода соли можно представить в виде соотношения тангенсов углов наклонов начальных участков двух кинетических кривых: для комплекса и свободных липосом. По данным рис. 6, связывание липосом в комплекс с ПЛ увеличивает начальную скорость выхода соли в 6 раз. Причина этого может заключаться в следующем. Из литературы известно, что адсорбция катионного полимера на поверхности смешанных анионных липосом индуцирует латеральную сегрегацию липидов в липосомальной мембране и формирование двух типов кластеров: первые состоят из анионных липидов, электростатически связанных с адсорбированной катионной макромолекулой, вторые представлены электронейтральными (цвиттер-ионными) липидами. Граница между двумя типами несмешивающихся липидных кластеров рассматривается в литературе как область с неупорядоченной организацией алкильных цепей липидных молекул [28, 43, 44]. Молекулы ДЦГ, расположенные на границах кластеров, могут приобретать дополнительную мобильность, которая облегчает конформационный переход, вызванный уменьшением рН липосомальной суспензии, и тем самым ускоряет выход водорастворимого вещества из липосом в окружающий раствор.
Рис. 6.
Относительная электропроводность комплексов липосом ДОФХ/ПОФС1–/ДЦГ концентрации 1 мг/мл с ПЛ-1 (1), ПЛ-2 (2) и ПЛ-3 (3), сформированными при рН 7 и перенесенными в буфер при рН 5. Концентрация липосом 1 мг/мл, концентрация поликатиона 0.0015 осново-моль/л; ацетатный буфер рН 5.0, концентрация 0.003 моль/л.
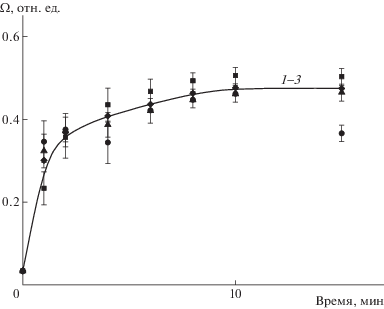
Во-вторых, высвобождение соли из липосом, включенных в комплексы с различными ПЛ, описывается одной и той же кинетической кривой. Такой результат может указывать на одинаковое устройство межфазных комплексов и/или на одинаковое количество дефектов, формируемых в липосомальной мембране двумя полилизинами. Однако этот вопрос требует дополнительного исследования.
В-третьих, ускоренное высвобождение соли из липосом, связанных в комплекс с ПЛ, приводит в итоге и к большему предельному количеству перешедшего во внешний раствор материала, а именно 50% против 30% для свободных (не связанных с ПЛ) липосом. Однако 100%-ный выход инкапсулированного вещества не регистрируется ни для свободных липосом, ни для их комплексов с ПЛ. По-видимому, данное ограничение связано с тем, что молекулы цвиттер-ионных липидов способны перемещаться в латеральном направлении (вдоль каждого липидного монослоя); эта миграция “залечивает” дефекты, возникающие в ходе конформационных перестроек молекул флипида, и блокирует выход соли в окружающий раствор.
В-четвертых, большая часть соли (около 80%) покидает липосомы в течение 2 мин после замены буфера (уменьшения рН раствора). Данный результат имеет первостепенное значение для биомедицинского использования рН-чувствительных липосом с поликатионной оболочкой.
ЗАКЛЮЧЕНИЕ
Таким образом, в работе описан подход к синтезу липосомальных контейнеров с адсорбированным поликатионом, которые быстро высвобождают инкапсулированное водорастворимое вещество при подкислении окружающего раствора. Модифицированные поликатионом липосомы представляют интерес для инкапсулирования и контролируемой доставки лекарств.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (коды проектов 18-29-02080 и 16-03-00375).
Список литературы
Allen T.M., Cullis P.R. // Adv. Drug Deliv. Rev. 2013. V. 65. P. 36.
Sercombe L., Veerati T., Moheimani F., Wu S.Y., Sood A.K., Hua S. // Front. Pharmacol. 2015. V. 6. Art. 286. P. 1.
Kundu S.K., Sharma A.R., Lee S.-S., Sharma G., Priya Doss C.G., Yagihara S., Kim D.Y., Nam Ju-S., Chakraborty C. // BioMed. Res. Int. 2014. V. 2014. P. 15.
Bozzuto G., Molinari A. // Int. J. Nanomedicine. 2015. V. 10. P. 975.
Atbiaw N., Aman E., Dessalegn B., Masrie O., Debalke D., Enbiyale G., Yirga A., Tekilu G., Abrhaley A., Mitku F. // Pharm. Pharmacol. Int. J. 2018. V. 6. № 3. P. 183.
Simão A.M.S., Bolean M., Cury T.A.C., Stabeli R.G., Itri R., Ciancaglini P. // Biophys. Rev. 2015. V. 7. № 4. P. 391.
Mendes L.P., Delgado J.M.F., Costa A.D.A., Vieira M.S., Benfica P.L., Lima E.M., Valadares M.C. // Toxicol. Vitro. 2015. V. 29. № 6. P. 1268.
Liposomes: A Practical Approach. Practical Approach Series. V. 264 / Ed. by V. Torchilin, V. Weissig. Oxford; New York: Oxford Univ. Press: Oxford, 2003.
Xia Y., Fang M., Dong J., Xu C., Liao Z., Ning P., Zeng Q. // Colloids Surf. B. 2018. V. 170. P. 514.
Lee Y., Thompson D.H. // WIREs Nanomedicine Nanobiotechnology. 2017. V. 9. P. 1.
Karanth H., Murthy R.S. // J. Pharmacy Pharmacology. 2007. V. 59. № 4. P. 469.
Asokan A., Cho M.J. // Biochimica Biophysica Acta. 2003. V. 1611. № 1–2. P. 151.
Kato Y., Ozawa S., Miyamoto C., Maehata Y., Suzuki A., Maeda T., Baba Y. // Cancer Cell. Int. 2013. V. 13. P. 89.
Tzanis G., Bonou M., Benetos G., Biliou S., Liatis S., Kapelios C., Toutouzas K., Tousoulis D., Barbetseas J. // Int. J. Cardiol. 2018. V. 262. P. 20.
Singh P., Choudhury S., Kulanthaivel S., Bagchi D., Banerjee I., Ahmed S.A., Pal S.K. // Colloids Surf. B. 2018. V. 162. P. 202.
Guo Y., Zhang Y., Ma J., Li Q., Li Y., Zhou X., Zhao D., Song H., Chen Q., Zhu X. // J. Control. Release. 2018. V. 272. P. 145.
Jain A., Jain S.K. // Curr. Drug Targets. 2018. V. 19. № 3. P. 259.
Brazdova B., Zhang N., Samoshin V.V., Guo X. // Chem. Commun. 2008. V. 39. P 4774.
Samoshina N.M., Liu X., Brazdova B., Franz A.H., Samoshin V.V., Guo X. // Pharmaceutics. 2011. V. 3. № 3. P. 379.
Samoshin V.V. // Biomolec. Concepts. 2014. V. 5. № 2. P. 131.
Samoshin A.V., Veselov I.S., Chertkov V.A., Yaroslavov A.A., Grishina G.V., Samoshina N.M., Samoshin V.V. // Tetrahedron Lett. 2013. V. 54. № 41. P. 5600.
Yaroslavov A.A., Sybachin A.V., Zaborova O.V., Migulin V.A., Samoshin V.V., Ballauff M., Kesselman E., Schmidt J., Talmon Y., Menger F.M. // Nanoscale. 2015. № 7. P. 1635.
Sybachin A.V., Zaborova O.V., Imelbaeva K.M., Samoshin V.V., Migulin V.A., Plamper F.A., Yaroslavov A.A. // Mendeleev Commun. 2016. V. 26. № 4. P. 276.
Samoshin A.V., Veselov I.S., Huynh L., Shestakova A.K., Chertkov V.A., Grishina, G.V., Samoshina N.M., Samoshin V.V. // Tetrahedron Lett. 2011. V. 52. № 41. P. 5375.
Samoshin V.V., Brazdova B., Chertkov V.A., Gremyachinskiy D.E., Shestakova A.K., Dobretsova E.K., Vatlina L.P., Yuan J., Schneider H.-J. // ARKIVOC. 2005. P. 129.
Samoshin V.V., Chertkov V.A., Gremyachinskiy D.E., Dobretsova E.K., Shestakova A.K., Vatlina L.P. // Tetrahedron Lett. 2004. V. 45. № 42. P. 7823.
Chou T.H., Liang C.H., Lee Y.C., Yeh L.H. // Phys. Chem. Chem. Phys. 2014. V. 16. № 4. P. 1545.
Efimova A.A., Sybachin A.V., Yaroslavov A.A. // Polymer Science C. 2011. V. 53. № 1. P. 89.
Yaroslavov A.A., Sybachin A.V., Zaborova O.V., Pergushov D.V., Zezin A.B., Melik-Nubarov N.S., Plamper F.A., Müller A.H., Menger F.M. // Macromol. Biosci. 2014. V. 14. № 4. P. 491.
Blanchet C.E., Spilotros A., Schwemmer F., Graewert M.A., Kikhney A., Jeffries C.M., Franke D., Mark D., Zengerle R., Cipriani F., Fiedler S., Roessle M., Svergun D.I. // J. Appl. Cryst. 2015. V. 48. № 2. P. 431.
Konarev P.V., Volkov V.V., Sokolova A.V., Koch M.H.J., Svergun D.I. // J. Appl. Cryst. 2003. V. 36. Part 5. P. 1277.
Svergun D.I. // J. Appl. Crystal. 1992. V. 25. № 4. P. 495.
Sybachin A.V., Efimova A.A., Litmanovich E.A., Menger F.M., Yaroslavov A.A. // Langmuir. 2007. V. 23. № 20. P. 10034.
Petzold G., Schwarz S. // Adv. Polym. Sci. 2014. V. 256. P. 25.
Bordi F., Cametti C., Diociaiuti M., Gaudino D., Gili T., Sennato S. // Langmuir. 2004. V. 20. № 13. P. 5214.
Rinaudo M., Quemeneur F., Pepin-Donat B. // Int. J. Polym. Anal. Charact. 2012. V. 17. № 1. P. 1.
Szilagyi I., Trefalt G., Tiraferri A., Maroni P., Borkovec M. // Soft Matter. 2014. V. 10. № 15. P. 2479.
Juranić I. // Croat. Chem. Acta. 2014. V. 87. № 4. P. 343.
Ivashkov O.V., Sybachin A.V., Efimova A.A., Pergushov D.V., Orlov V.N., Schmalz H., Yaroslavov A.A. // ChemPhysChem. 2015. V. 16. № 13. P. 2849.
Yaroslavov A.A., Efimova A.A., Sybachin A.V., Izumrudov V.A., Samoshin V.V., Potemkin I.I. // Colloid J. 2011. V. 73. № 3. P. 430.
Khomutov G.B., Kim V.P., Koksharov Y.A., Potapenkov K.V., Parshintsev A.A., Soldatov E.S., Usmanov N.N., Saletsky A.M., Sybachin A.V., Yaroslavov A.A., Taranov I.V., Cherepenin V.A., Gulyaev Y.V. // Colloid. Surf. A. 2017. V. 532. P. 26.
Bonechi C., Martini S., Ciani L., Lamponi S., Rebmann H., Rossi C., Ristori S. // PLoS One. 2012. V. 7. P. e41438.
Yaroslavov A.A., Kuchenkova O.Ye., Okuneva I.B., Melik-Nubarov N.S., Kozlova N.O., Lobyshev V.I., Menger F.M., Kabanov V.A. // Biochim. Biophys. Acta. 2003. V. 1611. № 1–2. P. 44.
Melby E.S., Mensch A.C., Lohse S.E., Hu D., Orr G., Murphy C.J., Hamers R.J., Pedersen J.A. // Environ. Sci., Nano. 2016. V. 3. № 1.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


