Высокомолекулярные соединения (серия А), 2019, T. 61, № 6, стр. 524-531
ТЕРМО- И рН-ЧУВСТВИТЕЛЬНЫЕ МИКРОГЕЛИ НА ОСНОВЕ ВЗАИМОПРОНИКАЮЩИХ СЕТОК КАК СОСТАВЛЯЮЩИЕ ДЛЯ СОЗДАНИЯ ПОЛИМЕРНЫХ МАТЕРИАЛОВ
И. Р. Насимова a, *, О. В. Вышиванная a, b, М. О. Галлямов a, b, Е. Ю. Кожунова a
a Московский государственный университет им. М.В. Ломоносова. Физический факультет
119991 Москва, Ленинские горы, д. 1, стр. 2, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 ул. Вавилова, 28 Москва, Россия
* E-mail: nasimova@polly.phys.msu.ru
Поступила в редакцию 17.05.2019
После доработки 25.06.2019
Принята к публикации 05.07.2019
Аннотация
Представлена методика создания пленок из термо- и рН-чувствительных микрогелей на основе взаимопроникающих сеток поли-N-изопропилакриламида и полиакриловой кислоты. Исследованы различные способы сшивания частиц микрогелей в единый материал. Установлено, что все пленки при повышении температуры испытывают термоиндуцированный переход из набухшего в сколлапсированное состояние. Время коллапса составляет несколько секунд, что значительно быстрее коллапса макрогеля сопоставимого размера и похожего состава.
ВВЕДЕНИЕ
Полимерные гели (как макро-, так и микромасштабов), особенно так называемые восприимчивые или “умные” гели, давно зарекомендовали себя как системы, хорошо подходящие для создания на их основе материалов, применяемых в различных областях: например, при разработке суперабсорбентов, носителей лекарственных препаратов и т.д. [1–4]. Следует отметить, что для прикладных работ именно объекты микромасштаба, такие как микрогели, имеют наибольший интерес. Прежде всего микрогели хороши тем, что представляют собой частицы субмикронного размера, в результате чего (в отличие от макрогелей) могут быстро и обратимо реагировать на изменения внешней среды. Известные методики синтеза микрогелей относительно просты и позволяют получать частицы, имеющие узкое распределение по размерам и способные оставаться стабильными к агрегации вплоть до очень высоких концентраций [5]. Среди возможных способов использования микрогелей, отличных от макрогелей, можно назвать, например, стабилизацию с их помощью коллоидных систем. Внедрение в микрогели различных добавок – лекарственных препаратов, металлических наночастиц, молекул биополимеров, красителей, существенно расширяет круг областей для их использования.
Среди восприимчивых полимерных систем особенное место занимают материалы на основе термочувствительного полимера поли-N-изопропилакриламида (ПНИПА). Способность изменять конформацию в ответ на изменение температуры и тот факт, что температура перехода лежит в области физиологических температур, обусловливают их возможное применение в качестве контейнеров для хранения и доставки лекарств [6–8]. Если говорить о микрогелях, использование в качестве мономера НИПА позволяет применять для их получения гетерофазную осадительную полимеризацию [9]. Суть метода состоит в том, что, если в качестве одного из мономеров выступает термочувствительный мономер, полимерная цепь при достижении некоторой критической длины коллапсирует, образуя частицы-прекурсоры. Как только частицы микрогеля достигают критического размера, они стабилизируются по электростатическому механизму и их рост прекращается [5].
Последние несколько лет особое внимание ученых привлекают микрогели, состоящие из двух независимых подсеток, цепочки которых химически не сшиты между собой, но удерживают одну сетку в другой за счет физических зацеплений, – так называемые микрогели на основе взаимопроникающих сеток (ВПС-микрогели) [10, 11]. Использование взаимопроникающих сеток из различных полимерных компонентов открывает дополнительные возможности по управлению микроструктурой всей частицы микрогеля как целого. Так, например, ВПС-микрогели на основе сеток ПНИПА и полиакриловой кислоты (ПАК) будут являться одновременно термо- и pH-чувствительными. В одной из предыдущих работ нашей группы [12] методом компьютерного моделирования было продемонстрировано, что при помещении ВПС-микрогелей в растворитель, который является плохим для одного полимера и хорошим для другого, одна подсетка коллапсирует, а другая остается набухшей, что приводит к образованию сложных структур. Было показано, что такие системы могут формировать классические структуры ядро–корона, ядро–оболочка–корона и другие структуры, в зависимости от длины субцепи и молекулярной массы системы.
Из микрогелей можно собрать двух- и трехмерные структуры, чтобы воспользоваться их преимуществами на макромасшабах. В таких материалах можно настраивать размеры, изменять показатель преломления и механические свойства, инкапсулировать различные препараты, а также получить быстрые времена отклика на внешние воздействия, что делает их перспективными для многих областей применения [13–15]. Известны работы, в которых микрогели образовывали структуры типа фотонных кристаллов, например, [16, 17]. Группа под руководством L.A. Lyon создала чувствительные микролинзы из ансамблей микрогелей на основе сополимеров НИПА и акриловой кислоты. Эти микролинзы можно оптически переключать за короткие временные промежутки [18, 19] и использовать для обнаружения белков [20]. Множество работ посвящено исследованию пленок и покрытий из термочувствительных полимеров, в частности ПНИПА и его сополимеров, и влиянию на их свойства различных факторов, таких как способ получения пленки, концентрация, количество сшивающего агента, и др. [21–24]. Покрытия из микрогелей ПНИПА являются перспективными для создания ткани, позволяющей контролировать и регулировать клеточную адгезию. Такие ткани обеспечивают адгезию или отрыв клеточной культуры простым переключением температуры [22, 25, 26]. Кроме того, пленки и покрытия из микрогелей ПНИПА и его сополимеров могут применяться для ингибирования адгезии бактерий [27] или в качестве биосенсоров на ферменты [28]. В работах [29, 30] показана эффективность пленок из микроглей на основе сополимера НИПА и акриловой кислоты для контролируемого высвобождения лекарственных средств.
В настоящей работе ВПС-микрогели ПНИПА и ПАК будут использованы для создания на их основе пленок макромасштаба в результате осаждения микрочастиц и последующего их сшивания между собой. Ниже приведена схема формирования материала из микрогелей.
Можно ожидать, что такие материалы будут обладать презаданной микроструктурой и демонстрировать более короткие времена отклика, что позволит управлять выделением иммобилизованных в них веществ. Это открывает широкие перспективы с точки зрения их возможного применения для создания функциональных мягких лекарственных форм: пластырей и покрытий повреждений кожного покрова, повязок, насыщенных лекарственными препаратами или антибактериальными веществами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения микрогелей со структурой взаимопроникающей сетки проводили синтез второй полимерной сетки в микрогелях-матрицах. В качестве исходных микрогелей (микрогелей–матриц) использовали гели на основе термочувствительного гомополимера N-изопропилакриламида. В качестве полимера, составляющего вторую сетку, выбрали полиакриловую кислоту: данный полимер обладает pH-чувствительностью. Кроме того, мономеры акриловой кислоты имеют свойство образовывать водородные связи со звеньями НИПА. Это обеспечивает возможность синтеза второй сетки именно внутри сетки частицы-матрицы [10, 11].
Синтез микрогелей-гомополимеров ПНИПА (микрогелей-матриц)
Синтез проводили радикальной термоинициированной осадительной полимеризацией НИПА в водном растворе в присутствии сшивателя N,N'-метилен-бис-акриламида (БИС) (концентрация БИС 1 мол. % по отношению к мономеру). Перед введением в смесь инициатора водный раствор мономеров и сшивателя в течение 1 ч перемешивали (800 об/мин) в азотной атмосфере при температуре 70°C. Инициатором служил персульфат аммония. Концентрация мономера в реакционной смеси составляла 1 мас. %, инициатора – 0.07 мас. %. Полимеризация проходила в азотной атмосфере при температуре 70°C и постоянном перемешивании со скоростью 800 об/мин в течение 24 ч. Водные дисперсии синтезированных микрогелей постепенно охлаждали до комнатной температуры и “отмывали” путем диализа (размер пор диализных мешков ~20 000) для удаления низкомолекулярных соединений и непрореагировавшего мономера.
Синтез микрогелей на основе взаимопроникающих сеток (ВПС-МГ)
Сетку из полиакриловой кислоты синтезировали по методике, описанной нами ранее в работе [31]. Синтез осуществляли методом радикальной редокс-инициированной полимеризации в условиях, когда микрогель-матрица находится в набухшем состоянии. Его проводили следующим образом: готовили 0.1%-ную дисперсию микрогелей-матриц ПНИПА в дистилированной воде, в которую добавляли сшиватель БИС и инициатор персульфат аммония (соотношение реагентов указано в табл. 1). Полученный раствор перемешивали в течение 1 ч (800 об/мин) в азотной атмосфере при температуре 23°C. После этого добавляли N'-тетраметилэтилендиамин (ТМЭДА). Полимеризация проходила в азотной атмосфере при температуре 23°C и постоянном перемешивании со скоростью 800 об/мин.
Таблица 1.
Содержание реагентов при синтезе ВПС-микрогелей
| Образец | МГ-матрица, мл | АК, мл | Вода, мл | Сшиватель, г | Инициатор, г |
|---|---|---|---|---|---|
| ВПС-МГ-БИС | 2 | 0.046 | 15 | 0.015 (БИС) | 0.004 |
| ВПС-МГ-БАК | 2 | 0.046 | 15 | 0.003/0.012 (БИС/БАК) | 0.004 |
Для одного из образцов 70% сшивателя составлял сшивающий агент, в структуре которого присутствуют дисульфидные мостики – N,N'-бис-акрилоил-цистамин (БАК, ВПС-МГ-БАК). В данном случае с помощью проведения реакций восстановления–окисления с использованием дитиотреитола и NaIO4 можно “расшить” и повторно “перезашить” часть дисульфидных групп. БАК предварительно растворяли в диметилформамиде (с = 60 мг/мл) и добавляли к реакционному раствору непосредственно перед добавлением ТМЭДА.
Время полимеризации составляло 120 мин. В данном синтезе время реакции – важный показатель: от него зависит количество сформировавшейся ПАК, а также ее распределение в ВПС- микрогеле и во внешнем растворе. Как нами было продемонстрировано в статье [31] при увеличении времени полимеризации происходит постепенное разрастание сетки акриловой кислоты, что ведет к формированию структур типа ядро–оболочка. При времени полимеризации более 130 мин начинается агрегация и сшивание частиц между собой, образцы становятся нестабильными и выпадают в осадок.
Водные дисперсии синтезированных ВПС- микрогелей “отмывали” путем диализа (размер пор диализных мешков ~20 000) для удаления низкомолекулярных соединений и непрореагировавшего мономера.
Исследования методами динамического и статического рассеяния света
Эксперименты по динамическому и статическому рассеянию света проводили на приборе “PhotoCor Complex” (“ФотоКор”, Россия) с He-Ne лазером мощностью 10 мВт (λ = 633 нм). Измерения при температурах 23 и 40°С проводили в интервале величин угла рассеяния 30°–140° с шагом 10°. Распределения по времени релаксации τ и гидродинамическому радиусу Rh рассчитывали из корреляционных функций по методу CONTIN. Величину коэффициентов диффузии D определяли из наклона зависимости 1/τ от q2 (q – волновой вектор). Значения Rh рассчитывали по уравнению Стокса–Эйнштейна. Радиус инерции Rg рассчитывали по методу Гинье:
(1)
$\ln \left( {\frac{{Kc}}{{{{R}_{\theta }}}}} \right) = \ln \left( {\frac{1}{{{{M}_{w}}\exp \left( { - \frac{1}{3}R_{g}^{2}{{q}^{2}}} \right)}} + 2{{A}_{2}}c} \right),$Температурные исследования проводили при угле рассеяния 90°, скорость нагревания 1 град/мин, при каждой температуре образцы выдерживали в течение 5 мин перед измерениями. Температуру конформационного перехода Tкп определяли как точку перегиба зависимости гидродинамического радиуса от температуры.
Получение пленок на основе ВПС-микрогелей
Для получения пленок микрогели осаждали в результате центрифугирования (скорость центрифугирования 14 500 оборотов в минуту, время – 20 мин) и сшивали между собой используя три различных способа.
Первый способ. После центрифугирования и удаления супернатанта осажденные ВПС-микрогели, сшитые БИС, подвергали отжигу при 100°С в течение 12 ч. Можно предположить, что такая обработка будет способствовать образованию межмолекулярных ангидридных связей за счет дегидратации карбоксильных групп и соответственно частичному сшиванию оболочек частиц, состоящих из звеньев полиакриловой кислоты, между собой. После отжига полученную пленку помещали в дистилированную воду.
Второй способ. ВПС-микрогели, сшитые БИС, сшивали между собой в результате добавления раствора мультивалентной соли сульфата алюминия (с = 10 мг/мл), ионы которого способны связываться одновременно с несколькими карбоксильными группами, образуя солевые связи. После добавления раствора соли образец подвергали повторному цетрифугированию и оставляли на 12 ч. Затем полученную пленку помещали в дистилированную воду.
Третий способ. Сшивание частиц ВПС-МГ-БАК происходило в результате “расшивания” и последующего сшивания дисульфидных мостиков, входящих в структуру БАК, выступающего в качестве сшивателя при синтезе второй подсетки на основе акриловой кислоты. Для этого осажденные микрогели заливали буферным раствором HEPES с pH 7.4, после чего повторно центрифугировали, заливали раствором дитиотреитола в буферном растворе HEPES с pH 8.6 (с = 0.6 мг/мл) и оставляли при аккуратном перемешивании на 12 ч. Полученный раствор снова центрифугировали, отделяли супернатант, заливали раствором дитиотреитола, центрифугировали, отделяли супернатант и заливали буферным раствором HEPES с pH 7.4. После еще одного цикла центрифугирования осажденные микрогели заливали раствором NaIO4 в буферном растворе HEPES с pH 7.4 (с = 1.2 мг/мл) и снова центрифугировали. Полученный после отделения супернатанта осадок оставляли на 12 ч, после чего полученную пленку помещали в дистиллированную воду.
Изучение термоиндуцированного коллапса и pH-индуцированного сжатия пленок на основе ВПС-микрогелей
Для изучения термоиндуцированного коллапса пленок на основе ВПС-микрогелей образцы помещали в подогреваемую кювету, заполненную дистилированной водой. По мере роста температуры делали серию последовательных фотографий образца. Коэффициент набухания определяли как соотношение αT= lT/lT23– отношение длины образца при текущей температуре к длине набухшего образца при температуре 23°С. Для изучения pH-индуцированного сжатия пленок образцы помещали в кювету в среде с нейтральным pH и понижали pH до 3 в результате добавления концентрированной фосфорной кислоты. Коэффициент набухания определяли как соотношение αpH= lpH3/lpH6– отношение длины образца при pH 3 к длине при pH 6.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для изучения свойств частиц микрогелей в растворе синтезированные дисперсии частиц гомополимерных сеток ПНИПА и ВПС-микрогелей на их основе были исследованы методами динамического и статического рассеяния света. На рис. 1 приведены примеры температурных зависимостей гидродинамического радиуса для гомополимерных микрогелей-матриц ПНИПА и взаимопроникающих сеток. Эксперименты по исследованию свойств ВПС-микрогелей выполняли при двух различных pH раствора: 7.5 – когда все группы акриловой кислоты диссоциированы и сетка полиакриловой кислоты ведет себя как полиэлектролит; и 3 – когда группы акриловой кислоты находятся преимущественно в недиссоциированном состоянии (pKа 4.8). Из представленных на рисунке данных можно заключить, что как и гомополимерные микрогели, так и синтезированные ВПС-микрогели обладают термочувствительными свойствами и уменьшаются в размерах при нагревании выше критической температуры. Видно, что при pH 7.5 формирование сетки ПАК внутри микрогеля ПНИПА не меняет температуру конформационного перехода Tк.п, составляющую 32–33°С для микрогелей на основе гомополимера ПНИПА. В то же время для ВПС-микрогелей, сшитых БИС, при pH 3 температура коллапса значительно понижается, а также уширяется диапазон температур перехода.
Рис. 1.
Зависимость гидродинамического радиуса Rh от температуры T для гомополимерных микрогелей-матриц ПНИПА (1) и ВПС-микрогелей ВПС-МГ-БИС (а) и ВПС-МГ-БАК (б) при pH 7.5 (2) и 3.0 (3).
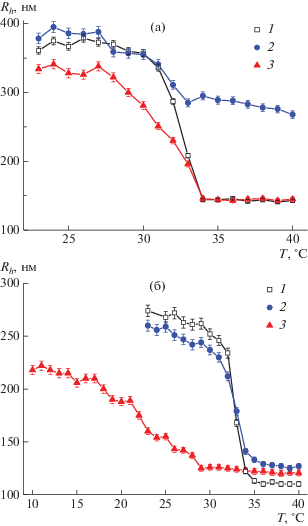
В табл. 2 суммированы все данные, полученные из экспериментов по светорассеянию при температурах ниже и выше температуры конформационного перехода для ПНИПА.
Таблица 2.
Значения гидродинамического радиуса Rh, радиуса инерции Rg и фактора асимметрии Rg/Rh для гомополимерных микрогелей-матриц и ВПС-микрогелей на их основе при температурах ниже и выше НКТР при разных значениях pH
| Образец | pH | Rh, нм | Rg, нм | Rg/Rh | Rh, нм | Rg, нм | Rg/Rh |
|---|---|---|---|---|---|---|---|
| T = 23°C | T = 40°C | ||||||
| ПНИПА-МГ-1 | 7.5 | 351 ± 6 | 165 ± 15 | 0.47 ± 0.04 | 142 ± 2 | 109 ± 5 | 0.77 ± 0.04 |
| ВПС-МГ-БИС | 7.5 | 375 ± 4 | 183 ± 18 | 0.49 ± 0.05 | 236 ± 3 | 131 ± 5 | 0.56 ± 0.03 |
| ВПС-МГ-БИС | 3.0 | 324 ± 17 | 157 ± 19 | 0.48 ± 0.05 | 145 ± 2 | 112 ± 5 | 0.77 ± 0.04 |
| ПНИПА-МГ-2 | 7.5 | 280 ± 3 | 150 ± 25 | 0.54 ± 0.09 | 103 ± 1 | 78 ± 5 | 0.76 ± 0.05 |
| ВПС-МГ-БАК | 7.5 | 273 ± 4 | 155 ± 25 | 0.57 ± 0.09 | 125 ± 2 | 89 ± 3 | 0.71 ± 0.03 |
| ВПС-МГ-БАК | 3.0 | 228* ± 5 | 123*± 18 | 0.54* ± 0.07 | 120 ± 1 | 94 ± 4 | 0.78 ± 0.03 |
При сравнении значения Rh для ПНИПА-МГ и ВПС-микрогелей, установлено, что введение в систему второй сетки придает микрогелям pH-чувствительность. При повышении pH с 3 до 7.5 при комнатной температуре для ВПС-микрогелей наблюдается полиэлектролитное набухание, радиус частиц увеличивается в ~1.2 раза. При высокой температуре полиэлектролитное набухание более заметно для образца ВПС-МГ-БИС.
По значениям Rh и Rg были определены факторы асимметрии Rg/Rh. Из представленных в табл. 2 данных следует, что значение фактора асимметрии Rg/Rh при комнатной температуре для всех образцов составляет 0.5 ± 0.1. Это позволяет предположить, что исследованные микрогели имеют структуру “мягкой сферы”, или сферы с опушкой из слабо сшитых полимерных цепочек [31], структура сетки в данном случае в основном задается структурой сетки ПНИПА. При повышении температуры величина Rg/Rh для образцов ПНИПА-МГ и ВПС при рН 3 (группы акриловой кислоты недиссоциированы, вторая сетка ведет себя как незаряженная) увеличивается до 0.77 ± ± 0.03, что близко к теоретическому значению для твердой сферы (0.78) и свидетельствует о формировании плотного объекта в связи с коллапсом всех входящих в состав микрогеля полимерных цепочек. Для ВПС-микрогелей при температуре выше НКТР при pH 7.5 (сетка полиакриловой кислоты ведет себя как полиэлектролит) значения Rg/Rh заметно ниже, чем для твердой сферы, т.е. сетка ПНИПА коллапсирует, формируя более плотное ядро, а сетка ПАК остается частично набухшей на поверхности частицы.
Изученные ВПС-микрогели были использованы для получения на их основе пленок макромасштаба. Методика описана в экспериментальной части. На рис. 2 приведены фотографии кусков пленок, полученных разными способами в набухшем (T = 23°С) и сколлапсированном состоянии (T = 34°С).
Рис. 2.
Фотографии кусков пленок, полученных в результате отжига при температуре 100°С (а, б), сшивания мультивалентными ионами (в, г), “перезашивания” дисульфидных мостиков (д, е) в набухшем при 23°С (а, в, д) и сколлапсированном при 34°С состоянии (б, г, е).

Кривые коллапса αT(T) для всех полученных образцов пленок представлены на рис. 3.
Рис. 3.
Зависимость степени набухания от температуры для пленок, полученных в результате отжига при температуре 100°С (1), сшивания мультивалентными ионами (2), “перезашивания” дисульфидных мостиков (3).
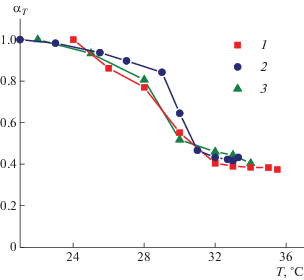
Как видно на рис. 2 и 3, все полученные образцы пленок подвергаются термоиндуцированному коллапсу. Небольшое несоответствие температур перехода из набухшего в сколлапсированное состояние по сравнению с исходными микрогелями можно объяснить несовершенством метода измерения текущей температуры в кювете. Также было обнаружено, что в спонтанно сформировавшемся в измерительной ячейке незначительном градиенте температур интенсивности порядка 1 град/см макроскопические куски геля в циклах коллапс–деколлапс часто совершают малое, но различимое направленное смещение по направлению градиента.
Было проведено сравнение скорости коллапса для образцов пленок, полученных в результате сшивания микрочастиц и специально синтезированного образца ВПС-макрогеля сходного состава. Установлено, что пленки на основе частиц ВПС-микрогелей коллапсируют в первые несколько секунд после погружения их в горячую воду (Т = 50°С), в то время как макрогелю сопоставимого размера требуется время порядка десятков минут для того, чтобы достигнуть равновесной сколлапсированной конформации.
Поскольку вторая подсетка несет в себе группы слабой акриловой кислоты, способные диссоциировать при повышении pH (pKа 4.8), можно ожидать проявления не только термочувствительного, но и pH-чувствительного поведения образцов пленок. Пленки будут набухать при pH выше pKa, когда все группы акриловой кислоты диссоциированы и сетка полиакриловой кислоты ведет себя как полиэлектролит, и сжиматься при pH ниже pKa, когда группы акриловой кислоты находятся преимущественно в недиссоциированном состоянии. Установлено, что понижение pH c 6 до 3 приводит лишь к незначительному сжатию пленок αpH ~ 0.8–0.9.
ЗАКЛЮЧЕНИЕ
На основании проведенных исследований можно заключить, что все три использованных в работе способа сшивания ВПС-микрогелей на основе ПНИПА и ПАК позволяют получить не растворимые в воде пленки макромасштаба. Установлено, что все пленки при повышении температуры испытывают термоиндуцированный переход из набухшего в сколлапсированное состояние. Температура перехода близка к температуре перехода исходных ВПС-микрогелей. Время коллапса составляет несколько секунд, что значительно быстрее коллапса ВПС-макрогеля на основе ПНИПА и ПАК сравнимого масштаба и сходного состава, что делает такие материалы перспективными для применения в различных высокотехнологичных приложениях.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 17-73-20167).
Список литературы
Khokhlov A.R., Starodubtzev S.G., Vasilevskaya V.V. // Advances in Polymer Science. Berlin; Heidelberg: Springer, 1993. V. 109. P. 123.
Kramarenko E.Y., Philippova O.E., Khokhlov A.R. // Polymer Science C. 2006. V. 48. № 1. P. 1.
Philippova O.E., Khokhlov A.R. // Polymer Science: a Comprehensive Reference / Ed. by K. Matyjaszewski, M. Möller. Amsterdam: Elseiver, 2012. P. 339.
Makhaeva E., Tenhu H., Khokhlov A. // Polymer. 2000. V. 41. P. 9139.
Pich F., Richtering W. // Polymer Science: a Comprehensive Reference / Ed. by K. Matyjaszewski, M. Möller. Amsterdam: Elseiver, 2012. P. 309.
Das M., Mardyani S., Chan W.C.W., Kumacheva E. // Adv. Mater. 2006. V. 18. P. 80.
Nerapusri V., Keddie J.L., Vincent B., Bushnak I.A. // Langmuir. 2007. V. 23. P. 9572.
Leobandung W., Ichikawa H., Fukumori Y., Peppas N.A. // J. Control. Release. 2002. V. 80. P. 357.
Hoare T., Pelton R. // Langmuir. 2004. V. 20. P. 2123.
Xia X., Hu Z. // Langmuir. 2004. V. 20. P. 2094.
Nigro V., Angelini R., Bertoldo M., Bruni F., Ricci M.A., Ruzicka B. // Soft Matter. 2017. V. 13. P. 5185.
Rudyak V.Y., Gavrilov A.A., Kozhunova E.Y., Chertovich A.V. // Soft Matter. 2018. V. 14. P. 2777.
Pacholski C. // Zeitschrift Phys. Chem. 2015. V. 229. P. 283.
Aguirre G., Khoukh A., Taboada P., Chougrani K., Alard V., Billon L. // Polym. Chem. 2018. V. 9. P. 1155.
Latnikova A., Grigoriev D., Schenderlein M., Möhwald H., Shchukin D. // Soft Matter. V. 2012. V. 8. P. 10837.
Zhou J., Wang G., Marquez M., Hu Z. // Soft Matter. 2009. V. 5. P. 820.
Reese C.E., Mikhonin A.V., Kamenjicki M., Tikhonov A., Asher S.A. // J. Am. Chem. Soc. 2004. V. 126. P. 1493.
Kim J., Serpe M.J., Lyon L.A. // Angew Chem. Int. Ed. 2005. V. 44. P. 1333.
Serpe M.J., Kim J., Lyon L.A. // Adv. Mater. 2004. V. 16. P. 184.
Kim J., Nayak S., Lyon L.A. // J. Am. Chem. Soc. 2005. V. 127. P. 9588.
Keal L., Lapeyre V., Ravaine V., Schmitt V., Monteux C. // Soft Matter. 2017. V. 13. P. 170.
Kyrey T., Witte J., Pipich V., Feoktystov A., Koutsioubas A., Vezhlev E., Frielinghaus H., von Klitzing R., Wellert S., Holderer O. // Polymer. 2019. V. 169. P. 29.
Schmidt S., Motschmann H., Hellweg T., von Klitzing R. // Polymer. 2008. V. 49. P. 749.
Sorrell C.D., Lyon L.A. // J. Phys. Chem. B. 2007. V. 111. P. 4060.
Schmidt S., Zeiser M., Hellweg T., Duschl C., Fery A., Möhwald H. // Adv. Funct. Mater. 2010. V. 20. P. 3235.
Tsai H.-Y., Vats K., Yates M.Z., Benoit D.S.W. // Langmuir. 2013. V. 29. P. 12183.
Keskin D., Mergel O., van der Mei H.C., Busscher H.J., van Rijn P. // Biomacromolecules. 2019. V. 20. P. 243.
Sigolaeva L., Pergushov D., Oelmann M., Schwarz S., Brugnoni M., Kurochkin I., Plamper F., Fery A., Richtering W., Sigolaeva L.V., Pergushov D.V., Oelmann M., Schwarz S., Brugnoni M., Kurochkin I.N., Plamper F.A., Fery A., Richtering W. // Polymers. 2018. V. 10. P. 791.
Nolan C.M., Serpe M.J., Lyon L.A. // Biomacromolecules. 2004. V. 5. P. 1940.
Serpe M.J., Yarmey K.A., Nolan C.M., Lyon L.A. // Biomacromolecules. 2004. V. 6. P. 408.
Kozhunova E.Y., Vyshivannaya, O.V., Nasimova I.R. // Polymer. 2019. V. 176. P. 127.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


