Высокомолекулярные соединения (серия А), 2021, T. 63, № 2, стр. 99-109
ГИБРИДНЫЕ МАТЕРИАЛЫ НА ОСНОВЕ ДИМЕТИЛБИГУАНИДА (МЕТФОРМИНА) И СОПОЛИМЕРА N-ВИНИЛПИРРОЛИДОНА С ДИМЕТАКРИЛАТОМ ТРИЭТИЛЕНГЛИКОЛЯ
С. В. Курмаз a, *, Н. В. Фадеева a, А. А. Грищук a, Н. С. Емельянова a, В. М. Игнатьев a, Г. В. Шилов a, Ю. В. Солдатова a, И. И. Файнгольд a, Р. А. Котельникова a
a Институт проблем химической физики Российской академии наук
142432 Черноголовка, Московской обл., пр. академика Семенова, 1, Россия
* E-mail: skurmaz@icp.ac.ru
Поступила в редакцию 26.07.2020
После доработки 25.09.2020
Принята к публикации 03.11.2020
Аннотация
Получены и охарактеризованы в водных средах и в твердом состоянии гибридные материалы на основе метформина – лекарственного препарата широкого спектра действия и разветвленного амфифильного сополимера N-винилпирролидона и диметакрилата триэтиленгликоля с мольным соотношением сомономеров 80 : 20 и среднемассовой молекулярной массой 1.96 × 105. Установлено, что в водных буферных растворах они существуют в виде наноструктур, поведение и динамические параметры которых зависят от концентрации метформина, сополимера и температуры. С помощью квантово-химического моделирования показано, что группы NH2 метформина образуют водородную связь по карбонильной группе N-винилпирролидона, сложноэфирной и простой эфирной группам диметакрилата. Из данных электронной абсорбционной спектроскопии определена эффективная константа связывания метформина с сополимером. Обнаружено, что полимерная композиция с 20 мас. % метформина оказывает ингибирующее действие на ключевой фермент сорбитолового пути метаболизма глюкозы – альдозоредуктазу.
ВВЕДЕНИЕ
Повышение эффективности лекарств и биологически активных соединений является важной задачей современной фармакологии и медицинской химии. Одним из способов ее решения является включение молекул биологически активных соединений в наноносители с заданной структурой и свойствами, например в дендримеры [1, 2]. Молекулы биологически активных соединений обладают уникальной способностью образовывать надмолекулярные структуры за счет гидрофобных и электростатических взаимодействий, водородных связей и вследствие инкапсулирования в полости дендримера [3, 4]. Дендримеры считаются идеальными в качестве систем доставки благодаря трехмерной глобулярной структуре, нанометровым размерам, монодисперсности, липофильности и способности легко проникать в клетку [5]. Однако их синтез является многоступенчатым; к тому же дендримеры, содержащие первичные аминогруппы и имеющие положительно заряженную оболочку, весьма токсичны для клеток [6] и нуждаются в дополнительной функционализации.
В связи с этим были разработаны многочисленные амфифильные полимеры с гиперразветвленной структурой [7–10], которые, несмотря на нерегулярность и несовершенство архитектуры, обладают такими ценными свойствами, как высокая растворимость, низкая вязкость раствора и большая плотность функциональных групп на периферии макромолекулы. Механизмы их самоорганизации в растворе разнообразны, и такие полимеры являются отличными предшественниками для создания гибридных наноструктур [11, 12]. Их значение как носителей биологически активных соединений для фармакологических целей растет [10]; они обеспечивают пролонгированное действие лекарств, изменяют их распределение в организме и снижают токсичность. Полимеры с разветвленной структурой могут быть синтезированы поликонденсацией [13], полимеризацией с раскрытием цикла [14], псевдоживой полимеризацией [15, 16], методами “click” химии [17], радикальной сополимеризацией моно- и дивинильных мономеров в присутствии агентов каталитической [18] или обычной [19] передачи цепи (the “Strathclyde methodology”).
“Strathclyde methodology” – один из самых простых и эффективных методов получения разветвленных сополимеров из коммерческих виниловых мономеров. Радикальная сополимеризация таких мономеров, контролируемая агентом передачи цепи, позволяет создавать точки разветвления с использованием полифункциональных мономеров как разветвляющих агентов. Таким методом были синтезированы амфифильные сополимеры с разветвленной структурой, реагирующие на изменение температуры или рН среды [20–22]. Метод позволяет получать сополимеры с необходимыми характеристиками (мономерный состав, молекулярная масса и степень разветвления) в течение 3–5 ч с выходом, близким к 100%. Проблема недостаточного контроля ММР образующихся сополимеров и композиционной неоднородности при сополимеризации мономеров с различной реакционной способностью может быть решена путем фракционирования [23]. Для получения композиционно однородного сополимера с узким ММР, безусловно, более эффективной является RAFT-сополимеризация мономеров [24]. Однако существуют проблемы выбора подходящего RAFT-агента, условий реакции, низкой конверсии мономеров, длительности процесса, а также включения RAFT-агента в полимерные цепи и его влияния на токсичность полимера.
Ранее нами была синтезирована линейка амфифильных сополимеров N-винилпирролидона (ВП) с диметакрилатами различного строения в присутствии 1-декантиола – агента передачи цепи [25]. В отсутствие передатчика цепи при определенных мольных соотношениях реагентов также могут быть получены амфифильные сополимеры ВП [26], которые существуют в полярных средах в виде отдельных макромолекул с гидродинамическим радиусом ~4–5 нм и их агрегатов нанометрового размера, обладают низкой цитотоксичностью и проникают в клетки, доставляя молекулы гидрофобного биологически активного соединения [26]. В сополимеры ВП с диметакрилатом триэтиленгликоля (ДМТЭГ) были успешно инкапсулированы фуллерен С60 [27], флуоресцентный маркер тетрафенилпорфиринат цинка (II) [28], биядерные тетранитрозильные комплексы железа [29] и органические комплексы платины (IV) [30, 31] с противоопухолевой активностью.
Было сделано предположение, что сополимеры ВП разветвленного строения также могут служить платформами для гидрофильных биологически активных соединений, например N,N-диметилбигуанидина гидрохлорида (метформин – МЕТ), который используется в течение многих десятилетий для лечения сахарного диабета второго типа [32]. Помимо гликемического контроля он обладает противомикробными [33], противовирусными [34], и противовоспалительными эффектами, влияет на секрецию желудочной кислоты [35], активирует аденозинмонофосфат-активированную протеинкиназу, что приводит к снижению скорости роста опухоли [36], воздействует на определенные типы раковых клеток и онкогенов как in vivo, так и in vitro [37–39]. Однако в связи с низкой липофильностью метформина существует проблема его биодоступности, которая может быть решена путем получения его липофильных производных или включения в амфифильные наноносители, способные проникать в клетки. Предполагается, что включение гидрофильного МЕТ в амфифильный полимерный носитель позволит повысить его биодоступность и соответственно понизить дозу лекарства при сохранении эффективного контроля уровня сахара в крови. Более того, в комбинированной форме метформин может выступать ингибитором каталитической активности альдозоредуктазы и тем самым препятствовать развитию диабетических осложнений сосудистого характера.
Цель настоящего исследования – получение гибридных материалов на основе МЕТ и амфифильного сополимера ВП с содержанием звеньев ДМТЭГ ~20 мол. %, характеризация материалов в растворах и в твердом состоянии комплексом физико-химических методов, включая квантово-химическое моделирование, а также исследование их влияния на каталитическую активность альдозоредуктазы в гомогенате печени мышей in vitro. В работах [30, 31] установлено, что данный сополимер не оказывает существенного влияния на жизнеспособность клеток HeLa A172 во всех исследованных концентрациях, является биосовместимым, способен проникать в клетки и доставлять активное вещество. Предварительные результаты показывают, что в мягких условиях сополимеры ВП–ДМТЭГ гидролизуются по связи С–О олигомерного блока диметакрилата; в живом организме этот процесс может быть активирован ферментами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ВП (“Alfa Aesar”) очищали от ингибитора NaOH (0.1%) перегонкой в вакууме. ДМТЭГ (“Aldrich”, 95%) применяли без дополнительной очистки. В работе использовали метформин гидрохлорид (“Aldrich”) – кристаллический порошок с температурой плавления полиморфной модификации 224.1°C (теплота плавления 54.8 кДж/моль).
Сополимер ВП–ДМТЭГ получали радикальной сополимеризацией в толуоле из мономерной смеси мольного состава 100 : 5 по методике [26]. В ходе сополимеризации происходило фазовое разделение, в результате которого одна из фракций сополимера ВП–ДМТЭГ осаждалась из реакционной смеси. Ее отделяли от раствора путем фильтрования, промывали толуолом, гексаном и сушили на воздухе и в вакууме до постоянной массы. Эта фракция сополимера была взята для получения гибридных материалов. Линейный ПВП синтезировали в толуоле радикальной полимеризацией, инициированной ДАК, в тех же условиях, что и сополимер.
Состав сополимера рассчитывали из данных элементного анализа, который проводили на приборе “Vario cube” Elementar GmbH. Содержание С, Н и N в сополимере составляло 60.9, 8.4 и 7.7% соответственно. Мольное содержание звеньев ВП и ДМТЭГ в сополимере, найденное из данных элементного анализа, составляло 80.4 и 19.6%.
Молекулярную массу сополимера определяли с помощью эксклюзионной жидкостной хроматографии с использованием двух детекторов: рефрактометра и светорассеяния по методике [26]. Среднемассовая молекулярная масса сополимера ВП–ДМТЭГ оказалась равной 1.96 × 105.
Гибридные материалы на основе МЕТ и сополимера получали по следующей методике. Готовили раствор МЕТ в бидистилляте (5 мг/мл) и растворы сополимера ВП–ДМТЭГ в изопропиловом спирте с концентрацией 3.7 и 1.5 мг/мл. Помещали 4 мл раствора сополимера в бюкс и добавляли по каплям раствор МЕТ при постоянном перемешивании с помощью магнитной мешалки. Содержание МЕТ в расчете на сополимер варьировали от 5 до 40 мас. %. Гибридные структуры на основе линейного ПВП приготавливали аналогичным образом, используя раствор ПВП в изопропиловом спирте (3.7 мг/мл) и раствор МЕТ в воде (5 мг/мл). Изопропиловый спирт и воду удаляли из системы при комнатной температуре и сушили материал в вакууме. Полимерные пленки, содержащие МЕТ, растворяли в 4 мл водного буферного раствора PBS (137 мМ NaCl, 2.68 мМ KCl, 4.29 мМ Na2HPO4, 1.47 мМ KH2PO4, pH 6.8).
Спектры поглощения буферных растворов наноструктур МЕТ – (со)полимер записывали на спектрофотометре “СПЕКС ССП-705-1”. Измерения проводили в кварцевых кюветах толщиной 0.2 см. Из спектральных данных определяли эффективную константу связывания МЕТ с сополимером по методу [40]. Для этого в 4 мл раствора сополимера или ПВП в изопропиловом спирте (0.37 мг/мл) добавляли по каплям при постоянном перемешивании 0.15, 0.20, 0.25, 0.30, 0.35 и 0.40 мл раствора МЕТ в бидистилляте (0.5 мг/мл). После удаления изопропилового спирта и воды к пленкам добавляли водный буферный раствор (4 мл) и записывали спектры поглощения полученных растворов. Строили зависимости 1/(D – D0) от 1/[MET], где D – оптическая плотность полосы поглощения МЕТ в присутствии сополимера или ПВП в буферном растворе при длине волны 230 нм, D0 – оптическая плотность буферного раствора сополимера при данной длине волны. Зависимости были аппроксимированы уравнением первой степени. Отношение отсечения к тангенсу угла наклона соответствовало эффективной константе связывания МЕТ с (со)полимером.
Исследование динамического рассеяния света водными растворами наноструктур МЕТ выполняли на угле детектирования 90° на установке “Photocor Compact” (“Photocor Instruments Inc.”, США), оснащенной диодным лазером с длиной волны 654 нм. Измерения проводили после фильтрования водных растворов через микропористый фильтр с диаметром пор 0.45 мкм. Перед измерениями виалы с растворами термостатировали в течение ~15 мин. Экспериментальные данные обрабатывали с помощью программного обеспечения DynaLS v. 2.8.3. Результаты эксперимента представляли в виде характерных времен корреляционных функций рассеянного света и распределения частиц по коэффициентам диффузии. Используя уравнение Эйнштейна–Стокса D = kT/6πηR, где k – константа Больцмана, T – абсолютная температура, η – сдвиговая вязкость среды, в которой взвешены дисперсные частицы, рассчитывали гидродинамический радиус частиц Rh.
Динамическую вязкость буферных растворов (со)полимеров и наноструктур МЕТ–(со)полимер измеряли на вискозиметре Штабингера SVM 3000 при 20°С. Для каждого раствора проводили от трех до шести измерений, результаты которых усредняли. Строили зависимость динамической вязкости η растворов наноструктур от содержания в них МЕТ.
Квантово-химические расчеты выполняли в рамках теории функционала плотности с полной оптимизацией геометрии исходных молекул и их комплексов в программе Gaussian 09 [41]. В качестве метода и базиса использовали гибридный функционал TPSSh [42] и базисный набор 6-311++G**//6-31G*. Влияние растворителя учитывали с помощью модели поляризуемого континуума. Для оптимизации геометрии сополимера и полученных продуктов были взяты три мономерных звена сополимера. Расчеты показали отсутствие мнимых частот и, следовательно, все оптимизированные структуры соответствуют минимумам на поверхности потенциальной энергии.
ИК-спектры порошков МЕТ, сополимера и полимерных композиций после их сушки в вакууме регистрировали в режиме нарушенного полного внутреннего отражения на приборе FTIR “Bruker α” в интервале 400–4000 см–1, число сканирований –16.
Термические свойства МЕТ, сополимера и полимерных композиций исследовали методами ТГА и ДСК. Измерения проводили с помощью синхронного термического анализатора “STA 409C LUXX NETZSCH” (Германия, 2006) в аргоне при скорости нагревания 5 град/мин. Температуру стеклования композиций полимер–МЕТ измеряли на приборе “Mettler Toledo” при скорости нагревания 5 град/мин.
Каталитическую активность альдозоредуктазы определяли по методике, описанной в работе [43]. Печень мышей гомогенизировали в натрий фосфатном буфере (pH 6.2) с использованием гомогенизатора “DAIHAN Scientific HG-15D”. Массовое соотношение печень : буфер составляло 1 : 10. Гомогенат печени центрифугировали в течение 30 мин при 9000 об/мин и температуре 4°C на центрифуге “Ohaus FC5515R”. Затем отбирали супернатант образца, содержащий фермент альдозоредуктазу. В спектрофотометрическую кювету помещали 0.3 мл супернатанта, 0.2 мл 1мМ D,L-глицеральдегида и 0.2 мл исследуемого вещества. Объем реакционной пробы доводили до 1 мл натрий-фосфатным буфером (pH 6.2). Контрольная проба не содержала исследуемых соединений. Реакцию инициировали добавлением 0.2 мл 0.1 мМ никотинамидадениндинуклеотидфосфа́та (НАДФН). Активность альдозоредуктазы анализировали спектрофотометрически по изменению поглощения НАДФН при 340 нм в течение 5 мин на спектрофотометре “Agilent Cary 60”.
Концентрацию белка в супернатанте печени мышей определяли по методу Лоури [44]. Активность фермента рассчитывали по формуле
где D1 – оптическая плотность образца в начале эксперимента; D2 – оптическая плотность образца через время t; t – время эксперимента, мин; 6.22 – коэффициент миллимолярной экстинкции НАДФН при 340 нм; [мг белка] – содержание белка в пробе. Активность альдозоредуктазы в отсутствие ингибитора считали за 100%. Статистическую обработку проводили при помощи программы Microsoft Office Excel. Достоверность результатов определяли по t-критерию Стьюдента. Различия между средними значениями считали достоверными, если уровень значимости был более 95% (p < 0.05).РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Основная фракция сополимера ВП–ДМТЭГ (Дополнительный материал, рис. Д1а) представляла собой не растворимый в толуоле продукт радикальной сополимеризации. Из-за высокой реакционной способности метакрилового мономера на начальной стадии преимущественно полимеризуется ДМТЭГ [25]. По мере его расходования увеличивается вклад ВП в реакцию полимеризации. После полимеризации диметакрилата образуется полимерная структура с боковыми двойными связями, по которым присоединяются ПВП-цепи различной длины (Дополнительный материал, рис. Д1б). Основная фракция сополимера ВП–ДМТЭГ имела более высокое содержание метакрилатных звеньев (19.6 мол. %), чем фракция, растворимая в толуоле. Как следствие, в ее ИК-спектре (Дополнительный материал, рис. Д2а) имелись отдельные полосы поглощения метакрильной группы С=О при ν = 1721 см–1 и группы С=О лактамного цикла звеньев ВП при частоте ~1660 см–1. В области 3000–3600 см–1 наблюдалась широкая полоса поглощения валентных колебаний воды, связанной водородной связью с сополимером.
Рис. 1.
Зависимости I(T) (а) и распределения интенсивности рассеяния света по размерам частиц для водных буферных растворов сополимера ВП–ДМТЭГ (1) и гибридных структур на основе сополимера, содержащих 10 (2), 20 (3) и 40 мас. % МЕТ (4) (б). Распределения нормированы на высоту пика. Т = 20°С. Цветные рисунки можно посмотреть в электронной версии.
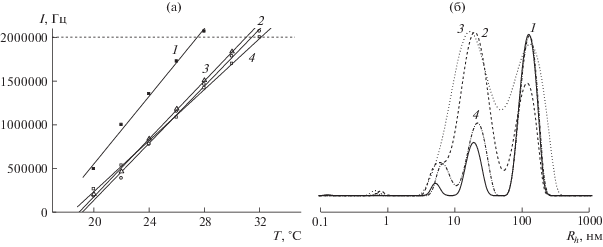
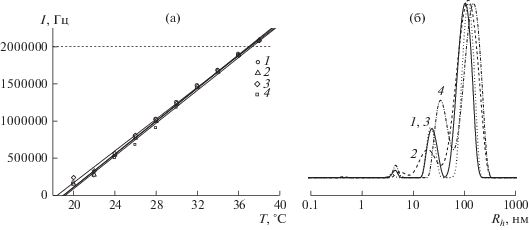
Рис. 2.
Зависимости I(T) для водных буферных растворов гибридных структур, содержащих 10 (1), 20 (2), 30 (3) и 40 мас. % МЕТ (4) (а), а также соответствующие распределения интенсивности рассеяния света по размерам частиц при Т = 24°C (б). Концентрация сополимера 1.5 мг/мл.
В ИК-спектре сополимера полосы поглощения, соответствующие валентным и деформационным колебаниям подвешенных С=С-связей ДМТЭГ, не обнаружены. В спектре ЯМР 1H (Дополнительный материал, рис. Д2б) кроме сигналов, относящихся к звеньям ВП при δ = 3.0–4.0, 1.4–2.4 и 3–4 м.д., имелись слабые сигналы протонов CH3-группы ДМТЭГ при δ ~ 0.9 м.д. В области δ = 4–5 м.д. можно было выделить слабые сигналы протонов непрореагировавших метакрильных групп. Таким образом, остаточная ненасыщенность в сополимере была незначительной, поскольку основная часть подвешенных связей С=С расходовалась в реакции межмолекулярного сшивания, ведущей к появлению боковых ответвлений в полимерных цепях.
На разветвленный характер макромолекул указывают ММР, смещенное в область высоких значений Mw (Дополнительный материал, рис. Д3а) по сравнению с ММР линейного ПВП, и высокая среднемассовая ММ. Доказательством их разветвленной природы также могут служить зависимости Mw от элюентного объема VR (Дополнительный материал, рис. Д3б). В диапазоне VR от 5 до 8 мл при одном и том же значении VR элюируются макромолекулы с высокой плотностью упаковки полимерных цепей вследствие разветвленного строения.
Рис. 3.
Зависимости динамической вязкости водных растворов от концентрации МЕТ для гибридных структур МЕТ на основе сополимера (1) и линейного ПВП (2). Т = 20°С.
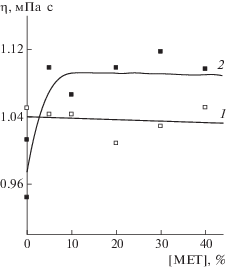
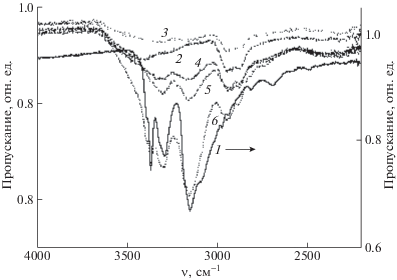
Рис. 4.
ИК-спектры МЕТ (1), сополимера ВП–ДМТЭГ (2), а также композиций на основе сополимера, содержащих 10 (3), 20 (4), 30 (5) и 40 мас. % МЕТ (6).
Сополимер состоит из мономерных звеньев, сильно отличающихся по полярности. Амфифильный характер сополимера определяет его растворимость в полярных (вода, спирты) и в малополярных (хлороформ, ТГФ, ацетон и т.д.) растворителях. Методом динамического рассеяния света исследовали поведение сополимера в изопропиловом спирте и водном буферном растворе. Из зависимости интенсивности рассеяния света I от концентрации полимера в изопропиловом спирте и буферном растворе были определены критические концентрации агрегатообразования сополимера, равные 7 и 2 мг/мл соответственно. Таким образом, спирт является лучшим растворителем для сополимера, чем вода и, как следствие, агрегация макромолекул наблюдается при более высокой концентрации. На рис. Д4 (Дополнительный материал) приведены распределения интенсивности I рассеяния света по размерам частиц в спиртовых и водных буферных растворах сополимера. В спиртовом растворе сополимера (рис. Д4а, кривая 1) имеется два типа частиц с гидродинамическим радиусом около 3 и 20 нм, соответствующих изолированным макромолекулам и их агрегатам. С увеличением концентрации сополимера размер агрегатов возрастает до 30 нм. На рис. Д4б видно, что в сильно разбавленном водном буферном растворе распределение по размерам представляет собой широкий пик с максимумом при Rh = 77 нм. По мере увеличения концентрации сополимера распределение становится более узким, и основной вклад в рассеяние света вносят частицы с Rh ≈ 45 нм. Таким образом, при сопоставимой концентрации сополимера в изопропиловом спирте и воде размеры полимерных частиц заметно различаются.
Формирование гибридных наноструктур МЕТ и их поведение в буферных растворах
С учетом данных динамического рассеяния света о размерах полимерных частиц гибридные наноструктуры МЕТ получали в спиртовом растворе сополимера (3.7 мг/мл). Известно [45], что вода, ДМСО и этанол являются хорошими растворителями для МЕТ, а ацетон, пропанол-1 и другие высшие спирты – плохими. При добавлении водного раствора МЕТ в термодинамически плохой для него растворитель молекулы МЕТ захватываются полимерными частицами.
Доказательством наличия наноструктур МЕТ в водных буферных растворах могут служить данные динамического рассеяния света. На рис. 1а приведены зависимости интенсивности рассеяния света I от температуры для водных растворов сополимера и гибридных наноструктур на его основе с различным содержанием МЕТ. Для водного раствора сополимера интенсивность рассеяния света линейно возрастает с повышением температуры и при ~28°С достигает значения 2 × 106 Гц, предельного допустимого для корректной оценки гидродинамического радиуса Rh рассеивающих центров. При этом вследствие агрегации рассеивающих центров раствор сополимера начинает опалесцировать. Зависимости I(T) для водных растворов гибридных наноструктур лежат ниже, чем для исходного сополимера. Температура достижения критического значения I для них составляет 31–32°С, т.е. выше на 3–4 градуса. Модификация оболочки полимерных частиц гидрофильными молекулами МЕТ приводит к увеличению их растворимости и совместимости с водой. Следует отметить, что зависимости I(T) для всех водных растворов наноструктур практически совпадают, несмотря на увеличение количества МЕТ в растворе. Такой характер зависимостей I(T) может быть связан с инкапсулированием молекул МЕТ, т.е. их проникновением во внутренние полости полимерных частиц.
На рис. 1б видно, что кривая динамического рассеяния света для исходного сополимера является полимодальной, на ней присутствуют три пика при Rh ~ 5, 19 и 125 нм. При введении 10 и 20 мас. % МЕТ интенсивности первого и второго пиков заметно возрастают и, по-видимому, МЕТ сначала связывается с отдельными макромолекулами и их малыми агрегатами. При увеличении содержания МЕТ до 40 мас. % интенсивность второго пика понижается, а интенсивность третьего – становится близкой к интенсивности пика сополимера. С повышением температуры пики сополимера и наноструктур смещаются в область более высоких значений Rh, в ряде случаев плохо разделяются (Дополнительный материал, рис. Д5). Таким образом, динамические характеристики гибридных наноструктур в водных буферных растворах зависят от содержания МЕТ в полимерных частицах и температуры.
Рис. 5.
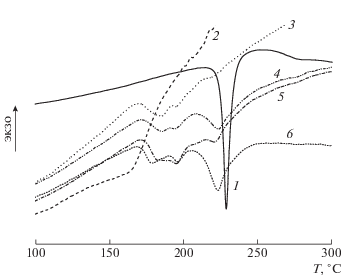
Кривые ДСК для МЕТ (1), сополимера ВП–ДМТЭГ (2), а также композиций на основе сополимера, содержащих 10 (3), 20 (4), 30 (5) и 40 мас. % МЕТ(6).
На рис. 2 приведены данные динамического рассеяния света для буферных растворов гибридных наноструктур с различным содержанием МЕТ, полученных при концентрации сополимера 1.5 мг/мл. Зависимости I(T) для этих систем совпадают (рис. 2а). Температура, при которой интенсивность рассеяния света достигает порогового значения 2 × 106 Гц, составляет 38°С, т.е. на 6 градусов выше, чем у водных растворов гибридных наноструктур, полученных в более концентрированном растворе. Из рис. 2б следует, что при комнатной температуре распределение интенсивности света по размерам частиц для водных растворов гибридных наноструктур является полимодальным. Значения Rh в максимуме основных пиков составляют около 20 и 100 нм для наноструктур с 10% МЕТ и увеличиваются до 40 и 150 нм при содержании МЕТ 40%. С повышением температуры растет вклад в рассеяние света частиц с размером 30–40 нм (Дополнительный материал, рис. 6).
Рис. 6.
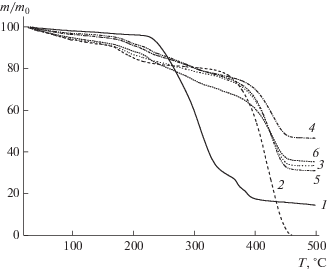
Кривые ТГА для МЕТ (1), сополимера ВП–ДМТЭГ (2), а также композиций на основе сополимера, содержащих 10 (3), 20 (4), 30 (5) и 40 мас. % МЕТ(6).
В пользу механизма инкапсулирования МЕТ в полимерные частицы могут свидетельствовать данные вискозиметрии. На рис. 3 приведены зависимости динамической вязкости от концентрации МЕТ для водных растворов гибридных наноструктур на основе сополимера (3.7 мг/мл) и линейного ПВП (3.7 мг/мл). Видно, что динамическая вязкость водных растворов наноструктур на основе сополимера не зависит от содержания в них МЕТ и определяется исключительно характеристиками сополимера. При введении 5 мас. % МЕТ в ПВП вязкость раствора заметно возрастает по сравнению с вязкостью исходного полимера, и далее практически не зависит от концентрации МЕТ. Несмотря на то, что вязкость у линейного полимера (Mw = 46 × 103) ниже, чем у сополимера, кривая для него (кривая 2) расположена выше, чем кривая для наноструктур на основе сополимера. Это может быть обусловлено присутствием в растворе надмолекулярных структур, образованных в результате адсорбции МЕТ на полимерных клубках.
Согласно расчетам, эффективные константы связывания МЕТ с сополимером и ПВП составляют 2.3 × 103 и 0.36 × 103 л/моль соответственно. Большее значение константы связывания для наноструктур МЕТ–сополимер может быть обусловлено наличием дополнительных центров связывания – атомов кислорода простой эфирной связи в олигомерном блоке –(CH2–CH2–O–)3 звеньев ДМТЭГ.
Важная информация о поведении (со)полимеров и наноструктур МЕТ на их основе в водных буферных растворах была получена при анализе спектров поглощения, записанных через 2 месяца. Так, в спектре водного раствора ПВП через 2 месяца появилась слабая по интенсивности полоса поглощения при 270 нм. Согласно литературным данным [46], ей сопутствует слабая полоса при длине волны 440 нм, которая связана c переносом заряда при образовании комплексов пирролидонового кольца с молекулами воды. По-видимому, со временем водородная связь между молекулами воды и группами С=О лактамного цикла в ПВП упрочняется и возможен перенос заряда, в результате которого суммарный заряд на молекулах воды становится отрицательным. Похожие изменения происходят и в спектре поглощения водного раствора сополимера ВП–ДМТЭГ. Со временем также появляется полоса поглощения при длине волны 250 нм. Однако в водных растворах наноструктур эти полосы поглощения не наблюдаются, что может быть обусловлено замещением воды молекулами МЕТ.
Структура комплексов сополимер–МЕТ по данным квантово-химического моделирования
Для квантово-химического моделирования структуры комплексов МЕТ и сополимера использовали последовательность из трех звеньев ДМТЭГ–ВП–ДМТЭГ и ДМТЭГ–ВП–ВП. В работе [47] рассматривалась оптимизированная геометрия участка ВП–ВП–ВП и структуры его комплексов с молекулами МЕТ. Расчеты показали, что МЕТ может координироваться за счет групп NH2 моно- и бидентатно по карбонильной группе звеньев ВП; в случае бидентатной координации – за счет одной, соседних, либо удаленных групп NH2. Наиболее энергетически выгодной и прочной является структура с координацией соседних NH2-групп МЕТ по карбонильным кислородам ВП-фрагмента.
Оказалось, что МЕТ может также координироваться по сложноэфирной и простой эфирной группе ДМТЭГ за счет групп NH2. Структуры комплексов с разным типом координации МЕТ приведены ниже.
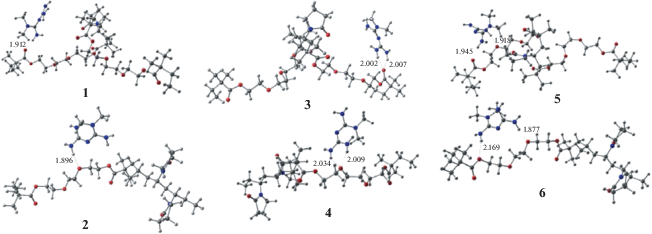
Возможна его монодентатная координация по сложноэфирной (1) и простой эфирной (2) группе, бидентатная координация соседних NH2-групп МЕТ (3, 4), а также координация с образованием мостиков удаленными группами NH2 между сложноэфирной, простой эфирной группами (5) и между двумя сложноэфирными группами (6).
Таким образом, МЕТ способен связываться по различным функциональным группам не только ВП, но и звеньев ДМТЭГ. Так как все расчеты проведены для водных растворов, необходимо учесть молекулы воды как потенциальные реагенты, также способные образовывать водородные связи с рассматриваемыми функциональными группами сополимера. Было найдено, что для всех рассмотренных вариантов координации вытеснение воды из тех же положений молекулой МЕТ энергетически выгодно, хотя энергия такого процесса невелика 1.5–4.5 ккал/моль.
Физико-химические свойства полимерных композиций МЕТ
Полимерные композиции МЕТ обладали более низкой растворимостью в хлороформе по сравнению с исходным сополимером. Так, при растворении композиции с 20% МЕТ (1 мг/мл) получали коллоидные растворы с заметной опалесценцией. ИК-спектры сополимера и полимерных композиций МЕТ в области 3600–3000 см–1 существенно отличаются (рис. 4). В ИК-спектрах композиций имеются широкие полосы поглощения с максимумами при ~3290 и 3150 см–1, которые соответствуют валентным колебаниям NH-групп МЕТ [48]; с увеличением содержания МЕТ растет поглощение в данной области. Узкая полоса поглощения МЕТ при частоте 3370 см–1 полностью отсутствует в композициях, содержащих 10–30 мас. % МЕТ, что свидетельствует о его связывании с сополимером. Полоса поглощения МЕТ в составе композиции при частоте ~3150 см–1 существенно ослабляется, что также обусловлено взаимодействием его групп NH с сополимером. Обращает на себя внимание уменьшение интенсивности полосы поглощения в области валентных колебаний групп ОН воды в композиции МЕТ, что может быть связано с вытеснением воды молекулами МЕТ из сополимера. В композиции, содержащей 40 мас. % МЕТ, наблюдается характерная для свободного МЕТ узкая полоса при частоте 3370 см–1.
МЕТ представляет собой кристаллическое соединение полиморфной модификации, которое плавится в диапазоне температур от 224 до 232°С [49]. На рис. 5 приведены кривые ДСК для МЕТ, исходного сополимера и полимерных различного состава. Узкий пик плавления с минимумом при Т = 225°С соответствует плавлению свободного МЕТ. На кривых ДСК для композиций МЕТ имеются эндотермические пики при Т > 170°С. Их интенсивность зависит от концентрации МЕТ в полимерной матрице. Интенсивность пика при 220°С является максимальной при содержании МЕТ в полимерной матрице 30 и 40%. Эти пики могут быть связаны как с разрушением полимерных комплексов МЕТ, так и с плавлением агрегатов МЕТ различных размеров.
На рис. 6 показаны кривые ТГА для МЕТ, сополимера и композиций разного состава. Кристаллический МЕТ термически стабилен в широком диапазоне температур и начинает заметно терять массу лишь при температуре более 230°С. Выше данной температуры он разлагается, потеря массы составляет около 80% при 400°С. Видно, что исходный сополимер ВП–ДМТЭГ теряет массу уже при низких температурах, что связано с испарением воды; потеря массы составляет более 10% при 100°С. Основная потеря массы сополимером происходит при температуре выше 400°С. Полимерные композиции, содержащие 20 и 30% МЕТ, имеют близкую термическую стабильность до 260°С, которая выше, чем у исходного сополимера. С увеличением температуры термическая стабильность композиций снижается по сравнению с таковой у сополимера, оставаясь существенно более высокой, чем у МЕТ. При температуре выше 400°С потеря массы у полимерных композиций МЕТ ниже, чем у исходного сополимера.
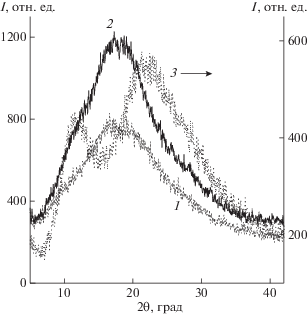
Данные РСА также позволяют сделать вывод о характере распределения МЕТ в композиции на основе сополимера ВП–ДМТЭГ (рис. 7). На дифрактограмме кристаллического МЕТ имеются узкие пики в области 10°–40° с интенсивным рефлексом около 22° [48]. На дифрактограмме композиции, содержащей 20 мас. % МЕТ (рис. 7, кривая 1), широкий пик представляет собой суперпозицию близко расположенных пиков с максимумами при 17° и 19°, обусловленных присутствием МЕТ в полимерной матрице. Кристаллическая фаза МЕТ не обнаружена, и МЕТ, скорее всего, молекулярно диспергирован в полимерной матрице или образует фазовые области малого размера. Следует отметить, что на дифрактограмме сополимера с высоким содержанием ДМТЭГ имеется интенсивный рефлекс при 18° (рис. 8 , кривая 2), в то время как на дифрактограмме сополимера с низким содержанием ДМТЭГ (рис. 7, кривая 3) присутствуют два максимума при 12° и ~21°, связанные с межмолекулярной интерференцией и внутримолекулярной интерференцией на пирролидоновых кольцах как в ПВП [46]. Смещение пика в сторону меньших углов в сополимере с высоким содержанием ДМТЭГ указывает на увеличение среднего внутримолекулярного расстояния между лактамными циклами звеньев ВП.
Рис. 7.
Дифрактограммы для композиции на основе сополимера ВП–ДМТЭГ (1) и сополимера ВП–ДМТЭГ (2, 3). Содержание звеньев ДМТЭГ в сополимере 20 (1, 2) и 5 мол. % (3).
МЕТ оказывает заметное влияние на температуру стеклования сополимера, которая была определена в ДСК-экспериментах при третьем сканировании образцов после полного удаления воды. На кривых ДСК композиций наблюдали две ступеньки изменения теплоемкости. Ступенька в низкотемпературной области была слабо выраженной, и отвечающая ей температура стеклования Тс1 связана, по-видимому, с размораживанием подвижности разветвленных цепей. Вторая температура стеклования Тс2, по-видимому, обусловлена подвижностью линейных цепей ПВП. С увеличением содержания МЕТ от 0 до 40% значение Тс1 возрастало от 50 до 61°С, а величина Тс2, наоборот, снижалась от 172 до 150°С. Это позволяет сделать предположение о распределении МЕТ в наноструктурах на основе сополимера. При содержании МЕТ, равном 5–20%, его молекулы, вероятно, локализованы в оболочке полимерной частицы, образованной линейными цепями ПВП. При более высоких концентрациях молекулы МЕТ проникают во внутренние полости частицы, образуя физические сшивки между разветвленными цепями.
Влияние полимерной композиции МЕТ на каталитическую активность альдозоредуктазы
Гипергликемия при сахарном диабете второго типа индуцирует усиление интенсивности сорбитолового пути метаболизма глюкозы, ферментативной мишенью которого является альдозоредуктаза. Это приводит к накоплению в клетках сорбитола [50], НАДН/НАД+ (никотинамидадениндинуклеотид, восстановленная форма/ никотинамидадениндинуклеотид, окисленная форма) редокс-дисбалансу, истощению НАДФН (никотинамидадениндинуклеотидфосфат, восстановленная форма), снижению уровня глутатиона, усилению окислительного стресса и развитию диабетических осложнений [51]. В связи с патологической ролью сорбитолового пути в развитии микро- и макрососудистых нарушений [52] актуальным является поиск ингибиторов АР.
В работе изучали влияние МЕТ и полимерных композиций МЕТ на каталитическую активность альдозоредуктазы в гомогенате печени мышей in vitro (табл. 1). МЕТ снижает содержание глюкозы в крови и резистентность организма к инсулину [53]. Однако, как видно из полученных данных, он не влияет на каталитическую активность альдозоредуктазы. В то же время полимерная композиция ингибирует ее каталитическую активность in vitro на 23%, что потенциально способствует терапевтическому действию МЕТ на осложнения сахарного диабета второго типа. Полученный результат указывает на необходимость дальнейшего изучения действия данной полимерной композиции in vivo.
Таблица 1.
Влияние МЕТ, сополимера и композиции сополимер–МЕТ на каталитическую активность альдозоредуктазы в гомогенате печени мышей in vitro
| Соединение | Активность альдозоредуктазы | |
|---|---|---|
| мкМ НАДФН мин–1 мг–1 белка | % | |
| МЕТ | 12.45 ± 1.40 | 98 ± 7.8 |
| Сополимер | 13.33 ± 1.25 | 104.7 ± 6.1 |
| Композиция | 9.80 ± 2.30 | 77 ± 6.1 |
Примечание. Концентрация MET, сополимера, композиции сополимер–MET равна 5 × 10–5 моль/л. Контрольная проба – супернатант печени мышей (0.15 мл), D,L-глицеральдегид (0.2 мл, 1 мМ), НАДФН (0.2 мл, 0.1 мМ), натрий-фосфатный буфер (рН 6.2) имела активность альдозоредуктазы 12.73 ± ± 1.90 мкМ НАДФН мин–1 мг–1 белка (100 ± 6.2%).
ЗАКЛЮЧЕНИЕ
Таким образом, в работе впервые получены и охарактеризованы в водных растворах и в твердом состоянии новые гибридные материалы на основе МЕТ и амфифильного сополимера ВП–ДМТЭГ с содержанием ДМТЭГ 20 мол. %. Обнаружено, что полимерная композиция с 20 мас. % МЕТ снижает каталитическую активность альдозоредуктазы в гомогенате печени мышей in vitro в 1.3 раза по сравнению с контрольными образцами. Включение МЕТ в состав биосовместимого наноносителя позволит увеличить его способность проникать через клеточные мембраны и эффективность как лекарственного препарата широкого спектра действия, в том числе для терапии сахарного диабета второго типа и вызываемых им осложнений.
Работа выполнена по теме государственного задания АААА-А19-119071890015-6 (№ 0089-2019-0014) и Программы РАН “Основы высоких технологий и использование особенностей наноструктур в науках о природе”.
Список литературы
Mandal A.K. // Int. J. Polym. Mater. Polym. Biomater. 2020.
Kalomiraki M., Thermos K., Chaniotakis N.A. // Int. J. Nanomed. 2016. V. 11. P. 1.
Singh J., Jain K., Mehra N.K., Jain N.K. // Artific. Cells Nanomed. Biotechnol. 2016. V. 44. P. 1626.
Lombardo D. // Biochem. Res. Int. 2014. V. 837651. P. 1.
Kannan R.M., Nance E., Kannan S., Tomalia D.A. J. Int. Med. 2014. V. 276. P. 579.
Agrawal A., Kulkarni S. // Int. J. Res. Dev. Pharm. Life Sci. 2015. V. 4. P. 1700.
Gao C., Yan D. // Progr. Polym. Sci. 2004. V. 29. P. 183.
Smeets N.M.B. // Eur. Polym. J. 2013. V. 49. P. 2528.
Paleos C.M., Tsiourvas D., Sideratou Z., Tziveleka L.-A. // Exp. Opin. Drug Deliv. 2010. V. 7. P. 1387.
Zeng X., Zhang Y., Wu Z., Lundberg P., Malkoch M., Nyström A.M. // J. Polym. Sci., Polym. Chem. 2011. V. 50. P. 280.
Zhou Y., Yan D. // Chem. Commun. 2009. V. 9. P. 1172.
Zhou Y., Huang W., Liu J., Zhu X., Yan D. // Adv. Mater. 2010. V. 22. P. 4567.
Voit B.I., Lederer A. // Chem. Rev. 2009. V. 109. P. 5924.
Tonhauser C., Schüll C., Dingels C., Frey H. // ACS Macro Lett. 2012. V. 1. № 9. P. 1094.
Vogt A.P., Sumerlin B.S. // Macromolecules. 2008. V. 41. P. 7368.
Wang Z., He J., Tao Y., Yang L., Jiang H., Yang Y. // Macromolecules. 2003. V. 36. P. 7446.
Malkoch M., Schleicher K., Drockenmuller E., Hawker C.J., Russell T.P., Wu P., Malkoch M., Schleicher K., Drockenmuller E., Hawker C.J., Russell T.P., Wu P., Fokin V.V. // Macromolecules. 2005. V. 38. P. 3663.
Smeets N.M.B., Freeman M.W., McKenna T.F.L. // Macromolecules. 2011. V. 44. P. 6701.
O’Brien N., McKee A., Sherrington D.C., Slark A.T., Titterton A. // Polymer. 2000. V. 41. P. 6027.
Luzon M., Boyer C., Peinado C., Corrales T., Whittaker M., Tao L., Davis T.P. // J Polym. Sci., Polym. Chem. 2010. V. 48. P. 2783.
Chambon P., Chen L., Furzeland S., Atkins D., Weaver J.V.M., Adams D.J. // Polym. Chem. 2011. V. 2. P. 941.
Besenius P., Slavin S., Vilela F., Sherrington D.C. // React. Funct. Polym. 2008. V. 68. P. 1524.
Kurmaz S.V., Obraztsova N.A., Perepelitsina E.O., Shilov G.V., Anokhin D.V., Pechnikova E.V. // Materials Today Commun. 2015. V. 4. P. 130.
Moad G., Rizzardo E., Thang S.H. // Aust. J. Chem. 2012. V. 65. P. 985.
Kurmaz S.V., Pyryaev A.N. // Polymer Science B. 2010. V. 52. № 1–2. P. 1.
Kurmaz S.V., Obraztsova N.A., Balakina A.A., Te-rent’ev A.A. // Russ. Chem. Bull. 2016. V. 65. P. 2097.
Kurmaz S.V., Obraztsova N.A., Kabachkov E.N. // Colloid Polym. Sci. 2016. V. 294. P. 2087.
Kurmaz S.V., Gak V.Yu., Kurmaz V.A., Konev D.V. // Russ. J. Phys. Chem. A. 2018. V. 92. P. 329.
Kurmaz S.V., Rudneva T.N., Sanina N.A. // Mendeleev Commun. 2018. V. 28. P. 73.
Kurmaz S.V., Fadeeva N.V., Fedorov B.S., Kozub G.I., Emel’yanova N.S., Kurmaz V.A., Manzhos R.A., Balakina A.A., Terentyev A.A. // Mendeleev Commun. 2020. V. 30. P. 22.
Kurmaz S.V., Sen’ V. D., Kulikov A.V., Konev D.V., Kurmaz V.A., Balakina A.A., Terent’ev A. A. // Russ. Chem. Bull. 2019. V. 68. P. 1769.
Pala L., Rotella C.M. // J. Endocrinol. Invest. 2014. V. 37. P. 497.
Thomas L., Russell A.D., Maillard J.Y. // J. Appl. Microbiol. 2005. V. 98. P. 533.
Denys A., Machlanski T., Bialek J., Mrozicki S. // Praeventivmedizin. 1977. V. 164. P. 85.
Pinelli A., Trivulzio S., Pojaga G., Rossoni G. // Pharmacol. Res. 1996. V. 34. P. 225.
Zhou G., Myers R., Li Y., Chen Y., Shen X., Fenyk-Melody J., Wu M., Ventre J., Doebber T., Fujii N. // J. Clin. Invest. 2001. V. 108. P. 1167.
Akinyeke T., Matsumura S., Wang X., Wu Y., Schalfer E.D., Saxena A., Yan W., Logan S.K., Li X. // Carcinogenesis. 2013. V. 34. P. 2823.
Lonardo E., Cioffi M., Sancho P., Sanchez-Ripoll Y., Trabulo S.M., Dorado J., Balic A., Hidalgo M., Heeschen C. // PLoS One. 2013. V. 8. P. 76518.
Shank J.J., Yang K., Ghannam J., Cabrera L., Johnston C.J., Reynolds R.K., Buckanovich R.J. // Gynecol. Oncol. 2012. V. 127. P. 390.
Connors K.A. Binding Constants: the Measurement of Molecular Complex Stability. New York: Wiley, 1987.
Frisch M.J., Trucks G., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Mennucci B., Petersson G.A., Nakatsuji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G., Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J.A., Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R., Normand J., Raghavachari K., Rendell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Martin R., Morokuma L.K., Zakrzewski V.G., Voth G.A., Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D., Farkas О., Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J., Gaussian 09, Revision B.01. Gaussian 09, Revis. B.01, Gaussian, Inc., Wallingford CT. 2009.
Tao J., Perdew J.P., Staroverov V.N., Scuseria G.E. // Phys. Rev. Lett. 2003. V. 91. P. 146401.
Abdel Motaal A., El-Askary H., Crockett S., Kunert O., Sakr B., Shaker S., Grigore A., Albulescu R., Bauer R. // Phytomedicine. 2015. V. 22. P. 829.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. // J. Biol. Chem. 1951. V. 193. P. 265.
Benmessaoud I., Koutchoukali O., Bouhelassa M., Nouar A., Veesler S. // J. Cryst. Growth. 2016. V. 451. P. 42.
Lebedeva T.L., Fel’dshtein M.M., Kuptsov S.A., Platé N.A. // Polymer Science A. 2000. V. 42. № 9. C. 1504.
Игнатьев В.М., Емельянова Н.С., Фадеева Н.В., Курмаз С.В. // Журн. физ. химии. 2020. Т. 94. № 5. С. 173.
Rebitski E.P., Aranda P., Darder M., Carraro R., Ruiz-Hitzky E. // Dalton Trans. 2018. V. 47. P. 3185.
Childs S.L., Chyall L.J., Dunlap J.T., Coates D.A., Stahly B.C., Stahly G.P. // Cryst. Growth Des. 2004. V. 4. P. 441.
Yan L. // Anim. Model. Exp. Med. 2018. V. 1. № 1. P. 7.
Zheng H., Wu J., Jin Z., Yan L.-J. // Biochem. Insights. 2016. V. 9. P. 1.
International Diabetes Federation. Diabetes Atlas. Brussels, 2017.
Stage T.B., Brosen K., Christensen M.M. // Clin. Pharmacokinet. 2015. V. 54. P. 811.
Дополнительные материалы
- скачать ESM_1.tiff
- Рис. 1. Химическая (а) и возможная топологическая (б) структура сополимера.
- скачать ESM_2.tiff
- Рис. 2. ИК-спектры (а) и спектры ЯМР 1Н (б) сополимера ВП–ДМТЭГ.
- скачать ESM_3.tiff
- Рис. 3. Кривые молекулярно-массового распределения (а) и зависимости Mw от элюентного объема VR (б) сополимера ВП–ДМТЭГ (1) и ПВП (2).
- скачать ESM_4.tiff
- Рис. 4. Изменение интенсивности рассеяния света спиртовыми растворами при концентрации сополимера 3.5, 10 и 20 мг/мл (а) и водными буферными растворами при концентрации сополимера 0.1, 1.4 и 3.5 мг/мл (б). Т = 25°С.
- скачать ESM_5.tiff
- Рис. 5. Кривые распределения интенсивности рассеяния света по размерам частиц водных растворов сополимера и гибридных наноструктур, содержащих 10, 20 и 40 мас.% МЕТ при 28°С. 0.1
- скачать ESM_6.tiff
- Рис. 6. Кривые распределения интенсивности рассеяния света по размерам частиц водными буферными растворами гибридных наноструктур, содержащих 10, 20, 30 и 40 мас.% МЕТ при 36°С. [Сополимер] = 1.5 мг/мл.
Инструменты
Высокомолекулярные соединения (серия А)


