Высокомолекулярные соединения (серия Б), 2019, T. 61, № 1, стр. 35-43
Новые полимеры c фенантролиновыми звеньями: синтез и свойства
М. Я. Гойхман a, b, *, И. В. Подешво a, Н. Е. Борисова c, d, Н. Л. Лорецян a, И. В. Гофман a, Р. Ю. Смыслов a, Н. С. Гулий a, И. А. Валиева a, Е. Л. Краснопеева a, Л. С. Литвинова a, А. В. Якиманский a, b
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
b Санкт-Петербургский государственный университет
198504 Санкт-Петербург, Петродворец, Университетский пр., 26, Россия
c Московский государственный университет им. Ломоносова. Химический факультет
119991 Москва, Ленинские горы,1, Россия
d Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119334 Москва, ул. Вавилова, 28, Россия
* E-mail: goikhman@hq.macro.ru
Поступила в редакцию 11.04.2018
После доработки 12.09.2018
Принята к публикации 26.09.2018
Аннотация
Синтезирован ряд сополиамидов с фенантролиновыми группами в основной цепи и металл-полимерных комплексов иридия и европия на их основе. Все полученные полимеры обладают высокими деформационно-прочностными свойствами и термостойкостью. Для комплексов европия характерна интенсивная люминесценция в области 610–620 нм.
ВЕДЕНИЕ
В последние десятилетия большое внимание исследователей привлекают полимеры, содержащие комплексы ионов переходных металлов, поскольку использование таких комплексов, особенно на основе Ir(III) и Eu(III), позволило получить ряд материалов, обладающих ценными в практическом отношении свойствами. Введение металлокомплексных фрагментов в полимерную матрицу дает возможность осуществлять тонкую настройку фотофизических и электрохимических свойств материалов в зависимости от природы металла и химической структуры лиганда, сохраняя одновременно важные особенности полимеров, например, способность к переработке, пленкообразующие свойства и т.д. Металлосодержащие полимеры и, в частности, металл-полимерные комплексы (МПК) являются базовой темой научных исследований в таких областях, как супрамолекулярная химия [1–3], фундаментальные исследования переноса электрона и энергии [4–6]. Эти материалы служат для создания ионных датчиков [7–9], электронных устройств [10–12], окислительно-восстановительных агентов в электрокатализе [13], биологически активных препаратов [14].
Среди широкого ряда азотсодержащих гетероциклов, используемых в качестве лигандов при получении МПК, важное место занимает 1,10-фенантролин, благодаря удачному сочетанию структурных и химических свойств. Жесткость фенантролинового фрагмента и его планарная структура делают его лучшим хелатирующим агентом по сравнению с 2,2'-дипиридином и 2,2'-бихинолином. Использование производных 1,10-фенантролина позволило разработать перспективные синтетические стратегии, приводящие к созданию соединений сложной молекулярной архитектуры, таких как катенаны и ротаксаны. Комплексы фенантролина с переходными металлами отличаются широким разнообразием люминесцентных свойств. Во многих случаях эти производные применяют в оптоэлектронных устройствах. Классическим примером служит батокупроин (2,9-диметил-4,7-дифенил-1,10-фенантролин), который используется в качестве материала в органических светоизлучающих диодах.
Необходимо отметить, что во многих случаях комплексы на основе немодифицированного 1,10-фенантролина являются слабоизлучающими соединениями. Таким образом, стратегия, направленная на увеличение интенсивности люминесценции комплексов фенантролина, должна включать химическую функционализацию фенантролинового цикла в различных положениях с последующим введением синтезированных соединений в полимерную цепь.
Цель настоящего исследования – разработка методов синтеза новых доступных бифункциональных фенантролинсодержащих мономеров 1,10-фенантролин-2,9-дикарбоновой кислоты и 1,10-фенантролин-4,7-дихлор-2,9-дикарбоновой кислоты, получение на их основе полиамидов с фенантролиновыми группами в основной цепи, синтез МПК с производными Ir(III) и Eu(III) и сравнительное исследование их свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Очистка исходных соединений и растворителей
Eu(NO3)3 ⋅ 6H2O, IrCl3 ⋅ 3H2O, теноилтрифторацетон (ТТА), 2-этоксиэтанол, ванилиновая кислота, терефталевая кислота, неокупроин, окись селена, муравьиная кислота, перекись водорода, N-метилпирролидон, пропиленоксид, N-хлорсукцинимид, бензоилпероксид – коммерческие продукты (товарные продукты фирмы “Aldrich”), их использовали без дополнительной очистки. Другие реагенты и растворители применяли после предварительной очистки. 4,4'-диаминодифенилоксид (ДАДФЭ) очищали перегонкой под вакуумом; Тпл = 190°С. Тионилхлорид очищали простой перегонкой, Ткип = 78°С. Диоксан перегоняли при 104°С. ДМФА осушали гидридом кальция и перегоняли под вакуумом, Ткип = = 53°С. Пиридин осушали над гранулированным едким кали, очищали перегонкой, Ткип = 115°С. Этанол перегоняли при Ткип = 78°С.
Синтез мономеров
Синтез 1,10-фенантролин-2,9-диальдегида 1 (Схема 1). В трехгорлую круглодонную колбу с мешалкой, холодильником и капельной воронкой помещали 34.7 диоксана, 0.7 мл воды и 1.09 г (0.0098 моля) окиси селена. Смесь доводили до кипения. По каплям добавляли раствор 1 г (0.0048 моля) неокупроина в 23 мл диоксана и кипятили 30 мин. После охлаждения выпадает осадок желтого цвета. Продукт очищали растворением в слабой соляной кислоте с последующим добавлением раствора КОН до рН 7. Выход 0.8 г (80%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 10.35 (с, 2Н), 8.80 (д, 2Н), 8.35 (д, 2Н), 8.3 (c, 2Н).
Синтез 1,10-фенантролин-2,9-дикарбоновой кислоты 2 (Схема 1). В колбу, снабженную термометром и мешалкой, помещали 0.2 г соединения 1 и 2 мл муравьиной кислоты. Раствор охлаждали до 0°С на ледяной бане, по каплям добавляли 0.87 мл перекиси водорода и оставляли перемешиваться в течение 1 ч при охлаждении. Смесь оставляли на ночь в холодильной камере при 5°С. Образовавшийся желтый осадок отфильтровывали, промывали водой и сушили. Продукт очищали путем растворения в 5%-ном растворе КОН с последующим добавлением раствора НСl до рН 7. Выход 90%. Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 8.8 (д, 2Н), 8.45 (д, 2Н), 8.25 (с, 2Н).
2,9-диметил-4,7-дихлор-1,10-фенантролин получали в соответствии с методикой, приведенной в работе [15].
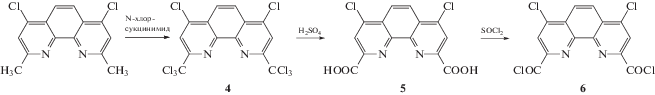
Синтез 4,7-дихлор-2,9-бис(трихлорметил)-1,10-фенантролина 4. В одногорлую колбу, снабженную магнитной мешалкой и обратным холодильником, добавляли 500 мл четыреххлористого углерода, 10 г (36.2 ммоля) 2,9-диметил-4,7-дихлор-1,10-фенантролина, 50 г (376 ммоль) N-хлорсукцинимида и 20 мг бензоилпероксида. Реакционную массу кипятили в течение 8 ч, добавляя по 20 мг бензоилпероксида каждые 1.5–2.0 ч, затем охлаждали, отфильтровывали осадок, удаляли растворитель на роторном испарителе. Сухой остаток оранжевого цвета растворяли в хлористом метилене, промывали насыщенным раствором карбоната натрия, сушили над сульфатом натрия, удаляли растворитель (при необходимости, можно пропустить через слой силикагеля, элюентом служил хлористый метилен). Выход 82%. ЯМР 1Н: (CDCl3, δ, м.д.): 8.50 (c., 2H), 8.43 (c., 2H). ЯМР 13C (CDCl3, δ, м.д.): 76.27, 76.59, 76.90, 120.78, 124.10, 127.11, 157.89.
Синтез 4,7-дихлор-1,10-фенантролин-2,9-дикарбоновой кислоты 5. В одногорлую колбу, снабженную магнитной мешалкой и обратным холодильником, добавляли 1 г (2.07 ммоля) 2,9-трихлорметил-4,7-дихлор-1,10-фенантролина и 2 мл H2SO4, перемешивали в течение 2 ч при 90°C, затем смесь охлаждали и по каплям добавляли 10 мл воды при интенсивном перемешивании. Полученную реакционную массу кипятили 1 ч, охлаждали, выпавший серый осадок отфильтровывали, многократно промывали водой, сушили в вакууме водоструйного насоса при 70–80°C на водяной бане. Продукт серо-зеленого цвета. Выход 72%. ЯМР 1H (ДMСO-d6, δ, м.д.): 8.57 (c., 2H), 8.49 (c., 2H).
Синтез дихлорангидридов 1,10-фенантролин-2,9-дикарбоновой кислоты 3 и 1,10-фенантролин-4,7-дихлор-2,9-дикарбоновой кислоты 6. К 0.3 г кислоты добавляли 6 мл тионилхлорида, кипятили 8 ч. После охлаждения растворитель отгоняли досуха на водяной бане. Выход 95%.
Соединение 3. Найдено, %: С 55.42; H 2.01; Cl 22.99; N 9.20.
Для С14H6Cl2N2O2
вычислено, %: С 55.11; H 1.98; Cl 23.24; N 9.18; O 10.49.
Соединение 6. Найдено, %: С 44.80; H 1.15; Cl 37.84; N 7.39.
Для С14H4Cl4N2O2
вычислено, %: С 44.96; H 1.08; Cl 37.92; N 7.49; O 8.56.
Дихлорангидрид терефталоил-бис(3-метокси-4-оксибензойной) кислоты получали в соответствии с методикой, приведенной в работе [16].
Синтез полимеров
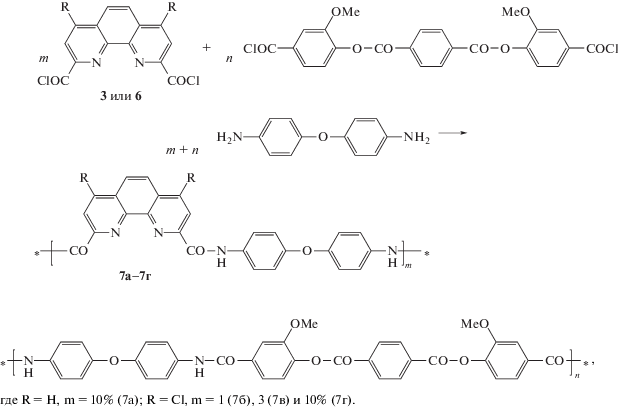
В двугорлую круглодонную колбу, снабженную мешалкой, помещали 0.1 г (0.05 ммоля) ДАДФЭ и 3 мл N-метилпирролидона, перемешивали до полного растворения, после чего раствор охлаждали до –15°С. В охлажденный раствор добавляли 0.0155 г (0.005 ммоля) дихлорангидрида 3 и 0.2298 г (0.045 ммоль) дихлорангидрида терефталоил-бис(3-метокси-4-оксибензойной) кислоты. Суспензию перемешивали при –15°С в течение 30 мин, после чего снимали охлаждающую баню, добавляли 0.1 мл окиси пропилена и после полного растворения дихлорангидридов перемешивали при комнатной температуре в течение 4–5 ч.
Методика приведена для сополимера (7а, cхема 2), содержащего 10% фенантролиновых звеньев. По аналогичной методике были синтезированы сополимеры (7б–7г), содержащие 1, 3, 10% дихлорфенантролиновых звеньев соответственно.
Соединение 7a. Найдено, %: С 70.52; H 4.06; N 3.01.
Для С3770H2410N220O840
вычислено, %: С 70.39; H 4.04; N 3.05; O 22.52.
Соединение 7б. Найдено, %: С 70.07; H 4.09; N 2.28; C l 0.10.
Для С3590H2489N202O894Сl2
вычислено, %: С 70.18; H 4.05; N 2.35; O 23.30; C l 0.12.
Соединение 7в. Найдено, %: С 70.11; H 4.08; N 2.55 Cl 0.38.
Для С3570H2467N206O882Cl6
вычислено, %: С 70.05; H 4.03; N 2.50; O 23.07; C l 0.35.
Соединение 7г. Найдено, %: С 69.60; H 4.04; N 3.02 Cl 1.12.
Для С3570H2390N206O882Cl20
вычислено, %: С 69.58; H 3.99; N 3.01; O 22.27; Cl 1.18.
Расчет выполнен для сополимеров 7 с (m + n) = = 100.
Из полученных растворов полимеров на стеклянных подложках отливали пленки, которые сушили при 100°С до постоянной массы. Толщина пленок 6.25 мкм.
Синтез двуядерного иридиевого комплекса [Ir(ppy)2Cl]2 8 ( рpy – 2-финилпиридин) проводили по методике [17], синтез Eu(TTA)3 10 – по методике [18].
Синтез МПК иридия
Синтез МПК иридия, содержащего 10% фенантролиновых звеньев, проводили по методике, описанной в [19].
Соединение 9а. Найдено, %: С 69.64; H 3.90; N 3.23; Ir 2.19.
Для С3500H2525N234O840Ir7
вычислено, %: С 69.38; H 3.99; N 3.19; O 21.24; Ir 2.20.
Соединение 9а. Найдено, %: С 68.60; H 3.90; N 3.21; Cl 0.99; Ir 2.35.
Для С3674H2516N236O840Cl20Ir8
вычислено, %: С 68.54; H 3.91; N 3.17; O 20.91; Cl 1.10; Ir 2.37.
Расчет выполняли для сополимеров 9а и 9г с (n + p + q) = 100, для случая прохождения реакции комплексообразования на 100%.
Синтез МПК европия
В двугорлую круглодонную колбу, снабженную мешалкой, помещали 0.7134 г (0.11 ммоля) полиамида 7а, содержащего 10% фенантролиновых звеньев, растворенного в 7 мл N-метилпирролидона. К раствору полимера добавляли 0.0901 г (0.011 ммоля) Eu(TTA)3. Смесь нагревали в течение 10 ч при 90°С, после чего охлажденный до комнатной температуры раствор высаживали в этанол. Образовавшиеся полимерные волокна экстрагировали этанолом, затем сушили и растворяли в N-метилпирролидоне.
Соединение 11а. Найдено, %: С 66.59; H 3.82; N 2.76; Eu 1.96.
Для С3709H2541N220O892S26F78Eu9
вычислено, %: С 66.64; H 3.80; N 2.73; O 21.37; S 1.25; F 2.23; Eu 1.98
Соединение 11б. Найдено, %: С 69.82; H 4.05; N 2.28; Eu 0.20.
Для С3610H2502N202O89Cl2S3F8Eu1
вычислено, %: С 69.79; H 4.03; N 2.32; O 23.17; Cl 0.12; S 0.13; F 0.23; Eu 0.21.
Соединение 11в. Найдено, %: С 68.90; H 4.00; N 2.44; Eu 0.56.
Для С3628H2504N206O897Cl5S7F21Eu2
вычислено, %: С 68.95; H 3.96; N 2.42; O 22.72; Cl 0.34; S 0.37; F 0.66; Eu 0.58.
Соединение 11г. Найдено, %: С 65.90; H 3.77; N 2.71; Eu 1.96.
Для С3714H2524N220O890Cl20S27F80Eu9
вычислено, %: С 65.88; H 3.73; N 2.69; O 21.13; Cl 1.05; S 1.26; F 2.26; Eu 2.00.
Соединение 11г'. Найдено, %: С 66.04; H 3.69; N 2.76; Eu 1.88.
Для С3709H2518N220O891Cl20S25F77Eu8
вычислено, %: С 66.03; H 3.74; N 2.71; O 21.18; Cl 1.05; S 1.21; F 2.16; Eu 1.92.
Из полученных 10%-ных растворов полимеров в N-метилпирролидоне на стеклянных подложках отливали пленки, которые сушили при 100°С до постоянной массы. Толщина пленок 6, 25 мкм.
Методика приведена для МПК 11a, содержащего 10% фенантролиновых звеньев при эквимольном соотношении фенантролиновое звено : Eu(TTA)3. По аналогичной методике были синтезированы МПК 11б–11г, содержащие 1, 3 и 10% дихлорфенантролиновых звеньев соответственно и эквимольные количества Eu(TTA)3, а также МПК 11г', содержащий 10% дихлорфенантролиновых звеньев при мольном соотношении фенантролиновое звено : Eu(TTA)3 = 1 : 7.
Спектры ЯМР 1Н для 1%-ных растворов регистрировали на спектрометре “Аvance-400” (“Вruker”, Германия) с рабочей частотой 400 МГц на ядрах 1Н, внутренний стандарт Me6Si2.
Средние ММ сополимеров и МПК определяли методом ВЭЖХ на хроматографе фирмы “Agilent Technologies 1260 Infinity” (The Agilent 1260 Infinity Multi-Detector GPC/SEC System), снабженном тремя детекторами: рефрактометрическим (DRI, Wavelength 660 нм), вискозиметрическим (VS) и светорассеивающим (LS: Rayleigh scattering angles 15° and 90°; Laser wavelength/power 660 нм/50 мВ). Температура детекторов 40°С. В установку входил набор последовательно соединенных хроматографических колонок: предколонка PLgel 5 мкм Guard 50 × 7.5 мм и две стирогелевые колонки Agilent Technologies PLgel 5 мкм MIXED-C, 300 × 7.5 мм. Колонки термостатировали при 50°С. Подвижная фаза: 0.1 M раствор LiBr в ДМФА. Скорость подвижной фазы 1.0 мл/мин. Ввод пробы осуществляли с помощью автосамплера, объем пробы 100 мкл. Образцы сополимеров и МПК (с = 1.5 мг/мл) растворяли в элюенте.
Механические характеристики пленок сополиамидов и комплексов при комнатной температуре определяли в режиме одноосного растяжения с помощью универсальной установки для механических испытаний “AG-100kNX Plus” (“Shimadzu”, Япония). В процессе испытаний определяли следующие характеристики пленок: модуль упругости Е, предел пластичности σп, прочность σр и предельную деформацию до разрушения εр.
Спектры люминесценции регистрировали на спектрофлуориметре “LS-100” (фирма PTI). Использовали ширину щелей монохроматоров возбуждения и регистрации 1 мм при обратной линейной дисперсии 4 нм/мм. Фотолюминесценцию возбуждали при длине волны 360–380 нм в полосе поглощения формируемого МПК с ионами IrI.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На начальном этапе работы были синтезированы реакционноспособные бифункциональные мономеры для поликонденсации, содержащие фенантролиновую группу – дихлорангидриды 1,10-фенантролин-2,9-дикарбоновой кислоты (Схема 1) и 1,10-фенантролин-4,7-дихлор-2,9-дикарбоновой кислоты (Схема 2).
В соответствии со схемой 1 синтез дихлорангидрида 1,10-фенантролин-2,9-дикарбоновой кислоты из неокупроина проводили в три стадии: на первой был получен 1,10-фенантролин-2,9-диформил 1 окислением метильных групп до альдегидных с помощью диоксида селена, на второй стадии из диальдегида окислением перекисью водорода была получена дикарбоновая кислота 2. Дикарбоновая кислота 5 была синтезирована из 2,9-диметил-4,7-дихлор-1,10-фенантролина (схема 2). На первой стадии было проведено полное хлорирование метильных групп исходного соединения, в результате чего был получен 4,7-дихлор-2,9-бис(трихлорметил)-1,10-фенантролин 4. На второй стадии был проведен кислотный гидролиз соединения 4 до 1,10-фенантролин-2,9-дикарбоновой кислоты 5.
На заключительном этапе дикарбоновые кислоты нагреванием в тионилхлориде были превращены в более реакционноспособные производные – дихлорангидриды 1,10-фенантролин-2,9-дикарбоновой кислоты 3 и 1,10-фенантролин-4,7-дихлор-2,9-дикарбоновой кислоты 6.
На основе указанных дихлорангидридов, 4,4'-диаминодифенилового эфира и дихлорангидрида терефталоил-бис-(3-метокси-4-оксибензойной) кислоты методом низкотемпературной поликонденсации синтезировали сополиамиды, содержащие в основной цепи фенантролиновые группы в разной концентрации (Схема 3).
Дихлорангидрид терефталоил-бис-(3-метокси-4-оксибензойной) кислоты был выбран в качестве сомономера, поскольку, как было показано ранее, на его основе можно получать полиамиды с высокой характеристической вязкостью, пленки которых обладают хорошей термостойкостью и высокими механическими характеристиками [16].
В работе были использованы соединения таких металлов, как европий и иридий, поскольку МПК на основе европия [20, 21] и иридия [22, 23] обладают перспективными фотолюминесцентными свойствами.
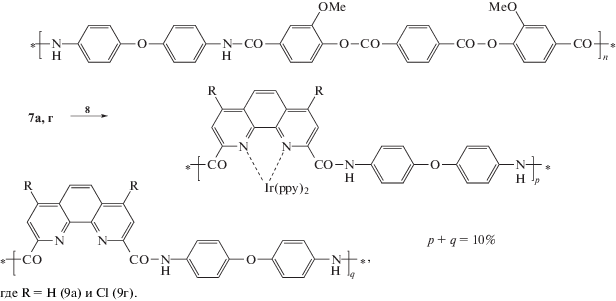
Известно, что МПК иридия удобно получать взаимодействием макромолекулярных лигандов с [Ir(ppy)2Cl]2

Реакцией в цепях сополиамидов 7а,7г с двуядерным мостиковым комплексом иридия 8 были получены комплексы иридия 9а и 9г (Схема 4).
Что касается МПК европия, то, согласно многочисленным литературным данным [24–26], наиболее многообещающим способом их получения является взаимодействие полимеров (Схема 5), содержащих лигандные группы, с низкомолекулярным комплексом Eu(TTA)3

Степень модификации полимеров была определена с помощью спектроскопии ЯМР 1Н и элементного анализа. Показано, что количество фенантролиновых групп полимерной цепи, вступивших в реакцию с комплексом 8, составляет 70–80% (табл. 1), а с комплексом 10 равно 80–90% в зависимости от состава сополимера (табл. 1) При этом в ряду МПК иридия выход реакции модификации практически не зависит от концентрации фенантролиновых звеньев и наличия в них заместителей, в то время как в ряду МПК европия выход реакции модификации несколько возрастает при переходе от 1,10-фенантролин-2,9-дикарбоновой кислоты к 1,10-фенантролин-4,7-дихлор-2,9-дикарбоновой кислоте.
Таблица 1.
Состав, молекулярные и механические характеристики синтезированных полимеров и МПК
| Полимер | Состав полимера m = p + q | Степень модифи-кации, % | Е, ГПа | σп, МПа | σр, МПа | εр, % | Mn | Mw |
|---|---|---|---|---|---|---|---|---|
| 7а | m = 0.1 | – | 2.92 | 151 | 135 | 13 | 25 318 | 16 000 |
| 7г | m = 0.1 | – | 3.34 | 133 | 180 | 41 | 13 929 | 22 867 |
| 9а | p = 7.2 | 72 | 3.36 | 143 | 137 | 9.5 | 25 229 | 18 750 |
| q = 2.8 | ||||||||
| 9г | p = 7.9 | 79 | 3.76 | 140 | 134 | 4.7 | 17 388 | 24 950 |
| q = 2.1 | ||||||||
| 11а | p = 8.7 | 87 | 4.49 | 191 | 185 | 6.4 | 27 423 | 21 155 |
| q = 1.3 | ||||||||
| 11б | p = 0.84 | 84 | 3.17 | 133 | 131 | 7.0 | 18 034 | 28 921 |
| q = 0.16 | ||||||||
| 11в | p = 2.43 | 81 | 4.21 | 180 | 167 | 13 | 25 030 | 38 919 |
| q = 0.57 | ||||||||
| 11г | p = 8.9 | 89 | 3.87 | 144 | 132 | 5.2 | 24 959 | 40 203 |
| q = 1.1 | ||||||||
| 11г' | p = 8.5 | 85 | 3.84 | 162 | 191 | 31 | 19 829 | 39 656 |
| q = 1.5 |
Молекулярные характеристики сополимеров 7 и МПК 9а, 9г, 11а–11г, 11г' приведены в табл. 1. Как видно, образование МПК в целом сопровождается закономерным увеличением молекулярной массы.
Синтезированные МПК представляют собой тройные сополимеры, в которых присутствуют как звенья, содержащие комплексные фрагменты, так и звенья с фенантролиновыми группами, не вступившими в реакцию комплексообразования. Следует отметить, что такое поведение (неполная конверсия) характерно для большинства полимераналогичных реакций.
Полимеры, содержащие фенантролиновые группы в концентрации до 10%, были способны к образованию прочных пленок. Получение полимеров с концентрацией фенантролиновых групп выше 10% было нецелесообразным, поскольку интенсивность люминесценции МПК на основе таких полимеров резко падала вследствие концентрационного тушения.
Рассматривая результаты испытаний исследуемых материалов, необходимо подчеркнуть, что из синтезированных полимеров удалось изготовить прочные, оптически прозрачные пленки, обладающие высокими механическими свойствами (табл. 1) и хорошей термической стабильностью.
Результаты явно демонстрируют заметное увеличение жесткости материала (рост модуля упругости и предела пластичности) при введении МПК в макроцепи. Этот эффект реализуется при образовании комплексов иридия и европия. Комплекс с европием показывает наиболее высокие прочностные свойства (табл. 1) и температуры стеклования и плавления (190 и 311°С) по сравнению с исходным полимером (173 и 295°С). Однако реальный рост жесткости имеет место, когда концентрация комплексов достаточна для этого. Например, у образца 11б, в котором концентрация комплексов 1%, модуль даже несколько ниже, чем у исходного сополиамида 7г. Образование комплекса с иридием 9г наряду с ростом жесткости пленки приводит к резкому снижению предельной деформации – почти в 10 раз. В случае комплекса с европием 11г' также происходит заметный рост жесткости пленки, однако при этом не наблюдается резкого снижения деформируемости материала (по сравнению с базовым сополиамидом 7г предельная деформация упала с 41 до 31%).
Нетривиальный результат получен при испытании пленки 11в (рис. 1). У этой пленки – одни из самых высоких значений модуля и предела пластичности, однако при ее испытаниях зарегистрирован качественно иной характер деформации, чем на остальных пленках, для которых характерен однородный процесс деформации. На образце 11в зарегистрирован четко видимый на деформационной кривой максимум – предел пластичности с последующим образованием шейки. Данный факт может отражать повышенную структурную неоднородность исследуемого материала.
Исследование люминесцентных характеристик синтезированных МПК (рис. 2) показало, что исходные сополимеры 7а, 7г и комплекс с иридием 9а, практически не люминесцируют, а комплекс, содержащий дихлорфенантролиновые звенья 9г, слабо люминесцирует в области 580 нм, т.е. иридиевые МПК не обладают достаточно интенсивной люминесценцией в видимой области. Исходя из этого дальнейшие исследования проводились на комплексах европия.
На рис. 3 представлены спектры люминесценции синтезированных комплексов сополимеров с европием. Комплексы на основе сополимеров с дихлорфенантролиновыми звеньями 11б–11г интенсивно люминесцируют в области 620 нм, а комплекс, содержащий фенантролиновые фрагменты 11а, люминесцирует в несколько раз слабее в этой же области. Исследование оптических свойств комплексов европия с сополимерами, содержащими дихлорфенантролиновые звенья, показало, что интенсивность люминесценции можно варьировать изменяя соотношение [лигандное звено]: [инертное звено] или концентрацию европия при выбранном соотношении [лигандное звено] : [инертное звено]. Как видно на рис. 3, максимальная интенсивность люминесценции наблюдается при содержании фенантролиновых звеньев 10% и содержании европия [один комплексный фрагмент на 7 лигандных звеньев] (11г'), что позволяет избежать концентрационного тушения.
ЗАКЛЮЧЕНИЕ
Таким образом, в результате проведенных исследований было показано, что использование в качестве мономера дихлоранигидрида 1,10-фенантролин-4,7-дихлор-2,9-дикарбоновой кислоты позволяет получать прочные термостойкие сополиамиды, а синтезированные на их основе комплексы с Eu(TTA)3 обладают значительной фотолюминесценцией в видимой области 620 нм, в 2 раза превосходящей по интенсивности фотолюминесценцию для аналогичных систем, не содержащих заместителей в положениях 4 и 7 фенантролинового фрагмента.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 16-03-00441-а) и Фонда содействия развитию малых форм предприятий в научно-технической сфере “УМНИК” (проект № 10853ГУ/2016 29.12.2016).
Список литературы
Lehn J.-M. // Angew. Chem. 1988. V. 27. P. 89.
Eisenbach C.D., Schubert U.S. // Macromolecules. 1993. V. 26. P. 7372.
Glasson C.R.K., Lindoy L.F., Meehan G.V. // Coord. Chem. Rev. 2008. V. 252. P. 940.
Baxter S.M., Jones W.E., Danielson E., Worl L., Strouse G., Younathan J., Meyer T.J. // Coord. Chem. Rev. 1991. V. 111. P. 47.
Rabek J.F. // Prog. Polym. Sci. 1988. V. 13. P. 83.
Aly S.M., Ho C.-L., Wong W.-Y., Fortin D., Harvey P.D. // Macromolecules. 2009. V. 42. P. 6902.
Prodi L., Bolletta F., Montalti M., Zaccheroni N. // Coord. Chem. Rev. 2000. V. 205. P. 59.
Heller A., Feldman B. // Chem. Rev. 2008. V. 108. P. 2482.
Qin C., Wong W.-Y., Wang L. // Macromolecules. 2010. V. 44. P. 483.
Marin V., Holder E., Hoogenboom R., Schubert U.S. // Chem. Soc. Rev. 2007. V. 36. P. 618.
O’Regan B., Gratzel M. // Nature. 1991. V. 353. P. 737.
Ulbricht C., Beyer B., Friebe C., Winter A., Schubert U.S. // Adv. Mater. 2009. V. 21. P. 4418.
Magdesieva T.V., Nikitin O.M., Yakimansky A.V., Goikhman M.Ya., Podeshvo I.V. // Electrochim. Acta. 2011. V. 56. P. 3666.
Alshehri S.M., Aldalbahi A., Ahamad T. // Adv. Polym. Technol. 2015. V. 34. № 4. P. 21512.
Larsen A.F., Ulven T. // Organic Lett. 2011. V. 13. P. 3546.
Goikhman M.Ya., Yevlampieva N.P., Kamanina N.V., Podeshvo I.V., Gofman I.V., Mil’tsov S.A., Khurchak A.P., Yakimanskii A.V. // Polymer Science A. 2011. V. 53. № 6. P. 457.
Yang M., Ling Q., Hiller M., Fun X., Liu X., Wang L., Zhang W. // J. Polym. Sci., Polym. Chem. 2000. V. 38. P. 3405.
Пат. 2450025 Россия. // Б. И. 2012. № 13.
Goikhman M.Ya., Podeshvo I.V., Gofman I.V., Smyslov R.Yu., Loretsyan N.L., Popova E.N., Gulii N.S., Abalov I.V., Yakimanskii A.V. // Polymer Science B. 2016. V. 58. № 6. P. 703.
Yang M., Ling Q., Hiller M., Fun X., Liu X., Wang L., Zhang W. // J. Polym. Sci., Polym. Chem. 2000. V. 38. P. 3405.
Pan Yu., Zheng A., Hu F., Xiao H. // J. Appl. Polym. Sci. 2006. V. 100. P. 1506.
Iridium(III) in Optoelectronic and Photonics Applications / Ed. by Eli Zysman-Colman. New Jersey: Wiley, 2017.
Goikhman M.Ya., Podeshvo I.V., Loretsyan N.L., Gofman I.V., Smyslov R.Yu., Nekrasova T.N., Smirnova V.E., Polevoi A.A., Yakimanskii A.V. // Russ. Chem. Bull. 2012. V. 61. № 5. P. 966.
Zhao Q., Jianq C., Shi M., Li F., Yi T., Cao Y., Huang C. // Organometallics. 2006. V. 25. P. 3631.
Dandekar M.P., Kondawar S.B., Itankar S.G., Nandanwar D.V. // Proc. Mater. Sci. 2015. V.10. P. 580.
Yakimanskii A.V., Goikhman M.Ya., Podeshvo I.V., Anan’eva, T.D., Nekrasova T.N., Smyslov R.Yu. // Polymer Science A. 2012. V. 54. № 12. P. 921.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)