Высокомолекулярные соединения (серия Б), 2019, T. 61, № 2, стр. 116-122
ОДНОСТАДИЙНЫЙ ВЫСОКОТЕМПЕРАТУРНЫЙ КАТАЛИТИЧЕСКИЙ СИНТЕЗ ЗВЕЗДООБРАЗНЫХ ОЛИГОИМИДОВ ПО СХЕМЕ (В4+АВ)
А. Ю. Цегельская a, *, А. Е. Солдатова a, Г. К. Семенова a, М. Д. Дутов b, И. Г. Абрамов c, А. А. Кузнецов a
a Институт синтетических полимерных материалов им. Н.С. Ениколопова Российской академии наук
117393 Москва, ул. Профсоюзная, 70, Россия
b Институт органической химии им. Н.Д. Зелинского Российской академии наук
119991 Москва, Ленинский пр., 47, Россия
c Ярославский технический университет
150023 Ярославль, Московский пр., 88, Россия
* E-mail: pech651@yandex.ru
Поступила в редакцию 31.05.2018
После доработки 25.06.2018
Принята к публикации 09.07.2018
Аннотация
Методом одностадийной высокотемпературной поликонденсации 1,4-фенилен-бис-(5-окси-1,3-фенилендиамина) (мономер В4) с 4-(3-аминофенокси)фталевой кислотой (мономер AВ) в расплаве бензойной кислоты синтезированы четырехлучевые звездообразные олигоимиды с концевыми аминогруппами. Олигомеры имеют узкое молекулярно-массовое распределение (Ð = 1.2–1.3) и растворимы в органических растворителях. Ацилированием концевых аминогрупп уксусным ангидридом получены звездообразные олигоимиды с концевыми ацетамидными фрагментами.
Работы в области синтеза, исследования структуры и поиск новых областей применения звездообразных полимеров в последние годы выделились во вполне самостоятельное быстро расширяющееся научное направление [1–3]. Так называемые полимерные “звезды” содержат один разветвляющий центр и три (или более) полимерных цепи, прикрепленные к нему с одного конца. Разветвляющим центром может служить низкомолекулярное соединение, а также олигомер общей формулы Bn, где В – функциональные группы, при n ≥ 2. Такие соединения, с одной стороны, можно использовать для создания полимерных наночастиц типа “ядро–оболочка” [1], причем несомненным технологическим достоинством будет являться простота их синтеза. С другой стороны, симметричная структура звезд и возможность ее контроля выгодно отличают звезды от сверхразветвленных полимеров. Кроме того, звездообразная форма макромолекул предоставляет большие возможности для молекулярного конструирования. В настоящее время получены блок-сополимерные, “микто-арм”-, дендритные звезды и т.д. Последние исследования в области полимерных звезд обобщены в ряде обзоров [2–4].
Как известно, для получения полимерных звезд, как и для синтеза дендримеров [5], применяются два основных подхода: “рост от разветвляющего центра” и “присоединение предварительно выращенных боковых цепей к разветвляющему центру” [1, 2]; при этом второй подход является преобладающим. В подавляющем большинстве работ используют методологию контролируемой цепной полимеризации – анионной и, особенно, радикальной. Одним из наиболее впечатляющих достижений в этой области является синтез звездообразных полимеров с узким молекулярно-массовым распределением (Ð = 1.1).
В области поликонденсационных звездообразных полимеров до последнего времени прогресс был значительно более скромным. Тем не менее в работах T. Yokozawa было показано, что, применяя процесс так называемой “цепной поликонденсации”, можно получить полимерные звезды с узким ММР [6]. Этот процесс может быть реализован при условии, если имеется мономер типа АВ' с малоактивной группой В', способный реагировать с активным разветвляющим многофункциональным “инициатором” Bn. При присоединении к Bn звена АВ' вследствие мезомерного или индуктивного эффекта образовавшегося нового заместителя, концевая группа В' становится активной. За счет этого поддерживается селективный рост луча. Реакция присоединения повторяется снова и снова по квази-цепному механизму и приводит к образованию “хорошо охарактеризованных” звезд. Средняя молекулярная масса лучей определяется мольным соотношением AВ'/Bn.
Использование описанного выше “эффекта замещения” в синтезе звезд с узким ММР [6] является одним из вариантов более общего подхода [7–10], разработанного для получения “хорошо охарактеризованных” поликонденсационных полимеров линейного строения, таких как полиамиды, полиэфиры, сложные полиэфиры и полиэфирсульфоны. Различие заключается только в том, что в первом случае используют полифункциональный, а во втором – монофункциональный инициатор. Подход, основанный на использовании “эффекта замещения”, был примен также для полимеров различной топологической структуры (блок-, привитые-сополимеры, звезды) [11–13].
Для получения линейных поликонденсационных полимеров с узким ММР авторы работы [6] предложили еще один подход – “двухфазный метод”. Он заключается в проведении “цепной поликонденсации” в гетерогенной системе, где “инициатор” находится в одной фазе, а мономер АВ – в другой [7, 14]. В отличие от “метода замещения”, “двухфазный метод” может быть использован не только для низкоактивных мономеров AВ', но и для мономеров АВ, имеющих равную с “инициатором” реакционную способность. Эффект селективного “квазицепного” роста цепи реализуется за счет того, что реакция присоединения АВ к инициатору протекает в фазе, в которой концентрация мономера АВ мала по сравнению с концентрацией инициатора.
В статье H.R. Kricheldorf [15] проведен анализ результатов, полученных T. Yokozawa, и сформулирован общий принцип, представляющий оба описанных выше подхода как два частных случая его реализации. Так, для синтеза “хорошо охарактеризованных” полимеров должны быть выбраны условия, при которых скорость реакции присоединения мономера АВ к “инициатору” была бы выше, чем скорость автополиконденсации. Из этой простой формулировки следует, что достичь желаемого эффекта можно более простым и общим методом, а именно медленным добавлением мономера АВ в гомогенную реакционную систему, содержащую “инициатор” [15].
В этой связи интересно отметить, что подобный подход – медленное добавление мономера АВ2 к центральному разветвляющему агенту – часто используют в синтезе сверхразветвленных полимеров для уменьшения ММР, причем применительно к таким полимерам этот подход развит как в теоретическом, так и в практическом аспекте [16–19].
В настоящей работе предпринята попытка реализовать подход “медленного добавления мономера” AB для получения четырехлучевых олигоимидных звезд с узким MMР.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в работе 4-(3-аминофенокси)фталевую кислоту (АФФК) и 1,4-фенилен-бис-(5-окси-1,3-фенилендиамин) (ТАФБ) синтезировали по методикам работ [20, 21]. Бензойную кислоту квалификации ч.д.а. перекристаллизовывали из смеси этанол–вода и сушили в вакууме, Tпл = 122°С.
Диметилацетамид и диметилформамид квалификации ч. сушили над P2O5 и очищали перегонкой в вакууме, Ткип = 165 и 153°С соответственно. Уксусный ангидрид, диэтиловый эфир применяли без дополнительной очистки.
Синтез звездообразного олигомера ТАФБ–АФФК-10
Синтез звездообразного олигомера ТАФБ–АФФК-10 при мольном соотношении ТАФБ : АФФК = 1 : 10 осуществляли следующим образом. В трехгорлую колбу емкостью 50 мл, снабженную мешалкой и трубкой для подачи аргона, загружали 28 г бензойной кислоты, 0.32 г (1 ммоль) ТАФБ и нагревали до 140°C. В смесь ТАФБ и бензойной кислоты в течение 30 мин при перемешивании вводили 2.73 г (10 ммоль) твердой АФФК. Смесь перемешивали еще 90 мин, продувая сильным током аргона. Затем горячую смесь выливали в керамическую чашку, охлаждали, после чего затвердевшую реакционную массу измельчали и многократно промывали эфиром до полного удаления бензойной кислоты. Выход продукта составил 85%. Аналогично синтезировали олигомер при мольном соотношении ТАФБ : АФФК = 1 : 20 (ТАФБ–АФФК-20), а также модельное соединение ТАФБ–АФФК-4 при мольном соотношении ТАФБ : АФФК = 1 : 4.
Синтез звездообразного олигоимида ТАФБ–АФФК-10 с концевыми ацетамидными группами
Продукт поликонденсации ТАФБ–АФФК-10 в количестве 1.0 г (0.37 ммоля) при 25°С растворяли в 4 мл ДМАА и к раствору при перемешивании по каплям вводили 1.5 мл уксусного ангидрида (15.0 ммоль). Перемешивание продолжали в течение 30 мин при 25°С. Реакционный раствор выливали в дистиллированную воду. Выпавший порошкообразный продукт отфильтровывали, несколько раз промывали водой и сушили в вакууме при 60°С. Модельные соединения ацилированные ТАФБ и ТАФБ–АФФК-4 получали аналогично обработкой уксусным ангидридом мономера ТАФБ и продукта конденсации ТАФБ–АФФК-4 соответственно.
Методы исследования
ИК-спектры регистрировали на ИК-фурье-спектрометре “Bruker”, модель “Equinox 55/S” в диапазоне 4000–400 см–1. Образцы готовили в виде таблеток с CsI (содержание исследуемого вещества составляло 1%). Спектры ЯМР 1Н регистрировали на приборе “Bruker AМ-300” на частотах 300.13 МГц. Химические сдвиги приведены относительно SiMe4. Термограммы ДСК в диапазоне 20–400°С записывали на приборе “DSC-500” (Россия) при скорости нагревания 16 град/мин. Измерения ГПХ проводили на приборе “Stayer” с колонками “Phenogel” (5000–70 000) с использованием ДМФА в качестве элюента, при 60°С и скорости потока 1 мл/мин. В качестве эталона применяли полистирольные стандарты с М = = (0.2–7.0) × 104. Обработку первичных данных проводили при помощи программного обеспечения “МультиХром Версия 1,5Х”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Использованный в настоящей работе основной исходный мономер – 4-(3-аминофенокси)фталевая кислота (мономер AB) в твердом состоянии представляет собой кристаллическое вещество, находящееся в нереакционноспособной цвиттерионной форме [22], в которой фталевый фрагмент существует в виде фталат-иона, а аминогруппа – ариламмониевого иона. При растворении АФФК в “активном” растворителе – расплавленной бензойной кислоте при 140°С – создаются условия, при которых АФФК переходит в форму аминодикарбоновой кислоты. Фрагмент фталевой кислоты может далее дегидратироваться с образованием фрагмента фталевого ангидрида, который вступает в автополиконденсацию по реакции ацилирования аминогруппы [23]. Технологически реакция имидизации протекает одновременно с поликонденсацией. Интересной общей особенностью синтеза полиимидов в расплаве бензойной кислоты, установленной ранее, в отличие от синтеза в других высококипящих растворителях при 140–160°С является необратимость роста цепи, что позволяет при синтезе сополиимидов получать как статистические, так и блок-сополимеры [24, 25], изменяя лишь характер введения интермономера. Синтез в расплаве бензойной кислоты также успешно был применен для синтеза сверхразветвленных полиимидов по схеме В3(B4) +А2 [21, 26, 27].
В настоящей работе для получения олигоимидных звезд в качестве центрального разветвляющего агента был выбран тетрафункциональный амин (I), на основе которого ранее получен сверхразветвленный полиимид [21]:
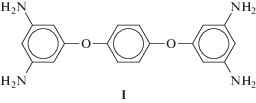
В отличие от орто-замещенных ароматических тетрааминов – исходных мономеров для синтеза полибензимидазолов – все аминогруппы в молекуле I отделены друг от друга; это предполагает отсутствие большого различия в их реакционной способности, что весьма важно для целей получения симметричных полиимидных звезд.
Четырехлучевые олигоимидные звезды были синтезированы в рамках подхода В4+АВ (схема 1). Методическое отличие настоящей работы от работы [20], в которой получали гомополиимид на основе АФФК, заключается в том, что, во-первых, синтез осуществляется в расплаве бензойной кислоты в присутствии добавки ароматического четырехфункционального амина, а во-вторых, АФФК вводится в расплав бензойной кислоты, содержащий ТАФБ, постепенно в течение 30 мин:
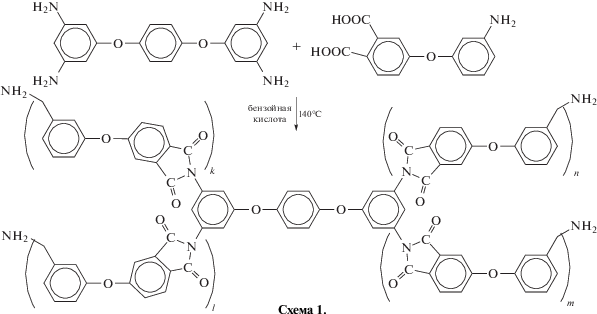
Реакция протекает в гомогенной среде; продукты синтеза выделены в виде порошков бежевого цвета, растворимых в амидных растворителях, ДМСО и хлороформе. Полученные олигомеры являются аморфными веществами с температурой стеклования в области 180°С (рис. 1, термограмма 1). На рис. 2а (спектр 1) приведен ИК-спектр олигоимида, полученного при мольном соотношении исходных реагентов ТАФБ : АФФК = 1 : 10 (ТАФБ–АФФК-10). В ИК-спектре присутствуют типичные полосы поглощения в области 1720 и 1780 см–1 (асимметричные и симметричные колебания С=О в имидном цикле), 3500 и 3400 см–1 (валентные колебания N–H аминогруппы).
Рис. 1.
Термограммы продукта поликонденсации ТАФБ и 3-АФФК в бензойной кислоте до (1) и после обработки уксусным ангидридом (2).
Рис. 2.
Спектры ИК (а) и ЯМР 1Н (б) олигомера ТАФБ–АФФК-10 (1) и его модифицированного уксусным ангидридом аналога (2).
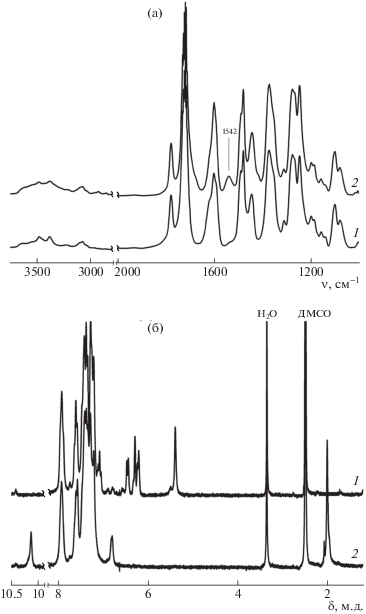
Сигнал 5.38 м.д. в спектре ЯМР 1Н ТАФБ–АФФК-10 соответствует протонам аминогрупп, сигналы 6.2–6.5 и 7.2–7.9 м.д. – ароматическим протонам концевых и внутрицепных фрагментов соответственно (рис. 2б, кривая 1). Для подтверждения структуры олигомеров был проведен анализ спектров ИК и ЯМР 1Н их производных, полученных обработкой уксусным ангидридом (ацилированный ТАФБ–АФФК-10). В ИК-спектре ацилированного олигомера (рис. 2а, спектр 2) существенно понижается интенсивность поглощения в области 3500–3400 см–1, а также появляется полоса поглощения в области 1542 см–1 (амид II, деформационные колебания N–H ацетамидного фрагмента). В спектре ЯМР 1Н ацилированного ТАФБ–АФФК-10, по сравнению со спектром исходного соединения (рис. 2б), исчезает сигнал протона аминогруппы при 5.38 м.д.; в области слабых полей появляется сигнал протона амидной группы (10.1 м.д.), а также сигнал протонов метильной группы ацетамидного фрагмента в области 2.0 м.д.
На рис. 3 приведены спектры ЯМР 1Н двух модельных соединений: ацилированный ТАФБ – соединение получено обработкой уксусным ангидридом тетраамина ТАФБ (рис. 3, спектр 1); aцилированный ТАФБ–АФФК-4 – соединение получено обработкой продукта ТАФБ-АФФК-4 (рис. 3, спектр 2). В спектре ацилированного ТАФБ наблюдается только один сигнал протона N–H амидной группы при 10.0 м.д., в спектре ацилированного ТАФБ–АФФК-4 – три сигнала при 10.0, 10.1 и 10.2 м.д., отнесенных к протонам ацетамидных групп структур а, б, в соответственно (схема 2, концевые фрагменты ацилированного ТАФБ–АФФК-4):
Рис. 3.
Спектры ЯМР 1Н модельных соединений ацилированных ТАФБ (1), ТАФБ–АФФК-4 (2) и олигоимида ацилированного ТАФБ–АФФК-10 (3).
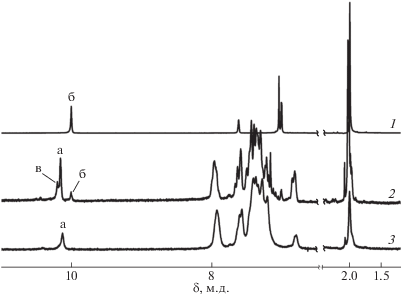
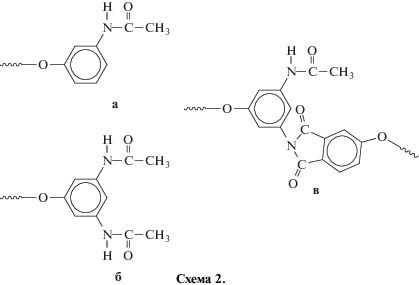
При этом структура части (в) относится к фрагменту ТАФБ, у которого присоединение звена мономера АФФК прошло только по одной из двух соседних аминогрупп, находящихся в мета-положении друг к другу; структура части (б) относится к фрагменту ТАФБ, в котором присоединение не прошло по обеим соседним группам; структура части (а) относится к концевому фрагменту луча АФФК.
Из сравнения спектров ЯМР 1Н ацильных производных ТАФБ–АФФК-10 (рис. 2б, спектр 3), и спектров модельных соединений aцилированных ТАФБ–АФФК и ТАФБ–АФФК-4 (рис. 3, спектры 1 и 2) видно, что в первом случае отсутствует сигнал при 10.0 м.д. Это позволяет сделать вывод о том, что при мольном соотношении ТАФБ : : АФФК = 1 : 10 присоединение АФФК прошло по всем четырем аминогрупам ТАФБ и, таким образом, из каждой молекулы ТАФБ образовалась звезда с четырьмя лучами.
Интегрирование сигналов показало, что отношение интенсивности сигналов ароматических протонов и протонов ацетамидной группы превышает расчетное отношение для предполагаемой структуры звездообразного олигомера. Спектр ЯМР 1Н ацилированного олигоимида ТАФБ–АФФК-10 (рис. 2б, спектр 2) подтверждает, что аминогруппы являются реакционноспособными, а структура полученного продукта соответствует звездообразному четырехлучевому олигоимиду.
Ацилирование концевых аминогрупп приводит к небольшому возрастанию температуры стеклования (Tg) по сравнению с Tg исходного звездообразного олигоимида 187°С (рис. 1, термограмма 2).
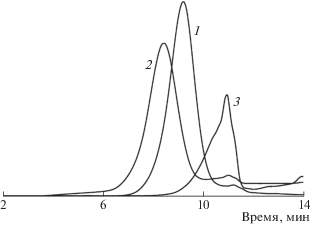
Ацилированные олигомеры с мольным отношением ТАФБ : АФФК равным 1 : 10 и 1 : 20 исследованы методом ГПХ. По данным ГПХ (рис. 4, таблица 1) можно сделать вывод, что полученные олигомеры обладают необычно узким для поликоденсационных продуктов ММР. С уменьшением соотношения ТАФБ : АФФК значения Мw и Mn конечных продуктов возрастают. На хроматограммах ГПХ олигомеров кроме максимума в высокомолекулярной области имеется максимум в более низкомолекулярной области, не меняющий своего положения при варьировании исходного соотношения мономеров. Вероятно, наряду с формированием звездообразного олигомера идет частичная автополиконденсация АФФК с формированием небольшого количества макроциклических олигомеров. На рис. 4 также приведена хроматограмма низкомолекулярного гомоолигоимида АФФК, полученного в отдельном опыте, максимум которой совпадает с максимумом хроматограмм продуктов поликонденсации АФФК в присутствии ТАФБ в низкомолекулярной области. По результатам исследований можно сделать вывод, что мономер АВ в основном расходуется на образование звездообразного четырехлучевого олигомера с узким ММР, средняя длина лучей которого задается исходным соотношением мономеров.
Рис. 4.
Кривые ГПХ ацилированных олигомеров ТАФБ–АФФК, полученных при исходном мольном соотношении 1 : 10 (1), 1 : 20 (2) и гомоолигоимида АФФК (3).
Таким образом, метод высокотемпературной поликонденсации в расплаве бензойной кислоты является удобным и быстрым способом получения олигомеров звездообразной имидсодержащей структуры с концевыми реакционными группами. Данные олигоимиды имеют узкое ММР и растворимы в органических растворителях. Они являются структурным элементом для высокомолекулярных соединений различной архитектуры: сверхразветвленные и сшитые полимеры, блоксополимеры.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 16-03-01119А).
Список литературы
Gao H. // Macromol. Rapid Commun. 2012. V. 33. P. 722.
Hadjichristidis N., Pitsikalis M., Iatrou H., Driva P., Sakellariou G., Chatzichristidi M. // Polymer with Star-Related Structure in Polymer Science: a Comprehensive Reference. Amsterdam: Elsevier, 2012. V. 6. P. 29.
Ren J.M., McKenzie T.G., Fu Q., Wong E. H.H., Xu J., An Z., Shanmugam S., Davis T.P., Boyer C., Qiao G.G. // Chem. Rev. 2016. V. 116. P. 6743.
Voit B.I., Lederer A. // Chem. Rev. 2009. V. 109. P. 5924.
Frechet J.M.J., Tomalia D.A. // Dendrimers and other Dendritic Polymers, New York: Wiley, 2001.
Sugi R., Hitaka Y., Yokoyama A., Yokozawa T. // Macromolecules. 2005. V. 38. P. 5526.
Yokoyama A., Yokozawa T. // Macromolecules. 2007. V. 40. P. 4093.
Shibasaki Y., Araki T., Nagahata R., Ueda M. // Eur. Polym. J. 2005. V. 41. P. 2428.
Kovalev A.I., Takeuchi K., Barzykin A.V., Asai M., Ueda M., Rusanov A.L. // Macromol. Chem. Phys. 2005. V. 206. P. 2112.
Yokozawa T., Yokoyama A. // Prog. Polym. Sci. 2007. V. 32. P. 147.
Yokozawa T., Yokoyama A. // Polym J. 2004. V. 36. P. 65.
Ohta Y., Kamijyo Y., Fujii S., Yokoyama A., Yokozawa T. // Macromolecules. 2011. V. 44. P. 5112.
Ohishi T., Masukawa T., Fujii S., Yokoyama A., Yokozawa T. // Macromolecules. 2010. V. 43. P. 3206.
Yamazaki Y., Ajioka N., Yokoyama A., Yokozawa T. // Macromolecules. 2009. V. 42. P. 606.
Kricheldorf H.R. // Macromol. Rapid Commun. 2007. V. 28. P. 1839.
Litvinenko G.I., Muller A.H.E. // Macromolecules. 2002. V. 35. P. 4577.
Hanselmann R., Ho1lter D., Frey H. // Macromolecules. 1998. V. 31. P. 3790.
Bharathi P., Moore J.S. // Macromolecules. 2000. V. 33. P. 3212.
Sunder A., Hanselmann R., Frey H., Mullhaupt R. // Macromolecules. 1999. V. 32. P. 4240.
Buzin P.V., Yablokova M.Yu., Kuznetsov A.A., Smir-nov A.V., Abramov I.G. // High Perform. Polym. 2004. V. 16. P. 505.
Tsegelskaya A.Yu., Dutov M.D., Serushkina O.V., Semenova G.K., Kuznetsov A.A. // Macromol. Symp. 2017. V. 375. № 1. P. 1600202.
Носова Г.И., Котон М.М., Михайлова Н.В., Любимова Г.В., Денисов В.М. // Изв. АН СССР. 1987. № 8. С. 1810.
Лавров С.В., Кузнецов А.А., Берендяев В.И., Котов Б.В., Котина Н.Б., Якушкина В.В., Цегельская А.Ю. Пат. 1809612 Россия. 1996.
Kuznetsov A.A., Tsegelskaya A.Yu., Buzin P.V., Yablokova M.Yu., Semenova G.K. // High Perform. Polym. 2007. V. 19. P. 711.
Batuashvili M.R., Tsegelskaya A.Yu., Kuznetsov A.A., Kaminskii V.A. // Russ. Chem. Bull. 2014. V. 63. № 12. P. 2711.
Kuznetsov A.A., Akimenko S.N., Tzegelskaya A.Y., Perov N.S., Semenova G.K., Shakhnes A.K., Sheve-lev S.A. // Polymer Science B. 2014. V. 56. № 1. P. 41.
Chukova S.N., Perov N.S., Kuznetsov A.A., Shakhnes A.K., Krasovskii V.G., Shevelev S.A. // Russ. Chem. Bull. 2015. V. 64. № 2. P. 473.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


