Высокомолекулярные соединения (серия Б), 2019, T. 61, № 4, стр. 261-271
БИОРАЗЛАГАЕМЫЕ ПЛЕНКИ НА ОСНОВЕ ОКИСЛЕННОЙ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ: ПОЛУЧЕНИЕ, СТРУКТУРА, СВОЙСТВА
П. М. Бычковский a, b, Т. Л. Юркштович b, Н. В. Голуб a, b, С. О. Соломевич a, b, *, Н. К. Юркштович b, Д. А. Адамчик b
a Учебно-научно-производственное республиканское унитарное предприятие “УНИТЕХПРОМ БГУ”
220045 Минск, ул. Курчатова, 1, Беларусь
b Научно-исследовательский институт физико-химических проблем Белорусского государственного университета
220050 Минск, ул. Ленинградская, 14, Беларусь
* E-mail: sergeysolomevich@gmail.com
Поступила в редакцию 05.01.2019
После доработки 15.03.2019
Принята к публикации 29.03.2019
Аннотация
Проведено сравнительное изучение реакционной способности целлюлозы, отличающейся надмолекулярной структурой (бактериальная, регенерированная и хлопковая целлюлоза), в реакции окисления растворами оксида азота (IV) в хлороформе. Методами ИК-спектроскопии, элементного анализа, титриметрии, рентгенографии, электронной микроскопии изучено влияние концентрации окислителя (10–40%) и продолжительности реакции на состав модифицированной целлюлозы, степень набухания, морфологические особенности волокнистой сетки пленок, скорость деградации в условиях in vitro. Оптимизированы условия получения гель-пленок окисленной бактериальной целлюлозы с содержанием карбоксильных групп в интервале 1.6–25.6% и степенью водопоглощения 160–6340%. Установлено, что по мере роста содержания карбоксильных групп гидролитическая устойчивость окисленной бактериальной целлюлозы резко падает: гель-пленки с содержанием карбоксильных групп в интервале 13.5–24.8% деградируют в течение трех суток.
ВВЕДЕНИЕ
Технология получения нового поколения раневых покрытий, пригодных для ускоренного лечения сложных ран и устойчивых раневых инфекций в регенеративной медицине и в онкологии, является важным научным направлением [1, 2]. Используемые с этой целью современные полимерные материалы по своей структуре и свойствам существенно отличаются от ранее применяемых волокнообразующих полимеров [3–5]. Известно, что наибольшему количеству характеристик идеального раневого покрытия удовлетворяют нетканые материалы на основе биосовместимых полимеров природного происхождения, в том числе, на основе коллагена, рекомбинантных белков паутины, бактериальной целлюлозы, хитозана, пектинов и других [6–8].
Бактериальная целлюлоза обладает трехмерной нанофибриллярной структурой, которая придает ей комплекс свойств, необходимых для применения в медицине и биологии: высокую водоудерживающую способность, механическую прочность, способность регулировать функциональное состояние клеток, управлять процессами восстановления живых тканей [9–12]. Кроме того, характерными особенностями бактериальной целлюлозы являются химическая чистота, гибкость, возможность формирования гель-пленок любой формы и размера, атравматичность при удалении из раны [13]. Все указанные свойства бактериальной целлюлозы позволяют рассматривать ее как один из наиболее перспективных материалов для раневых покрытий нового поколения, временного заменителя кожи при лечении ран и ожогов, матриц для пролонгированной и адресной доставки лекарственных веществ [14–16].
Бактериальная целлюлоза так же, как и растительная целлюлоза, не является биодеградируемым материалом, имеет достаточно низкую сорбционную способность по отношению к биологически активным веществам, реализуемую, в основном, за счет слабых водородных связей с гидроксильными группами, что существенно ограничивает использование бактериальной целлюлозы в медицине. Для устранения отмеченных недостатков бактериальную целлюлозу подвергают химическому модифицированию с целью введения в ее состав функциональных групп, присутствие которых позволяет регулировать такие свойства материалов на основе бактериальной целлюлозы, как скорость биодеградации, сорбционная емкость, скорость высвобождения лекарственного средства [17–19].
Одним из наиболее эффективных способов придания целлюлозе способности к биодеградации, увеличения сорбционной емкости по отношению к биологически активным веществам является ее окисление. В литературе приведены результаты исследований влияния условий окисления бактериальной целлюлозы периодатом натрия [20], гипохлоритом натрия с использованием ТЕМРО [21], а также оксидом азота (IV) [22] на функциональный состав и скорость биодеградации образцов.
Цель данной работы состояла в определении влияния предварительной подготовки бактериальной целлюлозы к окислению в системе оксид азота(IV)–трихлорметан на функциональный состав, структуру и свойства окисленных образцов, их устойчивость к действию фосфатного буферного раствора с рН 7.4.
Среди известных окислителей целлюлозы наибольший интерес представляют растворы оксида азота (IV) в индифферентных растворителях [8], поскольку при их использовании первичные гидроксильные группы глюкопиранозного цикла целлюлозы преимущественно окисляются до карбоксильных (более 80%) и сохраняется физическая форма целлюлозного материала. Сведения о влиянии условий окисления БЦ в таких системах на морфологию поверхности, свойства продуктов реакции, скорость деградации в литературе отсутствуют.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения пленок на основе окисленной бактериальной целлюлозы в работе использовали бактериальную целлюлозу, продуцируемую культурой Acetobacter xylinum (предоставлена Институтом высокомолекулярных соединений РАН, Санкт-Петербург).
Предварительной стадией окисления бактериальной целлюлозы являлась дегидратация, которую осуществляли тремя способами: отжимом между плотно прилегающими резиновыми валиками, инклюдированием и лиофильным высушиванием.
При иинклюдировании 500 г бактериальной целлюлозы (содержащей 84.5 г воды в 1 г бактериальной целлюлозы) извлекали из воды (хранение), отжимали между двумя валиками до степени дегидратации 40% и помещали в 500 мл ацетона на 24 ч. Затем образец извлекали из емкости с ацетоном и дважды обрабатывали циклогексаном. Время каждой обработки в циклогексане составляло 24 ч, объем растворителя при первой и второй обработке 250 мл.
Карбоксилсодержащую бактериальную целлюлозу получали окислением бактериальной целлюлозы в виде высушенных пленок или гель-пленок 5–40% растворами оксида азота (IV) в трихлорметане при модуле ванны (объем раствора на единицу массы частично дегидратированной бактериальной целлюлозы, мл/г) 10 : 1. Процесс проводили при 289 ± 1 К в течение различного времени (до 72 ч). Сорбированный в процессе реакции оксид азота (IV) и CНCl3 частично удаляли вентилированием на воздухе в течение 20–30 мин. Образцы промывали 3–5 раз дистиллированной водой, помещали в 2 моль/л раствор хлорида натрия (жидкостной модуль ванны 4 : 1) и выдерживали в течение 2 ч. Раствор электролита сливали, и образцы повторно промывали водой (3 раза), помещали в раствор 1% раствора глицерина (жидкостной модуль ванны 5 : 1) на 12 ч и лиофильно высушивали.
Содержание карбоксильных групп в образцах окисленной бактериальной целлюлозы находили барийацетатным методом [20], а содержание азота – методом Кьельдаля [23].
ИК-спектры лиофильно высушенных пленок окисленной бактериальной целлюлозы записывали при комнатной температуре на инфракрасном спектрофотометре “Thermo Nicolet FT-IR Nexus”. Препарирование образцов осуществляли прямым прессованием с бромидом калия.
Структуру высушенных образцов окисленной бактериальной целлюлозы изучали рентгенодифракционным методом (дифрактометр ДРОН-3 в монохроматизированном CuKα-излучении, Ni-фильтр, HZGb-4A).
Морфологию поверхности высушенной окисленной бактериальной целлюлозы исследовали методом сканирующей электронной микроскопии с напылением золотом (электронный микроскоп LEO 1420).
Для определения водопоглощения образцы на сутки погружали в деионизированную воду (Т = = 25°С). После удаления капель воды образцы взвешивали, отжимали между листами фильтровальной бумаги, высушивали в течение суток в вакуумном шкафу при температуре 50°С в присутствии оксида фосфора (V), остаточном давлении 0.1 атм и вновь взвешивали. Водопоглощение (г/г) пленок рассчитывали по формуле
где m и mс – масса насыщенного водой и обезвоженного образцов соответственно.Степень набухания бактериальной целлюлозы и окисленной бактериальной целлюлозы определяли гравиметрически в соответствии с работой [24]. Для оценки степени набухания образцы отделяли от избытка воды центрифугированием на стеклянном фильтре с размером пор 100 мкм при центробежном ускорении 2400 г.
Степень деградации пленок окисленной бактериальной целлюлозы в условиях in vitro находили по потере массы в фосфатном буферном растворе [25]. Для этого 0.5 г лиофильно высушенной пленки (точная навеска в пересчете на 100% вещество) помещали в 50 мл буферного раствора при рН 7.4 и температуре 37 ± 0.5°С. После инкубации в буферном растворе в течение определенного времени образцы количественно отделяли от раствора на стеклянном фильтре (размер пор 100 мкм), промывали водой для удаления фосфатов натрия и калия, сушили при температуре 50°С под вакуумом. Потерю массы образца Δm, % определяли по формуле [26]
Здесь mисх и m – массы сухих образцов до и после нахождения в буферном растворе.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В растворе оксида азота (IV) в трихлорметане оксиметильные группы целлюлозы окисляются до карбоксильных:
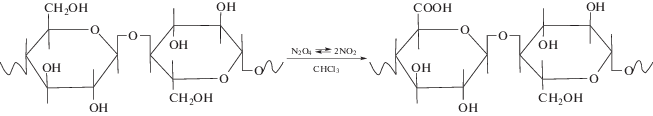
Степень окисления зависит от концентрации окислителя, объема окисляющего раствора, соотношения окислитель: целлюлоза, типа используемого растворителя, а также условий реакции (температуры и продолжительности). Помимо указанных факторов, на скорость и степень окисления целлюлозы влияет ее происхождение, которое, в свою очередь, определяет ее структурные особенности [27].
В отличие от растительной целлюлозы, бактериальная целлюлоза обладает ультратонкой наносетчатой структурой, большой удельной площадью поверхности. Необходимым условием сохранения пористой структуры бактериальной целлюлозы является нахождение ее в воде или водных растворах электролитов. Сушка бактериальной целлюлозы на воздухе при комнатной или повышенной температуре, в вакууме над оксидом фосфора (V) или методом лиофильного высушивания сопровождается коллапсом, что выражается в усадке материала (вплоть до 80% по объему). Высушенные образцы бактериальной целлюлозы характеризуются низкими значениями водопоглощающей способности (~2.9 г/г), жесткостью, что препятствует их использованию в медицинских целях. Между тем, присутствие воды в системе оксид азота (IV)–трихлорметан приводит к дополнительному расходу окислителя на побочную реакцию:
Из описанного выше следует, что введение карбоксильных групп в состав бактериальной целлюлозы при условии максимального сохранения ее пористой структуры представляет собой сложную задачу и для ее решения необходимо оптимизировать не только параметры процесса окисления, но стадии предварительной дегидратации бактериальной целлюлозы, отмывки и сушки продуктов реакции.
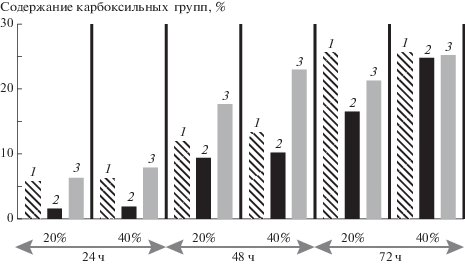
На рис. 1 сопоставлены кинетические кривые окисления 10–40% растворами оксида азота (IV) в хлороформе предварительно дегидратированной бактериальной целлюлозы, регенерированной целлюлозы и хлопковой целлюлозы. Видно, что для всех целлюлоз скорость окисления увеличивается по мере роста концентрации оксида азота (IV) в растворе. Диапазон концентраций, в котором скорость окисления в наибольшей степени зависит от концентрации окислителя, для бактериальной целлюлозы при разных условиях предварительной обработки находится в пределах 10–20%, для хлопковых волокон он гораздо шире – 10–40%. При этом кинетические кривые для бактериальной и хлопковой целлюлозы, относящиеся к концентрации окислителя 10%, практически идентичны. Следовательно, в таких условиях реакционная способность бактериальной целлюлозы сравнима с реакционной способностью хлопковой целлюлозы и определяется особенностями надмолекулярной структуры целлюлозы (степень кристалличности у бактериальной целлюлозы и хлопковых волокон достаточно высокая и составляет 84 и 70% соответственно).
Рис. 1.
Зависимость содержания карбоксильных групп в бактериальной (1, 2, 8), хлопковой (3, 5, 7) и регенерированной (4, 6) целлюлозе от времени окисления. Концентрация раствора N2O4–CHCl3 40 (1, 3), 20 (2, 4, 5) и 10% (6, 7, 8). Образцы бактериальной целлюлозы предварительно дегидратированы путем лиофильного высушивания.

На рис. 1 видно, что кинетические кривые для регенерированной и хлопковой целлюлозы состоят из двух участков: один описывает быстрый рост степени окисления со временем (2–24 ч), второй (24–72 ч) – низкую скорость окисления (изменение содержания карбоксильных групп составляет ~3%), что свидетельствует о разной доступности волокон растительной целлюлозы по отношению к окислителю. В отличие от этого, для бактериальной целлюлозы скорость реакции окисления при использовании 20–40% растворов оксида азота (IV) остается практически постоянной вплоть до 72 ч, что позволяет достичь максимально возможной степени окисления (содержание карбоксильных групп CCOOH 25.6%; степень замещения 1.0). Различный вид кинетических кривых окисления бактериальной целлюлозы и растительной целлюлозы говорит о том, что в состав бактериальной целлюлозы входят однородные ассоциаты, обладающие практически одинаковой доступностью по отношению к оксиду азота (IV), что может являться следствием большей доступности кристаллитов бактериальной целлюлозы по отношению к оксиду азота (IV).
На рис. 2 видно, что скорость предварительно дегидратированных путем лиофилизации и инклюдирования образцов бактериальной целлюлозы в начале реакции (до 24 ч) выше, чем у образцов, дегидратированных путем отжима. Это свидетельствует о присутствии в последнем случае большего количества влаги и дополнительном расходе окислителя на побочную реакцию.
Рис. 2.
Влияние условий дегидратации бактериальной целлюлозы перед окислением на изменение содержания карбоксильных групп. Образцы получены при дегидратации исходной гель-пленки методами инклюдирования (1), отжима (2) и лифильного высушивания (3).
Наличие карбоксильных групп в составе бактериальной, регенерированной и хлопковой целлюлоз после воздействия на них 10–40% растворов оксида азота (IV) в трихлорметане подтверждается данными химического анализа и ИК-спектроскопии. В ИК-спектрах всех модифицированных образцов присутствует интенсивная полоса поглощения вблизи 1710 см–1, обусловленная асимметричными валентными колебаниями связей С=О карбоксильных групп (рис. 3).
Рис. 3.
ИК-спектры образцов исходной (1) и окисленной бактериальной целлюлозы (2, 3) с содержанием карбоксильных групп 14.3 (2) и 23.0% (3).

Таким образом, отличительной особенностью окисления бактериальной целлюлозы в системе N2O4 по сравнению с окислением регенерированной и хлопковой целлюлозы является широкий диапазон изменения содержания в образцах карбоксильных групп и достижение в конечном итоге максимально возможной степени замещения при сравнительно “мягких” условиях проведения процесса: невысокая концентрация окислителя (раствор 20%).
Различие в доступности нановолокон бактериальной целлюлозы для окислителя на разных стадиях окисления было оценено с помощью рентгенодифрактометрии. На рис. 4 видно, что кристаллическая решетка целлюлозы (кривая 1) сохраняется для окисленной бактериальной целлюлозы, полученной воздействием 10%-ных растворов оксида азота, причем изменения степени кристалличности по сравнению с исходным полисахаридом не происходит. Эти данные свидетельствуют о том, что карбоксильные группы находятся преимущественно на поверхности нановолокон и не нарушают их надмолекулярную структуру.
Рис. 4.
Рентгенограммы исходной (1) и окисленной в системе N2O4–CHCl3 бактериальной целлюлозы (2, 3). Содержание карбоксильных групп 4.6 и 23.0% (2, 3); условия получения: раствор 10 и 20% соответственно.
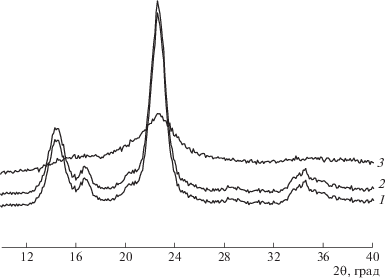
При окислении бактериальной целлюлозы 20–40% раствором N2O4 наблюдается четко выраженный внутрикристаллитный характер взаимодействия молекул оксида азота (IV) с макромолекулами полисахарида, который вызывает аморфизацию образцов.
Аналогичное влияние концентрации растворов оксида азота (IV) на надмолекулярную структуру окисленной целлюлозы характерно и для хлопковых волокон [27].
Одним из известных методов оценки изменения межмолекулярных взаимодействий в результате окисления целлюлозы раствором оксида азота в трихлорметане является определение степени набухания окисленных образцов. Сравнительные результаты влияния условий окисления на степень набухания целлюлозы различного происхождения представлены в табл. 1.
Таблица 1.
Влияние условий реакции окисления на свойства окисленной целлюлозы
| Полисахарид | Условия окисления | Содержание | Водопог-лощение, % | Степень набу-хания, % | |||
|---|---|---|---|---|---|---|---|
| Способ/степень дегидратации | Концен-трация оксида азота(IV), % | Обра-ботка | карбок-сильных групп, % | нитро-эфирных групп, % | |||
| Окисленная бактериальная целлюлоза | Инклюдирование | 5 | 2н NaCl | 3.6 | 0.47 | 4330 | 1515 |
| 5 | – | 3.6 | 0.47 | 160 | 160 | ||
| Инклюдирование | 10 | 2н NaCl | 5.2 | 0.61 | 4430 | 1450 | |
| 10 | – | 5.2 | 0.61 | 230 | 176 | ||
| Инклюдирование | 20 | 2н NaCl | 1.6 | 0.22 | 6340 | 1370 | |
| 20 | 2н NaCl | 23.0 | 0.21 | 6300 | 1260 | ||
| Отжим/0.8 | 20 | 2н NaCl | 9.4 | 0.15 | 1650 | 590 | |
| 20 | 2н NaCl | 16.5 | 0.19 | 1030 | 750 | ||
| Инклюдирование | 40 | 2н NaCl | 17.7 | 0.21 | 3900 | 1290 | |
| 40 | 2н NaCl | 21.3 | 0.20 | 3780 | 1210 | ||
| Отжим/0.6 | 40 | 2н NaCl | 1.4 | 0.18 | 1260 | 599 | |
| 40 | 2н NaC | 4.1 | 0.19 | 2400 | 1460 | ||
| 40 | 2н NaCl | 24.8 | 0.21 | 2580 | 1860 | ||
| Окисленная регенерированная целлюлоза | – | 20 | – | 9.0 | 0.30 | – | 145 |
| – | 20 | – | 10.8 | 0.28 | – | 178 | |
| Окисленная хлопковая целлюлоза | – | 10 | – | 5.4 | 0.23 | – | 26 |
| – | 20 | – | 9.0 | 0.21 | – | 39 | |
| – | 20 | – | 10.8 | 0.23 | – | 47 | |
Видно, что по мере увеличения количества карбоксильных групп в составе окисленной регенерированной и хлопковой целлюлозы, а также при повышении концентрации оксида азота (IV) в системе окисления степень набухания целлюлозы возрастает. Полученные результаты находятся в соответствии с существующими теоретическими представлениями и свидетельствуют о том, что основными факторами, определяющими степень набухания катионитов на основе растительной целлюлозы, являются содержание ионогенных групп и степень структурной упорядоченности.
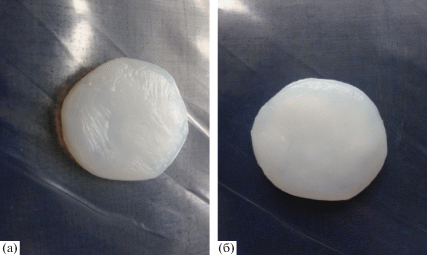
Напротив, степень набухания пленок окисленной бактериальной целлюлозы уменьшается как по мере роста содержания карбоксильных групп, так и при понижении степени кристалличности. Можно предположить, что процесс окисления в системе оксид азота (IV)–трихлорметан сопровождается уплотнением волокнистой сетки бактериальной целлюлозы. Однако, если перед окислением провести дегидратацию бактериальной целлюлозы путем инклюдирования, а после окисления дополнительно обработать ее растворами электролита и глицерина, происходит разрыхление системы межмолекулярных связей, и водопоглощение пленок увеличивается до 63.4 г на 1 г окисленной бактериальной целлюлозы (табл. 1; рис. 5). Таким образом, варьирование способов дегидратации бактериальной целлюлозы и дополнительной обработки окисленной бактериальной целлюлозы в процессе отмывания позволяет в широких пределах изменять степень набухания и степень водопоглощения пленок, которые могут быть использованы в качестве носителей лекарственных веществ.
Рис. 5.
Фотографии образцов влажной невысушенной бактериальной целлюлозы (а) и окисленной бактериальной целлюлозы с содержанием карбоксильных групп 7.0% после набухания в воде (б).
Изменение структуры бактериальной целлюлозы, которое определяется главным образом условиями реакции окисления, приводит к значительному изменению морфологии поверхности окисленных образцов (рис. 6). На микрофотографиях видно, что поверхность нативной бактериальной целлюлозы представляет собой сетчатую структуру со случайно связанными нановолокнами, которые практически одинаковы по диаметру. Согласно данным работы [19], диаметр каждого волокна приблизительно 100 нм, а размер пор находится в диапазоне 10–500 нм.
Рис. 6.
Микрофотографии образцов исходной бактериальной целлюлозы (а) и окисленной бактериальной целлюлозы (б–г). Содержание карбоксильных групп в окисленной бактериальной целлюлозе 7.0 (б), 11.0 (в) и 25.2% (г). Концентрация раствора окислителя при приготовлении окисленной бактериальной целлюлозы 10 (б), 20 (в) и 40% (г).

В результате воздействия на бактериальную целлюлозу 10 или 20% растворов окислителя волокнистая структура поверхности окисленной бактериальной целлюлозы (CСООН 0.5–24.5%, степень замещения 0.02–0.95) становится менее отчетливой: происходит агромерация наноразмерных волокон в более крупные волокна, волокнистая сетка постепенно становится более плотной, превращаясь в пластины разного размера неправильной формы, соединенные между собой рыхлой сеткой агломерированных волокон. По краям пластин видны фрагменты разорванных нановолокон. Нарушение целостности полимерной пленки сопровождается увеличением размеров межслойного пространства, а также частичным отслаиванием отдельных слоев. Можно предположить, что повышенная поверхностная плотность заряда карбоксилсодержащих волокон уменьшает сцепление слоев окисленной бактериальной целлюлозы друг с другом.
Отличительной особенностью пленок окисленной бактериальной целлюлозы (CСООН 16.2–25.2%, степень замещения 0.61–1.0), окисленных в 40% растворе N2O4, является дальнейшее дезинтегрирование поверхности, которое приводит к образованию чешуек эллипсообразной формы и практически одинакового размера. Каждая чешуйка представляет собой наночастицу с толщиной до 100 нм и диаметром в диапазоне 1–3 мкм. Анализ полученных фотографий свидетельствует о самосборке чешуек и образовании ими отдельных чешуйчатых лент.
Экспериментальные данные, представленные в табл. 2, свидетельствуют о том, что скорость деградации образцов окисленной бактериальной целлюлозы в фосфатном буферном растворе увеличивается по мере роста степени окисления. В зависимости от скорости деградации пленки окисленной бактериальной целлюлозы можно разделить на две группы.
Таблица 2.
Потеря массы пленок окисленной бактериальной целлюлозы с разной степенью окисления после гидролиза в фосфатном буферном растворе
| Концентрация окислителя, % | ССООН, % | Водопогло-щение, % | Δm, % | ||||
|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | |||
| – | – | 0 | 0 | 0 | 0.5 | 5.7 | |
| 5 | 1.6 | 4330 | – | – | 51.9 | 52.2 | 53.2 |
| 10 | 5.2 | 4430 | – | 13.2 | 48.2 | 56.0 | 55.7 |
| 17.1 | 520 | 93.2 | 100 | – | – | – | |
| 20 | 5.6 | 6300 | – | 50.7 | 51.0 | 51.5 | 50.8 |
| 9.9 | 650 | – | 38.3 | 38.9 | 39.2 | 41.3 | |
| 13.5 | 460 | 96.1 | 100 | – | – | – | |
| 22.1 | 98.4 | 100 | – | – | – | ||
| 23.4 | 530 | 97.1 | 100 | – | – | – | |
| 40 | 1.4 | 1260 | – | 25.1 | 27.7 | 30.2 | 30.2 |
| 4.1 | 2400 | – | 30.0 | 31.9 | 32.5 | 34.8 | |
| 7.2 | 2580 | – | 51.8 | 51.6 | 54.0 | 60.7 | |
| 16.7 | 520 | 90.4 | 100 | – | – | – | |
К первой группе относятся пленки с содержанием карбоксильных групп 13.5–25.6%, которые полностью разрушаются в течение трех суток.
Во второй группе, образцы окисленной бактериальной целлюлозы с содержанием карбоксильных групп в интервале 3.2–9.9%, которые более устойчивы к деструкции в условиях in vitro (продолжительность процесса гидролиза достигает 60 суток). Для этой группы пленок на процесс гидролитической деградации помимо содержания карбоксильных групп оказывает влияние их степень водопоглощения: чем она выше, тем больше скорость деградации.
Как следует из представленных данных, гидролитическая деструкция окисленной бактериальной целлюлозы с относительно низким содержанием карбоксильных групп происходит по двустадийному механизму: в течение первых семи суток снижение массы происходит наиболее интенсивно; в последующие дни скорость деструкции значительно снижается (табл. 2). Согласно литературным данным, первая стадия – это статистический разрыв макромолекул, протекающий преимущественно в аморфных областях, вторая стадия отвечает процессу, который происходит, главным образом, в пределах кристаллической области.
Следует отметить, что после инкубации в фосфатном буферном растворе набухшие образцы окисленной бактериальной целлюлозы сохраняют целостность, хорошо моделируются на поверхностях со сложным рельефом, легко удаляются с поверхности.
Таким образом, на основании полученных результатов можно выделить следующие особенности процесса окисления бактериальной целлюлозы.
Во-первых, в отличие от растительной целлюлозы, окисление бактериальной целлюлозы в системе N2O4–CНCl3 с концентрацией окислителя 20–40% протекает с постоянной скоростью и приводит к получению гель-пленок с максимально возможным содержанием карбоксильных групп (25.6%, степень замещения 1.0). Включение карбоксильных групп в состав бактериальной целлюлозы сопровождается уплотнением волокнистой сетки, и как следствие, понижением степени набухания и водопоглощения.
Во-вторых, водоудерживающая способность окисленной бактериальной целлюлозы зависит от способа дегидратации бактериальной целлюлозы, условий окисления и дополнительной обработки модифицированной целлюлозы в процессе отмывания. Предварительная дегидратация бактериальной целлюлозы путем инклюдирования, окисление 5–20% растворами оксида азота (IV) в трихлорметане; дополнительная обработка окисленной бактериальной целлюлозы 2 моль/л раствором хлорида натрия и 1% раствором глицерина позволяют получить пленки с содержанием карбоксильных групп в интервале 1.6–25.6%, максимальным сохранением пористой структуры, наименьшей потерей степени набухания и водопоглощения.
В-третьих, основным фактором, влияющим на скорость деградации окисленной бактериальной целлюлозы в фосфатном буферном растворе с рН 7.4, является содержание карбоксильных групп. С ростом содержания карбоксильных групп гидролитическая устойчивость окисленной бактериальной целлюлозы резко падает: окисленная бактериальная целлюлоза с содержанием карбоксильных групп более 13.5% деградируют в течение трех суток.
Список литературы
Boateng J.S., Matthews K.H., Stevens H.N.E., Eccleston G.M. // J. Pharm. Sci. 2008. V. 97. № 8. P. 2892.
Günter C.I., Machens H.G. // Wound Medic. 2014. V. 4. P. 9.
Petersen N., Gatenholm P. J. // Microbiol. Biotechnol. 2011. V. 91. № 5. P. 1277.
Martina B., Katerina K., Miloslava R., Jan G., Ruta M. // Adv. Polym. Technol. 2009. V. 28. № 3. P. 199.
Yang J.A., Yeom J., Hwang B.W., Hoffman A.S., Hahn S.K. // Prog. Polym. Sci. 2014. V. 39. № 12. P. 1973.
Veeruraj A., Liu L., Zheng J., Wu J., Arumugam M. // Mater. Sci. Eng. C. 2019. V. 95. P. 29.
Mohandas A., Deepthi S., Biswas R., Jayakumar R. // Bioactive Mater. 2018. V. 3. № 3. P. 267.
Lin S.P., Loira Calvar I., Catchmark J.M., Liu J.R., Demirci A., Cheng K.C. // Cellulose. 2013. V. 20. № 5. P. 2191.
Backdahl H., Helenius G., Bodin A., Nannmark U., Johansson B.R., Risberg B., Gatenholm P. // Biomaterials. 2006. V. 27. № 9. P. 2141.
Pertile R.A.N., Andrade F.K., Alves C., Gama M. // Carbohydr. Polym. 2010. V. 82. № 3. P. 692.
Cacicedo M.L., Castro M.C., Servetas I., Bosnea L., Boura K., Tsafrakidou P., Dima A., Terpou A., Koutinas A., Castro G.R. // Bioresour. Technol. 2016. V. 213. P. 172.
Dayal M.S., Catchmark J.M. // Carbohydr. Polym. 2016. V. 144. № 25. P. 447.
Shanshan G., Jianqing W., Zhengwei J. // Carbohydr. Polym. 2012. V. 87. № 2. P. 1020.
Tsai Y.H., Yang Y.N., Ho Y.C., Tsai M.L., Mi F.L. // Int. J. Biol. Macromol. 2019. V. 122. № 1. P. 380.
Svensson A., Nicklasson E., Harrah T., Panilaitis B., Kaplan D.L., Brittberg M., Gatenholm P. // Biomaterials. 2005. V. 26. № 4. P. 419.
Cacicedo M.L., Islan G.A., Leon I.E., Alvarez V.A., Chourpa I., Allard-Vannier E., Garcia-Aranda N., Diaz-Riascos Z.V., Fernandez Y., Schwartz Jr.S., Abasolo I., Castro G.R. // Coll. Surf. B. 2018. V. 170. P. 596.
Hu L., Zhang H., Gao A., Hou A. // Carbohydr. Polym. 2018. V. 201. P. 382.
Khamrai M., Banerjee S.L., Kundu P.P. // Carbohydr. Polym. 2017. V. 174. P. 580.
Khan S., Ul-Islam M., Ikram M., Ul Islam S., Ullah M.W., Israr M., Jang J.H., Yoon S., Park J.K. // Int. J. Biol. Macromol. 2018. V. 117. P. 1200.
Wu J., Zheng Y., Yang Z., Lin Q., Qiao K., Chen X., Peng Y. // RSC Adv. 2014. V. 4. P. 3998.
Honglin L., Xiong G., Hu D., Ren K., Yao F., Zhu Y., Gao C., Wan Y. // Mater. Chem. Phys. 2013. V. 143. № 1. P. 373.
Shi X., Cui Q., Zheng Y., Peng S., Wang G., Xie Y. // RSC Adv. 2014. V. 4. P. 607.
Jones J.B. Kjeldahl Method for Nitrogen Determination. Athens; Ga: Micro Macro Publishing, Inc., 1991.
Treesuppharat W., Rojanapanthu P., Siangsanoh C., Manuspiya H., Ummartyotin S. // Biotechnol. Rep. 2017. V. 15. P. 84.
Jong S.J., van Eerdenbrugh B., van Nostrum C.F., Kettenes-van den Bosch J.J., Hennink W.E. // J. Control. Rel. 2001. V. 71. P. 261.
Backdahl H., Helenius G., Bodin A., Nannmark U., Johansson B.R., Risberg B., Gatenholm P. // Biomaterials. 2006. V. 27. P. 2141.
Yurkshtovich N.K., Chekhovsrii A.K., Golub N.V., Kaputskii F.N. // J. Polym. Sci., Polym. Chem. 2003. V. 45. № 5. P. 460.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


