Высокомолекулярные соединения (серия Б), 2019, T. 61, № 4, стр. 272-281
СОРБЦИОННОЕ ВЗАИМОДЕЙСТВИЕ С ВОДОЙ ГИДРОКСИАПАТИТА, ГИАЛУРОНОВОЙ КИСЛОТЫ И β-КАЗЕИНА, ИНДИВИДУАЛЬНЫХ КОМПОНЕНТОВ СИНТЕТИЧЕСКИХ БИОМИНЕРАЛЬНЫХ КОМПОЗИЦИЙ
Т. В. Смотрина a, c, *, А. В. Северин b, Н. В. Щеглова a
a Марийский государственный университет
424000 Йошкар-Ола, пл. Ленина, 1, Россия
b Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, Россия
c Поволжский государственный технологический университет
424000 Йошкар-Ола, пл. Ленина, 3, Россия
* E-mail: tatyana-smotrina@yandex.ru
Поступила в редакцию 13.02.2019
После доработки 05.03.2019
Принята к публикации 18.03.2019
Аннотация
Проведено сравнительное изучение специфики взаимодействия с водой индивидуальных компонентов органоминеральных комплексов: гидроксиапатита, гиалуроновой кислоты и казеина. Определены количественные параметры сорбции воды. Методом протонного магнитного резонанса изучены механизмы сорбции и релаксационные свойства в системах гидроксиапатит–вода и биополимер–вода.
ВВЕДЕНИЕ
В настоящее время лечение костных травм, остеопороза, а также стоматологических заболеваний требует применения как специальных биооптимизованных кальцийсодержащих лекарственных препаратов в сочетании с биологически активными средствами, так и пищевых добавок (или даже полноценных пищевых продуктов) на их основе. Синтетический гидроксиапатит Са10(РО4)6(ОН)2 в наносостоянии – одно из наиболее подходящих веществ для решения обозначенных выше проблем, поскольку его можно назвать естественным компонентом человеческого организма полностью с ним совместимым, обладает повышенной адгезионной и адсорбционной способностью [1, 2]. Органоминеральные композиционные материалы на основе такого гидроксиапатита и природных биополимеров, особенно тех, которые являются его естественными “партнерами” по человеческому организму, способны существенно повысить эффективность медицинских препаратов на их основе. Поэтому создание лекарственных композиций на основе гидроксиапатита и биологически активных полимерных систем – важная и актуальная задача современной науки.
В качестве таких систем предлагается использовать природные полимеры, среди которых гиалуроновая кислота (полисахарид − главный компонент межклеточной жидкости в составе медицинских и косметических средств [3, 4]) и казеины (основные молочные белки − совместно с гидроксиапатитом могут входить в состав лекарственных и стоматологических средств, в том числе как модификаторы гидроксиапатита, а также применяться в молочной и пищевой промышленности [5–8]). Исследованию свойств композитов на их основе были посвящены работы [9–11]. Показано, что синтез гидроксиапатита в активной среде биополимеров может повлечь существенное изменение морфологии и размеров наночастиц, вплоть до достижения ими нативного размера (5–7 нм), что приведет к увеличению его биологической активности [9, 10, 12]. Однако необходимо учитывать, что все подобные композиты синтезируются в водных растворах, поэтому для выявления особенностей поведения данных систем необходимо принимать во внимание и их взаимодействие с третьим компонентом – водой.
Особенности поведения воды при синтезе нанодисперсного гидроксиапатита были частично исследованы в работе [13]. Было установлено, что образующиеся нанокристаллы содержат три молекулы воды на одну молекулу гидроксиапатита, и при этом они не входят в кристаллическую решетку Са10(РО4)6(ОН)2. Кроме того, адсорбируясь на различных гранях и активных центрах, молекулы воды способны сохраняться даже при повышенной температуре [14]. Такая (хемосорбированная) вода в дальнейшем активно участвует в процессе взаимодействия нанокристаллов как с биополимерами, так и c низкомолекулярными органическими и неорганическими соединениями [12, 15, 16].
Гиалуроновая кислота и казеин по своей природе являются гидрофильными полярными полимерами. Вхождение в состав макромолекул карбоксильных групп обусловливает их полианионный характер при физиологическом pH. При добавлении воды каждая молекула гиалуроновой кислоты может увеличиваться в объеме до тысячи раз, образуя слабо упакованный гидрогель [17]. Благодаря амфифильному строению и наличию ионизированных кислотных групп казеин в водной среде в результате самоассоциации образует сфероидальные мицеллы [18], которые способны удерживать до 4 г воды на 1 г белка [19]. Очевидно, что вода играет ключевую роль в функционировании этих полимеров, однако многие вопросы, касающиеся механизма взаимодействия с водой и характера молекулярных движений в системе биополимер–вода остаются открытыми.
При сорбции воды в гидрофильных полимерах развиваются релаксационные процессы [20], приводящие к перестройке элементов надмолекулярной структуры и, как следствие, изменению физико-механических характеристик материалов на их основе. Поэтому изучение характера взаимодействия с водой индивидуальных компонентов органоминеральных композиций методами сорбции и релаксационной спектроскопии ЯМР необходимо для прогнозирования изменений поверхностных, сорбционных, адгезионных и макроскопических физико-механических свойств этих композиций при хранении, транспортировке, а также целенаправленном использовании в водных растворах или в контакте с влажными средами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе использовали гидроксиапатит в виде порошка (размер частиц 45–60 мкм), полученный из водной суспензии 5.5%, синтезированной по методике [13]. Методика заключается в смешении суспензии оксида кальция квалификации х.ч. при интенсивном перемешивании с раствором ортофосфорной кислоты квалификации о.с.ч. (“ИРЕА-2000”, Россия) с концентрацией 35−37% по массе, полноту протекания реакции контролировали по расходу кислоты и с помощью рН метра. Также применяли гиалуроновую кислоту в виде порошка ее высокомолекулярной натриевой соли (гиалуронан) с молекулярной массой М ≥ 106 × 103 (“Shiseido”) и казеин в виде аморфного порошка β-казеината натрия квалификации ч.
Перед проведением сорбционных и ЯМР-релаксационных исследований образцы помещали в сушильный шкаф и выдерживали до постоянной массы при температуре 70°С. В процессе высушивания образующие суспензию наночастицы гидроксиапатита естественно агрегировали и образовывали текстуру используемого порошка, в которой, тем не менее, они могли сохранять свою индивидуальность даже после прогревания при 800°С [14]. В выбранных условиях высушивания остаточное содержание воды (по данным работы [13]) составляло 3−5% по массе, что впоследствии было подтверждено данными спектроскопии ЯМР. Относительно низкую температуру сушки для гидроксиапатита выбрали в связи с необходимостью сопоставления полученных результатов с результатами аналогичного исследования органоминеральных композиций на его основе, полимерные компоненты которых подвергаются деструкции при более высоких значениях температуры [4, 21].
Равновесную сорбцию водяного пара измеряли изопиестическим методом, относительную влажность воздуха в эксикаторах создавали насыщенными растворами солей. Эксикаторы термостатировали при 25°С.
Параметры ядерной магнитной релаксации измеряли на ЯМР-анализаторе “Спин Трэк” с частотой резонанса на ядрах 1Н 19 МГц. Длительность возбуждающего 90-градусного радиочастотного импульса 2 мкс, “мертвое” время 10 мкс. Исследования релаксационных процессов осуществляли во временной области после воздействия на образец возбуждающей импульсной последовательности.
Сигнал спада свободной индукции измеряли после воздействия на исследуемый образец 90-градусного импульса. Для восстановления формы сигнала на временах, меньших “мертвого” времени, использовали импульсную последовательность “Solid Echo” 90$_{x}^{^\circ }$–τ–90$_{y}^{^\circ }$ [22]. Амплитуду Ак и время спин-спиновой релаксации Т2к быстро релаксирующей компоненты ССИ устанавливали по кривой затухания твердотельного эха. Амплитуду Ад и время спин-спиновой релаксации Т2д медленно релаксирующей компоненты при относительно высоких значениях скорости затухания определяли непосредственно при анализе ССИ, при низких значениях скорости – с использованием импульсной последовательности Карра−Парселла−Мейбума−Гила {90$_{x}^{^\circ }$–(τ–180$_{y}^{^\circ }$–τ–эхо)n} [23] для исключения влияния неоднородности внешнего магнитного поля и процессов самодиффузии малых молекул.
Время спин-решеточной релаксации Т1 определяли измерением кривой восстановления продольной намагниченности с помощью импульсной последовательности 90°–τ–90°, используемой при условии Т1$ \gg $ Т2, что характерно для твердотельных образцов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Несмотря на различные происхождение, состав, аморфно-кристаллическую структуру, природу сорбционных центров, для всех образцов характерны S-образные изотермы сорбции водяного пара (рис. 1).
Рис. 1.
Изотермы сорбции паров воды образцами гидроксиапатита (1), гиалуроновой кислоты (2) и казеина (3).

В рамках классификации Роджерса [24], применяемой для полимерных сорбентов, S-образные изотермы IV типа наблюдаются для гидрофильных полярных соединений, в том числе гиалуроновой кислоты и казеина, находящихся в неравновесном стеклообразном состоянии. На начальной выпуклой части изотермы происходит специфическое взаимодействие молекул воды с активными центрами в свободном объеме полимера. Вторая часть (вогнутая) характеризуется набуханием полимера (увеличение свободного объема) и переходом полимера в высокоэластическое равновесное состояние. В приближении такого механизма для описания сорбции паров воды гиалуроновой кислотой и казеином в данной работе использовано уравнение квазихимической модели абсорбции Лаатикайнена−Линдстрема [25]:
(1)
$а = {{а }_{m}}\frac{{\alpha (p{\text{/}}{{p}_{0}})}}{{\left( {1 - \beta (p{\text{/}}{{p}_{0}})} \right)\left( {1 - \beta (p{\text{/}}{{p}_{0}}) + \alpha (p{\text{/}}{{p}_{0}})} \right)}},$Квазихимическая модель не противоречит требованиям термодинамики [26] и успешно применяется для описания сорбции неинертных паров набухающими полимерными системами (полисахариды, полиамиды, белки и другие) [27–30].
В предположении физической адсорбции S-образную изотерму для гидроксиапатита можно отнести ко II типу по классификации Брунауэра, Деминга, Деминга, Теллера [31], характерному для макропористых (или непористых) адсорбентов.
Представленный выше механизм сорбции паров полимерами не отвечает структурным особенностям гидроксиапатита, поэтому для описания сорбционного процесса и вычленения вклада минеральной составляющей в сорбционную емкость композиционных материалов в работе была применена модель полимолекулярной адсорбции Гугенгейма–Андерсона–де Бура [32], уравнение которой, в отличие от традиционной модели БЭТ, изоморфно уравнению (1):
(2)
$а = {{а }_{m}}\frac{{{{C}_{{\text{G}}}}k(p{\text{/}}{{p}_{0}})}}{{\left( {1 - k(p{\text{/}}{{p}_{0}})} \right)\left( {1 - k(p{\text{/}}{{p}_{0}}) + {{C}_{{\text{G}}}}k(p{\text{/}}{{p}_{0}})} \right)}}$Здесь аm – емкость мономолекулярного слоя; CG – константа, численно равная отношению времени жизни молекул адсорбата в первом и последующем слоях; параметр k учитывает отличие состояния сорбата в адсорбционных слоях выше первого от состояния соответствующей жидкости.
Если обозначить константу k как β, а произведение CGk как α, то уравнение (2) совпадает с уравнением (1), которое с учетом поправки на различный физический смысл этих констант можно использовать для описания изотерм сорбции исследуемых материалов. Параметры уравнения (1) представлены в таблице. Там же приведена предельная величина сорбции а0 при относительном давлении p/р0 = 1.
Уравнение (1) хорошо описывает экспериментальные данные в широкой области относительного давления (вплоть до p/p0 = 0.98) и может быть использовано для сопоставления сорбционных свойств индивидуальных компонентов и органоминеральных композиций на их основе. Уравнение (1) позволяет также рассчитать изотермы прочно связанной с активными центрами ац и относительно свободной ас воды по уравнениям (3) и (4) соответственно (рис. 2):
(3)
${{а }_{{\text{ц }}}} = {{а }_{m}}\frac{{\alpha (p{\text{/}}{{p}_{0}})}}{{\left[ {1 + (\alpha - \beta )(p{\text{/}}{{p}_{0}})} \right]}}$(4)
${{а }_{{\text{c}}}} = {{а }_{m}}\frac{{\alpha \beta {{{(p{\text{/}}{{p}_{0}})}}^{2}}}}{{\left\{ {(1 - \beta (p{\text{/}}{{p}_{0}}))\left[ {1 + (\alpha - \beta )(p{\text{/}}{{p}_{0}})} \right]} \right\}}}$Рис. 2.
Изотермы прочно связанной (1−3) и относительно свободной (4−6) воды для образцов гидроксиапатита (1, 4), гиалуроновой кислоты (2, 5) и казеина (3, 6). Для гидроксиапатита разделение вкладов “прочно связанной” и “относительно свободной” воды является условным (пояснения см. в тексте).

Разделяя вклады прочно связанной и относительно свободной воды для гиалуроновой кислоты и казеина, можно условно разделить эти же вклады и для гидроксиапатита, физический смысл которых раскрывается далее при обсуждении данных ЯМР-релаксации. Изотерма “прочно связанной” воды для гидроксиапатита феноменологически описывается уравнением мономолекулярной адсорбции Ленгмюра; заполнение первичных сорбционных центров заканчивается при р/р0 = 0.1 образованием мономолекулярного слоя емкостью 0.008 г/г, что соответствует величине удельной поверхности монослоя воды Sуд = = 28 м2/г. Далее происходит формирование второго мономолекулярного слоя до р/р0 ∼ 0.8 (a ∼ 2am). Вклад “относительно свободной” воды в общую сорбционную емкость гидроксиапатита составляет ∼90%, а ее количество резко возрастает при р/р0 > 0.8 (правая ветвь изотермы), что соответствует полимолекулярной адсорбции при слабом адсорбционном взаимодействии второго и последующих слоев. В целом, низкие значения am, а0 и Sуд свидетельствуют об умеренной гидрофильности минеральной составляющей органокомплексов.
Для гиалуроновой кислоты и казеина сорбционная емкость значительно превышает искомую для гидроксиапатита (табл. 1). Изотермы сорбции прочно связанной и относительно свободной воды для этих биополимеров (рис. 2) представляют собой результат разделения вкладов сорбции в стеклообразном и высокоэластическом состояниях соответственно [33, 34].
Таблица 1.
Параметры уравнения (1)
| Образец | am, г/г | α | β | R2 | a0, г/г |
|---|---|---|---|---|---|
| Гидроксиапатит* | 0.008 | 13.4 | 0.92 | 0.999 | 0.096 |
| Гиалуроновая кислота | 0.127 | 4.6 | 0.85 | 0.999 | 0.821 |
| Казеин | 0.063 | 1.0 | 0.80 | 0.996 | 0.265 |
* Значения рассчитаны по уравнению (2) с учетом k = β, CGk = α.
Молекулярные взаимодействия индивидуальных компонентов биокомплексов с водой изучали методом релаксационной спектроскопии ЯМР. Релаксационные сигналы представляют собой суперпозицию быстро- и медленно затухающих компонент, которые обычно называют короткой и длинной соответственно (рис. 3). Амплитуда короткой компоненты пропорциональна количеству протонов твердой фазы (“жесткая решетка”), обладающих ограниченной подвижностью. Протоны молекул воды и подвижных фрагментов макромолекул вносят вклад в длинную компоненту с относительной амплитудой, пропорциональной их содержанию [35]. Аппроксимация сигнала ССИ проводилась с использованием уравнения (5), представляющего собой суперпозицию гауссовой (короткая компонента) и лоренцевой (длинная компонента) функций:
(5)
$A(t) = A_{{\text{к }}}^{{}}\exp ( - {{t}^{2}}{\text{/}}T_{{2{\text{к }}}}^{2}) + A_{{\text{д }}}^{{}}\exp ( - {{t}^{2}}{\text{/}}T_{{2{\text{д }}}}^{*}),$Рис. 3.
Спад свободной индукции ЯМР 1H для высушенных при 70°С образцов гидроксиапатита (1), гиалуроновой кислоты (2) и казеина (3); R2 = 0.978, 0.988 и 0.998 соответственно. Точки – эксперимент, линии – аппроксимация функцией (5).

Аппроксимация релаксационных сигналов уравнением (5) в целом дает удовлетворительные результаты. Для гидроксиапатита относительно небольшой коэффициент корреляции обусловлен низкой протонной плотностью (два атома водорода на одну молекулу гидроксиапатита), а следовательно, и меньшим отношением сигнал : : шум. Для гиалуроновой кислоты и казеина незначительное отклонение расчетной кривой от экспериментальной можно связать с наличием слабой осцилляции, возникающей в твердых телах за счет неусредненных диполь-дипольных взаимодействий.
На рис. 4 приведены зависимости от влагосодержания амплитуды короткой и длинной компонент, нормированные на общую амплитуду ССИ высушенного образца. Зависимости Т2к и Т2д от относительной величины сорбции паров представлены на рис. 5.
Рис. 4.
Зависимости амплитуды короткой (1−3) и длинной (4−6) компонент ССИ от величины сорбции для образцов гидроксиапатита (1, 4), гиалуроновой кислоты (2, 5) и казеина (3, 6).
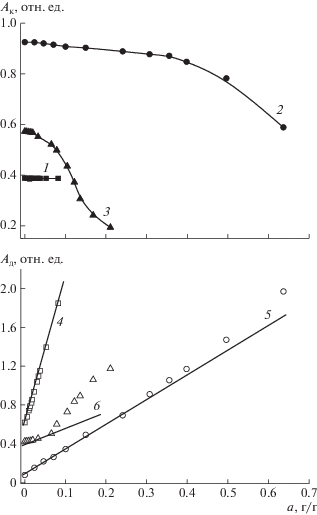
Рис. 5.
Зависимости времени спин-спиновой релаксации короткой (1−3) и длинной (4−6) компонент ССИ от величины сорбции для образцов гидроксиапатита (1, 4), гиалуроновой кислоты (2, 5) и казеина (3).

Для частиц гидроксиапатита амплитуда и время спин-спиновой релаксации твердотельной компоненты ССИ не зависят от влагосодержания (рис. 4 и 5, кривые 1), т.е. количество и подвижность протонов жесткой решетки не изменяются при взаимодействии с водяным паром. Амплитуда длинной компоненты прямо пропорциональна величине адсорбции (рис. 4, кривая 4). Для высушенного при 70°С гидроксиапатита относительный вклад амплитуды длинной компоненты в общую амплитуду сигнала составляет 59%, что указывает на присутствие в образце остаточной воды, содержание которой, определенное экстраполяцией линейной зависимости на ось абсцисс, составляет 3.9 мас. % (из них 0.8 мас. % легко удаляется при 110°С). Таким образом, содержание связанной воды в исследуемом образце ∼3.1 мас. %, что согласуется с данными работы [36] для кристаллического гидроксиапатита зубной эмали.
Следовательно, протоны адсорбированной гидроксиапатитом воды вносят вклад только в медленно затухающую компоненту ССИ, изменение молекулярной подвижности которой можно проследить по зависимости времени спин-спиновой релаксации. На начальном участке зависимости Т2д – f(а), соответствующем формированию адсорбционного слоя толщиной около двух молекул воды (a < 2am), доминирующий вклад в процессы спин-спиновой релаксации вносят протоны связанной воды (рис. 5, кривая 4). Далее наблюдается рост Т2д, значит, при р/р0 > 0.8 молекулы воды адсорбируются с меньшим энергетическим эффектом и представляют собой более подвижную часть адсорбата, что согласуется с сорбционными данными.
Изменение релаксационных свойств гиалуроновой кислоты под влиянием воды наглядно демонстрируют зависимости амплитуды и времени спин-спиновой релаксации быстро- и медленно затухающих компонент ССИ от величины сорбции. Снижение Ак, отклонение вверх от линейной зависимости значений Ад (рис. 4, кривые 2 и 5) и существенный рост Т2к (рис. 5, кривая 2) при влагосодержаниях, соответствующих правой ветви изотермы (р/р0 > 0.7), свидетельствует об увеличении локальной подвижности макромолекул и переходе наиболее подвижных протонов из твердотельной в лоренцеву компоненту релаксационной кривой. Это коррелирует с представлениями о расстекловании гиалуроновой кислоты и ее переходе в высокоэластическое состояние. Пластификация полимера растворителем способствует также ослаблению связи сорбент–сорбат и увеличению вклада относительно свободной воды в общую сорбционную емкость, что способствует более эффективному усреднению диполь-дипольных взаимодействий между молекулами воды и проявляется в постепенном нарастании Т2д с ростом влагосодержания (рис. 5, кривая 5). В целом, изменения параметров ЯМР-релаксации в системе гиалуроновая кислота–Н2О согласуются с описанным выше механизмом сорбции паров полярными набухающими в сорбате полимерами и подтверждают адекватность используемой в работе абсорбционной модели.
В исходном образце казеина вклад медленно релаксирующей компоненты в амплитуду ССИ составляет более 40% и не может быть обусловлен только протонами не удаляющейся при сушке воды. Согласно работам [37–39] β-казеин не имеет третичной структуры. Такие внутренне неупорядоченные белки отличаются от глобулярных низким содержанием упорядоченной вторичной структуры и высокой внутримолекулярной подвижностью. О высокой пластичности казеина даже при минимальной влажности упоминалось и в значительно более ранней работе [40]. Динамическая неоднородность структуры казеина, по-видимому, и обусловливает наличие медленно затухающей компоненты в ССИ высушенного образца.
В работе [41] при исследовании внутренней динамики белков методом твердотельного ЯМР было показано, что даже в сухих белках присутствуют внутренние движения в микросекундном диапазоне времен корреляции, амплитуда которых увеличивается при увлажнении. Учитывая высокую лабильность макромолекул казеина, подтверждением тому служит значительно более интенсивное, по сравнению с гиалуроновой кислотой, уменьшение амплитуды твердотельной и непропорциональное влагосодержанию увеличение амплитуды подвижной компоненты при величинах сорбции а > 0.1 г/г (правая ветвь изотермы) (рис. 4, кривые 3 и 6). Интересно, что в бычьем сывороточном альбумине, имеющем глобулярную структуру, возрастание соотношения амплитуд подвижной и жесткой фракций для увлажняемого белка происходило равномерно за счет роста количества воды в пробе [42].
Изменение подвижности протонов казеина в ходе сорбции можно проследить по зависимости времени спин-спиновой релаксации твердотельной компоненты ССИ (рис. 5, кривая 3). Гидратация полярных групп белка на начальном этапе сорбции практически не влияет на характер крупномасштабной подвижности. При величинах сорбции, соответствующих средней части изотермы, происходит постепенное нарастание локальной подвижности протонов “жесткой решетки”, и значение Т2к растет. При дальнейшей пластификации казеината водой (при р/р0 > 0.7, а > > 0.1 г/г), сопровождающейся переходом значительной части белковых фрагментов в подвижное высокоэластическое состояние, закономерно увеличивается вклад жестко фиксированных протонов полимерной матрицы в гауссову компоненту ССИ, вызывая снижение времени ее спин-спиновой релаксации.
Также еще одной особенностью системы казеин–вода, не наблюдавшейся для систем гидрокси-апатит–вода и гиалуроновая кислота–вода, является характер затухания поперечной намагничености в последовательности Карра−Парселла−Мейбума−Гила. Оказалось, что при влагосодержании <0.1 г/г релаксационные спады одноэкспоненциальны, а определяемое по ним время спин-спиновой релаксации (Т2д ∼ 32−34 мс) практически не зависит от содержания воды в образце. При дальнейшем увлажнении, сопровождающемся, как отмечалось, переносом намагниченности от наиболее лабильных протонов казеина из короткой в длинную компоненту, кривые затухания амплитуды спинового эха становятся неэкспоненциальными (рис. 6), на спадах достоверно регистрируется появление и последующее нарастание дополнительной относительно быстрой компоненты с Т2д ∼ 1−2 мс, также мало зависящим от содержания воды в полимере. Таким образом, с одной стороны, молекулы воды, связываясь с макромолекулами казеината, испытывают те же движения, что и сам белок, что согласуется с результатами исследования влияния гидратации на молекулярную динамику белков, подробно обсуждаемыми в работе [43]. С другой стороны, в казеине прослеживаются две фракции лабильных протонов с различными динамическими характеристиками, для которых не характерен быстрый обмен намагниченностью, что может указывать на их принадлежность различным элементам белковой структуры (молекулярной или надмолекулярной).
Рис. 6.
Кривые затухания поперечной намагниченности в последовательности Карра–Парселла–Мейбума–Гила для системы казеин–вода при влагосодержании 0.079 (1) и 0.211 г/г (2).

Процессы спин-решеточной (продольной) релаксации характеризуют перераспределения избыточной энергии радиочастотного поля между спиновой системой и ее окружением и, в отличие от спин-спиновой релаксации, чувствительны к сравнительно быстрым молекулярным движениям. Для исследуемых в данной работе систем кривые восстановления продольной намагниченности экспоненциальны и описываются единственным временем релаксации Т1, значение которого определяется долей ядер, имеющих сильную связь с решеткой. В роли таких релаксационных центров в отсутствие сорбированной влаги выступают парамагнитные примеси, дефекты решетки, быстро вращающиеся боковые и концевые группы и другие. Кроме того, в твердых телах существенна роль спиновой диффузии, усредняющей времена спин-решеточной релаксации различных протонов, что приводит к потере селективной динамической информации. Тем не менее изучение зависимостей Т1 – f(a) имеет смысл для получения обобщенной по всему образцу информации.
Снижение Т1 в процессе сорбции и последующий минимум (релаксационный переход) (рис. 7) свидетельствует о появлении дополнительных каналов ядерной магнитной релаксации, обусловленных движением молекул воды на частотах, близких к резонансным, а в случае полимеров − увеличением локальной подвижности макромолекул при их пластификации водой [44].
Рис. 7.
Зависимость времени спин-решеточной релаксации от величины сорбции образцов гидроксиапатита (1), гиалуроновой кислоты (2) и казеина (3).
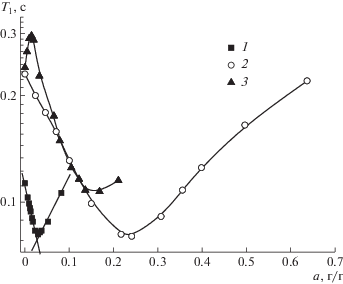
Достаточно низкие значения Т1 для высушенного гидроксиапатита можно связать с его высокой дисперсностью и в бóльшей степени с присутствием не удаляющейся при сушке воды. Четкий минимум зависимости, а также экспоненциальный рост значений по обе стороны от него свидетельствует об узком распределении времен корреляции и преобладании одного типа молекулярного движения. Это позволяет предположить, что в системе гидроксиапатит–вода спин-решеточная релаксация опосредована, главным образом, молекулами воды.
Для гиалуроната и казеината зависимости Т1 от величины сорбции аналогичны таковым для изученных ранее биополимеров в работах [44–46]. Преобладающий вклад в спин-решеточную релаксацию протонной намагниченности в этом случае вносит увеличение подвижности фрагментов макромолекул в присутствии воды. Минимум Т1 соответствует β-релаксационному переходу, связанному с мелкомасштабными движениями боковых заместителей и малых участков макромолекул, и наблюдается, как и в случае других биополимеров, при заполнениях примерно две молекулы воды на один активный центр.
Для казеина незначительный рост Т1 на начальной стадии гидратации (р/р0 ≤ 0.2) свидетельствует о блокировании в присутствии воды некоторого числа релаксационных центров. Это возможно при сорбции в элементах свободного объема биополимера, размер которых близок к размеру молекулы сорбата. В этих условиях молекула воды одновременно связывается с активными центрами соседних макромолекул, существенно ограничивая их подвижность. Такой эффект подобен явлению антипластификации [47], когда при добавлении небольшого количества пластификатора (в данном случае воды) создаются условия для более плотной упаковки макромолекул, приводящей к усилению взаимодействия между ними.
Таким образом, в работе показано, что гидроксиапатит и биополимеры как индивидуальные компоненты органоминеральных композиционных материалов имеют принципиально различные механизмы сорбции водяного пара. В отличие от гидроксиапатита, взаимодействие гиалуроната и казеината с водой сопровождается их набуханием и пластификацией, что, в свою очередь, отражается на сорбционной емкости, релаксационных свойствах и молекулярной динамике компонентов в системе полимер–вода.
Несмотря на то, что простой ПМР-релаксационный эксперимент позволяет получить лишь качественную информацию о динамических свойствах исследуемых систем, выявленные выше закономерности в совокупности с данными сорбционного метода могут служить основой при изучении структурных особенностей и межмолекулярных взаимодействий в органоминеральных композиционных материалах на основе гидроксиапатита и биополимеров.
Список литературы
Suchanek W., Yoshimura M. // J. Mater. Res. 1998. V. 13. № 1. P. 94.
Вересов А.Г., Третьяков Ю.Д., Путляев В.И. // Рос. хим. журн. 2004. Т. XLVIII. № 2. С. 52.
The Chemistry, Biology, and Medical Applications of Hyaluronan and Its Derivatives / Ed. by T.C. Laurent. London: Portland Press, 1998.
Хабаров В.Н., Бойков П.Я., Селянин М.А. Гиалуроновая кислота: получение, свойства, применение в биологии и медицине. М.: Практическая медицина, 2012.
Van Kemenade M.J.J.M, de Bruyn P.L. // J. Coll. Int. Sci. 1989. V. 129. P. 1.
Thachepan S., Li Mei, Mann S. // Nanoscale. 2010. V. 2. P. 2400.
Xiaoyun Pan, Minfang Mu, Bin Hu, Ping Yao, Ming Jiang // Biopolymers. 2006. № 81. P. 29.
Dumboski K.C. The Efficacy of 37% Phosphoric Acid + Mi Paste Plus on Remineralization of Enamel White Spot Lesions. Master of Science Thesis. Iowa: University of Iowa, 2011.
Severin A.V., Bozhevolnov V.E., Smykov I.T. // Moscow Univ. Chem. Bull. 2014. V. 69. № 1. P. 45.
Severin A.V., Ivanov P.L., Kostina J.V., Khabarov V.N., Kalmykova T.P., Antonov S.V. // Polymer Science B. 2016. V. 58. № 4. P. 428.
Калмыкова Т.П., Северин А.В., Костина Ю.В., Иванов П.Л. // Успехи в химии и хим. технол. 2016. Т. 30. № 12. С. 49.
Северин А.В., Силкин Н.И., Галиуллина Л.Ф., Мазалева О.Н., Рудин В.Н., Салахов М.Х., Хайруллин Р.Н., Челышев Ю.А. // Ученые записки Казанского ун-та. Сер. Естеств. науки. 2012. Т. 154. № 3. С. 127.
Melikhov I.V., Komarov V.F., Severin A.V., Bozhevol’nov V.E., Rudin V.N. // Dokl. Phys. Chem. 2000. V. 373. № 1–3. P. 125.
Suvorova E.I., Klechkovskaya V.V., Komarov V.F., Severin A.V., Melikhov I.V., Buffat P.A. // Cryst. Reports. 2006. V. 51. № 5. P. 881.
Khayrullin A.R., Khripunov A.K., Pautov V.D., Severin A.V., Tkachenko A.A. // Russ. J. Appl. Chem. 2013. V. 86. № 8. P. 1298.
Severin A.V., Badun G.A., Tyasto Z.A., Korobkov V.I., Rudin V.N. // Radiochemistry. 2009. V. 51. № 6. P. 633.
Ponedel'kina I.Yu., Lukina E.S., Odinokov V.N. // Russ. J. Bioorgan. Chem. 2008. V. 34. № 1. P. 1.
Faizullin D.A., Konnova T.A., Zuev Y.F., Haertle T. // Russ. J. Bioorgan. Chem. 2013. V. 39. № 4. P. 366.
Тихомирова Н.А., Левин А.Д., Аленичев М.К., Жованник И.Е. // Молочная пром-ть. 2010. № 10. С. 72.
Вода в полимерах / Под ред. С. Роуленда., пер. с англ. под ред. Г.Е. Заикова. М.: Мир, 1984.
Твердохлеб Г.В., Сажинов Г.Ю., Раманаускас Р.И. Технология молока и молочных продуктов. М.: ДеЛи принт, 2006.
Puwles J.G., Mansfield P. // Pliys. Lett. 1962. V. 2. № 2. P. 58.
Вашман А.А., Пронин И.С. Ядерная магнитная релаксационная спектроскопия. М.: Энергоатомиздат, 1986.
Чалых А.Е. Диффузия в полимерах. М.: Химия, 1987.
Laatikainen M., Lindstrom M. // Acta Po1ytechn. Scand., Chem. Technol. Met. 1987. № 178. P. 105.
Klyuev L.E., Grebennikov S.F. // Russ J. Phys Chem. A. 1998. V. 72. № 3. P. 451.
Klyuev L.E., Grebennikov S.F. // Russ. J. Phys. Chem. A. 1996. V. 70. № 11. P. 1902.
Смотрина Т.В., Смирнов А.К., Вихорева Г.А., Роговина С.З., Кынин А.Т., Гребенников С.Ф. // Химия растительного сырья. 2004. № 3. С. 39.
Vorotyntsev I.V., Gamayunova T.V. // Russ. J. Phys. Chem. A. 2009. V. 83. № 5. P. 818.
Smotrina T.V., Grebennikov S.F., Busygin K.N., Smotrin V.A., Zhizhenkov V.V., Kvachadze N.G. // Polymer Science A. 2017. V. 59. № 2. P. 206.
Грег С., Синг К. Адсорбция, удельная поверхность, пористость / Пер. с англ. А.П. Карнаухова. М.: Мир, 1984.
Kamalyan O.A. // Colloid J. 2010. V. 72. № 2. P. 286.
Chalykh A.E., Gerasimov V.K., Shcherbina A.A., Kulagina G.S., Khasbiullin R.R. // Polymer Science A. 2008. V. 50. № 6. P. 630.
Гребенников С.Ф., Эльтеков Ю.А. Сорбция в полимерных системах. СПб.: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования “Санкт-Петербургский государственный университет промышленных технологий и дизайна”, 2014.
Манк В.В., Лебовка М.М. Спектроскопия ядерного магнитного резонанса воды в гетерогенных системах. Киев: Наукова думка, 1988.
Вавилова Т.П. Биохимия тканей и жидкостей полостей рта. М.: ГЭОТАР-Медиа, 2008.
Dunker A.K., Lawson J.D., Brown C.J., Williams R.M., Romero P., Oh J.S., Oldfield C.J., Campen A.M., Ratliff C.M., Hipps K.W. // J. Mol. Graphics Modell. 2001. V. 19. P. 26.
Uversky V.N. // J. Biomol. Struct. Dyn. 2003. V. 21. P. 211.
Latnikova A.V., Noskov B.A., Lin S.-Y. // Colloid J. 2009. V. 71. № 2. P. 208.
Петров Г.С., Рутовский Б.Н. Технология синтетических смол и пластических масс. М.; Л.: Гос. научно-техн. изд-во хим. лит., 1946.
Blears D.J., Danyluk S.S. // Biochim. Biophys. Acta. 1968. V. 154. P. 17.
Fedyukina G.N., Volkov V.Ya. // Russ. J. Phys. Chem. A. 2008. V. 82. № 4. P. 655.
Крушельницкий А.Г. Дис. … д-ра физ.-мат. наук. Казань: Казанский ин-т биохимии и биофизики РАН, 2006.
Smotrina T.V., Smirnov A.K., Popova T.V., Shcheglova N.V. // Russ. J. Phys. Chem. A. 2008. V. 82. № 6. P. 916.
Смотрина Т.В., Кулакова Л.П. // Бутлеровские сообщения. 2011. Т. 25. № 7. С. 113.
Гребенников С.Ф., Смотрина Т.В., Басок М.О., Блинов И.П. // Изв. вуз: Технология легкой промышленности. 2010. Т. 8. № 2. С. 16.
Козлов П.В., Папков С.П. Физико-химические основы пластификации полимеров. М.: Химия, 1982.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


