Высокомолекулярные соединения (серия Б), 2019, T. 61, № 4, стр. 243-251
Кинетика тройной сополимеризации диоксида углерода с пропиленоксидом, бутеноксидом и циклогексеноксидом
О. М. Чуканова a, *, К. О. Коренков b, Е. О. Перепелицина a, Н. О. Гарифуллин a, И. В. Седов a, b
a Институт проблем химической физики Российской академии наук
142432 Московская обл, Черноголовка, пр. ак. Семенова, 1, Россия
b Московский государственный университет им. М.В. Ломоносова.
Факультет фундаментальной физико-химической инженерии
119991 Москва, Ленинские горы, Россия
* E-mail: olchukan@icp.ac.ru
Поступила в редакцию 20.02.2019
После доработки 21.02.2019
Принята к публикации 31.03.2019
Аннотация
Впервые изучена кинетика тройной сополимеризации СО2 с рядом эпоксидов: пропиленоксидом, бутеноксидом и циклогексеноксидом в присутствии бинарной каталитической системы. Значение скорости реакции рассчитывали, измеряя поглощение СО2 со временем. Представлены зависимости скорости реакции от состава эпоксидов в среде для реакций СО2 с бутеноксид–пропиленоксидом, СО2 с циклогексеноксид–пропиленоксидом, СО2 с циклогексеноксид–бутеноксидом. Определено соотношение констант сополимеризации при внедрении различных эпоксидов в сополимер. Температура стеклования тройных сополимеров определялась их составом и изменялась в диапазоне 9.3–122.3°С.
ВВЕДЕНИЕ
Синтез алифатических поликарбонатов из диоксида углерода и эпоксидов – это новый процесс формирования биосовместимых полимерных материалов. Вовлечение СО2 в синтез органических соединений позволяет уменьшить зависимость от нефтяного сырья, так как в полимерную цепь внедряется до 50 мольных процентов диоксида углерода [1]. Известно, что реакции СО2 с эпоксидами протекают в присутствии катализаторов (комплексов Co, Cr, Zn, Al и других) [2]. С начала 2000-х годов проводится интенсивный поиск новых активных катализаторов. Так, одна из известных активных каталитических систем состоит из саленового комплекса кобальта salenCoX ((salen = (R,R)-N,N '-бис-(3,5-ди-трет-бутилсалицилиден)-1,2-диаминоциклогексан); X = Cl, Br, динитрофеноксид и другие) и сокатализатора из ряда аммониевых солей или оснований [2]. Усилия исследователей направлены в основном на синтез новых катализаторов, в то время как кинетика процессов практически не исследовалась. Данные о скорости реакции, как правило, получают на основании измерения выхода продукта.
Различные эпоксиды могут применяться для проведения реакции, среди них наиболее широко используются пропиленоксид (ПО), бутеноксид (БО) и циклогексеноксид (ЦГО). Природа эпоксида оказывает значительное влияние на свойства алифатического поликарбоната. Сополимер СО2 с пропиленоксидом в твердом состоянии представляет собой стеклообразный продукт с температурой стеклования Тс = 25–45°С, который характеризуется рядом интересных свойств. Например, он плохо горит и не выделяет токсичных продуктов, отличается хорошими адгезионными свойствами. Пленки сополимера обладают хорошими барьерными свойствами по отношению к кислороду и воде. Это биоразлагаемый и биосовместимый материал [3]. Однако физико-механические свойства полипропиленкарбоната не позволяют использовать его как инженерный пластик. Температуру стеклования алифатического поликарбоната можно увеличить, используя циклогексеноксид или другие эпоксиды циклического строения.
Одним из подходов, позволяющих варьировать свойства алифатических поликарбонатов в широком диапазоне, является введение в полимерную цепь различных эпоксидов. Скорость реакции может значительно меняться при изменении природы эпоксида, наиболее быстро протекают реакции с участием пропиленоксида. Каталитическая система также оказывает влияние на скорость реакции. Процесс тройной сополимеризации СО2 с пропиленоксидом, циклогексеноксидом, алифатическими эпоксидами проводился с применением сложных катализаторов нового поколения в довольно жестких условиях: при температуре 70–75°С и давлении 2 МПа в работе [4], 90°С и 1.5–2.5 МПа в работе [5]. В литературе нет подробных исследований тройной сополимеризации в присутствии бинарной каталитической системы salenCoX/PPNCl (PPNCl = бис-(трифенилфосфин)иминияхлорид). Можно найти лишь сведения об отдельных опытах, в которых представлен выход тройных сополимеров СО2 с пропиленоксидом и циклогексеноксидом, как правило, при эквимольном их соотношении (см., например, в работе [6]). Кинетика тройной сополимеризации не изучена и нет данных о том, как изменяется скорость реакции при варьировании состава эпоксидов в среде.
Задача настоящей работы – изучение влияния состава эпоксидов на кинетику тройной сополимеризации в присутствии бинарной каталитической системы salenCoDNP/PPNCl (DNP = 2,4-динитрофеноксид) в относительно мягких условиях. Также в данном исследовании необходимо было решить ряд вопросов кинетического характера. Например, насколько можно увеличить скорость реакции с циклическим эпоксидом путем введения в среду более активного эпоксида – пропиленоксида. Важно было определить соотношение констант сополимеризации при применении разных эпоксидов. Использовали наиболее широко известные эпоксиды, для того чтобы сравнить полученные результаты с литературными данными.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и методы исследования
Катализатор (salen)Co(DNP) синтезировали по методике [7], используя (salen)Co(II) (“Strem Chemicals”) и 2,4-динитрофенол (≥97%, “Sigma-Aldrich”). Сокатализатор PPNCl получали от фирмы “Strem Chemicals”, CO2 (99.8%) – от “Линде Газ”. Пропиленоксид, бутеноксид и циклогексеноксид (“Sigma-Aldrich”) осушали перегонкой над CaH2.
Спектры ЯМР 1H регистрировали на приборе “Bruker AVANCE III 500-MHz”, растворяя образцы в CDCl3. Анализ сополимеров методом ГПХ проводили на приборе “Waters GPCV-2000” с двумя колонками “PLgel 5 мкм MIXED-C” в ТГФ при 35°C и скорости элюента 1 мл/мин. Значения молекулярной массы рассчитывали по калибровочной кривой, полученной с использованием полистирольных стандартов. Данные о температуре стеклования брали из анализа второго цикла нагревания при скорости 20 град/мин методом ДСК на приборе “822e Mettler Toledo”.
Реакция СО2 с пропиленоксидом
Процедура проведения реакции аналогична описанной ранее в работе [8]. SalenCoDNP и PPNCl растворяли в смеси эпоксидов (3.5–4.5 мл) в атмосфере аргона и перемешивали в течение 15 мин. Концентрация катализатора варьировалась в диапазоне (7.0–8.5) × 10–3 моль/л. Раствор переливали в предварительно откачанный металлический реактор объемом 0.1 л, снабженный магнитной мешалкой, в атмосфере СО2. В реакторе поднимали давление подачей СО2 и подключали к термостату, нагретому до 45°С. В ходе реакции поддерживали давление 0.6 МПа. Кинетику регистрировали, измеряя давление СО2 в калиброванной мерной емкости, соединенной с реактором. Количество СО2 рассчитывали по градуировочной кривой, выражающей зависимость массы СО2 от давления в мерной емкости. Реакцию заканчивали, охлаждая реактор до комнатной температуры и сбрасывая давление. Продукт растворяли в CH2Cl2 (5 мл), сополимер высаживали МеОН (30 мл) с добавлением 5% раствора HCl в МеОН (5 мл). Процедуру повторяли до получения бесцветного сополимера. После очистки сополимер высушивали в вакууме при температуре 100–140°С и взвешивали. Выход сополимера соответствовал количеству поглощенного СО2 с точностью ±10%. Продукты анализировали, применяя методы ГПХ и ЯМР. Относительное содержание звеньев различных эпоксидов в тройном сополимере рассчитывали по спектрам ЯМР 1Н [4, 6] (CDCl3, 500 МГц) м.д.: (–СО2–ПО–)n 1.33, 1.35 (д, 3H, CH3), 4.11–4.30 (м, 2H, CH2), 5.01 (м, 1H, CH); (–СО2–БО–)n 0.94 (м, 3H, CH3), 1.67 (м, 2H, CH2), 4.07–4.34 (м, 2H, CH2), 4.83 (м, 1H, CH); (–СО2–ЦГО–)n 1.30 (м, 2H, CH2), 1.44 (м, 2H, CH2), 1.69 (м, 2H, CH2), 2.10 (м, 2H, CH2), 4.62 (м, 2H, CH).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кинетика сополимеризации СО2 с пропиленоксидом в присутствии salenCoDNP/PPNCl была изучена ранее в работе [8]. Показано, что природа противоиона X в комплексе salenCoX влияет на энергию активации процесса [9], при значениях температуры более 40°С реакция протекает быстрее в присутствии salenCoDNP, чем salenCoCl при прочих равных условиях. В настоящей работе для проведения тройной сополимеризации применялись мягкие условия: температура 45°С, давление 0.6 МПа, так как преимуществом данной бинарной каталитической системы являлась довольно высокая ее активность, даже при низких значениях температуры и давлении. Для определения соотношения констант сополимеризации были использованы сочетания эпоксидов бутеноксид–пропиленоксид, циклогексеноксид–пропиленоксид и циклогексеноксид–бутеноксид:
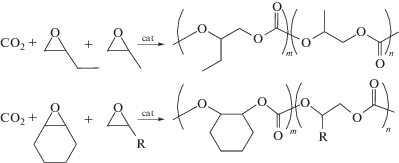
Схема 1.
При температуре 45°С и давлении 0.6 МПа процесс протекал с селективностью по поликарбонату более 97% во всех случаях, в качестве побочных продуктов наблюдалось формирование небольшого количества соответствующих циклических карбонатов.
Скорость сополимеризации, влияние состава среды
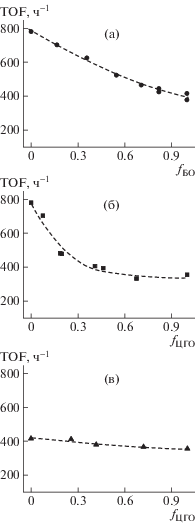
Кинетика была изучена по поглощению СО2 в ходе реакции. Для измерения скорости учитывались данные до достижения конверсии эпоксидов 30%, чтобы изменение состава среды не оказывало значительного влияния на скорость реакции. Типичные зависимости поглощения СО2 со временем для разных процессов тройной сополимеризации показаны на рис. 1. В этих опытах соотношение эпоксидов в среде было близко к эквимольному. Мольное соотношение эпоксидов в реакционной среде представлено как параметр f, который равен отношению молей первого эпоксида к суммарному количеству молей двух эпоксидов.
Рис. 1.
Зависимость поглощения СО2 со временем в тройной сополимеризации СО2–БО–ПО, где fБО = = 0.55 (1), СО2–ЦГО–ПО, где fЦГО = 0.54, и СО2–ЦГО–БО, где fЦГО = 0.42 (2, 3); Т = 45°С, давление 0.6 МПа, [salenCoDNP]/ [PPNCl] = 1.

Реакция протекала при постоянной скорости в течение 40–60 мин в зависимости от состава среды. При достижении конверсии эпоксидов 30% прослеживалось снижение скорости процесса. Это могло быть вызвано разными причинами: увеличением вязкости среды (например, при использовании циклогексеноксида) или изменением растворимости СО2 из-за накопления продуктов. Скорость далее рассчитывалась в единицах TOF (ч–1) как количество молей поглощенного СО2 за один час в расчете на моль катализатора.
Для определения того, насколько природа эпоксида влияет на скорость процесса, реакция проводилась при постепенном изменении состава среды. Изменение скорости в реакциях СО2–БО–ПО, СО2–ЦГО–ПО, СО2–ЦГО–БО при различных f (мольная доля первого эпоксида в среде) показано на рис. 2. Видно плавное изменение скорости тройной сополимеризации при применении смеси бутеноксида и пропиленоксида. Скорость сополимеризации СО2 с бутеноксидом всего в 2 раза ниже скорости сополимеризации СО2 с пропиленоксидом (рис. 2а). Более резкая зависимость получена при введении циклогексеноксида (рис. 2б), хотя значение скорости сополимеризации СО2 с циклогексеноксидом близко к скорости процесса СО2 с бутеноксидом. При близком значении скорости заметно слабое варьирование скорости при изменении состава среды в тройной сополимеризации СО2–ЦГО–БО (рис. 2в). Итак, процессы тройной сополимеризации при применении разных эпоксидов протекают с достаточно высокой скоростью в присутствии бикомпонентной каталитической системы salenCoDNP/PPNCl. При эквимольном соотношении эпоксидов в среде более высокая скорость характерна для тройной сополимеризации СО2–БО–ПО, чем для процессов с участием циклогексеноксида.
Соотношение констант сополимеризации и распределение эпоксидных звеньев в тройном сополимере
Изменение состава среды приводит к варьированию состава тройных сополимеров. Содержание звеньев одного из эпоксидов далее представлено в виде параметра F = m/(m + n) (см. схему 1 ). Зависимости составов тройных сополимеров от состава среды представлены на рис. 3.
Рис. 3.
Зависимости содержания звеньев с первым эпоксидом в тройном сополимере от его содержания в среде СО2–БО–ПО (а), СО2–ЦГО–ПО (б) и СО2–ЦГО–БО (в).
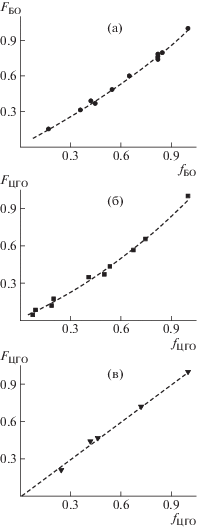
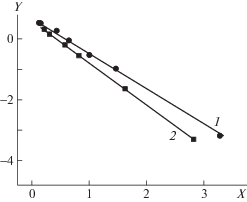
На рис. 3 видно, что различный характер зависимостей наблюдается при изменении состава среды в исследованных процессах. В первых двух случаях (рис. 3а, 3б) имеет место нелинейная зависимость, в то время как для тройной сополимеризации СО2–ЦГО–БО получена зависимость линейного типа, довольно хорошо описанная прямой линией от нуля до единицы. Скорость внедрения в тройной сополимер пропиленоксида или бутеноксида, циклогексеноксида различна, как это показано на рис. 2. По-видимому, более низкая скорость внедрения бутеноксида или циклогексеноксида приводит к нелинейному характеру зависимостей содержания звеньев с данными эпоксидами в сополимере. Напротив, когда значения скорости близки, как в случае тройной сополимеризации СО2–ЦГО–БО, прослеживалась практически идеальная линейная зависимость содержания звеньев одного из эпоксидов от состава среды. Полученные закономерности позволяют проводить оценку соотношения констант сополимеризации для эпоксидов разных типов по анализу данных с использованием соотношения Fineman–Ross [4]. Экспериментальная зависимость, рассчитанная в координатах Fineman–Ross (X = [$f_{{{\text{П О }}}}^{2}$/(1 – fПО)2] × [(1 – FПО)/FПО], Y = = [fПО/(1 – fПО)] × [(1 – 2FПО)/FПО]) для процессов тройной сополимеризации СО2–БО–ПО и СО2–ЦГО–ПО, дана на рис. 4. Зависимость рассчитана с использованием усредненных значений экспериментальных данных.
Рис. 4.
Зависимости Fineman–Ross для процессов СО2–БО–ПО, Y = –1.15X + 0.66 (1) и СО2–ЦГО–ПО, Y = –1.38X + 0.59 (2).
При внедрении эпоксидов может происходить повторение звеньев с одинаковым эпоксидом, либо внедрение другого эпоксида. Анализ данных в координатах Fineman–Ross позволяет определить соотношение констант при формировании разных последовательностей звеньев в полимерной цепи:
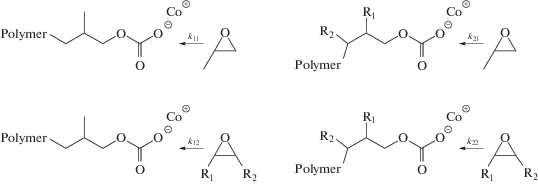
Схема 2.
По полученным данным, для процесса тройной сополимеризации СО2–БО–ПО соотношение констант k11/k12 (rПО) = 1.15, k22/k21 (rБО) = 0.66. В случае тройной сополимеризации СО2–ЦГО–ПО соотношение k11/k12 (rПО) = 1.38, k22/k21 (r ЦГО) = 0.59. Другие значения этих констант были получены для тех же процессов, но с использованием других катализаторов и в более жестких условиях реакции. И тот, и другой фактор может влиять на величину констант сополимеризации. По данным работы [4] для процесса СО2–ЦГО–ПО rПО = 1.4, rЦГО = 0.37, а в тройной сополимеризации СО2–БО–ПО rПО = 1.7, rБО = 0.58. В случае близкой реакционной способности сомономеров произведение констант (rПО × rБО) или (rПО × rЦГО) должно быть равно единице. По данным работы [1] оно составляло 0.81 и 0.63 соответственно. В данной работе (rПО × rБО) = 0.76 и (rПО × rЦГО) = 0.81. Возможно, относительная реакционная способность сомономеров изменяется при применении разных каталитических систем или условий проведения реакции, и этим обусловлены наблюдаемые различия в значениях.
Данные о составе не дают информации о распределении звеньев, характер зависимости содержания различных диад определяется значениями констант сополимеризации. Используя их, можно оценить вероятностное распределение диад с различной последовательностью звеньев [10]. Например, выполнить оценку вероятностей содержания диад –СО2–ПО–СО2–ПО– (Р11), –СО2–ПО–СО2–БО– (Р12), –СО2–БО–СО2–ПО– (Р21), –СО2–БО–СО2–БО– (Р22) при эквимольном соотношении эпоксидов. С учетом полученных значений соотношения констант сополимеризации, соответствующие вероятности равны: Р11 = = 0.3, Р12 = Р21 = 0.52, Р22 = 0.17. В случае тройной сополимеризации СО2–ЦГО–ПО Р11 = 0.35, Р12 = = Р21 = 0.5, Р22 = 0.15. Учитывая возможные экспериментальные ошибки, примерно половину всех диад составляют диады смешанного типа в обоих случаях. Полученные значения вероятностей свидетельствуют о том, что эпоксиды распределяются в основном по два звена по полимерной цепи. Вероятность содержания диад с пропиленоксидными звеньями выше, чем с бутеноксидными или циклогексеноксидными, что означает присутствие некоторого количества более крупных блоков с пропиленоксидными звеньями и более мелких – с другими эпоксидами.
Свойства тройных сополимеров
Синтезированные тройные сополимеры во всех случаях характеризовались бимодальным ММР с узким распределением. Бимодальное распределение характерно для сополимеров СО2 с эпоксидами, этот факт объясняют ростом двух молекул сополимера на каждом каталитическом центре. Рост сополимера протекает по механизму живой сополимеризации, если в среде нет агентов передачи цепи (воды, спиртов, кислот) [1, 2]. Результаты, полученные в настоящей работе, также свидетельствуют об увеличении молекулярной массы тройных сополимеров с конверсией эпоксидов. В табл. 1 показано, как изменяется молекулярная масса со временем реакции и с конверсией эпоксидов в тройной сополимеризации СО2–БО–ПО.
Таблица 1.
Изменение молекулярной массы и состава тройного сополимера СО2–БО–ПО со временем, fБО = 0.82
| Опыт, № | Время, мин | Конверсия | Mn, кг/моль | Đ | FБО | Тс |
|---|---|---|---|---|---|---|
| 1 | 61 | 0.187 | 8.2 | 1.1 | 0.86 | 9.8 |
| 2.8 | 1.4 | |||||
| 2 | 88 | 0.259 | 11.6 | 1.1 | 0.77 | 13.2 |
| 3.8 | 1.4 | |||||
| 3 | 184 | 0.555 | 19.4 | 1.0 | 0.78 | 15.6 |
| 6.1 | 1.5 |
Примечание. Здесь и в табл. 2 условия реакции: Т = 45°С, давление 0.6 Мпа.
Состав тройных сополимеров может меняться в ходе реакции. В данной работе был проведен анализ изменения состава тройного сополимера со временем при одинаковом соотношении эпоксидов в среде, эти данные представлены в табл. 1. Необычным оказался тот факт, что при небольшой конверсии эпоксидов (~0.2) содержание звеньев с бутеноксидом в тройном сополимере превысило его относительное мольное количество в среде (табл. 1, опыт № 1), хотя при увеличении времени процесса FБО ниже, чем fБО, это наблюдалось и в других опытах при конверсиях эпоксидов более 0.3. Как обсуждалось выше, соотношение констант сополимеризации показывает, что процесс внедрения пропиленоксида в сополимер протекает быстрее, чем бутеноксида. Поэтому довольно сложно объяснить более высокое содержание в сополимере звеньев бутеноксида, чем в среде, при небольшой конверсии. Подобный анализ изменения состава тройного сополимера с конверсией эпоксидов был выполнен в работе [5] в тройной сополимеризации СО2–ЦГО–ПО при эквимольном соотношении эпоксидов в среде. При конверсии эпоксидов до 0.5 наблюдалось близкое к эквимольному соотношению звеньев циклогексеноксида в тройном сополимере.
Варьирование состава эпоксидов позволяет получать сополимеры с различными свойствами. Известно, что введение циклогексеноксида повышает температуру стеклования сополимеров [6]. Данные о некоторых характеристиках синтезированных тройных сополимеров представлены в табл. 2; на рис. 5 приведены кривые ДСК тройных сополимеров.
Таблица 2.
Тройная сополимеризация СО2 с пропиленоксидом, бутеноксидом и циклогексеноксидом при разном составе эпоксидов в среде (мольные доли f и F рассчитаны для первого эпоксида в списке)
| Опыт, № | Эпоксиды | f | F | TOF, ч–1 | Mn, кг/моль | Đ | Тс, °С | Тд*, °С |
|---|---|---|---|---|---|---|---|---|
| 1 | БО–ПО | 0.17 | 0.15 | 702 | 14.5 | 1.0 | 20.9 | 252 |
| 4.1 | 1.6 | |||||||
| 2 | БО–ПО | 0.55 | 0.49 | 523 | 14.3 | 1.0 | 11.5 | 253 |
| 5.1 | 1.3 | |||||||
| 3 | БО–ПО | 0.82 | 0.74 | 444 | 22.3 | 1.0 | 13.4 | 256 |
| 6.3 | 1.6 | |||||||
| 4 | ЦГО–ПО | 0.51 | 0.36 | 366 | 11.7 | 1.7 | 54.5 | 301 |
| 4.1 | 1.3 | |||||||
| 5 | ЦГО–ПО | 0.75 | 0.66 | 335 | 16.4 | 1.0 | 90.1 | 310 |
| 5.3 | 1.4 | |||||||
| 6 | ЦГО–БО | 0.26 | 0.20 | 411 | 16.3 | 1.4 | 26.1 | 298 |
| 4.9 | 1.5 | |||||||
| 7 | ЦГО–БО | 0.42 | 0.44 | 379 | 16.3 | 1.0 | 50.5 | 303 |
| 5.1 | 1.5 | |||||||
| 8 | ЦГО–БО | 0.72 | 0.72 | 366 | 16.0 | 1.0 | 86.3 | 317 |
| 5.5 | 1.4 |
Рис. 5.
Кривые ДСК тройных сополимеров СО2–БО–ПО (а), СО2–ЦГО–ПО (б) и СО2–ЦГО–БО (в). Номера кривых соответствуют номерам образцов в табл. 2.
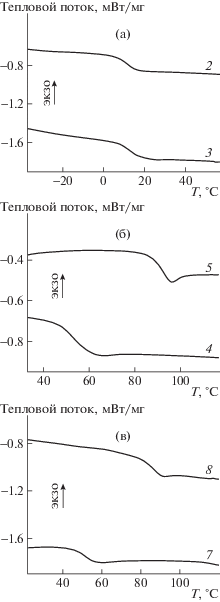
Тройные сополимеры с циклогексеноксидом имеют более высокую температуру стеклования и деструкции, чем тройные сополимеры с бутеноксидом. Температура стеклования тройных сополимеров меняется как с составом, так и с молекулярной массой. В табл. 1 показано изменение температуры стеклования с молекулярной массой: при двукратном увеличении значений Mn температура стеклования тройного сополимера СО2–БО–ПО возрастает от 9.8 до 15.6°С. Зависимости температуры стеклования от состава тройного сополимера представлены на рис. 6.
Рис. 6.
Изменение температуры стеклования тройных сополимеров СО2–БО–ПО (a) и СО2–ЦГО–ПО (б) с их составом.
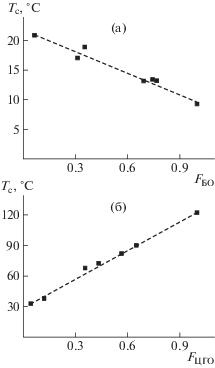
Так, с ростом содержания бутеноксидных звеньев в тройном сополимере прослеживалось закономерное уменьшение температуры стеклования (рис. 6а), увеличение же температуры стеклования наблюдалось с ростом содержания циклогексеноксидных звеньев (рис. 6б). Минимальная температура стеклования составила 9.3°С для двойного сополимера СО2 с бутеноксидом, максимальная – 122.3°С для сополимера СО2 с циклогексеноксидом. В тройных сополимерах, полученных с использованием этих двух эпоксидов, температура стеклования изменялась в данном диапазоне значений (рис. 7а).
Рис. 7.
Зависимости температуры стеклования (a) и температуры деструкции (б) тройных сополимеров СО2–ЦГО–БО от содержания звеньев с циклогексен-оксидом в тройном сополимере.

Температура деструкции в тройном сополимере СО2–ЦГО–БО была выше 295°С и росла с увеличением содержания звеньев циклогексеноксида в тройном сополимере (рис. 7б). При содержании звеньев циклогексеноксида равном 0.5, в тройных сополимерах СО2–ЦГО–ПО и СО2–ЦГО–БО значения температуры деструкции были близки и составляли 305–306°С, в то время как температура стеклования была ниже в тройном сополимере с бутеноксидом СО2–ЦГО–БО.
ЗАКЛЮЧЕНИЕ
Тройная сополимеризация СО2 с пропиленоксидом, бутеноксидом и циклогексеноксидом проведена в присутствии бикомпонентной каталитической системы в относительно мягких условиях (при температуре 45°С и давлении 0.6 МПа). Реакции протекали при постоянной скорости в течение 40–60 мин до конверсии эпоксидов 30%, после чего наблюдалось замедление процессов, возможно, связанное с накоплением сополимера, изменением вязкости растворов и растворимости СО2. Скорость сополимеризации уменьшалась при введении в пропиленоксид бутеноксида или циклогексеноксида. Значения скорости сополимеризации СО2 с бутеноксидом и СО2 с циклогексеноксидом сопоставимы, они в 2 раза ниже значений скорости процесса СО2 с пропиленоксидом. Получена нелинейная зависимость содержания звеньев с бутеноксидом или циклогексеноксидом в тройном сополимере от содержания этих эпоксидов в среде при применении пропиленоксида в качестве второго эпоксида. В процессе тройной сополимеризации СО2–ЦГО–БО, когда значения скорости внедрения эпоксидов в сополимер сопоставимы, наблюдалась линейная корреляция содержания циклогексеноксида в тройном сополимере от его относительного мольного количества в среде. Проведена оценка соотношения констант сополимеризации пропиленоксида, бутеноксида и циклогексеноксида. На основании этих значений выполнен анализ вероятностного содержания различных диад в тройном сополимере, который указывает на преимущественное распределение эпоксидов в виде коротких блоков по два звена при эквимольном содержании эпоксидов. Показано, что температура стеклования синтезированных тройных сополимеров изменялась в широком диапазоне от 9.3 до 122.3°С и определялась, главным образом, составом тройного сополимера, а также его молекулярной массой.
Авторы выражают благодарность А.В. Черняку за регистрацию спектров ЯМР 1Н.
Работа выполнена по теме Госзадания (гос. регистрация ФАНО № 0089-2019-0008) с использованием оборудования Аналитического центра коллективного пользования Института проблем химической физики РАН.
Список литературы
Kember M.R., Buchard A., Williams C.K. // Chem. Commun. 2011. V. 47. P. 141.
Kozak C.M., Ambrose K., Anderson T.S. // Coord. Chem. Rev. 2018. V. 376. P. 565.
Luinstra G.A. // Polym. Rev. 2008. V. 48. № 1. P. 192.
Seong J.E., Na S.J., Cyriac A., Kim B.-W., Lee B.Y. // Macromolecules. 2010. V. 43. № 2. P. 903.
Ren W.-M. Zhang X., Liu Y., Li J.-F., Wang H., Lu X.-B. // Macromolecules. 2010. V. 43. № 3. P. 1396.
Shi L., Lu X.-B., Zhang R., Peng X.-J., Zhang C.-Q., Li J.-F., Peng X.-M. // Macromolecules. 2006. V. 39. № 17. P. 5679.
Lu X.-B., Shi L., Wang Y.-M., Zhang R., Zhang Y.-J., Peng X.-J., Zhang Z.-C., Li B. // J. Am. Chem. Soc. 2006. V. 128. № 5. P. 1664.
Chukanova O.M., Bukhovets E.V., Perepelitsina E.O., Belov G.P. // Polymer Science B. 2015. V. 57. № 3. P. 224.
Chukanova O.M., Belov G.P. // Kinet. Katal. 2016. V. 57. № 6. P. 821.
Семчиков Ю.Д. Высокомолекулярные соединения. М.: Академия, 2003.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)