Высокомолекулярные соединения (серия Б), 2019, T. 61, № 5, стр. 356-362
ИССЛЕДОВАНИЕ ЗАКОНОМЕРНОСТЕЙ ТЕРМООКИСЛИТЕЛЬНЫХ ПРЕВРАЩЕНИЙ НЕСТАБИЛИЗИРОВАННОГО И СТАБИЛИЗИРОВАННОГО ПОЛИЭФИРЭФИРКЕТОНА
А. С. Шабаев a, А. А. Жанситов a, *, Э. В. Хакяшева a, С. Ю. Хаширова a
a Кабардино-Балкарский государственный университет им. Х.М. Бербекова
360004 Нальчик, ул. Чернышевского, 173, Россия
* E-mail: azamat-z@mail.ru
Поступила в редакцию 01.04.2019
После доработки 03.05.2019
Принята к публикации 17.05.2019
Аннотация
Исследованы закономерности термоокислительных превращений полиэфирэфиркетона в широком интервале температуры. Предложены механизмы термоокисления. Показаны возможности стабилизации полиэфирэфиркетона против термической и термоокислительной деструкции. Установлены оптимальные значения концентрации термостабилизатора в ПЭЭК.
ВВЕДЕНИЕ
Неослабевающий интерес к полиэфирэфиркетону (ПЭЭК) обусловлен тем, что данный полимер в комплексе удовлетворяет самым современным требованиям, предъявляемым к эксплуатационным свойствам, а также является перспективным материалом для разработки новых полимерных композиционных материалов [1–4].
В настоящее время крайне мало представлено работ о влиянии длительного воздействия высоких температур на термостабильность полимеров класса полиэфиркетонов, несмотря на то что именно такие комплексные исследования позволяют получить достоверную информацию о реальных условиях эксплуатации полимерного материала. В работах, посвященных исследованиям термических характеристик ПЭЭК [5–7], с помощью хромато-масс-спектрометрии были изучены продукты его термической деструкции. Среди газообразных продуктов пиролиза обнаружены СО и СО2, причем зафиксирован их суммарный выход. С помощью масс-спектрометрии идентифицированы различные продукты, среди которых обнаружены бензол, фенол, гидрохинон и другие фрагменты. Очевидно, что для суждения о механизме термораспада данного класса полимеров необходимо более детально исследовать изменения структурных характеристик полиэфирэфиркетона при кратковременном и длительном воздействии высоких температур, в том числе в присутствии стабилизирующих веществ.
Ранее [8, 9] были рассмотрены закономерности термической деструкции полиэфирэфиркетонов различного строения в широком интервале температуры, предложены схемы термораспада, а также выявлено влияние воды на эти процессы. На основании полученного материала целью настоящей работы явилось изучение закономерностей термоокислительных превращений ПЭЭК, а также возможности его термостабилизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования служил полиэфирэфиркетон, синтезированный в Центре прогрессивных материалов и аддитивных технологий Кабардино-Балкарского государственного университета им. Х.М. Бербекова [10]:
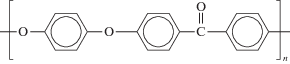
Синтез полиэфирэфиркетона проводили реакцией поликонденсации 1,4-дигидроксибензола с 4,4'-дифторбензофеноном при температуре 320°С в течение 5 ч:

В качестве растворителя использовали дифенилсульфон. После окончания синтеза дифенилсульфон экстрагировали изопропиловым спиртом и ацетоном. Сушку полимера осуществляли под вакуумом при 150°С в течение 12 ч. Вязкость ПЭЭК, измеренная в 0.5% растворе в H2SO4 при 25°С, составляла 0.4 дл/г.
Термогравиметрические исследования проводили на дериватографе TGA-4000 фирмы “Perkin-Elmer” при скорости нагревания 5 град/мин в атмосфере воздуха и азота. Анализ основных газообразных продуктов пиролиза выполняли на газовом хроматографе “Цвет-800” с детектором по теплопроводности по методике, описанной в работе [11]. ИК-спектроскопические исследования осуществляли на спектрофотометре “Spectrum Two фирмы “PerkinElmer”.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Метод исследования термической и термоокислительной деструкции полимеров, описанный в работе [11], позволил изучить кинетику поглощения кислорода с одновременным анализом газообразных продуктов термоокислительной деструкции. Предварительными опытами было установлено, что заметное поглощение кислорода наблюдается уже при 300°С, хотя по данным термогравиметрического анализа (рис. 1а) ПЭЭК начинает терять массу при температуре выше 500°С (потеря 2% массы на воздухе соответствует 530°С, в азоте – 549°С).
Рис. 1.
Термогравиметрические (а) и дифференциальные термогравиметрические кривые (б) ПЭЭК на воздухе (1) и в азоте (2).

Кривая потери массы на воздухе имеет две явно выраженные стадии (рис. 1б). Первая стадия соответствует реакциям разрыва основной полимерной цепи, скорость которых указывает на радикально-цепной механизм разрушения. На данном этапе разложения одновременно протекают реакции как окисления, так и сшивания. Таким образом, затрудняется доступ кислорода к основной полимерной цепи. На второй стадии при значениях температуры выше 600°С диффузионные процессы термоокисления (в том числе коксового остатка) начинают преобладать над простыми реакциями горения. Это приводит к наблюдаемому на дифференциальных термогравиметрических кривых заметному уменьшению скорости потери массы.
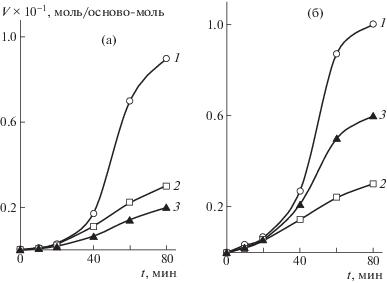
На рис. 2 представлены кинетические кривые поглощения кислорода в зависимости от времени и температуры термостатирования. Видно, что характер поглощения кислорода не меняется вплоть до 375°С. Очевидно, это связано со способностью ПЭЭК сшиваться при этих значениях температуры, что затрудняет окислительный процесс. При более высоких значениях температуры (400–425°С) процессы термической деструкции начинают преобладать над процессами сшивания, что неизбежно сказывается на скорости поглощения кислорода.
Рис. 2.
Кинетические кривые поглощения кислорода ПЭЭК при Т = 300 (1), 325 (2), 350 (3), 375 (4), 400 (5) и 425°С (6).

В ходе термоокислительной деструкции полимеров имеет место выделение газообразных продуктов, которые в основном состоят из оксида и диоксида углерода. Кроме них, образуется незначительное количество водорода (рис. 3) и следовое количество метана.
Рис. 3.
Кинетические кривые выделения водорода при термоокислительной деструкции ПЭЭК при Т = = 325 (1), 350 (2), 375 (3), 400 (4) и 425°С (5).

Количество водорода, образующееся при температуре 325–375°С, приблизительно соответствует количеству при термической деструкции. Однако при температуре 400–425°С (термоокислительная деструкция) водорода выделяется в разы больше, чем при термопиролизе [9]. Дополнительным источником образования водорода при этих условиях могут быть процессы окисления ароматических ядер, сопровождающиеся отрывом атома водорода.
При взаимодействии кислорода с ароматическим ядром происходит отрыв атома водорода
с образованием карбонильного радикала  :
:

который может быть окислен на воздухе до карбоновой кислоты или превратиться в альдегид с отщеплением атомарного водорода.
Следующая наиболее уязвимая связь в условиях термоокислительной деструкции – простая эфирная связь. В этом случае рекомбинация соседних радикалов, сопровождающаяся высвобождением атомарного водорода, приводит к образованию паркетных структур либо циклических соединений, таких как дибензофуран, который в большом количестве был обнаружен в работах [10, 11].

На рис. 4 представлены кинетические кривые выделения СО и СО2 при термоокислительной деструкции. Видно, что при всех значениях температуры термоокисления СО2 образуется значительно больше, чем СО, причем выход последнего можно наблюдать начиная с температуры 375°С. Исходя из структуры полимера и навески испытываемых образцов, было установлено, что максимальный суммарный выход СО и СО2 не может превышать 1 моль/осново-моль при полном разрушении кетонной группы. При температурах 350 и 375°С суммарный выход СО и СО2 не превышает 0.5 моль/осново-моль, что свидетельствует о разрушении лишь кетонной группы с образованием СО, который в присутствии кислорода окисляется до СО2:
Рис. 4.
Кинетические кривые выделения CO (а) и CO2 (б) при термоокислительной деструкции ПЭЭК при Т = 350 (1), 375 (2), 400 (3) и 425°С (4).


Дальнейшее повышение температуры до 400, 425°С сопровождается увеличением суммарного количества оксидов углерода до 6 моль/осново-моль (рис. 4). Дополнительный источник образования этих продуктов – окисление атомов углерода, входящих в состав бензольного кольца, до СО или СО2.
Таким образом, уже при 325°С заметно термоокисление ПЭЭК, которое сопровождается разрушением кетонных групп; дальнейшее повышение температуры приводит к окислению фрагментов бензольного кольца.
Исследования образцов ПЭЭК, выдержанных в течение 30 мин при температуре 400°С в инертной среде и на воздухе, показали заметные изменения в их ИК-спектрах (рис. 5). Известно [12], что наиболее выраженной спектральной особенностью ИК-спектров полимеров во время разложения является появление полос поглощения, специфичных для карбонильной группы C=O в области 1540–1870 см–1, причем точное волновое число зависит от химической структуры полимерной цепи. В случае ПЭЭК максимум интенсивности пика карбонильной группы находится в области 1740 см–1.
Рис. 5.
ИК-спектры ПЭЭК без термообработки (а), а также выдержанного в течение 30 мин при 400°С в аргоне (б) и на воздухе (в).
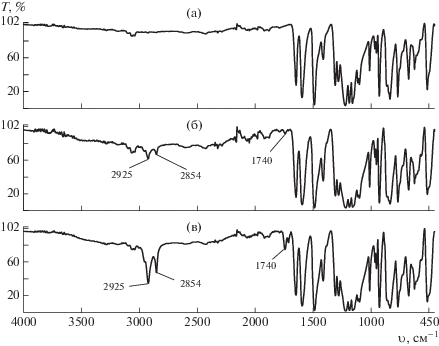
Высокая термическая стабильность ПЭЭК и многих других полимеров связана с наличием ароматических групп в молекулярной структуре. Мономерное звено ПЭЭК включает три фенильных кольца. Как видно на рис. 5, при термическом воздействии растет количество алифатических групп (полосы с максимумами в области 2854 и 2925 см–1); это указывает на то, что во время термообработки происходят реакции раскрытия кольца, причем на воздухе выражено ярче (рис. 5в). Это одна из вероятных причин снижения термостабильности при более длительном воздействии высоких значений температуры.
С целью повышения стабильности полиэфирэфиркетона в процессе переработки были изучены возможности его стабилизации.
Так, объектами исследования служили образцы ПЭЭК, ПЭЭК + 0.3% стабилизатора ПЭЭК + 0.5% стабилизатора. В качестве стабилизатора выступал дифосфонитовый антиоксидант Hostanox:

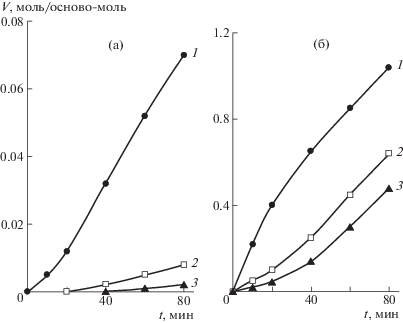
Исследования термической деструкции были проведены при температуре 500°С (начало интенсивных потерь массы по данным ТГА для ПЭЭК); время пиролиза до 80 мин. Кинетические кривые образования СО и СО2 при термической деструкции для всех трех образцов показали (рис. 6), что при времени пиролиза до 20 мин количество и скорость выделения этих газов практически одинаковы для образцов как со стабилизатором, так и без него.
Рис. 6.
Кинетические кривые образования СО (а) и СО2 (б) при термической деструкции и Т = 500°С для образцов ПЭЭК (1), ПЭЭК + 0.3% стабилизатора (2) и ПЭЭК + 0.5% стабилизатора (3).
В дальнейшем, при увеличении времени пиролиза, начиная с 30 мин выдержки, скорость образования СО и СО2 нестабилизированных образцов увеличивается в несколько раз. При этом характер выделения СО и СО2 и для стабилизированных образцов остается неизменным. Наблюдаемую взаимосвязь активности стабилизатора со временем термического воздействия можно интерпретировать с нескольких позиций.
Начало распада полимеров начинается с гомолитического разрыва основной полимерной цепи, сопровождающегося образованием активных радикалов.
Для нестабилизированных образцов сформировавшиеся радикалы участвуют в дальнейшем разрушении полимера, происходит переход от гомолитического распада к радикально-цепному, скорость которого намного выше.
В стабилизированных образцах введенный стабилизатор нейтрализует образовавшиеся при гомолитическом распаде полимеров радикалы, препятствуя переходу в радикально-цепной механизм, вследствие чего скорость разложения таких полимеров заметно не увеличивается.
Выход СО уменьшается пропорционально увеличению содержания стабилизатора. В то же время повышение процентного содержания стабилизатора до 0.5% увеличивает выход СО2 (рис. 6).
Похожая неоднозначная картина наблюдается на кинетических кривых образования Н2 при термической деструкции (рис. 7). Если введение 0.3% стабилизатора улучшает термические свойства полимера, то дальнейшее увеличение его содержания (до 0.5%) увеличивает выход водорода.
Рис. 7.
Кинетические кривые образования водорода при термической деструкции и Т = 500°С для образцов ПЭЭК (1), ПЭЭК + 0.3% стабилизатора (2) и ПЭЭК + 0.5% стабилизатора (3).

Образцы с содержанием стабилизатора 0.3 и 0.5% были также исследованы с целью выявления эффективности работы стабилизатора в окислительной среде. Для этого пиролитическая ячейка с образцом заполнялась кислородом [11], после чего осуществлялся пиролиз при температуре 400°С.
В отличие от термической деструкции при термоокислении с увеличением процентного содержания стабилизатора заметно уменьшается выход всех обнаруженных газообразных продуктов разложения (рис. 8, 9). Так, выход водорода для стабилизированного ПЭЭК (кривая 3) уменьшился в 5 раз (рис. 8) по сравнению с исходным (кривая 1); время пиролиза 80 мин.
Рис. 8.
Кинетические кривые выделения водорода при термоокислительной деструкции и Т = 400°С для образцов ПЭЭК (1), ПЭЭК + 0.3% стабилизатора (2) и ПЭЭК + 0.5% стабилизатора (3).

Рис. 9.
Кинетические кривые выделения СО (а) и СО2 (б) при термоокислительной деструкции и Т = 400°С для образцов ПЭЭК (1), ПЭЭК + 0.3% стабилизатора (2) и ПЭЭК + 0.5% стабилизатора (3).
Линейный ход кривых выделения водорода свидетельствует о простых реакциях разветвления и сшивания основной полимерной цепи ПЭЭК. При этом для образца ПЭЭК + 0.5% стабилизатора выход водорода и СО уменьшается практически на порядок.
Наблюдаемые эффекты свидетельствуют о связывании стабилизатором активных атомов водорода, что снижает степень их участия в разрыве основной полимерной цепи; это предположение подтверждается и снижением выделения СО:

В целом выявленные закономерности показывают возможность направленного регулирования глубины процессов термической деструкции ПЭЭК для его переработки без риска ухудшения основных технологических и эксплуатационных характеристик.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках соглашения № 14.577.21.0240 от 26 сентября 2017 г. (код проекта RFMEFI57717X0240).
Список литературы
Clavijo S., Membrives F., Boccaccini A.R., Santillan M.J. // J. Appl. Polym. Sci. 2014. V. 131. № 20. P. 40953.
Zhang G.A., Liao H., Coddet C. // Tribology Polym. Nanocomp. B. 2013. V. 55. P. 458.
Шереметьев С.В., Сергеева Е.А., Бакирова И.Н., Зенитова Л.А., Абдуллин И.Ш. // Вестн. Казанского технол. ун-та. 2012. Т. 15. № 20. С. 164.
Саламов А.Х., Микитаев А.К., Беев А.А., Беева Д.А., Кумышева Ю.А. // Фундаментальные исследования. 2016. Т. 1. С. 63.
Day M., Cooney J.D., Wiles D.M. // J. Anal. Appl. Pyrolisis. 1990. V. 18. P. 163.
Montaodo G., Puglisi C., Samperidi F. // Macromol. Chem. Phys. 1994. V. 195. № 4. P. 1241.
Tsai C.J., Perng L.H., Ling Y.C. // Rapid Commun. Mass Spectrom. 1997. V. 11. P. 1987.
Shabaev A.S., Zhansitov A.A., Kurdanova Z.I., Kuchmenova L.Kh., Khashirova S.Yu. // Chin. J. Chromatogr. 2018. V. 36. № 4. P. 395.
Шабаев А.С., Жанситов А.А., Башоров М.Т., Локьяева З.А., Чеченов И.З., Ржевская Е.В., Хаширов А.А. // Изв. Кабардино-Балкарского ун-та. 2017. Т. VII. № 2. С. 64.
Zhansitov A.A., Slonov A.L., Shetov R.A., Baikaziev A.E., Shakhmurzova K.T., Kurdanova Zh.I., Khashirova S.Yu. // Fibre Chem. 2018. V. 49. № 6. P. 414.
Shabaev A.S., Zhansitov A.A., Kurdanova Z.I., Khashirova S.Y. Mikitaev A.K. // Polymer Science B. 2017. V. 59. № 2. P. 216.
Mylläri V., Ruoko T.-P., Vuorinen J., Lemmetyinen H. // Polym. Degrad. Stab. 2015. V. 120. P. 419.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


